Игорь Борисович Львов
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Классификация простых эфиров и радикально — функциональная номенклатура
При замещении водорода гидроксила в спирте на углеводородный остаток образуется простой эфир.
Простые эфиры могут быть подразделены на эфиры:
- с открытой цепью;
- циклические;
- ароматические;
- насыщенные;
- ненасыщенные.
Циклические простые эфиры классифицируют по количеству атомов в цикле на:
- оксираны (эпоксиды);
- оксаны;
- диоксаны;
- оксоланы;
- краун-полиэфиры.
Алифатические простые эфиры могут иметь одинаковые радикалы — симметричные эфиры или разные — несимметричные эфиры.
Простые эфиры, согласно правилам радикально — функциональной номенклатуры называют по радикалам, которые связаны с атомом кислорода и добавляют слово «эфир»:
$(CH_3)_2-O-C_2H_5$ — изопропилэтиловый эфир, $(CH_3)_2CH-O-CH(CH_3)_2$ — диизопропиловый эфир, $CH_3-O-CH_2CH_2CH_2CH_3$ — н-бутилметиловый эфир.
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Номенклатура IUPAC
Согласно номенклатуре IUPAC простые эфиры рассматривают как алкоксиалканы (для алифатических групп) и арилоксиалканы (для ароматических групп).
Например, метилциклогексиловый эфир по номенклатуре IUPAC называется метоксициклогексан. Название 2-этоксигексана складывается из гексана и этокси-группы:
Рисунок 1.
Наиболее длинная алкильная группа (старший углеводородный радикал) будет определять корень названия эфира:
Рисунок 2.
«Номенклатура простых эфиров» 👇
Для некоторых простых эфиров сохраняются тривиальные названия:
Рисунок 3.
Рисунок 4.
Когда один из составляющих радикалов намного больше другого или есть несколько алкоксигрупп становится более удобным использовать алкокси-префиксные названия, чем названия с использованием слова «эфир».
Пример 1
3$beta$-метокси-5$alpha$-холестан, 2,3,5-триметоксихинолин.
Названия с использованием слова «эфир» удобны для простых соединений, с небольшим числом углеродных атомов, для симметричных соединений (например, дибутиловый эфир удобнее 1-бутоксибутана); для эфиров фенолов или полиолов, имеющих известные тривиальные названия (например, 1,3-диметиловый эфир глицерина или триметиловый эфир флороглюцина).
Правила номенклатуры простых полиэфиров
-
В случае неполных эфиров полигидроксисоединений, в качестве альтернативы, заместительные названия можно применять, используя название радикала $R$ в роли префикса к названию полигидроксисоединения $R’OH$ вместе с локантами положений и умножительными префиксами. Отмеченная курсивом прописная $O$ показывает замещение по атому кислорода.
Наиболее часто такая номенклатура применяется для производных углеводов. Введение алкильной группы по $O$-1 циклического сахара дает не эфир, а ацеталь, и эти производные называются алкилгликозидами.
-
Неполные эфиры полигидроксисоединений можно называть сочетая названия этерифицирующего радикала (или радикалов) и названия полигидроксисоединения и необходимых указаний положения или умножающих префиксов с добавлением слова «эфир».
- Если эфирным мостиком связаны две идентичные группы и они содержат группу, обладающую преимуществом перед эфирной группой в праве указываться в виде суффикса, то эфирный мостик указывают префиксом «окси».
- В соединениях $RO-X-OR$, где родоначальные соединения $RH$ идентичны и содержат группу, обладающую преимуществом перед эфирной группой в праве указываться в виде суффикса, название строится по методу, который применяется для обозначения групп идентичных звеньев.
- Линейные полиэфиры называют с использованием заместительной номенклатуры открытых цепей, где строение рассматривается как результат замещения в родоначальном соединении метиленовыхгрупп на кислородные атомы. Название производится от названия первоначальной молекулы , а префикс «окса» вместе с нужными локантами положения и умножающими префиксами показывает, какие метиленовые группы замещены на атомы кислорода.
- Если полиэфиры имеют симметричное линейное строение, то их называют как производные центральной части молекулы. Роль центральной части в молекулах с нечетным числом эфирных атомов кислорода играет эфирный мостик, а с четным числом — углеводородный радикал.
Изомерия простых эфиров
Для простых эфиров характерны:
-
изомерия, обусловленная строением углеводородных радикалов;
$C_2H_5-O-CH_2CH_2CH_3$ и $C_2H_5-O-CH(CH_3)_2$ -
метамерная изомерия;
Пример 2
Диэтиловый эфир $C_2H_5-O-$ $C_2H_5$ и метилпропиловый эфир $CH_3-O-C_3H_7$ являются метамерами, так как у них одна брутто-формула.
-
межклассовая изомерия: простые эфиры изомерны одноатомным спиртам.
Пример 3
Формула соединения состава $C_2P_6O$ соответствует как диметиловому эфиру $CH_3-O-$ $CH_3$ так и этиловому спирту $CH_3CH_2-OH$.
А соединению состава $C_4H_{10}O$ соответствуют не только диэтиловый, метилпропиловы и метилизопропиловый эфиры, но и четыре спирта состава $C_4H_9OH$.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Простые
эфиры можно рассматривать как производные
спиртов и фенолов, в которых атом водорода
гидроксильной группы замещен
углеводородным остатком. Общая
формула простого эфира R–О–R1.
В тех случаях, когда с атомом кислорода
связаны различные углеводородные
остатки, простой эфир называют смешанным,
одинаковые остатки – симметричным. В
зависимости от природы углеводородного
радикада простые
эфиры подразделяются на:
-
простые
эфиры с открытой цепью; -
циклические;
-
насыщенные;
-
ненасыщенные;
-
ароматические
и т. д.
По
названиям углеводородных остатков
составляют название простого эфира.
Примеры простых эфиров и их названий
приведены в таблице 14.
Таблица
14 – Классификация и номенклатура простых
эфиров
|
Формула |
Название |
Класс |
|
СН3–О–СН3 |
диметиловый эфир метоксиметан |
предельный |
|
С2Н5–О–С2Н5 |
диэтиловый эфир этоксиэтан |
предельный |
|
СН3–О–СН(СН3)2 |
метилизопропиловый эфир 2-метоксипропан |
предельный |
|
СН3–О–С6Н5 |
метилфениловыйэфир метоксибензол анилзол |
жирно-ароматический |
|
СН2=СН–О–С2Н5 |
винилэтиловый |
непредельный |
|
|
алкеноксид |
циклический |
|
|
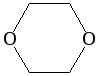
1,4-диоксан |
циклический |
|
|
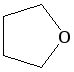
тетрагидрофуран |
циклический |
Способы
получения простых эфиров
-
Реакция
галогенопроизводных углеводородов с
алкоголятами – реакция Вильямсона.
В
качестве алкилирующих средств в этом
синтезе могут быть использованы
алкилгалогениды и диалкилсульфаты.
Вследствие возможного протекания
конкурирующей реакции элиминирования
этот способ более пригоден для первичных
субстратов и практически не используется
для третичных:
-
Дегидратация
спиртов под влиянием кислот. Метод
для получения симметричных простых
эфиров из первичных спиртов или смешанных
эфиров из первичного и третичного
спиртов:
-
Присоединение
спиртов к алкинам
приводит к образованию виниловых
эфиров:
4.
Окисление алкенов.
Мягкое
окисление алкенов надкислотами или
кислородом в присутствии серебряного
катализатора приводит к образованию
трехчленных циклических простых эфиров
– оксиранов (эпоксидов) (часть 1, глава
8.2).
Физические
свойства простых эфиров. Неспособность
молекул простых эфиров образовывать
водородные связи делает эти соединения
более легколетучими по сравнению со
спиртами с близкой молекулярной массой.
В смесях с оксисодержащими соединениями,
в частности, с водой, простые эфиры
образуют водородные связи за счет атома
кислорода как донора пары электронов,
поэтому низшие эфиры ограниченно
растворимы в воде. Циклические простые
эфиры, имея более доступный для сольватации
атом кислорода, образуют более прочные
водородные связи, поэтому они хорошо
растворимы в воде (таблица 15).
Таблица
15 – Физические свойства простых эфиров
|
Формула |
Название |
Мол. |
Температура, |
Растворимость в воде г/100 г |
|
|
плавления |
кипения |
||||
|
|
Диэтиловый |
74 |
–116 |
35 |
7,5 |
|
|
Ди |
100 |
–122 |
90 |
8 |
|
|
Тетрагидрофуран |
72 |
–108 |
66 |
Растворим |
|
Продолжение |
|||||
|
|
Диоксан |
88 |
12 |
101 |
Неограниченно |
|
|
Эпоксиэтан, |
44 |
–112 |
11 |
Неограниченно |
|
|
Эпоксипропан, |
58 |
–112 |
34 |
Растворим |
Химические
свойства простых эфиров. Простые
эфиры – один из немногих классов
органических соединений, обладающих
невысокой реакционной способностью. В
отличие
от спиртов простые эфиры, не имея
гидрофильного водорода, не проявляют
кислотных свойств, однако остальные
типы реакций, характерные для спиртов,
присущи и простым эфирам:
-
Наличие
в молекулах простых эфиров на атоме
кислорода НЭП
определяет их способность участвовать
в реакциях в качестве оснований. -
Вследствие
большей электроотрицательности атома
кислорода по сравнению с атомом углерода
связь Сδ+–Оδ–
в простых эфирах подобно связи С–О
в спиртах полярна. На углеродном атоме
имеется дефицит электронов, что делает
возможной нуклеофильную атаку по этому
атому с разрывом простой эфирной связи.
Однако этот процесс расщепления простого
эфира невыгоден по двум причинам:
-
вследствие
электронодонорных свойств углеводородных
заместителей, полярность связи С–О
невелика; -
алкокси-анион,
так же как и гидрокси-анион, невыгодная
уходящая группа (богата энергией),
поскольку в ней нет условий для
эффективной делокализации отрицательного
заряда.
Следовательно,
большинство простых эфиров – довольно
инертные химические соединения. Они
устойчивы к действию водных растворов
кислот, щелочей. Простые эфиры могут
расщепляться только некоторыми
реагентами, например, при нагревании с
концентрированной йодистоводородной
кислотой или под действием металлического
натрия при повышенной температуре.
1.
Основные свойства. Обладая
электронной парой на атоме кислорода,
простые эфиры могут образовывать
координационные комплексы с различными
протонными или апротонными кислотами.
Однако поскольку атом кислорода обладает
довольно высокой электроотрицательностью
и стерически мало доступен, он является
слабым донором электронной пары.
Вследствие этого простые эфиры – слабые
основания. Они могут образовывать соли
только с сильными кислотами (Н–кислоты
и кислоты Льюиса) и в отсутствие воды.
1.1
Взаимодействие с концентрированной
серной кислотой.
Простые эфиры протонируются, давая
растворы оксониевых солей:
В водной среде
оксониевые соли легко гидролизуются,
регенерируя при этом исходные эфир и
кислоту.
1.2
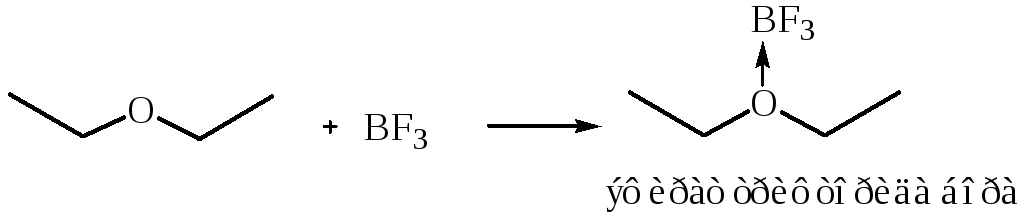
Взаимодействие с кислотами Льюиса.
Эфиры посредством семиполярной связи
образуют комплексы:
2.
Реакции нуклеофильного замещения.
Необходимыми условиями для расщепления
простой эфирной связи является наличие
сильного нуклеофила и перевод
алкокси-аниона в выгодную уходящую
группу. Последнее может быть достигнуто,
если SN
реакцию
осуществлять с оксониевой солью эфира,
т. е. в присутствии сильной кислоты.
Реакция
SN
у
простых эфиров идет еще труднее, чем у
спиртов, т. к. группа RO
–
является плохой уходящей группой. Однако
в кислой среде в результате протонирования
по кислороду она превращается в несколько
лучшую уходящую группу ROH
и нуклеофильное замещение становится
возможным.
Природа
углеводородного радикала определяет
в таких случаях, какой из механизмов –
SN1
или SN2
–
реализуется, причем закономерности
здесь такие же, как в случае алкилгалогенидов.
В качестве кислот, катализирующих
реакции нуклеофильного замещения
простых эфиров, обычно используют HI,
H2SO4,
НВr.
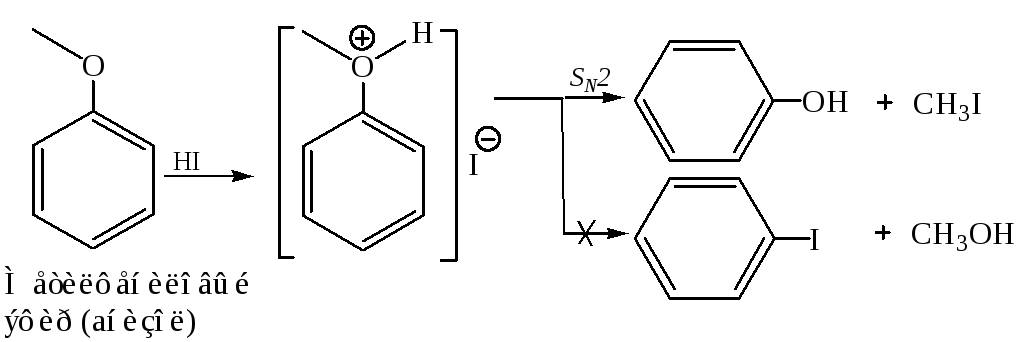
В
данном случае образуется исключительно
фенол, так как связь
прочнее по сравнению
,
и последняя разрывается легче.
3.
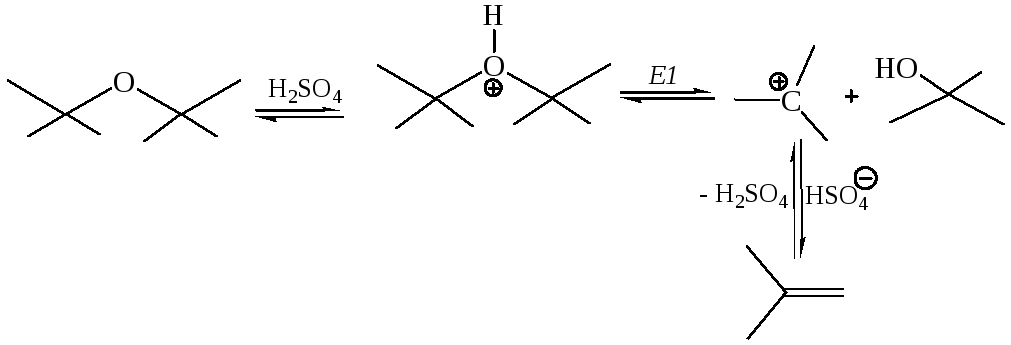
Отщепление (элиминирование)
для
простых эфиров, аналогично спиртам,
можно осуществить действием сильных
кислот, в частности, серной кислоты:
Реакции
простых эфиров Е2
типа
можно осуществить действием очень
сильных оснований, в частности,
алкилпроизводных щелочных металлов:
3.1
Расщепление простых эфиров при высоких
темепратурах активными металлами
(Шорыгин,
1910 г.):
4.
Окисление
простых
эфиров идет легко по С–Н
связи кислородом воздуха на
свету, поэтому
их хранят в темных (светонепроницаемых)
емкостях. При длительном хранении в
присутствии кислорода воздуха на свету
у алифатических эфиров происходит
свободнорадикальный процесс окисления,
приводящий к образованию неустойчивых
пероксидов.
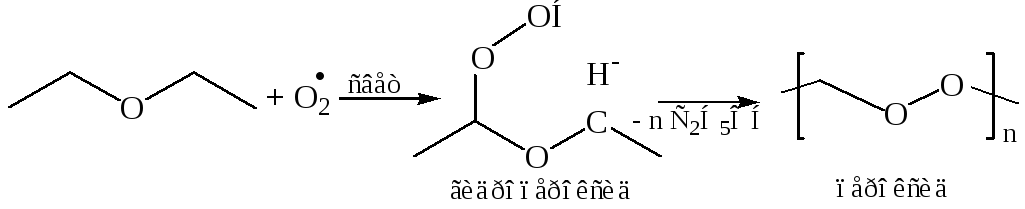
Автоокисление
эфиров протекает у α-углеродного
атома, поскольку в качестве интермедиатов
в этом случае выступают свободные
радикалы, стабилизированные делокализацией
неспаренного электрона с участием НЭП
атома кислорода:
|
|
|
|
Триплетный кислород |
Синглетный кислород |
Работа
с простыми эфирами, не освобожденными
от перекисей, требует особой осторожности.
Остаток после перегонки может содержать
опасные в отношении взрыва концентрации
перекисей. Эфиры, очищенные от перекисей,
хранят, как правило, над металлическим
натрием или гидридом кальция.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
План урока:
Строение простых эфиров
Номенклатура простых и сложных эфиров
Изомерия простых и сложных эфиров
Классификация простых и сложных эфиров
Способы получения простых и сложных эфиров
Физические свойства простых и сложных эфиров
Химические свойства простых и сложных эфиров
Применение простых и сложных эфиров
Строение простых эфиров
Для атомов углерода насыщенных простых эфиров характерно состоянии sp3-гибридизации, а в ненасыщенных соединениях – sp2-гибридизации.
Строение молекулы диметилового эфира
Номенклатура эфиров
Если в простых эфирах R и R’ идентичны, то молекула симметрична, а если различны, то молекула несиметрична. Согласно международной номенклатуре названия простых эфиров формируются с помощью суффикса «-овый» и слова «эфир».
Например, симметричная молекула С2Н5-О-С2Н5 называется диэтиловым эфиром.
В несимметричной молекуле радикалы располагаются по алфавиту. Например, молекула СН3-О-С2Н5 называется метилэтиловым эфиром.
Согласно систематической номенклатуре в сложных эфирах в спиртовом радикале суффикс заменяется на «-оат». В названиях сложных эфиров присутствуют название кислотного аниона и спиртового радикала.
Строение сложных эфиров
Например, C2H5-C(O)O-CH3 – метилэтаноат. С2Н5-С(О)О-С2Н5 – этилэтаноат.
Название соединения в тривиальной номенклатуре формируется названием спиртового радикала, слова «эфир» и названием кислоты.
Например, C2H5-C(O)O-CH3 также можно назвать как метиловый эфир этановой кислоты, а С2Н5-С(О)О-С2Н5 — этиловый эфир этановой кислоты.
Изомерия эфиров
Изомерия простых эфиров
Изомерия сложных эфиров
Классификация эфиров
Виды простых эфиров
Простые эфиры классифицируются по строению углеводородного скелета.
Виды сложных эфиров
Сложные эфиры классифицируются на несколько видов.
- Сложные эфиры, образованные низшими карбоновыми кислотами и спиртами
С5Н11-С(О)О-СН3 – метиловый эфир пентановой кислоты
С2Н5-С(О)О-С3Н7 – пропиловый эфир этиловой кислоты
- Сложные эфиры, образованные высшими карбоновыми кислотами и спиртами
СН3-(СН2)14-С(О)О-(СН2)29-СН3 – мирициловый эфир пальмитиновой кислоты (один из компонентов пчелиного воска)
СН3-(СН2)14-С(О)О-(СН2)15-СН3 – цетиловый эфир пальмитиновой кислоты (основной компонент спермацета)
- Жиры
Жиры отличаются от других представителей класса тем, что они образованы от глицерина ОН-СН2-СН(ОН)-СН2-ОН.
Общая формула жиров
Способы получения простых и сложных эфиров
Получение простых эфиров
Простые эфиры не встречаются в природе, но есть множество химических способов получения эфиров.
- Дегидратация между молекулами спиртов
С помощью этого способа получают симметричные молекулы. Реакция дегидратации (отщепления молекулы воды) протекает в присутствии минеральной кислоты и при нагревании.
C5H11-OH + HO-C5H11 → C5H11-O-C5H11 + Н2О
- Реакция Вильямсона (взаимодействие галогенпроизводных с алкоголятами)
С помощью этого метода можно синтезировать несимметричные молекулы.
С2Н5ONa + C3H7Cl → C2H5-O-C3H7 + NaCl
- Окисление алкенов
Данным способом можно получать циклические соединения класса. Для проведения реакции необходимо нагревание и наличие катализатора.
Способ получения сложных эфиров
Реакция этерификации протекает в присутствии минеральной кислоты.
CH3-COOH + C2H5OH → CH3-C(O)O-C2H5 + H2O
Физические свойства простых и сложных эфиров
Физические свойства простых эфиров
Для простых эфиров не характерно твердое состояние. Диметиловый эфир и метилэтиловый эфир – газы, а все остальные представители класса находятся в жидком состоянии. Простые эфиры кипят при более низких температурах, по сравнению со спиртами. Также им характерен приятный и сладкий запах.
Диэтиловый эфир – бесцветная жидкость, кипящая при температуре 35,5˚С. Он малорастворим в воде, но хорошо растворим в этиловом спирте. Температура воспламенения – 9,4˚С. При взаимодействии с воздухом образуется взрывоопасная смесь. Используется как растворитель. Это ядовитое вещество, которое опасно тем, что вызывает привыкание.
Диэтиловый эфир
Диоксан – хороший растворитель, из-за чего его иногда называют «органической водой». Температура кипения – 101˚С. Диоксан токсичен и ядовит.
1,4-диоксан
Простые эфиры не растворимы в воде. Эта особенность связана с неспособностью образовывать водородные связи. Простые эфиры – отличные растворители.
Физические свойства сложных эфиров
Сложные эфиры, образованные от низших карбоновых кислот и спиртов, находятся в жидком состоянии. Они обладают приятными запахами и не растворяются в воде. Приятные цветочные и плодовые запахи обусловлены наличием сложных эфиров.
У сложных эфиров более низкие температуры плавления и кипения, чем у карбоновых кислот. Эта особенность связана с отсутствием межмолекулярных водородных связей.
Сложные эфиры, образованные от высших карбоновых кислот и спиртов – воски. У них отсутствуют запахи. Также они совсем не растворимы в воде, но растворимы в органических растворителях. Воски бывают растительными, животными, ископаемыми и синтетическими.
Соты из пчелиного воска
Растительные воски можно встретить на поверхностях листовых пластин, стеблей, плодов. Они защищают от проникания лишней воды, высыхания, попадания микроорганизмов. Наиболее популярный животный воск – пчелиный. Из него насекомые строят соты. Также животный воск находится на шерсти животных. Он предотвращает попадание избыточной влаги на кожу.
Ланолин (воск шерсти животных)
Представитель ископаемых восков – горный воск, который представляет собой минерал из группы нефтяных битумов. Синтетические воски получают на основе нефтяных и смоляных парафинов и их производных.
Химические реакции простых и сложных эфиров
Химические реакции простых эфиров
- Взаимодействие с йодоводородной (HI) или бромоводородной (HBr) кислотой
Под действием концентрированной кислоты происходит разложение простого эфира.
R-O-R’ + HI →R-OH + R’-I
- Взаимодействие с соляной кислотой (HCl)
В результате данной реакции образуются нестойкие соли оксония.
- Взаимодействие с кислородом (окисление)
При хранении простых эфиров на воздухе образуются перекиси.
CH3-O-CH3 + O2→ CH3-O-O-CH3
Из-за образованных перекисей в процессе перегонки эфира может произойти взрыв, поэтому особенно важно очищать эфиры перед началом работы.
Химические реакции сложных эфиров
Химические реакции сложных эфиров обусловлены нуклеофильной атакой по атому углерода, находящимся в карбонильной группе, и замещением алкоксигруппы.
- Взаимодействие с водой (гидролиз)
При кислотном гидролизе сложный эфир превращается в исходную карбоновую кислоту и спирт. Реакция проходит в присутствии минеральной кислоты.
CH3-C(O)O-C2H5 + H2O → CH3COOH + C2H5OH
При щелочном гидролизе образуются соль карбоновой кислоты и спирт. Данная реакция необратима.
CH3-C(O)O-C2H5 + NaOH→ CH3-C(O)ONa + C2H5OH
Следует обратить внимание на то, что кислотный гидролиз обратим.
- Взаимодействие с водородом (гидрирование, или восстановление)
В процессе гидрирования образуются две молекулы спирта. Реакция идет при наличии катализатора.
C2H5-C(O)O-C2H5 + 2H2→ 2C2H5OH
CH3-C(O)O-C2H5 + 2H2→ CH3OH + C2H5OH
- Взаимодействие с аммиаком
При взаимодействии сложных эфиров и аммиака образуются амиды кислот и спирты.
C2H5-C(O)O-C3H7 + NH3→ C2H5-C(O)NH2 + C3H7OH
- Взаимодействие с кислородом (горение)
2СН3-С(О)О-СН3 + 7О2→2СО2 + 6Н2О
Применение эфиров
Простым эфирам характерна химическая инертность, поэтому они могут играть роль растворителя. Эфиры с разветвленными радикалами применяются в качестве антидетонационных добавок в моторных топливах. Также благодаря приятным запахам их можно встретить в парфюмерной продукции.
Сложные эфиры используются в парфюмерной, косметической продукции, пищевой промышленности, производстве лаков, красок, клеев и лекарственных препаратов. Также они могут выступать в роли растворителей.
Применение сложных эфиров.
Из сложных эфиров низших карбоновых кислот и спиртов, производят различные эссенции, а от ароматических спиртов – парфюмерную продукцию. Воски входят в состав смазочных веществ, кремов и мазей.
В XIX-ХХ веках ученые получили и изучили сложные эфиры, которые легли в основу многих лекарств. В число препаратов из эфиров входят салол, валидол. Раньше в качестве обезволивающего средства использовался метилсалицилат, который на современном рынке вытеснен другими эффективными лекарственными препаратами.
…
Простые эфиры – это органические вещества, в которых два углеводородных радикала соединены с атомом кислорода. Их можно представить как соединения, образованные замещением обоих атомов водорода молекулы воды двумя алкильными радикалами или замещением гидроксильного водорода спиртов одним алкильным радикалом. Далее рассмотрим каково Строение, изомерия и номенклатура простых эфиров.
Строение простых эфиров
Атомы углерода в насыщенных простых эфирах находятся в состоянии sp3— гибридизации, если углеводородный радикал имеет двойную связь – в состоянии sp2-гибридизации. В качестве примера приведем строение диэтилового эфира:
Подробно образование sp3— гибридных атомов рассмотрены в разделе Алканы, sp2-гибридных атомов — в разделе Алкены. Также общие принципы гибридизации атомных орбиталей рассмотрены в разделе Химическая связь и строение молекул/Метод валентных связей.
Классификация простых эфиров
Различают симметричные и несимметричные (смешанные) простые эфиры. В симметричных простых эфирах углеводородные остатки (радикалы) имеют одинаковое строение, а в смешанных – различное, например, дибутиловый эфир — симметричный, а метилбутиловый эфир — смешанный:
Кроме этого, существует классификация, построенная на различии в строении углеводородного радикала. Согласно этой классификации углеводородная цепь простых эфиров может быть:
- Открытая:
- Замкнутая (циклическая):
А сами углеводородные радикалы:
- Насыщенные:
- Ненасыщенные:
- Ароматические:
Изомерия и номенклатура простых эфиров
Общая формула простых эфиров CnH2n+2O. В другом виде общую формулу можно представить как R-O-R или R-O-R`, где R и R`— алкильные радикалы (насыщенные, ненасыщенные или ароматические).
По общей формуле видно, что простые эфиры изомерны спиртам, например, изомерами являются соединения с брутто формулой С5Н12О 2-пентанол и этилизопропиловый эфир:
Кроме обычных видов изомерии, для простых эфиров характерна и метамерия – это вид изомерии, которая заключается в существовании нескольких эфиров с одинаковой общей формулой, но в структуре которых алкильные радикалы отличаются числом углеродных атомов, например, этилбутиловый эфир и дипропиловый эфир:
Номенклатура простых эфиров обусловлена характером алкильных радикалов. Низшие эфиры обычно называют в соответствии с правилами рациональной номенклатуры, т.е. сначала дают названия радикалов, к которым затем прибавляют слово эфир. Если радикалы одинаковые, то к названию радикала прибавляют приставку -ди, если разные, то называют каждый из радикалов:
Простые эфиры, имеющие более сложное строение, называют по номенклатуре ИЮПАК как алкоксиалканы или алкоксиарены:
Для некоторых простых эфиров часто используют тривиальные названия (указаны в скобках):