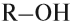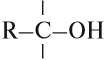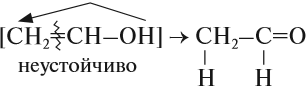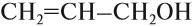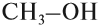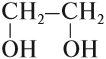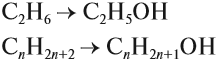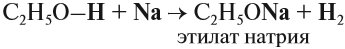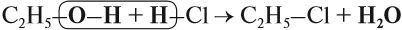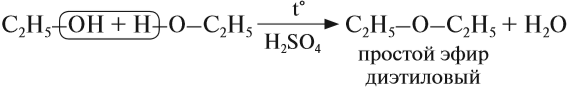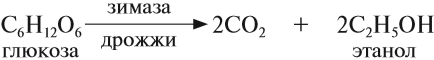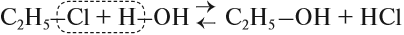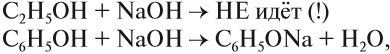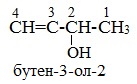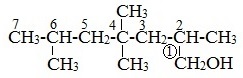Содержание
- Определение
- Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства одноатомных спиртов
- Физические свойства
- Химические свойства
- Получение и применение спиртов (на примере этилового спирта)
- Многоатомные спирты
- Понятие о фенолах
- Выводы
Определение
Спирты — это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксогруппу ОН.
Если углеводородный радикал обозначить буквой R, то в общем виде формулу молекулы спирта можно изобразить так:
У атома углерода, который соединен с гидроксогруппой, все связи должны быть простыми:
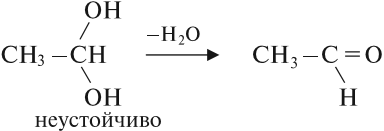
Соединения, у которых гидроксогруппа находится рядом с двойной связью, неустойчивы:
По строению углеводородного радикала спирты делят на:
- предельные
в углеводородном радикале, все связи простые;
- непредельные
в углеводородном радикале, есть кратная связь;
- ароматические
имеется бензольное кольцо, т. е. в углеводородном радикале есть ароматическая связь.
По числу гидроксогрупп спирты делят на:
- одноатомные
в состав молекулы входит одна гидроксогруппа ОН;
- многоатомные
в состав молекул входит две или более (много) гидроксогрупп.
Рассмотрим строение молекул и свойства предельных одноатомных спиртов.
Гомологический ряд, номенклатура, изомерия
Для того чтобы вывести общую формулу гомологического ряда предельных одноатомных спиртов, сравним их состав и состав алканов:
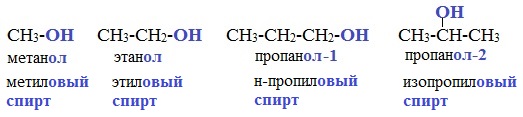
В названиях спиртов гидроксогруппа обозначается суффиксом ОЛ. Этот суффикс прибавляется к названию исходного углеводорода:
Кроме этих названий (по ИЮПАК) для простейших спиртов используют рациональные названия, которые происходят от названия радикала:
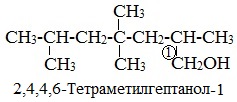
Начиная с n = 3, для спиртов возможна изомерия. Она связана с положением группы ОН в молекуле:
Вопрос. Как обозначить положение группы ОН в молекуле?
Как всегда, положение группы ОН обозначают цифрой, которая соответствует номеру атома углерода, соединённому с группой ОН. Нумерацию основной цепи начинают с того конца, к которому ближе группа ОН.
Таким образом: название спирта (1) пропанол-1; название спирта (2) пропанол-2.
Поскольку спирты называют «по радикалам», эти спирты можно назвать и так: пропиловый спирт (1) и изопропиловый спирт (2).
Задание 22.1. Составьте молекулярные формулы этих спиртов и убедитесь, что это — изомеры.
Спирты изомерны простым эфирам, в молекулах которых атом кислорода соединяет два углеродных радикала (это изомерия между разными классами веществ):
Простые эфиры — это вещества, в молекулах которых два радикала соединены атомом кислорода. Поэтому их называют, исходя из названий радикалов. Например, простой эфир (3) — это диметиловый эфир.
Задание 22.2. Составьте графическую формулу изомера пропиловых спиртов, который является простым эфиром. Назовите его.
Строение молекул
Если при помощи графической формулы показать строение молекулы этилового спирта, то легко можно увидеть, что атомы водорода в ней неравноценны:
Действительно, пять атомов водорода соединены с атомами углерода, а один — с атомом кислорода. Теория Бутлерова утверждает, что «атомы в молекуле взаимно влияют друг на друга». Поэтому можно ожидать, что этот атом водорода будет отличаться от остальных пяти. Это отличие заключается в том, что связь О–Н гораздо более полярна, чем связи С–Н. Дело в том, что атом кислорода имеет бОльшую электроотрицательность, чем атом углерода, т. е. способен сильнее смещать к себе общую пару электронов. В результате, на атомах кислорода и водорода связи О–Н появляются значительные заряды (+) и (–).
Вопрос. На каком атоме появляется (+), а на каком (–)?
Величина этих зарядов меньше единицы, но они способны притягивать к себе молекулы других реагирующих веществ, т. е. активнее участвовать в химических реакциях будут наиболее полярные связи.
Вывод. Самыми полярными связями в молекуле спирта являются связи О–Н и О–С. За счёт их разрыва происходят химические реакции (спирт функционирует). Поэтому ОH — функциональная группа спиртов.
Свойства одноатомных спиртов
Физические свойства
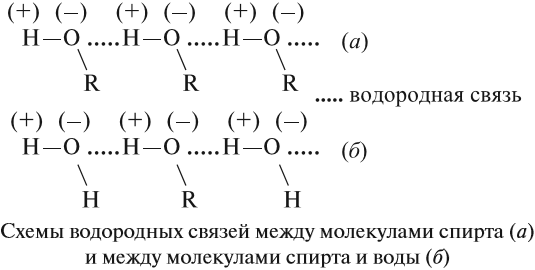
Поскольку в молекуле спирта появились полярные связи, он, в отличие от углеводородов, будет иметь более высокие температуры кипения и плавления (если сравнивать соединения с одинаковым числом атомов углерода). Это связано с тем, что полярные молекулы сильнее притягиваются друг к другу, и для того чтобы оторвать их друг от друга (перевести жидкость в газ), нужно затратить много энергии — дополнительно нагреть. Кроме того, между молекулами спиртов возникают водородные связи (а), которые дополнительно притягивают молекулы друг к другу. Поэтому этиловый спирт — бесцветная жидкость (а этан и диметиловый эфир — газы!) с т. кип. 78 °C. Спирт хорошо растворим в воде, так как и с молекулами воды спирт образует водородные связи (б).
Водородные связи непрочные, поэтому низшие одноатомные спирты (мало атомов углерода в молекуле) — летучие жидкости с характерным запахом.
Химические свойства
Спирты могут реагировать с натрием и другими щелочными металлами. При этом атом водорода ОН-группы замещается на атом металла:
Вопрос. Неорганические вещества какого класса способны вступать в реакции замещения с металлами, в результате чего выделяется водород?
Аналогичную реакцию дают кислоты, поэтому в этой реакции спирт проявляет кислотные свойства. Но это очень слабые свойства, так как растворы спиртов не изменяют окраску индикаторов и не реагируют с растворами щелочей.
Спирты реагируют с неорганическими кислотами:
В этой реакции отщепляется молекула воды, — значит, это реакция дегидратации. При записи таких реакций формулы исходных веществ записывайте так, чтобы функциональные группы были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга. Так, в результате реакции дегидратации, в которой участвуют две молекулы спирта, образуется простой эфир (дегидратация межмолекулярная):
Эта реакция происходит в присутствии концентрированной серной кислоты. Если смесь спирта и концентрированной серной кислоты нагреть сильнее, то молекула воды отщепляется от одной молекулы спирта (дегидратация внутримолекулярная):
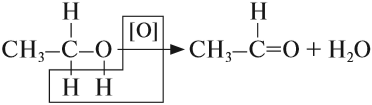
Спирты, у которых ОН-группа соединена с первым (последним) атомом углерода углеродной цепочки (первичные спирты) легко окисляются нагретым оксидом меди CuO, превращаясь в альдегиды:
При составлении этой реакции рекомендуется выделить (подчеркнуть) те атомы, которые образуют воду, и записать новую формулу без этих атомов. Спирты горят, образуя, как и углеводороды, углекислый газ и воду.
Задание 22.3. Составьте уравнение реакции горения этилового спирта.
Таким образом, для спиртов характерны реакции:
- замещения атома водорода ОН-группы;
- дегидратации (отщепления воды);
- окисления.
Все эти реакции идут с участием ОН-группы функциональной группы спиртов.
Задание 22.4. Составьте уравнения таких реакций для пропанола-1 (пропилового спирта). Уравнения реакций составляйте по аналогии с вышеперечисленными.
Получение и применение спиртов (на примере этилового спирта)
Этанол и другие спирты можно получить из алкенов.
Вопрос. При помощи какой реакции можно это осуществить (при затруднении см. урок 19.3)?
Задание 22.5. Составьте уравнение этой реакции.
Полученный таким способом спирт используют в технических целях: в качестве растворителя, для получения каучука, пластмасс и др. Кроме того, спирт используют как горючее.
Пищевой и медицинский спирты получают брожением глюкозы:
В лаборатории этиловый спирт можно получить гидролизом (взаимодействием с водой) хлорэтана:
Для того чтобы эта реакция стала необратимой, используют водный раствор щёлочи.
Задание 22.6. Составьте уравнения реакций:
- пропен + вода;
- 1-хлорпропан + NaOH (водный).
Назовите полученные вещества.
Многоатомные спирты
Многоатомные спирты содержат две и более гидроксогруппы в молекуле. При этом каждый атом углерода в молекулах спиртов может соединяться только с одной гидроксогруппой ОН, в противном случае образуются неустойчивые соединения:
Задание 22.7. Составьте формулы многоатомных спиртов, в молекуле которых:
- два атома углерода и две гидроксогруппы;
- три атома углерода и три гидроксогруппы.
У вас получились формулы простейших многоатомных спиртов:
Вопрос. Как в названии спирта обозначить число гидроксогрупп?
Названия по IUPAC этих спиртов составляют, используя уже известные правила, т. е. к названию углеводорода добавляют суффикс ОЛ, а перед ним указывают число ОН-групп при помощи префиксов ди- или три-. Например, этиленгликоль получит название: этандиол.
Задание 22.8. Назовите по правилам IUPAC глицерин.
Вопрос. Как вы считаете, какой из спиртов будет иметь большую температуру кипения — глицерин или пропанол-1? А растворимость в воде?
Многоатомные спирты за счёт многочисленных ОН-групп образуют многочисленные водородные связи и друг с другом, и с водой. Поэтому они имеют бОльшие температуры кипения и бОльшую растворимость в воде по сравнению с соответствующими одноатомными спиртами. Так, глицерин — бесцветная, густая жидкость, без запаха; он смешивается с водой в любых соотношениях и способен поглощать влагу из воздуха. Более того, безводный глицерин может отнимать воду из живых клеток кожи, вызывая ожоги. Растворы глицерина, наоборот, смягчают кожу.
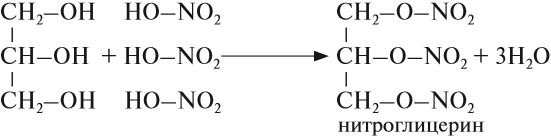
Химические свойства глицерина и других многоатомных спиртов очень похожи на свойства одноатомных спиртов: они реагируют с натрием и НСl, образуют эфиры, могут окисляться. Например, глицерин реагирует с азотной кислотой:
Нитроглицерин входит в состав сильнейшей взрывчатой смеси динамита. Его раствор используется как лекарство.
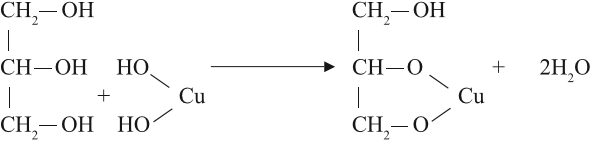
Но в химических свойствах многоатомных спиртов есть и существенные отличия. Так, они могут растворять осадок гидроксида меди II, образуя ярко-синий раствор:
Реакция происходит при обычных условиях, причём полученное соединение очень прочное: не изменяет свой цвет даже при кипячении. Одноатомные спирты такую реакцию не дают.
Вывод. Реакция растворения голубого осадка гидроксида меди II с образованием ярко-синего раствора — это качественная реакция на многоатомные спирты.
Задание 22.9. Составьте уравнения реакций этиленгликоля:
- с азотной кислотой;
- с Сu(ОН)2.
Подсказка. При составлении уравнений этих реакций записывайте формулы многоатомных спиртов так, чтобы цепочки атомов углерода располагались вертикально, а группы ОН были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга.
Глицерин находит широкое применение в кожевенной промышленности (смягчает кожу), используется в медицине, входит в состав невысыхающих красок. Кроме того, глицерин, точнее, остаток его молекулы входит в состав любого жира. Поэтому глицерин часто получают из природных жиров (уравнение реакции в уроке 25).
Понятие о фенолах
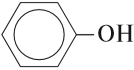
К фенолам относятся вещества, в молекулах которых гидроксогруппа ОН непосредственно связана с бензольным кольцом:
В этой молекуле ОН-группа и бензольное кольцо взаимно влияют друг на друга. Поэтому фенол по свойствам отличается и от спиртов, и от бензола. Рассмотрим примеры такого влияния.
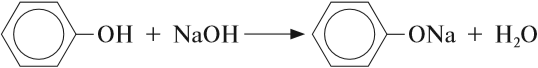
Бензольное кольцо влияет на ОН-группу, делая её более полярной, чем у спиртов. Поэтому фенол, в отличие от спиртов, реагирует с растворами щелочей:
или
В данной реакции фенол проявляет свойства кислоты. Отсюда его второе название — карболовая кислота («карболка»). Растворы фенола изменяют окраску индикатора.
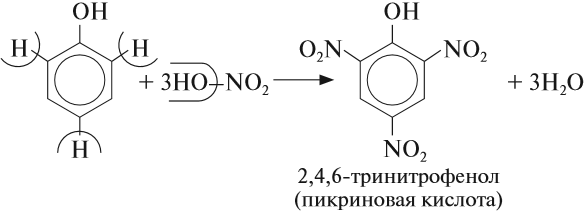
Гидроксогруппа влияет на бензольное кольцо. Фенол очень легко вступает в реакции замещения, причём, как и для толуола, реакция происходит в положениях 2, 4, 6 по отношению к гидроксогруппе:
В отличие от спиртов и бензола фенол обесцвечивает бромную воду даже при нормальных условиях. Реакция протекает аналогично предыдущей.
Задание 22.9. Составьте уравнение реакции фенола с бромом и сравните эту реакцию с реакцией толуола с бромом.
Фенол легко окисляется на воздухе, при этом его белые кристаллы розовеют. Фенол сильно ядовит, так как изменяет структуру и свойства белков — основу всего живого. Кроме того, попадая в воду, он окисляется растворённым в ней кислородом. В результате содержание кислорода в водоёме уменьшается, и обитатели его погибают. Для того чтобы обнаружить фенол в водоёме и любом растворе, используют качественную реакцию с FeCl3: при добавлении этого реактива к смеси, содержащей фенол, появляется фиолетовое окрашивание.
Фенол получают из производных бензола и каменноугольной смолы. В любом случае вначале исходное вещество или смесь превращают в фенолят, а затем выделяют чистый фенол при помощи кислоты:
Фенол применяют для дезинфекции и получения красителей и полимеров.
Выводы
Спирты и фенолы — это производные углеводородов, содержащие функциональную группу ОН. Для таких веществ характерны реакции замещения атома водорода в гидроксогруппе.
Спирты за счёт функциональной группы ОН образуют простые и сложные эфиры (см. урок 25), а фенолы реагируют и за счёт функциональной группы ОН, и за счёт ароматического ядра.
План урока:
Формула и строение спиртов
Классификация спиртов
Номенклатура спиртов
Изомерия спиртов
Методы получения спиртов
Физические свойства
Химические свойства
Применение спиртов
Формула и строение спиртов
Спирты из-за наличия функциональной группы -ОН можно рассматривать как производное воды Н-О-Н. Геометрическое строение воды и спиртов схоже. Угол связи R-O-H равен 109˚, при этом гидроксильный кислород находится в состоянии sp3-гибридизации.
Строение молекулы спирта
У спиртов особенное электронное строение. Алкоголи – дипольные молекулы, которые содержат связи C-H, C-O, O-H. Атом кислорода имеет частично отрицательный заряд, а атомы углерода и водорода – частично положительный. Связь О-Н имеет большую полярность, по сравнению со связью С-О. Это явление связано с разностью электроотрицательности кислорода и водорода. Но полярность связей недостаточна для диссоциации и образования ионов Н+. Поэтому можно сделать вывод, что спирты – неэлектролиты.
Формула спиртов: CnH2n+1OH
Классификация спиртов
В классификации спиртов заключены особенности строения молекул. По числу гидроксильных групп различают одноатомные, двухатомные, трехатомные и многоатомные спирты.
Также спирты классифицируют в зависимости от положения гидроксильной группы на первичные, вторичные и третичные.
Номенклатура спиртов
Для спиртов свойственно несколько типов номенклатуры.
- Тривиальная (историческая) номенклатура. Для простых спиртовых соединений свойственны упрощенные названия. В этом случае название радикала переводят в прилагательное с помощью окончания «овый» и добавляют слово «спирт». Например, CH3-CH2-CH2-OH – пропановый спирт.
У первых двух представителей гомологического ряда есть особенные исторические названия. Метанол – древесный спирт, а этанол – винный. Такие названия обусловлены историческим методом получения. Опьяняющие свойства этанола были известны не менее чем за 8000 лет до н.э.
- Систематическая номенклатура спиртов. Как правило, в химии используют именно этот вид номенклатуры. В одноатомных спиртах к названию радикала добавляется суффикс «ол», в двухатомных – «диол», в трехатомных – «триол». Положение гидроксигруппы обозначается наименьшим значением, если в составе спирта отсутствует карбонильная и/или карбоксильная группа.
Алгоритм названия спиртов
Систематическая номенклатура подчиняется определенному алгоритму.
- Выбор главной цепи в соединении.
- Нумерация начинается с того конца, к которому ближе функциональная группа.
- Название углеводородного радикала.
- Прибавление окончания «ол» и указание номера атома углерода, с которым связана гидроксогруппа.
Изомерия спиртов
Для спиртов свойственно несколько видов изомерии – изомерия углеродного скелета, положения заместителя и межклассовая (с простыми эфирами). Изомерия углеродного скелета начинается с бутанола.
Типы изомерии спиртов
Способы получения спиртов
Существует несколько реакций получения спиртов.
Реакция проходит по правилу Марковникова, т.е. атом водорода присоединяется к более гидрированному атому углерода, а гидроксильная группа – к менее. Например, в молекуле CH3-CH2-CH=CH2 атом водорода Н+ примыкает к атому углерода, стоящему в СН2 у кратной связи, а гидроксильная группа ОН— – к СН.
Физические свойства
Физические свойства определяются особенностями строения молекулы спирта. Алкоголи – бесцветные жидкости с характерным запахом. Температуры плавления и кипения спиртов выше, чем у соответствующих представителей других классов веществ. По гомологическому ряду они увеличиваются.
Все алкоголи имеют плотность ниже единицы, т.е. они плавают на поверхности воды. Спирты растворимы в большинстве органических растворителях.
Особенность алкоголей заключается в том, что в гомологическом ряде нет газов. Агрегатное состояние спиртов – жидкое или твердое. Это связано с тем, что атом кислорода в гидроксильной группе обладает частично отрицательным зарядом, а атом водорода – частично положительным. Кислород притягивает положительно заряженные атомы и образует с ними водородные связи. Большое количество таких связей обеспечивает «прилипание» молекул спирта между собой и обуславливает особенное строение.
Из этилового спирта изготавливают алкогольные напитки. Несмотря на относительную безопасность употребления этанола, его систематическое употребление пагубно влияет на организм:
- 100 мл пива – гибель 3000 клеток головного мозга,
- 100 мл вина – гибель 5000 клеток головного мозга,
- 100 мл водки – гибель 7500 клеток головного мозга.
В алкогольные напитки вместо этанола могут добавлять метанол, который опасен для жизни. Эти два спирта отличаются по характеру пламени:
- метиловый горит зеленым пламенем,
- этиловый – синим.
Но при наличии примесей в метаноле, зеленое пламя может и не появиться.
Химические свойства
Реакции замещения
- Замещение водорода в гидроксильной группе
- Взаимодействие с активными металлами (например, с натрием)
Реакция проводится в безводной среде. В воде алкоголяты металлов полностью гидролизуются.
2CH3-CH2-O[H] + 2Na → 2CH3-CH2-ONa + H2
- Взаимодействие с кислотами (этерификация)
CH3-O[H + HO]-NO2→ CH3-O-NO2 + H2O
- Замещение гидроксигруппы
- Взаимодействие с галогеноводородами при нагревании
CH3-CH2-[OH + H]Br→ CH3-CH2-Br + H2O
- Взаимодействие с аммиаком
Реакция идет при пропускании смеси паров спирта с аммиаком при 300˚С над оксидом алюминия.
CH3-CH2-[OH +H]-NH2→CH3-CH2-NH2 + H2O
При избытке в спирте алкильных радикалов в молекуле аммиака могут замещаться два или три атома водорода.
2CH3-CH2-[OH + H]-NH2 → C2H5-NH-C2H5 + 2H2O
Реакции отщепления
- Дегидратация
- Межмолекулярная дегидратация в присутствии концентрированной серной кислоты и при 140˚С
CH3-CH2-O[H + НО]-СН2-СН3→С2Н5-О-С2Н5 + Н2О
CH3-O[H + HO]-CH2-CH3→ CH3-O-C2H5 + H2O
- Внутримолекулярная дегидратация в присутствии концентрированной серной кислоты и при 170˚С
OH]-CH2-CH2-[H →CH2=CH2 + H2O
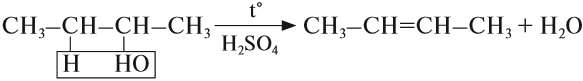
Для метанола не характерна внутримолекулярная дегидратация. Реакция вторичных и третичных спиртов проходит по правилу Зайцева. Т.е. при отщеплении воды от спирта атом водорода отрывается от соседнего менее гидрированного атома углерода. Например, в молекуле CH3-CH2-CH(OH)-CH3 атом водорода Н+ отщепляется от атома углерода в СН3, находящегося вблизи гидроксильной группы.
CH3-CH(OH)-CH2-CH3→CH3-CH=CH-CH3 + H2O
- Дегидрирование в присутствии катализатора меди и под действием нагревания
Реакции окисления
- Полное окисление (горение)
CH3-CH2-OH + 3О2→ 2СО2 + 3Н2О
Неполное окисление
Качественная реакция на многоатомные спирты
Качественная реакция – химическое превращение, которое сопровождается характерными признаками. С ее помощью можно распознать определенное вещество.Строение многоатомных спиртов, т.е. присутствие в молекуле нескольких гидроксильных групп, обуславливает образование при взаимодействии со свежеполученным осадком гидроксида меди (II) растворимых в воде комплексов василькового цвета.
Строение одноатомных спиртов такая качественная реакция не подтверждает.
Применение спиртов
Метанол, или древесный спирт, опасен для употребления. Он был получен путем перегонки твердых древесных пород. Этот одноатомный спирт недобросовестные производители алкогольных напитков применяют вместо этанола, что провоцирует гибель потребителей. Древесный спирт в организме под влиянием фермента алкогольдегидрогеназы преобразуется в формальдегид и муравьиную кислоту, которые провоцируют слепоту. 50 мл метанола – смертельная доза. Метанол непросто отличить от этанола, т.к. они имеют схожий запах и вид.
Применение метилового спирта
Области применения этилового спирта разнообразны. Этиловый спирт используют в получении синтетического каучука, лекарственных препаратов и применяют как растворитель. Этанол используется в изготовлении алкоголя. При попадании в организм он снижает болевые ощущения, уменьшает торможения в коре головного мозга, ускоряет мочеобразование, провоцирует расширение кровеносных сосудов. При больших количествах этанола происходит его окисление до ацетальдегида, что вызывает тяжелые отравления.
При систематическом употреблении алкоголя снижается работоспособность головного мозга, а клетки печени погибают. Дети и подростки, употребляющие алкоголь, подвержены инфекционным заболеваниям. Продолжительность жизни пьющих людей меньше на 10-12 лет по сравнению с людьми, ведущих здоровый образ жизни.
Применение этилового спирта.
Практическое применение трехатомный спирт глицерин нашел в косметической, медицинской и пищевой промышленности. Он смягчает и успокаивает кожу. Также глицерин входит в состав зубной пасты, что предотвращает ее высыхание.
Применение глицерина
Многоатомный спирт глицерин также применяют в промышленной отрасли для предотвращения кристаллизации продуктов. Его используют как увлажнитель для табака. Он входит в состав клеев и предохраняет их от слишком быстрого высыхания.
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у
насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH.
Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы
OH — глицерины) и т.д.

Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода),
вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).

Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол,
этанол, пропанол, бутанол, пентанол и т.д.

Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с
простыми эфирами, которых мы также коснемся в данной статье.

Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
- Гидратация алкенов
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
- Получение этанола брожением глюкозы
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором
щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода,
а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.

В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.

Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных
химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.

В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).

Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения.
У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
- Окисление спиртов
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся
алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.

В результате реакций спиртов с кислотами образуются различные эфиры.

Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t < 140°С), в результате которого образуются простые эфиры. При более
высокой температуре (t > 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:

Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое
окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при
которых углеродный скелет подвергается деструкции.

Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой
реакции выпадает маслянистый осадок.

Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие
от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.

Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор
окрашивается в характерный синий цвет.

Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов).
Это говорит об их более выраженных кислотных свойствах.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса «ол». Это разгружает словесную часть названия от цифр (например, 2-метилбутанол-1). В англоязычной литературе цифру ставят перед названием главной цепи: 2-метил-1-бутанол. Правила IUPAC разрешают учитывать особенности национального языка.
Другой способ построения названий спиртов основан на радикально-функциональной номенклатуре
Радикально-функциональная номенклатура ИЮПАК
Кроме заместительной номенклатуры, в основе которой лежит выбор родоначальной структуры, а соединение рассматривают как продукт замещения атомов водорода в этой структуре, правила ИЮПАК включают также радикально-функциональную номенклатуру.
Радикально-функциональная номенклатура обычно применяется для несложных органических соединений некоторых классов (спиртов, простых эфиров, кетонов, галогенопроизводных). В этом случае название составляют из названий углеводородных радикалов, а наличие функциональной группы, в отличие от заместительной номенклатуры, отражают не суффиксом, а названием соответствующего класса соединений.
Например:
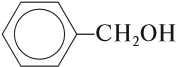
- C2H5OH — этиловый спирт;
C2H5Cl — этилхлорид;
CH3–O–C2H5 — метилэтиловый эфир;
CH3–CO–CH=CH2 — метилвинилкетон.
Не следует давать названия, в которых смешаны обе номенклатуры: изопропанол, трет-бутанол и т.п. (так как нет соответствующих углеводородов – изопропан или трет-бутан). Правильные названия этих соединений: изопропиловый спирт или пропанол-2, трет-бутиловый спирт или 2-метилпропанол-2.
В этом случае названия одноатомных спиртов производят от названий радикалов с добавлением слова «спирт» (название класса). В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт,
н-пропиловый
спирт, изопропиловый спирт.
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
Название спиртов по заместительной номенклатуре ИЮПАК образуется от названия соответствующих алканов с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо).
Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа. Цифрами после суффикса «ол» указывают положение гидроксильной группы в главной цепи.
По другому способу (радикально-функциональная номенклатура ИЮПАК) названия спиртов производят от соответствующего углеводородного радикала с добавлением слова «спирт», например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт, СН3-СН2-СН2-ОН – н-пропиловый спирт, СН3-СН(ОН) -СН3 – изопропиловый спирт.
В нумерации атомов углерода в главной цепи положение гидроксильной группы имеет приоритет перед положением кратных связей.
Непредельные спирты, содержащие гидроксильную группу у атома углерода, связанного двойной связью, называются енолами. Название этого класса соединений образовано из суффиксов —ен и —ол, указывающих на присутствие в молекулах двойной связи и гидроксильной группы.
Енолы, как правило, неустойчивы и самопроизвольно превращаются (изомеризуются) в карбонильные соединения — альдегиды и кетоны. Эта реакция обратима, а сам процесс называют кето-енольной таутомерией.
Для некоторых спиртов сохранились тривиальные (упрощенные) названия, сложившиеся исторически: винный спирт С2Н5ОН, пропаргиловый спирт НС≡ССН2–ОН, глицерин (глицерол) HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4, фенетиловый спирт С6Н5–CH2–CH2–OH.
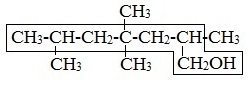
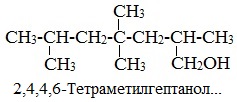
Правила составления названий алканолов с разветвленной цепью по международной номенклатуре
1. Найти в молекуле самую длинную прямую углеродную цепь, связанную с гидроксильной группой.
2. Пронумеровать атомы «С» в этой цепи так, чтобы атом «С», связанный с группой –ОН, имел наименьший номер.
3. Назвать алкан, соответствующий самой длинной цепи, указав положение всех заместителей.
4. Обозначить гидроксильную группу суффиксом –ол.
5. Цифрой указать положение группы –ОН.
Предельные одноатомные спирты