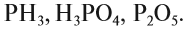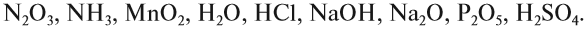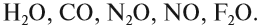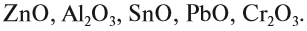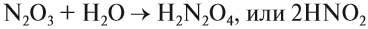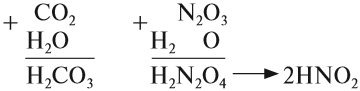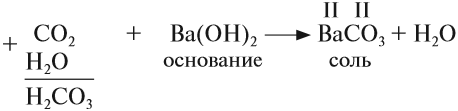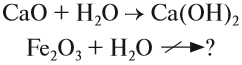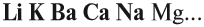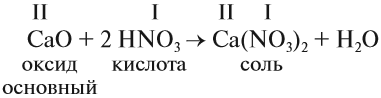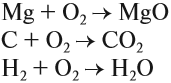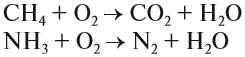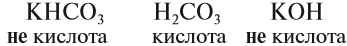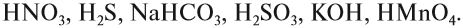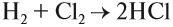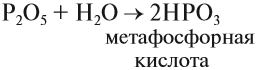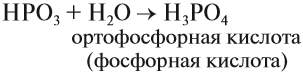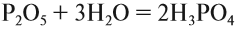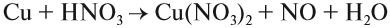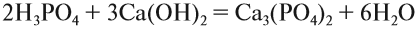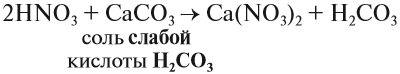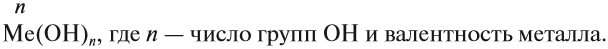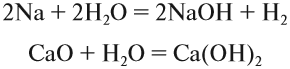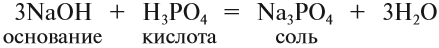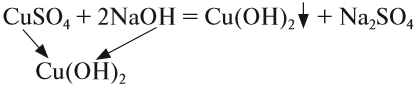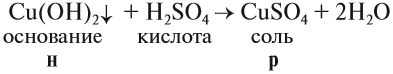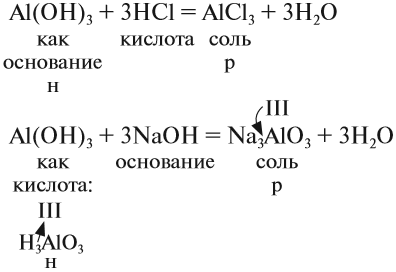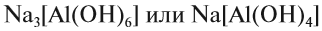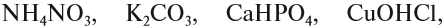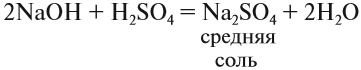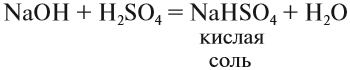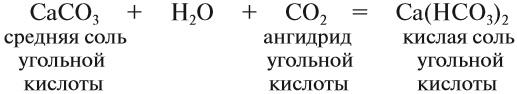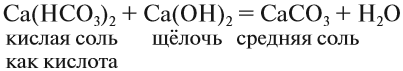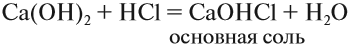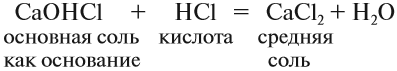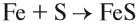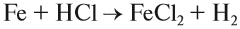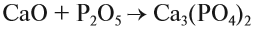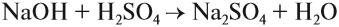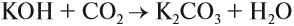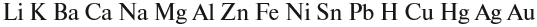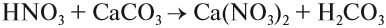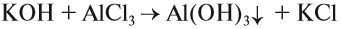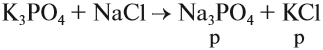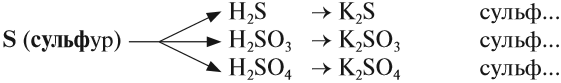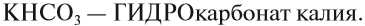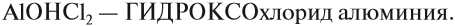Основные оксиды

4.6
Средняя оценка: 4.6
Всего получено оценок: 2457.
4.6
Средняя оценка: 4.6
Всего получено оценок: 2457.
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?
Классификация оксидов
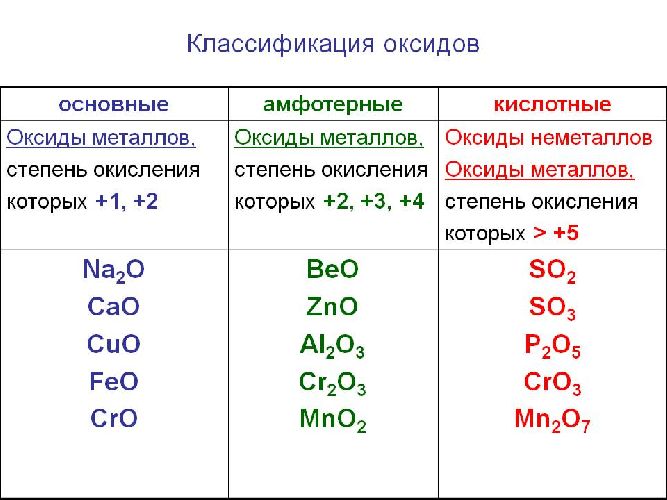
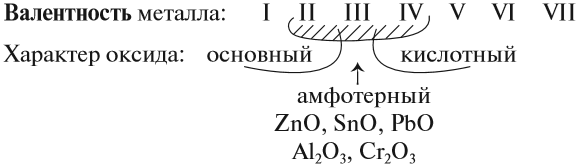
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO2), так и твердыми (Fe2O3) или жидкими веществами (H2O).
При этом большинство основных оксидов является твердыми веществами различных цветов.
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
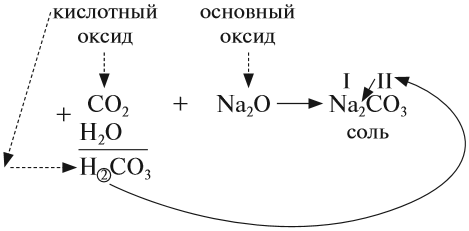
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K2O, СaO соответствуют основания KOH, Ca(OH)2 .
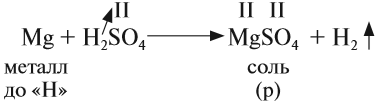
Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
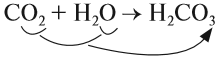
CaO (основной оксид)+CO2 (кислотный оксид)=СaCO3 (соль)
FeO (основной оксид)+H2 SO4 (кислота)=FeSO4 (соль)+2H2O (вода)
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
CaO+ZnO=CaZnO2
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
BaO (основной оксид)+H2O (вода)=Ba(OH)2 (основание щелочнозем. металла)
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
3CuO+2NH3 =3Cu+3H2 O+N2
При нагревании разлагаются только оксиды ртути и благородных металлов:
2AU2O=4Au+O2
2HgO=2Hg+O2
Список основных оксидов:
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
| Оксид калия | K2O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na2O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов
Что мы узнали?
При образовании основных оксидов одним из обязательных элементов является кислород.Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
10/10
-
Ярослав Галкин
10/10
-
Николай Булахов
9/10
-
Инал Абдуллаев
10/10
-
Дворникова Кристина
8/10
-
Ахмад Махаров
7/10
-
Сергей Ефремов
8/10
-
Анастасия Вострикова
10/10
-
Данила Волков
10/10
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 2457.
А какая ваша оценка?
Содержание
- Оксиды
- Свойства кислотных оксидов
- Свойства основных оксидов
- Свойства амфотерных оксидов
- Способы получения оксидов
- Выводы
- Кислоты
- Свойства кислот
- Выводы
- Основания
- Свойства и способы получения щелочей
- Свойства и способы получения нерастворимых в воде оснований
- Свойства амфотерных гидроксидов
- Выводы
- Соли
- Способы получения солей
- Названия солей
- Выводы
Оксиды
Оксиды — сложные вещества, молекулы которых состоят из атомов двух химических элементов, один из которых — кислород. Атом кислорода в оксидах всегда имеет степень окисления –2.
Определите, какое из следующих соединений — оксид:
Оксидом является последнее соединение — P2O5 (в состав РН3 не входит атом кислорода, а в состав H3PO4 входят атомы трёх химических элементов: H, Р, O).
Оксиды называют по схеме:
оксид чего? (название элемента).
Например: СаО — оксид кальция.
Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность.
Например: Fe2О3 — оксид железа III, FеО — оксид железа II.
Задание 2.1. Среди следующих соединений найдите оксиды и назовите их:
Задание 2.2. Составьте формулы следующих оксидов: оксид хрома III, оксид углерода IV, оксид магния, оксид серы VI, оксид азота V, оксид калия, оксид марганца VI.
Многие оксиды могут реагировать с кислотами или основаниями. Продуктами таких реакций являются соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов, которые к таким реакциям не способны. Такие оксиды называются несолеобразующими:
Задание 2.3. Назовите эти несолеобразующие оксиды.
Некоторые оксиды имеют особые (тривиальные) названия:
Солеобразующие оксиды делятся на три группы: основные, кислотные, амфотерные.
Точно установить характер оксида можно, только изучая его химические свойства. Например, кислотные оксиды реагируют с основаниями и не реагируют с кислотами. Основные оксиды реагируют с кислотами и не реагируют с основаниями. Амфотерные оксиды могут реагировать и с кислотами, и с основаниями, причём, реагируя с кислотами, они проявляют свойства основных оксидов, а реагируя с основаниями, — кислотных.
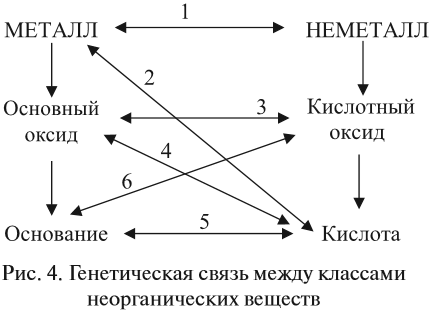
Отсюда вывод: в химических реакциях участвуют вещества с противоположными свойствами:
- основание и кислота;
- металл и неметалл;
- окислитель и восстановитель.
Впрочем, последние два случая мы рассмотрим позднее (см. уроки 2.4 и 7).
Поэтому, если определить по формуле оксида, какими свойствами он обладает, — можно предсказать, возможна ли эта реакция или нет! Но КАК это сделать? Вот некоторые правила:
- неметаллы образуют только кислотные оксиды*;
- металлы могут образовывать разные оксиды — основные, амфотерные, кислотные — в зависимости от валентности металла.
* Обратите внимание, что и безразличные оксиды образуются только неметаллами.
Предсказать свойства оксида металла может помочь эта схема.
Итак, основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Но как быть с амфотерными оксидами? «Любимая» валентность металлов в этих оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов:
Задание 2.4. Назовите эти амфотерные оксиды.
Задание 2.5. Классифицируйте нижеприведённые оксиды:
Упражнение рекомендуется выполнить по схеме:
1. Определить, не является ли данный оксид несолеобразующим;
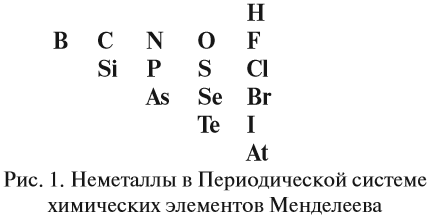
2. Определить, какой элемент входит в состав оксида: металл или неметалл, для чего выписать из таблицы Менделеева символы элементов – неметаллов: они расположены в главных подгруппах выше линии БОР — АСТАТ и на этой линии. Это:
3. Если в состав оксида входит атом неметалла — то оксид кислотный;
4. Для атома металла определить валентность, и по схеме определить характер оксида: основный, амфотерный или кислотный.
Например:
- Сr2О3 — амфотерный, так как хром — металл с низкой валентностью III;
- N2O3 — кислотный оксид, так как азот — неметалл;
- СrO3 — кислотный оксид, так как хром — металл с высокой валентностью VI.
Зная характер оксида, можно описать его свойства.
Свойства кислотных оксидов
1. Кислотные оксиды, кроме SiО2, реагируют c водой, образуя кислоту:
Чтобы составить формулу кислоты, нужно «сложить» все атомы исходных веществ, записывая на первом месте символ водорода, на втором — символ элемента, образующего оксид, и на последнем — символ кислорода. Если индексы получились чётными, их можно сократить:
Эти же реакции можно записать в виде «арифметического примера»:
Задание 2.6. Составьте уравнения реакций с водой для кислотных оксидов из задания 2.5, зная, что реакции идут по схеме:
кислотный оксид + вода → кислота
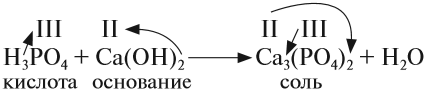
2. Кислотные оксиды реагируют с основными оксидами, образуя соль соответствующей кислоты, т. е. кислоты, которая образуется при взаимодействии этого оксида с водой (см. выше):
Для того чтобы составить такое уравнение, нужно:
- составить формулу кислоты («прибавив» к молекуле оксида молекулу воды);
- определить валентность кислотного остатка (это часть молекулы кислоты без атомов водорода). В данном случае кислотный остаток имеет состав СО3, его валентность равна числу атомов водорода в кислоте, т. е. II;
- составить формулу соли, записав вместо атомов водорода атом металла из основного оксида с его валентностью (в данном случае — натрий);
- составить формулу соли по валентности металла и кислотного остатка.
Задание 2.7. Составьте уравнения реакций с оксидом кальция кислотных оксидов из задания 2.5, зная, что реакции идут по схеме:
кислотный оксид + основный оксид → соль
3. Кислотные оксиды реагируют с основаниями, образуя соль соответствующей кислоты и воду:
Принципы составления уравнения те же, что и для реакций с основными оксидами (см. пункт 2).
Задание 2.8. Составьте уравнения реакций с гидроксидом натрия NаОН кислотных оксидов из задания 2.5, зная, что реакции идут по схеме:
кислотный оксид + основание → соль + вода
ЗАПОМНИТЕ! Кислотные оксиды и с кислотами и кислотными оксидами НЕ РЕАГИРУЮТ!
Свойства основных оксидов
1. Основные оксиды реагируют с водой, образуя основание. Реакция происходит, если получающееся основание растворимо в воде.
Общая формула оснований Ме(ОН)х, где х — валентность металла, равная числу ОН групп.
Последняя реакция не идет, так как основание Fe(ОН)3 нерастворимо в воде. Растворимость веществ в воде можно определить по таблице растворимости (рис. 2).
При определении возможности протекания данной реакции можно использовать и другое правило.
Основный оксид реагирует с водой, если он образован активным металлом. Такие металлы стоят в ряду напряжений до магния (см. табл. 3).
Задание 2.9. Составьте уравнения реакций с водой для основных оксидов из задания 2.5, зная, что реакции идут по схеме:
основный оксид + вода → основание
2. Основные оксиды реагируют с кислотами, образуя соль и воду:
Обратите внимание: при составлении формулы соли нужно вместо атомов водорода в формуле кислоты написать символ металла, а затем составить полученную формулу по валентности.
Задание 2.10. Составьте уравнения реакций с Н2SО4 для основных оксидов из задания 2.5, зная, что реакции идут по схеме:
основный оксид + кислота → соль + вода
3. Основные оксиды реагируют с кислотными оксидами, образуя соль (см. задание 2.7).
4. Некоторые основные оксиды реагируют при нагревании с водородом, при этом образуется металл и вода:
ЗАПОМНИТЕ! Основные оксиды с основаниями и основными оксидами НЕ РЕАГИРУЮТ!
ВЫВОД. В реакцию легче всего вступают вещества с противоположными свойствами, и не вступают в реакцию вещества со сходными свойствами.
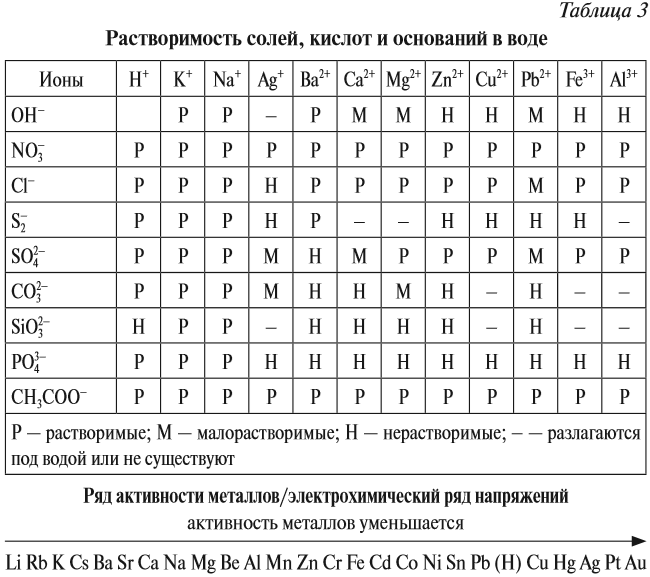
Свойства амфотерных оксидов
Амфотерные оксиды (от греч. amphi — двойной) проявляют двойственные свойства: они могут реагировать и с кислотами, и с основаниями (точнее, со щелочами). При этом образуются соль и вода.
Например,
* Такая реакция не происходит, но эта схема позволяет определить состав «кислотного остатка» и его валентность, а затем составить химическую формулу соли.
Задание 2.11. Составьте уравнения реакций с КОН и с НNО3 для амфотерных оксидов из задания 2.5.
Задание 2.12. С какими веществами (Н2О, NаОН, НСl) могут реагировать оксиды: Cr2O3, CrO, SO3, V2O5?
Составьте уравнения необходимых реакций. При составлении уравнений реакций помните:
- реагируют вещества с противоположными свойствами;
- сначала определите, какой это оксид (см. задание 2.5);
- затем, исходя из свойств этого оксида, составьте уравнения, пользуясь схемами заданий 2.6–2.10 и вышеприведенными уравнениями реакций для амфотерных оксидов.
Способы получения оксидов
Оксиды могут быть получены при разложении некоторых кислот, оснований, солей:
Оксиды обычно получают при сгорании в кислороде простых и сложных веществ:
Обратите внимание! При сгорании сложных веществ образуются оксиды элементов, которые входят в его состав. Исключение составляют только азот и галогены (F, Cl, Br, I), которые выделяются в виде простых веществ. Например:
Выводы
Молекулы оксидов состоят из атомов двух элементов. Один из этих элементов — кислород. Оксиды, образующие соли, бывают кислотные, амфотерные и основные. Оксиды реагируют с веществами, которые проявляют противоположные свойства.
- Основные оксиды — с кислотными оксидами или кислотами.
- Кислотные оксиды — с основными оксидами или основаниями.
- Амфотерные — и с кислотами, и с основаниями (щелочами).
В каждой из таких реакций образуется соль и вода.
Кислоты
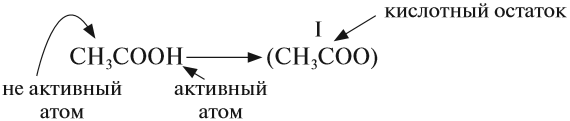
Кислоты — это сложные вещества, в состав молекул которых входит активный атом водорода и кислотный остаток. Этот активный атом водорода в химических реакциях способен замещаться на атом металла, в результате чего всегда получается соль.
В формулах неорганических кислот этот атом водорода записывается на первом месте*:
* В химических формулах органических кислот атом водорода стоит в конце, например, CH3–COOH уксусная кислота
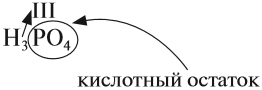
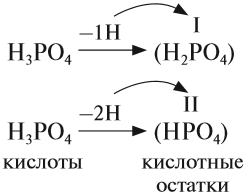
В состав любой кислоты кроме атомов водорода входит кислотный остаток. Кислотный остаток — это часть молекулы кислоты без атомов водорода (которые могут быть замещены на атом металла). Валентность кислотного остатка равна числу таких атомов водорода:
При определении валентности кислотного остатка учитываются те атомы водорода, которые участвовали в реакции или могут участвовать в ней. Так, фосфорной кислоте Н3РО4, в зависимости от условий, могут соответствовать кислотные остатки иного состава:
У органических кислот не все атомы водорода в молекуле способны замещаться на атом металла:
Задание 2.13. Определите состав и валентность кислотных остатков для кислот, учитывая, что все атомы водорода кислот участвуют в реакции:
По числу атомов водорода кислоты делят на одноосновные и многоосновные:
- НСl — одноосновная, так как один атом водорода;
- Н2СО3 — двухосновная, так как два атома водорода.
По составу кислоты делят на:
- бескислородные: НСl, Н2S;
- кислородсодержащие: НСlO, Н2SO4.
Бескислородные кислоты представляют собой растворы некоторых газов в воде, при этом и растворённому газу, и полученному раствору приписывают одинаковые свойства, хотя это не так. Например, из простых веществ водорода и хлора получается газ хлороводород:
Этот газ не проявляет кислотных свойств, если он сухой: его можно перевозить в металлических ёмкостях, и никакой реакции не происходит. Но при растворении хлороводорода в воде получается раствор, который проявляет свойства сильной кислоты, её перевозить в металлических ёмкостях нельзя! Этот раствор называется «соляная кислота».
Названия бескислородных кислот составляют по принципу:
«ЭЛЕМЕНТ» + «ВОДОРОД»ная кислота
- H2S — сероводородная кислота (это раствор газа сероводорода в воде);
- НСl — хлороводородная (соляная) кислота (это раствор газа хлороводорода в воде);
- НF — фтороводородная (плавиковая) кислота (это раствор газа фтороводорода в воде).
Кислородсодержащие кислоты могут быть получены при действии воды на кислотные оксиды (см. задание 2.6). Исходные кислотные оксиды называются «АНГИДРИДЫ кислот»:
Метафосфорная кислота неустойчива и, присоединяя воду, превращается в более устойчивую кислоту:
или в суммарном виде:
Таким образом, Р2O5 — ангидрид фосфорной кислоты, а также некоторых других, менее устойчивых кислот.
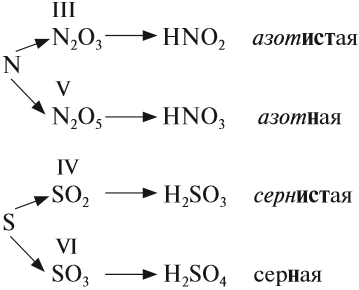
Обратите внимание! Название кислородосодержащей кислоты содержит в виде корня название элемента, входящего в состав ангидрида:
Если элементу соответствуют несколько кислот, то для кислоты с большей валентностью элемента, входящего в состав ангидрида, в названии употребляют суффикс «Н» или «В». Для кислот с меньшей валентностью элемента в названиях добавляют еще один суффикс «ИСТ».
Валентность элемента проще всего определять по формуле ангидрида:
Обратим внимание, что в названии сернистой кислоты основной суффикс -ИСТ-, а суффикс -Н- введён дополнительно для благозвучия.
Сведём всё известное о названиях кислот в таблицу 4.
Задание 2.14. Заполнить табл. 4, заменив знаки вопросов формулами и названиями соответствующих кислот.
Задание 2.15. Напишите НА ПАМЯТЬ формулы кислот: кремниевой, сернистой, серной, сероводородной, азотистой, азотной, соляной, фосфорной, угольной. Укажите ангидриды этих кислот (там, где они существуют).
Свойства кислот
Главным свойством всех кислот является их способность образовывать соли. Соли образуются в любой реакции, в которой участвует кислота, при этом замещаются активные атомы водорода (один, все или несколько).
1. Кислоты реагируют с металлами, при этом атом водорода кислоты замещается на атом металла — в результате образуется растворимая соль* и водород:
* Если образуется нерастворимая соль, то эта соль закрывает поверхность металла и реакция останавливается.
Не все металлы способны вытеснять водород из растворов кислот: этот процесс возможен только для тех металлов, которые стоят в ряду напряжений ДО водорода (рис. 3 или таблица 3).
Задание 2.16. Составьте уравнения возможных реакций:
- серная кислота + алюминий →
- соляная кислота + серебро →
- бромоводородная кислота + цинк →
При составлении уравнений пользуйтесь рядом напряжений и схемой реакции:
кислота + металл (до водорода) → соль + водород
Не забывайте, составляя формулы солей, учитывать валентность металла и кислотного остатка.
Некоторые кислоты могут растворять металлы, которые стоят в ряду напряжения после водорода, но водород при этом не выделяется:
2. Кислоты реагируют с основаниями, образуя соль и воду*. Это реакция обмена, и поэтому валентность составных частей в результате реакции не меняется:
* Реакция между кислотой и основанием называется реакцией нейтрализации.
Расставим коэффициенты:
Задание 2.17. Составьте аналогичные уравнения реакций по схеме:
кислота + основание → соль + вода
для:
- серной кислоты и Fe(ОН)3;
- соляной кислоты и Ва(ОН)2;
- сернистой кислоты и NаОН.
Не забудьте:
- составить формулу соли по валентности металла и кислотного остатка;
- расставить коэффициенты.
3. Кислоты могут реагировать с солями. При этом сильная кислота вытесняет более слабую из её соли.
- К сильным кислотам относятся: серная, азотная, соляная и др.
- К слабым кислотам относятся: угольная, кремниевая, сероводородная, азотистая.
Происходит реакция обмена: образуется новая соль и новая кислота.
Более подробно о подобных реакциях см. в уроке 6.
Задание 2.18. Составьте НА ПАМЯТЬ формулы: а) сильных, б) слабых кислот.
Задание 2.19. Составьте уравнения реакций по схеме:
(более сильная) кислота + соль → соль + кислота (более слабая):
- соляная кислота + FeS →
- азотная кислота + Na2SiO3 →
- серная кислота + K2CO3 →
4. И, наконец, выяснив свойства кислот, зададим себе вопрос: а можно ли обнаружить кислоту в растворе? Например, в одном стакане налита вода, а в другом — раствор кислоты. Как определить, где кислота? Хотя многие кислоты кислые на вкус, пробовать их НЕЛЬЗЯ — это опасно! Выручают особые вещества — ИНДИКАТОРЫ. Это соединения, которые изменяют цвет в присутствии кислот:
- синий ЛАКМУС становится красным;
- оранжевый МЕТИЛОРАНЖ тоже становится красным.
Выводы
Кислоты классифицируются:
- по числу атомов водорода на одноосновные, двухосновные и т. д.,
- по наличию атома кислорода в составе молекулы на бескислородные и кислородсодержащие,
- по силе на сильные и слабые,
- по устойчивости на устойчивые и неустойчивые.
Кислоты реагируют:
- с активными металлами (до «Н»),
- с основаниями,
- с основными и амфотерными оксидами,
- с солями более слабых кислот.
Кислоты обнаруживаются индикаторами в кислой («красной») области.
Основания
Основания — это сложные соединения, в состав молекул которых входит атом металла и гидроксогруппа ОН:
Валентность ОН-группы равна I.
Основания называют по схеме:
гидроксид (чего?) металла (n),
где n — переменная валентность металла.
Например:
- Са(ОН)2 — гидроксид кальция,
- Fе(OH)3 — гидроксид железа (III),
- NH4OH — гидроксид аммония.
Обратите внимание. В состав последнего основания не входит атом металла. Это исключение. Валентность группы NН4 (аммоний) равна I.
Основания бывают растворимые в воде и нерастворимые в воде. Это легко определить по таблице растворимости.
Растворимые в воде основания называются ЩЕЛОЧАМИ. В состав щелочей входят атомы активных металлов (они находятся в начале ряда напряжений, до магния). Гидроксид аммония тоже относится к щелочам, так как существует только в растворах.
Задание 2.20. Составьте, пользуясь таблицей растворимости или рядом напряжений, химические формулы 2–3 щелочей.
Свойства и способы получения щелочей
Щёлочи можно получить действием активного металла (К, Nа, Cа, Ва) или его оксида на воду:
1. Растворы щелочей реагируют с кислотными и амфотерными оксидами (см. урок 2.1) и с кислотами (см. урок 2.2). Последняя реакция называется реакцией НЕЙТРАЛИЗАЦИИ:
Реакция нейтрализации характерна для всех кислот!
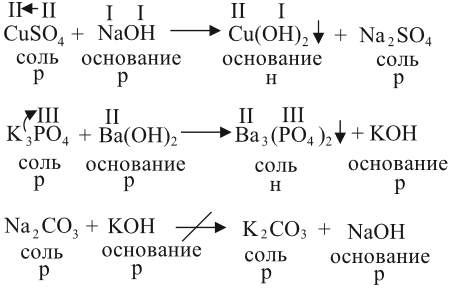
2. Растворы щелочей реагируют с растворами солей. Реакция происходит, если образуется хотя бы одно нерастворимое соединение. Эта реакция относится к реакциям обмена, т. е. в результате получается новая соль и новое основание:
- Последняя реакция не происходит, так как оба полученных вещества растворимы в воде.
- Валентности составных частей исходных молекул определяйте по кислотному остатку или по числу групп ОН.
- Полученные значения валентностей используйте при составлении формул полученных веществ.
- Растворимость получаемых веществ определяйте по таблице растворимости.
Задание 2.21. Расставьте коэффициенты в вышеприведённых уравнениях реакций.
Задание 2.22. Составьте уравнения реакций обмена:
- Fe(NO3)3 + гидроксид калия →
- Na2SO3 + гидроксид кальция →
- K3PO4 + гидроксид аммония →
Определите, какая из реакций не происходит и почему.
3. Растворы щелочей, как и растворы кислот, способны изменять окраску индикаторов:
- фиолетовый лакмус синеет,
- оранжевый метилоранж желтеет,
- бесцветный фенолфталеин краснеет.
Все изменения окрасок индикаторов можно свести в таблицу 5.
Обратите внимание: если к воде добавить кислоты, то в растворе будет кислая среда; если добавить щелочь — щелочная; в чистой воде среда нейтральная.
Вопрос 1. Можно ли при помощи фенолфталеина узнать, что налито в стакане: вода? НCl? КОН? А при помощи лакмуса?
Вопрос 2. Почему реакция между кислотой и щелочью названа реакцией нейтрализации?
Свойства и способы получения нерастворимых в воде оснований
Среди нерастворимых в воде оснований следует выделить особую группу веществ — амфотерные гидроксиды. Их свойства будут рассмотрены ниже. Способы получения их такие же, как и для нерастворимых оснований.
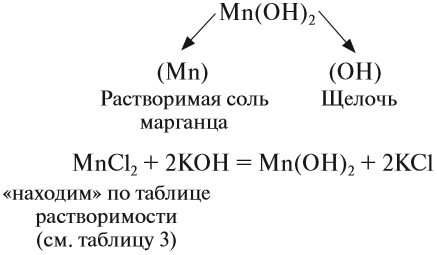
Нерастворимые основания получают, действуя на раствор соли, в состав которой входит нужный атом металла, раствором щёлочи:
Попробуем определить, какие вещества нужно взять для того, чтобы получить гидроксид марганца (II):
Задание 2.23. Напишите уравнения реакций, при помощи которых можно получить: а) гидроксид железа (III), б) гидроксид железа (II).
Свойства нерастворимых в воде оснований во многом отличаются от свойств щелочей: нерастворимые в воде основания не могут реагировать с растворами солей, а также с амфотерными и некоторыми кислотными оксидами. Они не изменяют окраску индикатора.
1. Нерастворимые основания могут реагировать с кислотами, если при этом происходит растворение исходного нерастворимого вещества (осадка):
Таким образом, эта реакция возможна, если образуется растворимая соль (см. таблицу 3).
2. Нерастворимые основания разлагаются при нагревании. При этом, чем меньше активность металла (см. ряд напряжений), тем легче разлагается основание на оксид и воду:
Свойства амфотерных гидроксидов
Амфотерные гидроксиды соответствуют амфотерным оксидам. Это означает, что в состав амфотерного гидроксида входит тот же атом металла и с той же валентностью, что и в состав амфотерного оксида:
Как вы думаете, почему эти вещества называются амфотерными? (Если ответить не можете — загляните в урок 2.1.)
Ответ простой — амфотерные соединения проявляют двойственные свойства, т. е. реагируют) и с кислотами, и со щелочами (и растворяются при этом):
Если эта реакция происходит с растворами щелочей, то вместо вещества состава Na3AlO3 (или NaAlO2)* образуется сложное комплексное соединение:
* Ортоалюминиевая кислота H3AlO3 теряет молекулу H2O, и образуется метаалюминиевая кислота HAlO2, в которой кислотный остаток AlO2 имеет валентность I.
Задание 2.24. Составьте уравнения реакций с кислотой и со щёлочью для амфотерных гидроксидов: а) гидроксида цинка; б) гидроксида хрома (III).
Выводы
Молекулы неорганических оснований содержат гидроксогруппу ОН. Все неорганические основания, кроме NH4OH, содержат атом металла. Основания делят на растворимые в воде (щёлочи) и нерастворимые в воде.
Растворы щёлочей реагируют:
- с кислотами (реакция нейтрализации),
- с кислотными и амфотерными оксидами,
- с растворами солей.
Щёлочи обнаруживаются индикаторами в щелочной («синей») области. Нерастворимые в воде основания не изменяют окраску индикатора, могут реагировать с некоторыми кислотами и кислотными оксидами, а также термически неустойчивы.
Соли
Соли — это продукт реакции между кислотой и основанием, например реакции нейтрализации. Даже если такая реакция невозможна, ЛЮБОЙ соли можно поставить в соответствие основание и кислоту. Поэтому в состав любой соли входит остаток основания (обычно атом металла или группа NH4) и остаток кислоты (кислотный остаток).
Задание 2.25. Попробуйте определить для каждой из этих солей
где в её молекуле остаток кислоты, а где — остаток основания. Определите валентности составных частей.
Обратите внимание, что в состав некоторых солей входят атомы водорода или группы ОН. Такое различие подсказывает, что соли могут быть разных типов. Рассмотрим три вида солей.
Средние соли. Такие соли получаются, если кислота и основание полностью прореагировали:
Кислые соли. Такие соли получаются, если не все атомы водорода кислоты были замещены на атом металла:
Кислотные остатки таких солей содержат атом водорода. Кислые соли образуются в результате гидролиза некоторых солей, а также при взаимодействии средней соли с ангидридом «своей» кислоты:
Кислые соли могут проявлять некоторые свойства кислот, например они могут реагировать с щелочами:
Основные соли. Такие соли образуются, если не все группы ОН основания замещены на кислотный остаток:
Такие соли содержат гидроксогруппу ОН. Основные соли образуются в результате гидролиза некоторых солей. Основные соли могут проявлять некоторые свойства оснований. Например, они могут реагировать с кислотами:
Способы получения солей
Вспомните, во многих примерах, которые иллюстрировали свойства оксидов, кислот, оснований, — продуктом реакции была соль. Попробуем обобщить эти сведения и выяснить, в результате каких процессов можно получить СОЛЬ заданного состава. Прежде всего, отметим, что способы получения солей можно условно разбить на 2 группы:
- I — получение солей из веществ, которые не являются солями;
- II — получение солей из других солей.
Реакции I группы основаны на том, что в реакцию вступают противоположные по свойствам вещества (рис. 4).
Приведём конкретные примеры:
1. Металл + неметалл (галоген или сера):
2. Металл + кислота:
3. Основный оксид + кислотный оксид:
4. Основный оксид + кислота:
5. Основание + кислота:
6. Основание + кислотный оксид:
Задание 2.26. Расставьте коэффициенты в этих уравнениях. Приведите свои примеры каждого типа.
Реакции II группы являются реакциями обмена или замещения. В каждой из таких реакций участвует соль, и поэтому способы получения солей по группе II фактически являются химическими свойствами солей:
7. Более активный металл вытесняет менее активный из растворов его солей:
обратный процесс не идёт:
Активность металлов можно определять по ряду напряжений:
В этом ряду любой металл активнее всех металлов, стоящих после него (правее него).
8. Сильная кислота вытесняет более слабую кислоту из её соли:
9. Щёлочь, реагируя с солью, образует новое основание и новую соль
Эта реакция происходит, если оба исходных вещества растворимы, а хотя бы одно из полученных веществ — нерастворимо.
10. Соль, вступая в реакцию обмена с другой солью, образует две новые соли
Эта реакция также происходит, если оба исходных вещества растворимы, а хотя бы одно из полученных веществ — нерастворимо.
Например, эта реакция:
невозможна, так как обе полученные соли растворимы. А этот процесс:
невозможен потому, что СаСО3 (мел) нерастворим в воде.
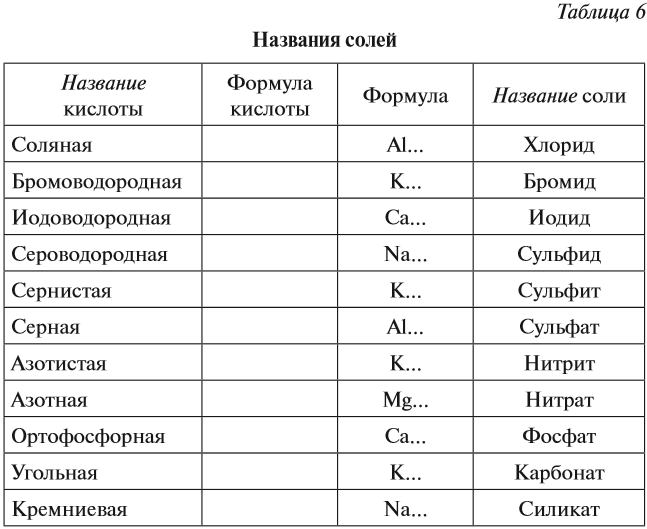
Названия солей
Названия солей происходят от латинского названия химического элемента, который входит в состав кислотного остатка (исключая кислород):
- S — сульфур;
- N — нитрогениум;
- С — карбонеум;
- Si — силициум.
Например:
Очевидно, что для солей разного состава должны быть разные названия. Это достигается введением суффиксов:
- для солей бескислородных кислот -ИД-;
- для солей кислородсодержащих кислот -ИТ- (меньшая валентность элемента), АТ- (бОльшая валентность элемента).
Задание 2.27. Составьте названия вышеприведённых солей серусодержащих кислот.
При правильной работе должно получиться:
Аналогично составляют названия остальных солей (табл. 6).
Задание 2.28. Дополните таблицу 6, составив химические формулы солей тех металлов, которые указаны в таблице.
При составлении названий кислых солей используют частицу «гидро»:
При составлении названий основных солей используют частицу «гидроксо»:
Задание 2.29. Назовите все соли, которые встречаются в тексте и уравнениях реакций этого раздела.
Задание 2.30. Составьте по 3–4 уравнения реакций получения:
- бромида магния;
- сульфата цинка.
Выводы
Соли состоят из остатков веществ, которые проявляют противоположные свойства: кислоты и основания.
.
Порядок составления формул оксидов
Формулы
оксидов можно составлять по правилу креста:

Рис.1

формул первым ставят
элемент степень окисления. которого со знаком +, а
вторым элемент с отрицательной степенью окисления. Для оксидов это
всегда кислород.
Далее
необходимо:
1. расставить степени
окисления
(с.о.) для каждого атома. Кислород в оксидах всегда имеет с.о. -2
(минус два).
2. Для того чтобы
правильно
определить степень окисления. второго элемента необходимо познакомится
с таблицей возможных степеней окисления некоторых элементов:
Таблица.1 Степени окисления некоторых элементов
|
Элемент |
Возможные степени окисления |
| N (азот) | -3, 0, +1, +2, +3, +4,+5. |
| P (фосфор) | -3, 0, +3, +5. |
| S (сера) | -2, 0, +4, +6. |
| C (углерод) | -4, 0, +2, +4. |
Степень окисления «0» —
ноль имеют:
1. Простые вещества: Н2,
Са, О2 …
2. Сложные в-ва (в сумме): Са+2О-2 (+2 – 2 =0)
Степень окисления со знаком +
характерна для элементов которые отдают свои электроны в соединениях
другим атомам или от которых оттянуты общие электронные пары, т.е.атомы
менее электроотрицательных элементов. например металлы
всегда имеют положительную степени окисления.
Подсказка: Узнать степени окисления для металлов
можно в таблице «растворимости…«.
В ней представлены заряды ионов металлов они обычно совпадают со
степенью окисления.
С неметаллами кислород образует оксид, если только этот неметалл менее
электроотрицательный, чем сам кислород см. таблицу
электроотрицательности.
рис.2

окисления.
элементов в бинарных соединениях равны по модулю, то индексы в формуле
не ставятся: Сa+2О-2.
Составим формулу
оксида натрия:
По
таблице растворимости заряд иона натрия +,
соответственно степень окисления натрия имеет значение +1 (Na+1),
с.о. кислорода в оксидах всегда -2.
Натрий
имеет положительный заряд, значит, его ставим первым, а вторым
ставим кислород и по правилу креста получим: Na2+1O-2
или Na2O.
Правило
наименьшего общего кратного
это способ наиболее универсальный для составления формул. Как им
пользоваться рассмотрим на примере.
Составить формулу
оксида серы (VI).
1.
У кислорода с.о. -2 следовательно в формуле он ставиться вторым, а
первым элементом будет сера ее с.о. указана в названии оксида VI, т. е
+6. S+6O-2.
2.
Найдем наименьшее общее кратное. Для чисел 2 и 6 это будет 6.
3.
Находим индексы и расставляем для каждого элемента. См. рисунки ниже.
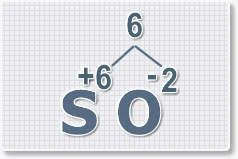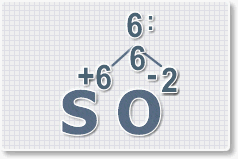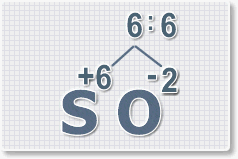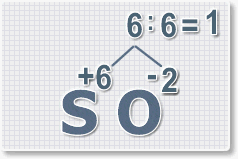
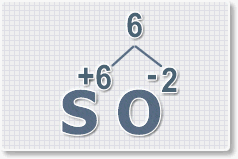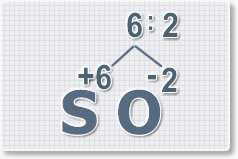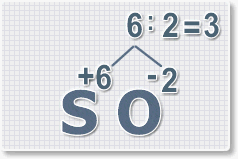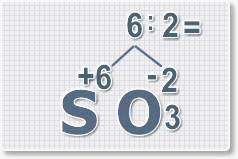
6 : 6 = 1 это индекс для серы.
Индексы со значением 1 в формулах не ставятся.
Рис.3
6 : 2 = 3
это индекс для кислорода
Рис.4
В результате получим
формулу оксида серы (VI):
* * *
Как составить формулы оксидов
Оксиды – это сложные химические вещества, которые состоят из двух элементов. Одним из них является кислород. Оксиды в большинстве случаев бывают кислотными и основными. Как легко понять из названия, кислотные оксиды реагируют с основаниями, образуя соль, то есть, проявляя свойства кислоты. Как составлять формулы оксидов?

Инструкция
Многие из оксидов способны реагировать с водой, образуя кислоту. Например:
SO3 + H2O = H2SO4 (образуется серная кислота).
SiO2 + 2KOH = K2SiO3 + H2O (нерастворимый в воде оксид кремния вступает в реакцию с гидроксидом калия.
Основные оксиды, напротив, вступают в реакции с кислотами, также образуя соль и воду. Те же из них, которые растворимы в воде, реагируют с ней, образуя основание. Характерные примеры:
ZnO + 2HCl = ZnCl2 + H2O (нерастворимый в воде оксид цинка реагирует с соляной кислотой).
Na2O + H2O = 2NaOH
Следует запомнить, что валентность кислорода в оксиде всегда равняется 2. Исходя из этого, при составлении формулы надо лишь знать валентность второго элемента. Например: щелочные металлы первой группы – одновалентные. Поэтому общая формула оксидов будет выглядеть так: Эл2О. Т.е., Li2O, Na2O, K2O, Rb2O. (Эл – «Элемент»).
Щелочноземельные металлы второй группы – двухвалентные. Общая формула оксидов – ЭлО. И выглядеть она будет: ВеО, MgO, СаО, SrO.
Амфотерные элементы третьей группы, соответственно, трехвалентные. Общая формула оксидов – Эл2О3. Характерный пример – уже упоминавшийся оксид алюминия Al2O3.
Элементы четвертой группы проявляют или больше кислотных свойств (углерод, кремний), или больше основных (германий, олово, свинец). В любом случае, общая формула – ЭлО2 (СО2, SiO2).
Общая формула пятой группы – Эл2О5. Пример – высший оксид азота, N2O5, из которого получают азотную кислоту. Или высший оксид ванадия, V2О5 (хотя ванадий – металл, его высший оксид проявляет кислотные свойства).
Соответственно, формула шестой группы, где находится сам кислород – ЭлО3. Высшие оксиды – SO3, СrO3, WO3. Обратите внимание, что хоть хром и вольфрам – металлы, их высшие оксиды по аналогии с оксидом ванадия также проявляют кислотные свойства.
Следует уточнить, что указывались лишь высшие оксиды элементов. Так, например, помимо оксида хрома CrО3, где хром шестивалентен, есть оксид Cr2O3, где этот элемент имеет валентность, равную 3. Помимо оксида азота N2O5, существуют оксиды N2O, NO, NO2. Подобных примеров очень много. Поэтому, при написании формулы оксида, проверяйте, какую валентность имеет в этом соединении элемент, соединенный с кислородом!
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Тренировочные тесты по теме Классификация оксидов.
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например, алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
2Na + O2 → Na2O2
Калий, цезий, рубидий образуют преимущественно надпероксиды состава MeO2:
K + O2 → KO2
Примечания: металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
Но есть некоторые исключения.
Например, сера сгорает только до оксида серы (IV):
S + O2 → SO2
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000оС), либо под действием электрического разряда, и только до оксида азота (II):
N2 + O2 = 2NO
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например, при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
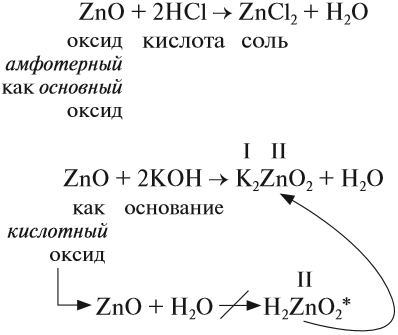
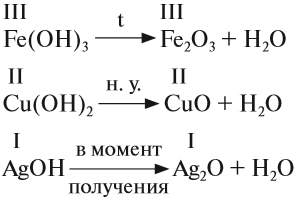
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Li2CO3 → CO2 + Li2O
CaCO3 → CaO + CO2
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Химические свойства основных оксидов.
Химические свойства кислотных оксидов.
Химические свойства амфотерных оксидов.