Алгоритмы отрабатываются сначала в классе
совместно с учителем, затем дома при выполнении
домашнего задания. В результате алгоритм
запоминается автоматически у более сильных
учеников. При работе со слабоуспевающими
учащимися проговариваем алгоритм снова и снова
до тех пор, пока он не запомнится.
Личный опыт показывает высокую эффективность
применения алгоритмов в обучении химии.
Алгоритм “Распределение электронов
в атоме ХЭ”
| 1. Запиши химический символ элемента. |
Распределение Кол-во e (N) на данном ЭУ: N = 2n2 1-й ЭУ 1s… 2-й ЭУ 3-й ЭУ 4-й ЭУ 4s… 4р… 4d… 4f… |
| 2. Слева снизу укажи заряд ядра его атома. |
|
| 3. Определи количество электронов в атоме ХЭ. |
|
| 4. Выясни количество энергетических уровней в атоме данного ХЭ ( = № периода!!!) |
|
| 5. Запиши распределение электронов по ЭУ (под “дугами”) |
|
| 6. Запиши графическую формулу 1-го ЭУ (“квадратик”, “стрелки”). |
|
| 7. Напиши электронную формулу 1-го ЭУ–1s… |
|
| 8. Запиши графическую формулу 2-го ЭУ (“квадратик”, “стрелки”). |
|
| 9. Напиши электронную формулу 2-го ЭУ – 2s… 2р… |
|
| 10. Запиши графическую формулу 3-го ЭУ (“квадратик”, “стрелки”). |
|
| 11. Напиши электронную формулу 3-го ЭУ – 3s… 3р… 3d… |
|
| 12. Если имеется 4-й ЭУ – запиши распределение электронов аналогично. |
|
| Количество электронов на ВЭУ = № группы. |
Химичекий идеал – 8 электронов на внешнем
энергетическом уровне.
В результате отдачи-принятия электронов
образуются химические соединения (вещества).
Алгоритм “Определение типа ХС в
соединении”
| 1. Определи состав соединения – металл-неметалл или неметалл-неметалл. |
|
| 2. Установи тип ХС – ионная, ковалентная (полярная, неполярная). |
|
| 3. Если связь ионная: | 3. Если связь ковалентная: |
| 4. Запиши электронное строение “соединяющихся” атомов по энергетическим уровням (“ДУГИ”) |
4. Запиши электронное строение ВЭУ каждого из “соединяющихся” атомов в виде графической электронной формулы (“СТРЕЛКИ”, “квадратики”). |
| 5. Выясни, сколько электронов может отдать металл для достижения “химического идеала” |
5. Определи количество неспаренных электронов в атомах каждого ХЭ по графической электронной формуле. |
| 6. Выясни, сколько электронов необходимо принять неметаллу для достижения “химического идеала”. |
6. Определи количество обобществляющихся электронов и количество образующихся общих электронных пар. |
| 7. Стрелкой покажи переход электронов от металла к неметаллу. |
7. Выясни значение электроотрица – тельности ХЭ в соединении. |
| 8. Если необходимо – допиши атом металла (неметалла). |
8. Запиши структурную формулу соединения, указав точками общие электронные пары в ( ), учитывая смещение общей электронной пары в сторону более ЭО-го ХЭ (если связь ков. пол.) |
| 9. Укажи состав образовавшихся ионов. |
Степень окисления
|
Степень окисления |
Примеры |
|
0 |
В атомах простых веществ: Na, Fe, O2, N2, B |
|
+ |
Металлы в соединениях: Na+Cl, Fe+2Br2, Fe+3Br3, Ca+2O Менее |
|
– |
Неметаллы в соединениях: NaCl–, FeBr2–, FeBr3–, CaO–2 Более |
Алгоритм составления формулы вещества
по известной степени окисления.
| 1. Запиши знаки ХЭ рядом.
2. Металл на первом
|
| 3. По периодической системе определи степени окисления каждого ХЭ, учитывая характер ХЭ – металл (отдает электроны) или неметалл (принимает электроны) Fe+3Br – 1 |
| 4. Найди наименьшее общее кратное значение степеней окисления ХЭ, образующих вещество. 3 |
| 5. Раздели наименьшее общее кратное на степень окисления металла (менее электроотрицательного ХЭ) > получишь индекс этого ХЭ, запиши индекс справо снизу этого ХЭ. 3 |
| 6. Раздели наименьшее общее кратное на степень окисления неметалла (более электроотрицательного ХЭ) > получишь индекс этого ХЭ, запиши индекс справо снизу этого ХЭ. 3 |
7. Назови соединение.
|
Алгоритм для решения задач
| 1. Составь и запиши “Дано:” – для этого определи, какие вещества взяли и какие получили в результате реакции. |
| 2. Определи, что необходимо найти (какую массу вещества или его количество или другие параметры). |
| 3. В решении составь и запиши уравнение химической реакции. |
| 4. Над формулами веществ запиши известные данные (только для чистых веществ, то есть не содержащих примеси). |
| 5. Над уравнением над формулами веществ запиши неизвестные величины, которые необходимо найти – обозначь их за “х”. |
| 6. Выполни расчеты по уравнению: найди относительную молекулярную, молярную массы и массу по уравнению веществ, с которыми работаешь решая задачу. Запиши эти данные под уравнением. |
| 7. Составь и реши пропорцию. |
| 8. Запиши ответ. |
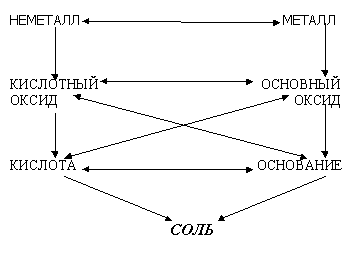
Генетическая связь между классами
неорганических соединений
Алгоритм “Электролиз водного
раствора”
|
1. Запиши уравнение диссоциации |
|
|
2. Запиши уравнение диссоциации |
|
| 3. Запиши ионы, направляющиеся к катоду (учитывай диссоциацию молекул воды). |
3. Запиши ионы, направляющиеся к аноду (учитывай диссоциацию молекул воды). |
| 4. По электрохимическому ряду напряжений металлов определи положение металла, входящего в состав соли. |
4. Выясни состав аниона (кислородсодержащий или бескислородный) |
| 5. Если металл находится правее водорода, то восстанавливается именно он: Сu+2 |
5. Если анион бескислородный, то окисляется именно он: S – 2 – 2ё ––> Sо |
| 5. Если металл находится левее Al (включительно), то восстанавлив- ливаются 2Н+ + 2ё ––> Н2о |
6. Если анион кислородсодержащий, то происходит окисление 4ОН– – 4ё |
| 5. Если металл находится правее Al, но левее водорода, то возможно протекание одновременно 2Н+ + 2ё ––> Н2о Мn+2 + 2ё ––> Мnо |
КАК НАЗВАТЬ органическое соединение
| 1. Определи принадлежность вещества к определенному классу – по наличию кратных связей, функциональных групп. СУФФИКС!!! |
| 2. Пронумеруй самую длинную цепь атомов углерода (или цикл из атомов С) с того края молекулы, к которому ближе кратная связь или функциональная группа. |
| 3. Установи нахождение кратных связей или радикальных групп в углеводородной цепи. |
| 4. Назови радикальные группы, их локализацию. |
| 5. Дай полное название органическому веществу. |
КАК НАПИСАТЬ формулу вещества по
названию
| 1. В названии вещества определите количество атомов углерода в самой длинной цепи. |
| 2. Запишите цепь из атомов углерода. |
| 3. По суффиксу определите принадлежность вещества к конкретному классу и дополните углеводородную цепь кратными связями или функциональной группой. |
| 4. Выделите названия радикалов и их локализацию. Напишите их формулы в углеводородной цепи. |
| 5. Дополните структурную формулу атомами водорода согласно валентности углерода = IV. |
Типичные реакции
Кислот
1. КИСЛОТА + ОСНОВАНИЕ ––> СОЛЬ + ВОДА
H2SO4 + 2NaOH ––> Na2SO4 + 2H2O
2. КИСЛОТА + ОКСИД МЕТАЛЛА > СОЛЬ + ВОДА
HNO3 + K2O ––> KNO3 + H2O
3. КИСЛОТА + МЕТАЛЛ ––> СОЛЬ + ВОДОРОД
2HCl + Zn ––> ZnCl2 + H2
4. КИСЛОТА + СОЛЬ ––> НОВАЯ КИСЛОТА +
НОВАЯ СОЛЬ
H2SO4 + 2NaCl ––> 2HCl + Na2SO4
Солей
1. СОЛЬ + КИСЛОТА ––> ДРУГАЯ СОЛЬ + ДРУГАЯ
КИСЛОТА
2. СОЛЬ + ЩЕЛОЧЬ ––> ДРУГАЯ СОЛЬ + ДРУГОЕ
ОСНОВАНИЕ
3. СОЛЬ + МЕТАЛЛ ––> ДРУГАЯ СОЛЬ + ДРУГОЙ
МЕТАЛЛ
4. СОЛЬ1 + СОЛЬ2 ––> СОЛЬ3 +
СОЛЬ4
Оснований
1. ОСНОВАНИЕ + КИСЛОТА ––> СОЛЬ + ВОДА
H2SO4 + 2NaOH ––> Na2SO4 + 2H2O
2. ЩЕЛОЧЬ + ОКСИД НЕМЕТАЛЛА > СОЛЬ + ВОДА
2LiOH + CO2 ––> Li2CO3 + H2O
3. ЩЕЛОЧЬ + СОЛЬ ––> НОВОЕ ОСНОВАНИЕ +
НОВАЯ СОЛЬ
2KOH + CuCl2 ––> Cu(OH)2 + 2KCl
4. НЕРАСТВОРИМОЕ ОСНОВАНИЕ ––> ОКСИД
МЕТАЛЛА + ВОДА
Cu(ОН)2 ––> CuО + H2O
Основных оксидов
1. ОСНОВНЫЙ ОКСИД + КИСЛОТА ––> СОЛЬ + ВОДА
HNO3 + K2O ––> KNO3 + H2O
2. ОСНОВНЫЙ ОКСИД + КИСЛОТНЫЙ ОКСИД ––> СОЛЬ
Na2O + SO3 ––> Na2SO4
3. ОСНОВНЫЙ ОКСИД + ВОДА ––> ЩЕЛОЧЬ (ОКСИД
АКТИВНОГО МЕТАЛЛА)
Li2O + H2O ––> 2LiOH
Кислотнх оксидов
1. КИСЛОТНЫЙ ОКСИД + ЩЕЛОЧЬ ––> СОЛЬ + ВОДА
2LiOH + CO2 ––> Li2CO3 + H2O
2. КИСЛОТНЫЙ ОКСИД + ОСНОВНОЙ ОКСИД ––> СОЛЬ
Na2O + CO2 ––> Na2CO3
3. КИСЛОТНЫЙ ОКСИД + ВОДА ––> КИСЛОТА
SO3 + H2O ––> H2SO4
ХИМИЯ: Алгоритмы решения типовых задач
Алгоритмы решения типовых задач по химии: последовательность выполнения действий, запись условий задачи обозначениями, оформление решения задачи, запись уравнений реакции, вычисления и ответ. Представлены алгоритмы решения 9-ти типовых задач.
Алгоритм № 1.
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите массу кислорода, выделившегося в результате разложения порции воды массой 9 грамм.
Алгоритм № 2.
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите объем кислорода (н.у.), выделившегося в результате разложения
порции воды массой 9 г.
Алгоритм № 3.
Расчет по химическому уравнению объемных отношений газов
ЗАДАЧА: Вычислите объем кислорода, необходимого для сжигания порции ацетилена объемом 50 л.
Алгоритм № 4.
Вычисление относительной плотности газа по другому газу
ЗАДАЧА: Вычислите плотность кислорода а) по водороду; 6) по воздуху.
Алгоритм № 5.
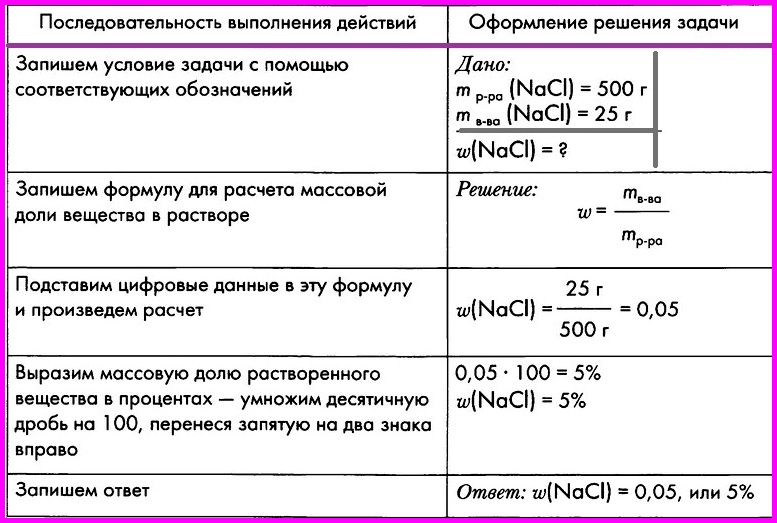
Вычисление массовой доли вещества в растворе
ЗАДАЧА: При выпаривании раствора массой 500 г образовалось 25 г кристаллической соли — хлорида натрия. Вычислите массовую долю соли в исходном растворе.
Алгоритм № 6.
Вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества.
ЗАДАЧА: Вычислите массу гидроксида натрия, необходимого для приготовления 400 г 20%-ного раствора гидроксида натрия.
Алгоритм № 7.
Расчеты по термохимическим уравнениям. Вычисление количества теплоты по известной массе вещества.
ЗАДАЧА: По термохимическому уравнению 2Сu + O2 = 2СuO + 310 кДж вычислите количество теплоты, выделившейся в результате окисления порции меди массой 16 г.
Алгоритм № 8.
Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты.
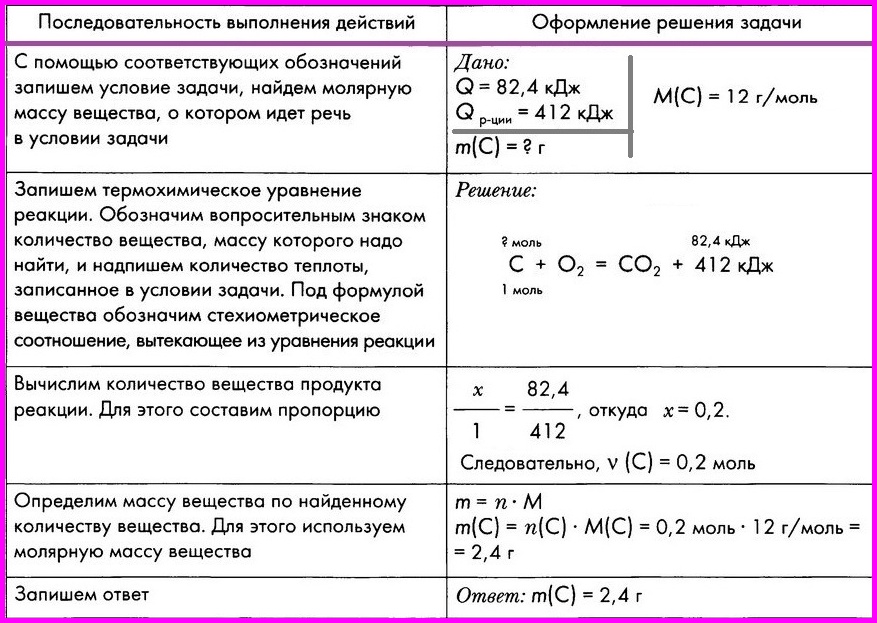
ЗАДАЧА: По термохимическому уравнению С + O2 = СO2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж.
Алгоритм № 9.
Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
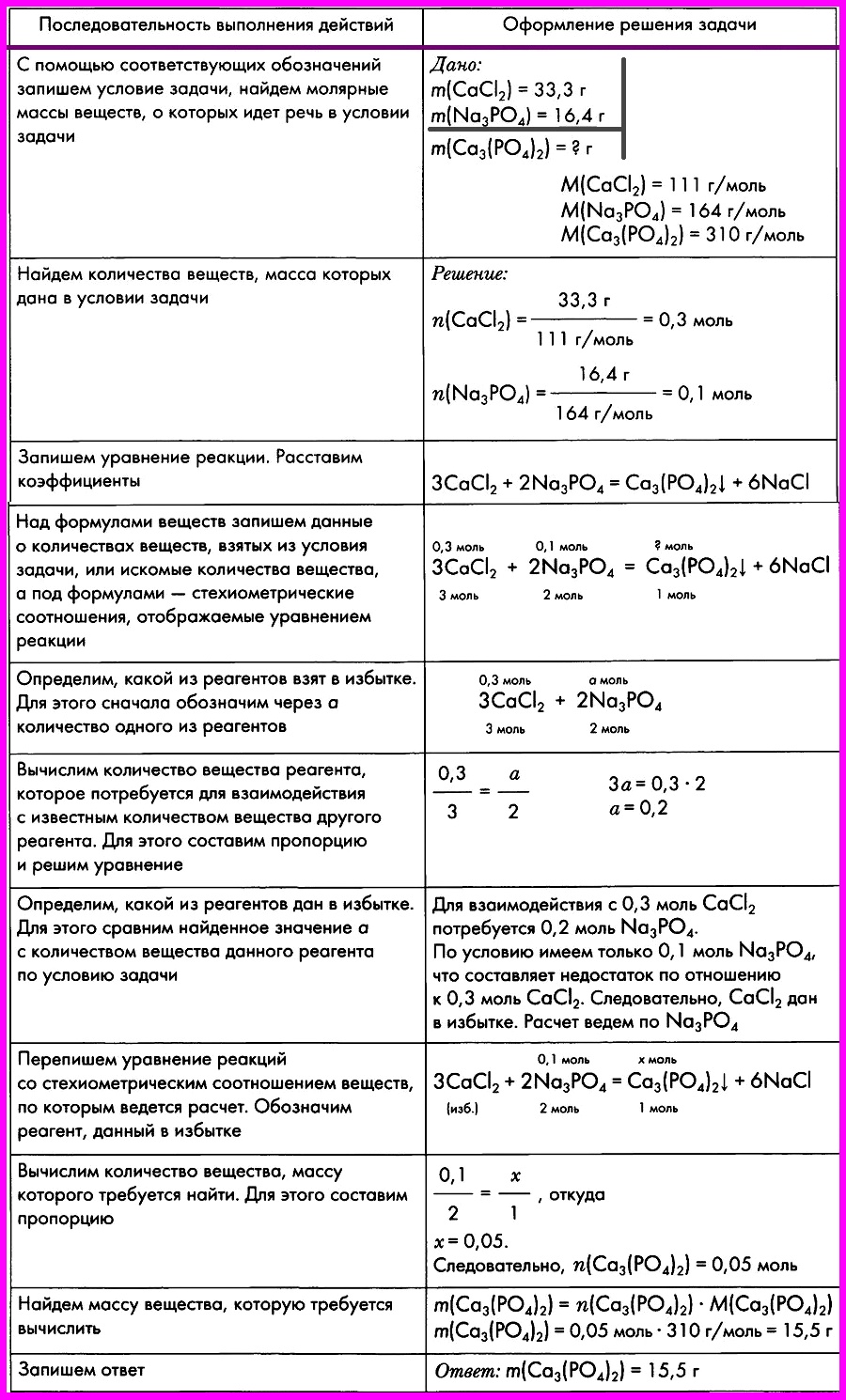
ЗАДАЧА: Смешали два раствора, один из которых содержал 33,3 г хлорида кальция, а другой — 16,4 г фосфата натрия. Вычислите массу образовавшегося фосфата кальция.
Вы смотрели Справочник по химии «Алгоритмы решения типовых задач». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Муниципальное
бюджетное общеобразовательное учреждение –
средняя
общеобразовательная школа №11
имени
Г.М.Пясецкого г. Орла
Утверждаю:
Директор
МБОУ-СОШ №11
__________
Кирилловский Л.Р.
«__»
____________ 2017г.
Согласовано:
Зам.
директора по УВР
___________
Исьемина В.В.
«__»
_____________2017г.
Рассмотрено
на заседании МО
Протокол
№ _____ от
«___»____
________2017г.
Руководитель МО
___________
Старчикова О.В.
АЛГОРИТМЫ и
примеры РЕШЕНИЯ
ЗАДАЧ ПО ХИМИИ
Разработала учитель химии: Суханова
Елена Сергеевна
Орёл 2017
АЛГОРИТМЫ
РЕШЕНИЯ ЗАДАЧ ПО ХИМИИ
1. Физические величины, используемые при решении задач
2. Алгоритм
вычисления массы (объёма) продукта реакции по известной массе или объёму
исходного вещества, содержащего примеси
3. Алгоритм
определения массовой доли элемента в соединении
4. Алгоритм
определения массовых соотношений элементов в соединении
5. Алгоритм определения молекулярной формулы вещества по массовым
соотношениям элементов
6. Алгоритм
расчёта выхода продукта реакции от теоретически возможного
7. Алгоритм
решения задачи на расчёт по уравнению реакции, если одно из реагирующих веществ
дано в избытке
8. Алгоритм
решения задачи на определение молекулярной формулы вещества по продуктам
сгорания
9. Алгоритм определения массовой доли примесей по массе (объёму) продуктов
реакции
10. Алгоритм определения молекулярной формулы кристаллогидрата
11. Алгоритм вычисления количества вещества продукта
реакции по массовой доле исходного вещества в растворе
12. Алгоритм составления термохимического
уравнения реакции (ТХУ)
13. Алгоритм расчёта по
термохимическим уравнениям реакций
14. Алгоритм определения состава смеси
15. Алгоритм вычисления относительной плотности газа
16. Алгоритм вычисления объёма вещества по известной
массе вещества
17. Алгоритм расчёта по
химическому уравнению реакции объёмных отношений газов
18. Алгоритмы решения
задач по уравнению химической реакции.
19. Алгоритмы решения
задач на концентрацию растворов.
1. Физические величины,
используемые при решении задач
|
наименование |
обозначение |
единица |
пример |
можно |
|
масса вещества |
m |
мг; г; |
m (H2O) = 15 г |
m= М· n m= ρ · М m= N/ NA · М m= V/ Vm· М mраств. mраствора = mраств. m = V · ρ |
|
относительная |
Ar |
безразмерная |
Ar (C) = 12 |
Ar смотрим в |
|
относительная |
Mr |
безразмерная |
Mr(H2O) = 18 |
Mr(H2O) = 2 Ar(H) + |
|
количество |
ν (ню) или n |
моль |
n(CH4) = 1,2 моль |
n = m/ М n = V/ Vm n = N/ NA |
|
молярная масса (численно |
М |
г/моль; кг/моль |
M(H2O) =18г/моль |
М = m/ n |
|
объём вещества (1 |
V |
мл; л; м3 |
V(O2) = 10 л |
V = Vm· n V=(m/ М) · Vm V = m/ ρ |
|
молярный объём |
Vm |
л/моль; м3/моль |
Vm= 22,4 |
Vm= V/ n Vm= М/ ρ Vm= V· (М/ m) |
|
плотность вещества |
ρ (ро) |
г/мл; г/см3; |
ρ(H2O) = 1 г/мл |
ρ = m/ V ρ = М/ Vm ρгаза = Мгаза/ |
|
относительная |
D |
безразмерная |
D H2 = 16 |
Dгаза по H2 = Мгаза/ Dгаза по |
|
массовая доля |
ω (омега) |
безразмерная или |
ω (С) = |
ω = mраств. |
|
массовая доля |
ω (омега) |
безразмерная или |
ω (С) = |
ω = n Ar/ Mr, где n – число |
|
объёмная доля |
φ (фи) |
безразмерная или |
φ (H2O) = 0,15 |
φ = V раств. |
|
массовая доля |
η (эта) |
безразмерная или |
η (СО2) |
η = mпракт.вых/ mтеор. η = νпракт.вых/ νтеор. η = Vпракт.вых/ Vтеор. |
|
число Авогадро |
NA |
число частиц |
NA = 6,02 · |
NA = N/ ν |
|
число частиц |
N |
атомы, молекулы |
N(NaOH) = 3,01 · 1023 |
|
|
массовая доля |
ω (омега) |
безразмерная или |
ω (СО2) |
ωчист.в-ва |
2.Алгоритм
вычисления массы (объёма) продукта реакции по известной массе или объёму
исходного вещества, содержащего примеси
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
количественный метод |
|
|
1.Прочитайте текст задачи. |
1.Сколько граммов оксида кальция можно |
|
2.Запишите |
m(CаСO3) = 200 г ω прим.=
m(CаO)=? |
|
3.Составьте |
3.Решение: CаСO3 = CаО + СO2 |
|
4.Массу 1 способ: ω (чист.вещ-ва)= 100% — ω (чист.вещ-ва) Отсюда: m (чист.вещ-ва) 2 способ: m (примеси) m |
4.Решение: 1 способ: ω (чист.вещества) m (чист.вещества) 2 способ: m (примеси) m Выбираем понятный для себя способ решения! |
|
5.В уравнении |
5.CаСO3 = CаО + СO2 |
|
6.Вычислите |
6.М(CаСO3) = 40 + 12 + 16·3 = 100 г/моль М(СaO) = 40 + 16 = 56 г/моль |
|
7.Массу чистого |
7.ν(CаСO3)= |
|
8.Над |
8. 1,8 моль |
|
9.Под |
9. 1,8 моль Х моль 1моль |
|
10.Составить |
10.
ν (CаО) = 1,8 моль. |
|
11.Вычислите m(вещества)= |
11. m(СаО) |
|
12.Запишите |
12.Ответ: |
|
метод |
|
|
1.Повторить |
|
|
7.По формуле m = |
m = m(CаСO3) = 100 г/моль · 1 m(СaO) = 56 г/моль · 1 |
|
8.Над |
3. 180 г |
|
9.Под |
4. 180 100 |
|
10.Составить и решить |
5.
100 г |
|
11.Запишите ответ. |
6.Ответ: |
3.Алгоритм определения
массовой доли элемента в соединении
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Вычислите массовую долю кислорода в дихромате |
|
2.Запишите |
K2Cr2O7
ω (О)=? |
|
3.Найдите |
3.Решение: Mr(K2Cr2O7) = 2Ar(K) + 2Ar(Cr) |
|
4.По |
4. ω = n*Ar(O)/Mr (K2Cr2O7) ω=7*16/294=0,38 или 38% |
|
5.Запишите |
Ответ: ω=0,38 или 38% |
4.Алгоритм определения
массовых соотношений элементов в соединении
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Определить массовые соотношения |
|
2.Запишите |
Al2O3
|
|
3.Найдите |
3.Решение: Mr(Al2O3) = 2Ar(Al) + 3Ar(O) |
|
4.Вычислите |
4. 54/6 : 48/6 = 9 : 8 |
|
5.Запишите |
Ответ: В |
5.Алгоритм определения
молекулярной формулы вещества по массовым соотношениям элементов
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Химическое |
|
2.Запишите |
2.Дано:
ω (N) = 16,47% ω (O) = 57,47%
NaxNyOz |
|
3.Запишите |
3.Решение: Ar(Na) = 23 Ar(N) =14 Ar(O) = 16 |
|
4.Составьте |
4. ω (Na) = ω (N) =16,47/14=1,2 ω (O) =57,47/16=3,6 x : y : z = 1,2 : |
|
5.Если |
x : y : z = 12: 12 |
|
6.Запишите |
Ответ: Простейшая |
6.Алгоритм расчёта выхода
продукта реакции от теоретически возможного
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Определите объём |
|
2.Запишите |
m η (CO2)
V |
|
3.Запишите |
3.Решение: CaCO3 t→ CaO + CO2 |
|
4.Над формулами |
200 CaCO3 t→ CaO + CO2 |
|
5.Вычислите |
Mr (CaCO3) = Ar(Ca) + Ar M(CaCO3) = 100 г/моль |
|
6.По формуле m = М ∙ n (где ν |
m = М · n m (CO2) = 12 |
|
7.Найдем объём |
V = Vm· n V (CO2) = Vm · n (CO2) |
|
8.Под уравнением |
200 CaCO3 t→ CaO + CO2 100 |
|
9.Составьте |
200/100= |
|
10.По |
Vпрактический = 0,9 · |
|
11.Запишите |
Ответ: Vпрактический (CO2) = 40,32 |
7.Алгоритм
решения задачи на расчёт по уравнению реакции, если одно из реагирующих веществ
дано в избытке
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Определите массу |
|
2.Запишите |
m m(H2SO4)
m |
|
3.Запишите |
3.Решение: 2KOH + H2SO4 = K2SO4 |
|
4.Вычислить |
Mr(KOH) = Ar(K) + Ar(O) + Ar(H) = 39 + M(KOH) = 56 г/моль Mr(H2SO4) = 2Ar(H) + M(H2SO4) = 98 г/моль Mr (K2SO4) = 2Ar(K) + M (K2SO4) = 174 г/моль |
|
5.Определим, |
n вещества=m/M n 2KOH=50/112=0,4 n H2SO4= 0,5 |
|
6.Расчёты |
|
|
метод |
|
|
7.Над формулами |
50г 2KOH + H2SO4 = K2SO4 |
|
8.Под уравнением |
m(KOH) = n · M = 2 m(K2SO4) = n · M = 1 50 г 2KOH + H2SO4 = K2SO4 112 174 |
|
9.Составьте |
50/112=x/174 x=77,7г |
|
количественный |
|
|
1.Выполняем |
|
|
7.Над формулами |
0,9 моль x 2KOH + H2SO4 = K2SO4 |
|
8.Под уравнением |
0,9 моль 2KOH + H2SO4 = K2SO4 |
|
9.Составьте |
0,9/2=x/174 |
|
10.Запишите |
Ответ: m(K2SO4) = 77,7 г |
8.Алгоритм решения задачи
на определение молекулярной формулы вещества по продуктам сгорания
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.При сгорании 1,3 г бескислородного |
|
2.Запишите |
m (CO2) = 4,4г m(H2O) = 0,9 m(вещества) DH2 = 39
СхHy = ? |
|
3.Запишите |
3.Решение: CxHy + O2 |
|
4.Вычислить |
Mr(CO2) = Ar(C) + 2Ar(O) = 12 M(CO2) = 44 г/моль Mr(H2O) = 2Ar(H) + M(H2O) = 18 г/моль |
|
5.Определим, сколько |
44 г CO2 4,4 г CO2 содержит 44/4,4=12/x x=1,2г |
|
6.Определим, |
18 г H2O 0,9 г H2O содержит 18/0,9=2/Y |
|
7.Находим |
n(C)=1,2/12=0,1 n (H)=0,1/1=0,1 моль |
|
8.Составляем |
Х : Y = 0,1 : |
|
9.Избавляемся от |
Х : Y = 1 : 1 |
|
10.Записать |
СH |
|
11.Рассчитать |
Mr(СH) = Ar(C) + Ar(Н) = 12 + 1 = 13 M(СH) = 13 г/моль |
|
12.Рассчитать |
М(вещества) = DH2. · 2 = 39 |
|
13.Сравнить |
М(вещества) M(СH) 78г/моль 13 |
|
14.Записать |
Ответ: формула |
9.Алгоритм определения
массовой доли примесей по массе (объёму) продуктов реакции
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Определите |
|
2.Запишите |
m (Al4C3) = 200 г V (CH4) = 30 л
ωпримесей = ? |
|
3.Запишите |
3.Решение: Al4C3 + 12Н2О |
|
4.Пусть Х – |
Х г Al4C3 + 12Н2О |
|
5.Под уравнением |
Mr (Al4C3) = 4Ar(Al) + M (Al4C3) = 144 m (Al4C3) = 1 V (СН4) = n (СН4) Х Al4C3 + 12Н2О 144 г 67, 2 л |
|
6.Составьте |
х/144=30/67,2 х=64,3 |
|
7.Определяем |
m(примесей) = 200 г – 64,3 г = 135,7 |
|
8.Определяем |
ωпримесей =135,7/200= |
|
9.Запишите |
Ответ: ωпримесей =68% |
10.Алгоритм определения
молекулярной формулы кристаллогидрата
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Определите |
|
2.Запишите |
mкристаллогидрата = 500 г mсоли = 320 г
CuSO4 .X H2O = ? |
|
3.Запишите |
3.Решение: Кристаллогидрат
|
|
4.Над формулами |
500г CuSO4 · |
|
5.Под уравнением |
Mr (CuSO4) = Ar(Cu) + Ar(S) + 4Ar(O) = 64 + 32 + 4 M (CuSO4) = 250 m (CuSO4) = 1 500 г CuSO4 · Х |
|
6.Составьте |
500/x=320/160 x=250 |
|
7.Вычислить |
m(воды) = m(кристаллогидрата) |
|
8.Вычислите |
Mr (H2O) = 2Ar(Н) + Ar(O) = 2 · 1 + 16 = M (H2O) = 18 г/моль |
|
9.Определить |
n воды=m/M=180г/18г/моль=10 |
|
10.Запишите |
Ответ: CuSO4 · |
11.Алгоритм
вычисления количества вещества продукта реакции по массовой доле исходного
вещества в растворе
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Рассчитайте |
|
2.Запишите |
mраствора = 250 г
n(Н2) |
|
3.Запишите |
3.Решение: Fe + 2HCl = FeCl2 + H2↑ |
|
4.Пользуясь |
mвещ. = mраствора m (HCl) = 250 г · 0,4 = 100 г |
|
метод |
|
|
5.Над формулами |
100 г Fe + 2HCl = FeCl2 + H2↑ |
|
6.Под уравнением |
Mr (HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5 M (HCl) = 36,5 г/моль m (HCl) = 2 моль · 36,5 100 Fe + 2HCl = FeCl2 + H2↑ 73 г 1моль |
|
7.Составьте |
100/73=x/1 x=1,37 |
|
количественный |
|
|
1.Выполняем |
|
|
5.Рассчитать |
Mr (HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5 M (HCl) = 36,5 г/моль |
|
6.Рассчитать |
nHCl = |
|
7.Над формулами |
2,7 Fe+ 2HCl = FeCl2 + H2↑ |
|
8.Под |
2,7 Fe+ 2HCl = FeCl2 + H2↑ 2 2,7 моль/2моль=х |
|
алгебраический |
|
|
1.Выполняем |
|
|
4.По |
Fe+ 2HCl = FeCl2 + H2↑ 2 n (HCl) = 2 моль HCl – 1 |
|
5.Находим |
Mr (HCl) = Ar(H) + Ar(Cl) = 1 + 35,5 = 36,5 M (HCl) = 36,5 г/моль |
|
6.Подставляем |
n (H2) = n=1/2 * 250*0,4/2*36,5 = 1,37 моль |
|
7.Запишите |
Ответ: n (Н2) |
12.Алгоритм составления термохимического уравнения реакции (ТХУ)
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.При сжигании 112г |
|
2.Запишите |
m (Fe) = 112 г Q = 824 кДж
ТХУ |
|
3.Запишите |
3.Решение: 4Fe+3O2 = 2Fe2O3 + Х кДж |
|
4.Над формулами записать, |
112г 4Fe+3O2 = 2Fe2O3 + Х кДж |
|
5.Под уравнением |
Mr (Fe) = Ar(Fe) = 56 M (Fe) = 56 г/моль m (Fe) = 4 моль · 56 112 г 4Fe+3O2 = 2Fe2O3 + Х кДж 224г |
|
6.Составьте |
112 г/224г= |
|
количественный |
|
|
1.Выполняем |
|
|
4.Рассчитать |
Mr (Fe) = Ar(Fe) = 56 M (Fe) = 56 г/моль nжелеза=m/M=112 г/56г/моль |
|
5.Над |
2 4Fe+3O2 = 2Fe2O3 + Х кДж 4 моль 2моль/4моль=824кДж/х |
|
6.Запишите |
Ответ: |
13.Алгоритм расчёта по термохимическим уравнениям реакций
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Вычислить, |
|
2.Запишите |
m (Р) =
Q = ? |
|
3.Запишите |
3.Решение: 4Р+5O2 |
|
4.Над формулами |
6,2 4Р+5O2 |
|
5.Под уравнением |
Mr (Р) = Ar(Р) = 31 M (Р) = 31 г/моль m (Р) = 4 моль · 31 6,2 4Р+5O2 124 |
|
6.Составьте |
|
|
количественный |
|
|
1.Выполняем |
|
|
4.Рассчитать |
Mr (Р) = Ar(Р) = 31 M (Р) = 31 г/моль |
|
5.Над |
0,2 4Р+5O2 4 моль |
|
6.Запишите |
Ответ: |
14.Алгоритм определения состава смеси
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Смесь магния и |
|
2.Запишите |
mсмеси = 10 г Vгаза = 2,5 л
ω (MgO) = ? |
|
3.Составьте уравнения химических реакций. Оба компонента смеси |
3.Решение: 1) Mg + 2НCl = MgCl2 + Н2↑ 2) MgO + 2НCl = MgCl2 + H2O |
|
4.Над формулами |
Х Mg + 2НCl = MgCl2 + Н2↑ |
|
5.Под уравнением |
Mr (Mg) = Ar(Mg) = 24 M (Mg) = 24 г/моль m (Mg) = 1 моль · 24 Х г 2,5 л Mg + 2НCl = MgCl2 + Н2↑ 24 г 22,4 |
|
6.Составьте |
Хг/24г=2,5л/22,4л |
|
7.Рассчитать |
m (MgO) = m (смеси) |
|
8.Рассчитать |
ω (MgO)=mCaO/mсмеси=7,3/10=0,73 или 73% |
|
количественный |
|
|
1.Выполняем |
|
|
4.Рассчитать |
n(H2)=V/Vm=2,5л/22,4л/моль=0,11 моль |
|
5.Над |
Х Mg + 2НCl = MgCl2 + Н2↑ 1 моль 1 Х моль/ Х= 0,11моль |
|
6.Рассчитать |
Mr (Mg) = Ar(Mg) = 24 M (Mg) = 24 г/моль m (Mg)= n*M= 0,11 моль*24 |
|
7.Рассчитать |
m (MgO) = m (смеси) |
|
8.Рассчитать |
ω (MgO) = m MgO/mсмеси= 7,3г/10г=0,73 или 73% |
|
9.Запишите |
Ответ: ω (MgO) = 73% |
15.Алгоритм вычисления относительной плотности газа
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Рассчитать |
|
2.Запишите |
СO2
D(О2) =? |
|
3.Запишите формулу расчёта относительной плотности: |
3.Решение: D=Mr(СO2)/Mr(O2) |
|
4.Вычислить относительные |
Mr (СO2) = Mr (О2) = 2Ar(О) = 2 · 16 = 32 |
|
5.Вставить |
D=44/32=1,375 |
|
6.Записать ответ. |
Ответ: D (О2) = 1,375 |
16.Алгоритм вычисления объёма вещества по
известной массе вещества
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Вычислить, какой |
|
2.Запишите |
m (Cl2) = 213 г
Vгаза (н.у.) |
|
3.Вычислить молярную массу хлора. |
3.Решение: Mr (Cl2) = 2Ar(Cl) = 2 · 35,5= М |
|
4.Вычислить |
nCl2=m/M=213г/71г/моль= 3 моль |
|
5.Рассчитать |
V = n · Vm V = 3 моль · 22,4 л/моль = 67,2 л |
|
6.Запишите ответ. |
Ответ: V =67,2 л |
17.Алгоритм расчёта по химическому уравнению
реакции объёмных отношений газов
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
1.Вычислите |
|
2.Запишите |
V (C3H6) = 30 л
V(O2) = ? |
|
3.Запишите уравнение реакции. |
3.Решение: 2C3H6 + 9O2 = 6CO2 + |
|
4.Над формулами |
30 л Х л 2C3H6 |
|
5.Под уравнением n – коэффициенты перед |
Vm = 22,4 л/моль V = n · Vm V(C3H6) = 2 V (O2) = 9 30 л Х л 2C3H6 44,8 л 201,6 л |
|
6.Составляем |
30л/44,8л=Хл/201,6л Х=135л |
|
или |
|
|
1.Выполняем |
|
|
5.Над |
30 л 2C3H6 2 моль 30 : 2 = Х : 9 |
|
6.Составить |
30л/2л=Хмоль/9моль |
|
7.Запишите ответ. |
Ответ: V = 135 л |
18.Алгоритм решения задач по уравнению
химической реакции
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
на нахождение массы вещества |
|
|
метод пропорций |
|
|
1.Прочитайте текст задачи. |
1.Какая масса |
|
2.Запишите |
m (H2SO4) = 196 г
m (КOH) = ? |
|
3.Запишите уравнение реакции. |
3.Решение: 2KOH |
|
4.Над формулами |
Х 2KOH |
|
5.Под |
Mr (KOH) = Ar(K) + Ar(O) + Ar(H) = 39 + 16 + M (KOH) = 56 г/моль m (KOH) = n · M = 2 Mr (H2SO4) = 2Ar(H) + M (H2SO4) = 98 m (H2SO4) = n · M = 1 Х 2KOH 112 г 98 |
|
6.Составляем |
Хг/112г=196г/98г |
|
количественный |
|
|
1.Выполнить |
|
|
4.Рассчитать молярные |
Mr (КOH) = Ar(К) + Ar(O) + Ar(H) M (КOH) = 56 г/моль Mr (H2SO4) = 2Ar(H) + M (H2SO4) = 98 |
|
5.Рассчитать |
n(H2SO4)=m/M=196г/98г/моль=2 |
|
6.Записать в |
Х 2KOH 2 |
|
7.Составить и |
Xмоль/2моль=2моль/1моль Х=4моль |
|
8.По формуле |
m (КOH) = n · M = 4 |
|
9.Записать ответ. |
Ответ: m (KOH) = 224 г |
|
на нахождение объёма вещества |
|
|
1.Прочитайте текст задачи. |
1.Какой |
|
2.Запишите |
m (Al) = 10,8 г
V(Н2) |
|
3.Запишите уравнение реакции. |
3.Решение: 2Al + 6HCl = 2AlCl3 + 3H2↑ |
|
4.Над формулами |
10,8 2Al + 6HCl = 2AlCl3 + 3H2↑ |
|
5.Вычислить |
Mr (Al) = Ar(Al) = 27 M (Al) = 27 г/моль m (Al) = n · M = 2 V = n · Vm = 3 |
|
6.Полученные |
10,8 2Al + 6HCl = 2AlCl3 + 3H2↑ 54г |
|
7.Составить и |
10,8г/54г=Хл/67,2л |
|
количественный |
|
|
1.Выполнить 1 – |
|
|
4.Рассчитать |
Mr (Al) = Ar(Al) = 27 M (Al) = 27 г/моль n(Al)=m/M=10,8г/27г/моль= |
|
5.Полученную |
0,4 2Al + 6HCl = 2AlCl3 + 3H2↑ 2 моль |
|
6.Составить |
0,4 |
|
7.По формуле |
Vm = 22,4 л/моль V = n · Vm V(H2) = 0,6 моль |
|
8.Записать ответ. |
Отсвет: V(H2) = 13,44 л |
|
на нахождение количества вещества |
|
|
1.Прочитайте текст задачи. |
1.Какое |
|
2.Запишите |
V (Н2)
n (Zn) = ? |
|
3.Запишите уравнение реакции. |
3. Решение: Zn + 2HCl = ZnCl2 + H2↑ |
|
4.Над формулами |
Х Zn + 2HCl = ZnCl2 + H2↑ |
|
5.По формуле |
V = n · Vm V(H2) = 1 |
|
6.Под формулами |
Х моль 67,2 Zn + 2HCl = ZnCl2 + H2↑ 1 моль 22,4 |
|
7.Составить |
Хмоль/1моль=67,2 |
|
количественный |
|
|
1.Выполнить |
|
|
4.Рассчитать |
n(Zn)=V/Vm=67,2л/22,4л/моль=3 моль |
|
5.Над формулами |
Х моль 3 Zn + 2HCl = ZnCl2 + H2↑ |
|
6.Под формулами |
Х Zn + 2HCl = ZnCl2 + H2↑ 1 моль |
|
7.Составить |
Х моль/ |
|
8.Записать ответ. |
Ответ: n(Zn) = 3 моль |
19.Алгоритм решения задач на концентрацию растворов
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
расчёт массовой доли растворённого вещества |
|
|
1.Прочитайте текст задачи. |
1.Рассчитать |
|
2.Запишите |
mсоли = 52 г mводы = 248 г
ω (КCl) = ? |
|
3.Рассчитать массу раствора. |
3.Решение: mраствора = mсоли + mводы mраствора = 52 |
|
4.По формуле |
ω (КCl) = mр.в./mр-ра=52г/300г=0,17 |
|
5.Записать ответ. |
Ответ: |
|
вычисление массы вещества в растворе по массе раствора и массовой |
|
|
1.Прочитайте текст задачи. |
1.Вычислите |
|
2.Запишите |
mр-ра = 600 г ω (КОН) = 15% =
m(КOH) = ? mводы |
|
3.Рассчитать |
ω (КOH) = mр.в/mр-ра mр.в.= ω * |
|
4.Рассчитайте |
mраствора = mсоли + mводы mводы = mраствора — mсоли mводы = 600 – 90 = 510 г |
|
5.Записать |
Ответ: |
|
решение задач на упаривание раствора |
|
|
при |
|
|
1.Прочитайте текст задачи. |
1. 200 г 20%-ного |
|
2.Запишите |
mр-ра 1 = 200 г mр-ра 2 = 60 г ω1
ω2 = ? |
|
3.Вычислить |
m р.в.1= ω1 |
|
4.Вычислить |
ω2 |
|
5.Записать |
Ответ: ω2 |
|
решение задач на концентрирование раствора |
|
|
при |
|
|
1.Прочитайте текст задачи. |
1.К 150 г |
|
2.Запишите |
mр-ра 1 = 150 г mсоли = 50 г ω1
ω2 = ? |
|
3.Вычислить |
m р.в.1= |
|
4.Вычислить |
m р.в.2= m р.в.1+m |
|
5.Вычислить |
m р-ра2= m р-ра1+ m |
|
6.Вычислить |
ω2 =80г/ |
|
7.Записать |
Ответ: ω2 |
|
решение задач на разбавление раствора |
|
|
к |
|
|
1.Прочитайте текст задачи. |
1.К 270 г 20% — |
|
2.Запишите |
mр-ра 1 = 270 г mводы = 30 г ω1
ω2 = ? |
|
3.Вычислить |
m р.в.1= |
|
4.Вычислить |
m р.-ра2= m р-ра.1+m |
|
5.Вычислить |
ω2 |
|
6.Записать |
Ответ: ω2 |
|
решение задач на смешивание растворов |
|
|
1.Прочитайте текст задачи. |
1. К 140 г 20%-ного 10%-ного |
|
2.Запишите |
mр-ра 1 = 140 г ω1 = 20% или m р-ра 2 = ω2
ω3 = ? |
|
3.Вычислить |
m р.в.1= m р.в.2= m р.в.3= |
|
4.Вычислить |
m р-ра 3=m р-ра1 + m р-ра2=140г+160г=300г |
|
5.Вычислить |
ω3 =44г/300г=0,15 |
|
6.Записать |
Ответ: ω3 |
Алгоритм № 1 определения состава атома.
|
1. Выберите элемент в ПСХЭ, запишите слева от знака химического элемента: внизу – порядковый номер, вверху – атомную массу. |
Углерод C Z=6 A(C)=12 12 6C |
|
2. Определите состав атома ( см. № 3 в справках). |
Число протонов N(р+) = 6 Число электронов N(ē) = 6 Число нейтронов N(n0) = 6 N(n0)=A-Z=12-6=6 |
|
3. Запишите состав атома: после знака химического элемента в скобках укажите состав ядра, за скобкой – число электронов |
Состав атома: 12 6C(6р+, 6n0)6 ē |
Алгоритм № 2 объяснения физического смысла порядкового номера химического элемента, номеров периода и группы в ПСХЭ Д.И. Менделеева.
|
1. Выберите элемент, запишите его химический знак. |
Азот N |
|
2. Объясните физический смысл: порядкового номера, Z. |
Z=7 7N
|
|
номера периода |
II период
|
|
Номера группы |
VA группа
|
Алгоритм № 3 определения строения атома по его положению в ПСХЭ.
|
1. Укажите химический элемент и его положение в ПСХЭ. |
Азот N II период VA группа Атомный номер (главная подгруппа) Z=7 |
|||||
|
2. Определите число энергетических уровней и число электронов в атоме. (см. № 4 в справках). |
|
|||||
|
3. Составьте схему строения атома. |
+7N 2ē, 5ē или N 2 5 |
|||||
|
*4. Составьте электронную конфигурацию (формулу атома). |
+7N 1s2 2s2 2p3 |
|||||
|
*5. Составьте схему распределения электронов по орбиталям. |
E
2s 2 p
1s |
Алгоритм № 4 определения зависимости свойств химических элементов от их положения в ПСХЭ и строения атома.
|
1. Запишите названия и химические знаки указанных элементов. |
Углерод C |
Кремний Si |
|
2. Определите по положению элементов в ПСХЭ их принадлежность к одному и тому же периоду или А группе (главной подгруппе). |
Z=6 II период IV A группа |
Z=14 III период IV A группа |
|
Принадлежат к одной группе IV A (главной подгруппе), располагаясь в ней сверху вниз |
||
|
3. Определите сходство и различие в строении атомов |
Сходство: IV A группа, 4ē в наружном энергетическом уровне. Различие: у углерода 2 энергетических уровня (II период), у кремния три энергетических уровня (III период; у кремния радиус атома больше, притяжение электронов наружного энергетического уровня меньше. |
|
|
4. Определите характер изменения свойств |
В А группе сверху вниз неметаллические свойства элементов уменьшаются, следовательно, у кремния Si они выражены меньше, чем у углерода С. |
Алгоритм № 5 определения вида химической связи по формуле соединения:
|
1. Запишите формулу соединения |
BeCl2 |
|
2. Укажите вид атомов, образующих химическую связь |
Атомы разных элементов |
|
3. Сравните электроотрицательность элементов (вычислите разность ЭО), см. № 6 в справках |
ЭО(Be)=1,5; ЭО(Cl)=3,0 Разность ЭО = 3,0-1,5=1,5 |
|
4. Определите вид связи |
Разность ЭО |
Алгоритм № 6 составления электронных и структурных формул соединения и схем, объясняющих образование ковалентной связи
|
1. Запишите формулу химического соединения |
Cl2 |
|
2. Укажите номер группы и определите число электронов на внешнем уровне (см. № 4 в справках) |
VII A группа 7 валентных ē |
|
3. Определите число неспаренных электронов (по формуле 8-N, где N – номер группы) |
8-7=1 |
|
4. Обозначьте наружные электроны (спаренные и неспаренные) точками |
. . :Сl о . . |
|
5. Составьте электронную схему образования связи и электронную формулу хлора |
. . . . . . . . :Сl о + оСl: → :Cl: Cl: . . . . . . . . |
|
6. Составьте структурную формулу хлора и укажите кратность связи. Кратность связи определяется числом общих электронных пар. |
Cl – Cl Одна общая электронная пара – одинарная связь |
|
7. Охарактеризуйте расположение электронной плотности связующей общей электронной пары между атомами |
Простое вещество Cl2 состоит из атомов одного элемента, поэтому общая электронная пара принадлежит связанным атомам в одинаковой мере |
|
8. Укажите разновидность ковалентной связи |
Неполярная |
Алгоритм № 7 составления схемы образования ионной сявзи:
|
1. Запишите формулу соединения |
CaF2 |
|
2. Определите число внешних электронов у атома металла (равно номеру группы) и, следовательно, заряд иона, в который он превратится в результате отдачи этих электронов |
Са – кальций II группа в ПСХЭ На внешнем слое 2 электрона Ca0 — 2ē→Ca2+ |
|
3. Определите число внешних электронов у атома неметалла и, следовательно, число недостающих до 8 электронов и соответственно заряд получившегося при приеме этих электронов иона |
F фтор VII группа в ПСХЭ На внешнем слое 7 электронов, до 8 не хватает одного F0 + 1ē→F— |
|
4. Найти наименьшее общее кратное (НОК) между зарядами образовавшихся ионов и определить число атомов металла, которое нужно взять, чтобы они отдали это НОК число электронов и число атомов неметалла, чтобы они приняли это НОК число электронов. |
НОК =2 (т. к. 2 и 1) Значит необходим один атом кальция и два атома фтора Ca0 и 2F0 |
|
5. Записать схему образования ионной связи между атомами металла и неметалла в последовательности атомы → ионы → ионное соединение. Коэффициенты и индексы «1» не пишутся. |
2ē Ca0 + 2F0 → Ca2+ + 2F— → Ca2+F—2 |
Алгоритм № 8 определения высшей и низшей степеней окисления (СО) элемента
|
1. Выберите химический элемент |
Сера S |
|
2. Укажите номер группы в ПСХЭ, в которой находится элемент |
VI A группа |
|
3. Определите высшую положительную СО элемента (см. № 8 в справках). |
+6 (S+6) |
|
4. Вычислите низшую отрицательную СО элемента (см. № 8 в справках). |
6-8=-2 (S-2) |
Алгоритм № 9 составления названий бинарных соединений:
|
1. Напишите формулу соединения |
CaO |
|
2. Назовите соединение |
Оксид кальция |
|
3. Напишите формулу соединения, элемент которого имеет переменную степень окисления |
+3 FeCl3-1 |
|
4. Назовите соединение |
Хлорид железа (III) |
Алгоритм № 10 выведения формул бинарных соединений по степеням окисления элементов:
|
1. Выберите два элемента, один из которых должен иметь положительную степень окисления (СО), а другой – отрицательную |
1. Кальций и сера 2. Магний и фтор 3. Магний и фосфор |
|
2. Запишите химические знаки элементов так, чтобы на первом месте находился элемент с положительной степенью окисления (в ряду ЭО он стоит правее) |
1. Ca и S 2. Mg и F 3. Mg и P |
|
3. Укажите для каждого элемента значения степеней окисления (высшая положительная СО равна номеру группы; низшая отрицательная – номеру группы минус |
Ca, Mg – II группа (+2) S – VI группа (6-8=-2) F – VII группа (7-8=-1) P – V группа (5-8=-3) |
|
4. Определите индексы (см. справку ниже) |
1. Сa+2 S-2 CaS
|
Справка
|
Значения степеней окисления |
Математическая запись |
Расстановка индексов |
|
Одинаковые |
Индексы = 1, если СО1=СО2 |
Индексы не записываются |
|
Значение степени окисления одного элемента нацело делится на значение другого |
Индекс = СО2CO1 |
Индекс записывают рядом со знаком элемента с меньшей степенью окисления |
|
Не делятся друг на друга нацело |
Индекс 1= [CO2] Индекс2=[CO1] |
Модули степеней окисления записывают индексами у знаков элементов крест-накрест |
Алгоритм № 11 определения степени окисления элемента в бинарных соединениях:
|
1. Запишите формулу соединения |
Fe2O3 |
|
|
2. Определите сначала низшую отрицательную степень окисления элемента (см. № 8 в справках), знак которого в формуле записан вторым |
O – VI группа 6-8= -2 |
|
|
3. Вычислите произведение индекса и известной СО |
Fe2+3 |
O3-2 (-2)·3=-6 |
|
4. Определите положительную СО элемента, исходя из электро-нейтральности соединения (сумма СО всех элементов равна 0) |
+6:2=+3 |
Алгоритм № 12 выведения формул солей по их названию
|
1. Запишите ионы металла и кислотного остатка, входящие в состав заданной соли, пользуясь таблицей растворимости |
1. хлорид натрия Cl— Na+ 2. фосфат калия PO43- K+ 3. сульфат алюминия SO42- Al3+ |
|
2. Запишите ионы так, чтобы на первом месте находился ион с положительным зарядом, а на втором – с отрицательным. |
1. Na+Cl— 2. K+PO43- 3. Al3+SO42- |
|
3. Определите индексы (см. справку ниже) |
1. Na+Cl— 2. K3+PO43- 3:1=3
3. Al23+(SO4)32- |
Справка
|
Значения разрядов ионов |
Математическая запись |
Расстановка индексов |
|
Одинаковые |
Заряд (Мn+)=заряд(Acdn—), где М – металл, Acd – кислотный остаток |
Индексы не записываются |
|
Значение заряда одного иона делится на значение заряда другого иона нацело |
Индекс=заряд2 заряд1 , где заряд2заряда1 |
Индекс записывают рядом со знаком иона, имеющего меньший заряд |
|
Не делятся друг на друга |
индекс1=заряду2 индекс2=заряду1 |
Модули зарядов ионов записывают индексами у знаков ионов «крест-накрест» |
Алгоритм решения задач на вычисление массы (объема) продукта реакции, если одно из исходных веществ дано в избытке
-
Запись краткого условия задачи.
-
Запись уравнения реакции.
-
Надписание над формулами веществ в уравнении реакции данных условия задачи.
-
Определение мольных отношений, молярных масс (М), масс веществ (m) и подписание их под формулами веществ, с которыми необходимо вести расчеты.
-
Определение массы вещества, которое расходуется в реакции полностью, т.е. в недостатке.
-
Определение массы, количества или объема искомого вещества.
-
Запись ответа задачи.
Алгоритм решения задач на вычисления, связанные с использованием понятия “выход продукта реакции”
-
Запись краткого условия задачи.
-
Запись уравнения реакции.
-
Надписание над формулами веществ в уравнении реакции данных условия задачи.
-
Определение мольных отношений, молярных масс (объемов) и масс (объемов) веществ и запись их под формулами веществ, с которыми необходимо вести расчеты.
-
Определение теоретического выхода искомого вещества по уравнению реакции.
-
Вычисление массовой доли практического выхода продукта в процентах от теоретически возможного.
-
Запись ответа задачи.
Алгоритм решения задач на вычисление массы (объема) продукта реакции, если исходное вещество содержит примеси
-
Запись краткого условия задачи.
-
Определение массы чистого вещества, исходя из содержания массовой доли (%) примесей в исходном материале.
-
Запись уравнения реакции.
-
Надписание над формулами веществ в уравнении реакции данных условия задачи.
-
Определение молярных отношений, молярных масс (М), масс веществ (m), молярных объемов (Vm) и объемов (V) и подписание их под формулами веществ, с которыми необходимо вести расчеты.
-
Определение объема (или массы) искомого вещества.
-
Запись ответа задачи.
Алгоритм решения задач на нахождение молекулярной формулы вещества по относительной плотности и массовой доле элемента в соединении
-
Запись краткого условия задачи.
-
Нахождение относительной молекулярной массы искомого вещества.
-
Нахождение простейшей формулы искомого вещества.
-
Нахождение относительной молекулярной массы по простейшей формуле искомого вещества.
-
Сравнение относительных молекулярных масс, найденных по истинной и простейшей формуле искомого вещества.
-
Нахождение истинной формулы искомого вещества.
-
Запись ответа задачи.
Алгоритм решения задач на нахождение молекулярной формулы вещества по массе (объему) продуктов сгорания
-
Запись краткого условия задачи.
-
Нахождение относительной молекулярной массы искомого вещества.
-
Нахождение массы искомого вещества.
-
Нахождение масс элементов в исходном веществе.
-
Определение, входит ли еще какой-либо элемент в состав искомого вещества. Если входит, то определяют его массу.
-
Определение простейшей формулы искомого вещества.
-
Определение истинной формулы искомого вещества.
-
Запись ответа задачи.
Алгоритмы решения задач
|
Последовательность выполнения действий
|
Оформление решения задачи
|
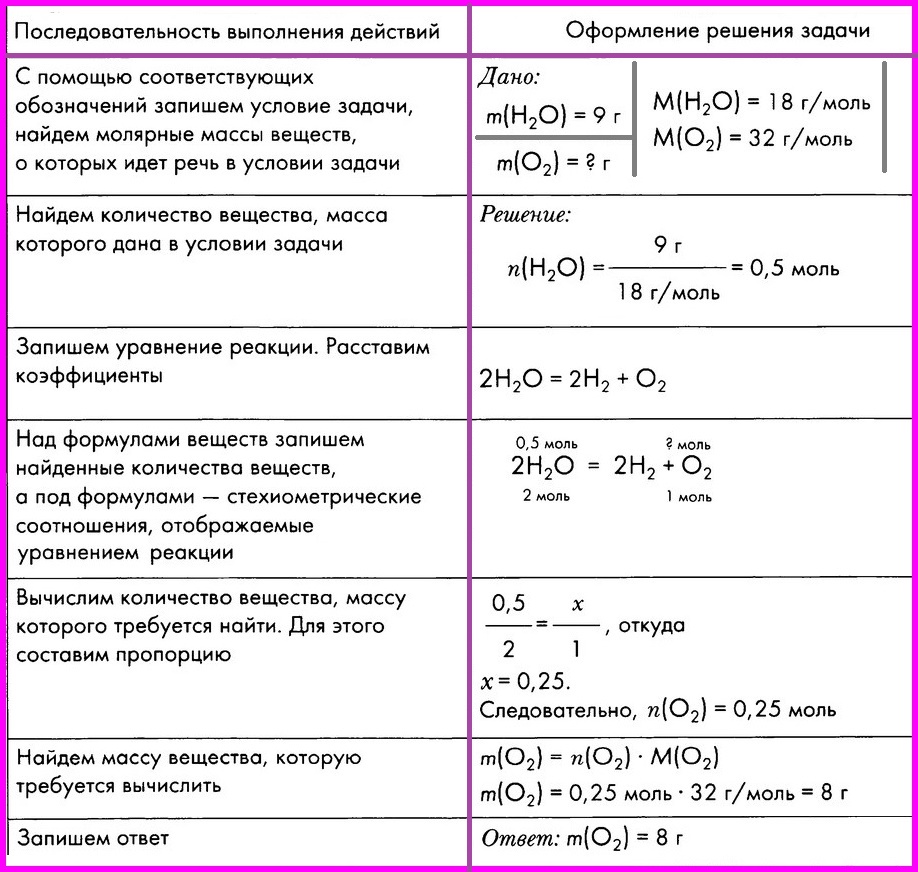
С помощью соответствующих обозначений запишем условие
|
Дано:
m(H2O) = 9 г М(H2O) = 18 г/моль
___________
m(О2) = ? г М(О2) = 32 г/моль
|
Найдем количество вещества, масса которого дана в условии
|
Решение: |
Запишем уравнение реакции, расставим коэффициенты
|
2H2O = 2H2 + O2
|
Над формулами веществ запишем найденные количества
|
|
Вычислим количество вещества, массу которого требуется
|
откуда х = 0,25 следовательно ν(О2)=
|
Найдем массу вещества, которую требуется вычислить
|
|
Запишем ответ
|
Ответ: масса кислорода 8 г.
|
Алгоритм 2
Вычисление массы вещества в
растворе по массе раствора и массовой доле растворенного вещества
Пример. Вычислите массу гидроксида натрия, необходимого для
приготовления 400 г 20%-го раствора гидроксида натрия.
Последовательность выполнения действий
|
Оформление решения задачи
|
С помощью соответствующих обозначений запишем условие
|
Дано:
mр-ра(NaОН) = 400 г
w(NaОН) = 20 % или 0,2
mв-ва(NaОН) = ?г
|
Запишем формулу для расчета массовой доли вещества в
|
Решение:
|
Преобразуем данную формулу для расчета массы вещества |
|
Подставим цифровые данные в эту формулу и произведем
|
|
Запишем ответ
|
Ответ: масса гидроксида натрия равна 80 г.
|
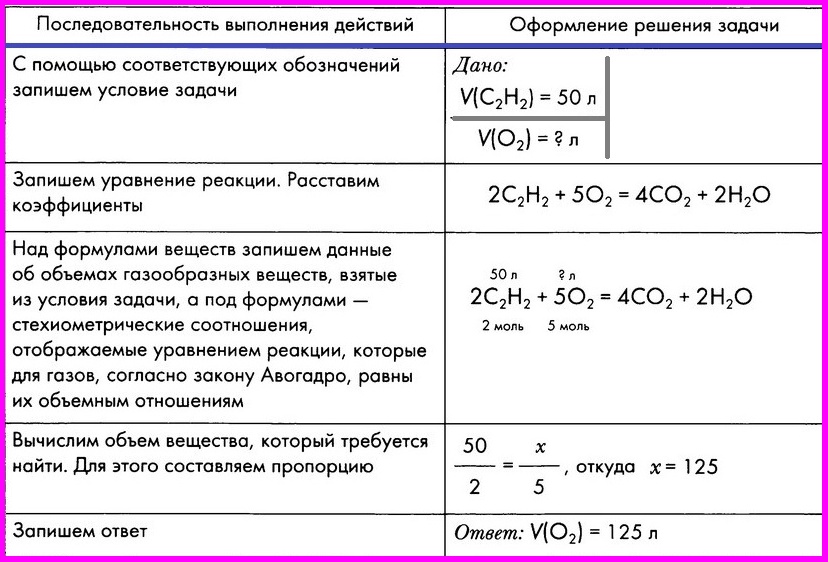
Алгоритм 3
Расчет по химическому уравнению объемных отношений газов.
Пример. Вычислите объем кислорода, необходимого для сжигания
порции ацетилена объемом 50л.
|
Последовательность
|
Оформление |
|
С помощью соответствующих |
Дано:
m(С2Н2) = 50 л
V(О2) = ? л |
|
Запишем уравнение реакции, |
2С2Н2 |
|
Над формулами веществ |
|
|
Вычислим объем вещества, |
откуда х = 125 л |
|
Запишем ответ |
Ответ: объем кислорода равен 125 л. |
Алгоритм 4
Вычисление массовой доли вещества в растворе.
Пример. При выпаривании раствора массой 500 г образовалось 25
г кристаллической соли – хлорида натрия. Вычислите массовую долю соли в
исходном растворе.
|
Последовательность
|
Оформление |
|
С помощью соответствующих |
Дано:
mр-ра(NaCl) = 500 г
mв-ва(NaCl) = 25 г
w(NaCl) = ? |
|
Запишем формулу для расчета |
Решение: |
|
Подставим цифровые данные в |
|
|
Выразим массовую долю |
0,05·100 = 5% w(NaCl) = 5% |
|
Запишем ответ |
Ответ: w(NaCl) |
Алгоритм 5
Вычисление относительной плотности газа по другому газу
Пример. Вычислите плотность кислорода а) по водороду; б) по
воздуху.
|
Последовательность выполнения действий
|
Оформление решения задачи |
|
Найдем относительные молекулярные массы газов, о которых |
Мr(О2)
Мr(Н2)
Мr(воздух) |
|
Относительная масса газа X по газу Y соответствует отношению |
|
|
Запишем ответ |
Ответ: |
Примечание. Понятие «относительная молекулярная масса воздуха»
употребляется условно, так как воздух не индивидуальное вещество, а смесь
газов.
Алгоритм 6
Расчеты по термохимическим
уравнениям. Вычисление количества теплоты по известной массе вещества.
Пример. По термохимическому уравнению 2Cu + O2 = 2CuO
+ 310 кДж
вычислите количество теплоты, выделившейся в результате
окисления порции меди массой 16 г.
|
Последовательность выполнения действий
|
Оформление решения задачи |
|
С помощью соответствующих обозначений запишем условие |
Дано:
m(Cu) = 16 г М(Cu) = 64 г/моль
Qр-и
Q = ? кДж |
|
Найдем количество вещества, масса которого дана в условии |
Решение:
|
|
Запишем термохимическое уравнение реакции |
2Cu + O2 |
|
Над формулами веществ надпишем сведения о количестве |
|
|
Вычислим количество вещества – продукта реакции. Для этого |
откуда х = 38,75 Следовательно, Q = 38,75 кДж |
|
Запишем ответ |
Ответ: Q = 38,75 кДж |







 ↑↓
↑↓ 



 2. Mg+2 F2-1 2:1=2 MgF2
2. Mg+2 F2-1 2:1=2 MgF2
 3. Mg3+2 P2-3 Mg3P2
3. Mg3+2 P2-3 Mg3P2