Разработка праймеров для qPCR — важный шаг при постановке анализа qPCR или обратной транскрипции-qPCR (RT-qPCR). Праймеры qPCR, которые плохо отжигаются или отжигаются более чем к одной последовательности во время амплификации, могут значительно повлиять на качество и надежность результатов.
Кроме того, если вы проводите одностадийную RT-qPCR, обратная транскриптаза будет использовать обратный праймер для запуска реакции транскрипции. В этом случае некачественный праймер приведет как к неэффективной обратной транскрипции, так и к неэффективной амплификации — проигрышная ситуация.
Учитывая вышесказанное, стоит потратить время, необходимое для разработки качественных праймеров для qPCR. В этой статье мы расскажем вам, как именно это сделать!
Хорошая новость заключается в том, что праймеры дешевы, поэтому вы можете легко протестировать несколько различных пар, чтобы выбрать лучшие для вашего эксперимента.
Плохая новость: тестирование праймеров требует времени и терпения, поэтому чем быстрее вы получите пару работающих праймеров, тем лучше.
Инструмент NCBI Primer-BLAST широко используется для дизайна праймеров для qPCR. В Интернете доступно множество других инструментов для проектирования праймеров, включая primer3, а поставщики ПЦР часто предлагают свои собственные бесплатные программы для проектирования.
Ниже описаны основные этапы проектирования праймеров для qPCR с использованием инструмента NCBI Primer-BLAST.
Этапы проектирования будут аналогичными, если вы используете другие программы проектирования праймеров, и приведенная ниже информация должна дать вам представление о параметрах, на которые следует обратить внимание.
Дизайн праймеров для qPCR: Начало работы
Зайдите в базу данных генов Pubmed и выполните поиск интересующего вас гена. В правом углу следующего экрана вы можете отфильтровать по видам.
Нажмите на интересующий вас ген и прокрутите страницу вниз, пока не найдете NCBI Reference Sequence (RefSeq) для вашего гена (например, «NM_203483»).
Нажмите здесь, и на следующем экране в правом углу экрана вы увидите ссылку «Pick primers».
Параметры праймеров для qPCR
Установите следующие параметры праймеров:
Размер продукта ПЦР/ампликона: Для эффективной амплификации подберите праймеры таким образом, чтобы длина ампликона составляла от 70 до 200 п.н.
Количество праймеров для возврата: Это зависит от вас, в зависимости от того, сколько вариантов вы хотите выбрать. Программе не потребуется много времени, чтобы разработать 10 пар праймеров, и это должно дать вам разумный шанс найти подходящую пару.
Температура плавления: Как правило, следует стремиться к минимальной температуре 60°C и максимальной 63°C; идеальная температура плавления составляет 60°C (с максимальной разницей в 3°C в температурах плавления, Tm, двух праймеров). Для определения этих температур можно использовать калькулятор Tm.
Выбор экзона/интрона
Чтобы избежать амплификации загрязняющей геномной ДНК, подберите праймеры таким образом, чтобы одна половина праймера гибридизовалась с 3′-концом одного экзона, а другая половина — с 5′-концом соседнего экзона.
Для этого просто выберите «Праймер должен охватывать стык экзона и экзона». Другие параметры изменять не нужно.
Параметры проверки специфичности пары праймеров: Используйте настройки по умолчанию. Программа будет использовать последовательность RefSeq мРНК выбранного вами организма для конструирования праймеров.
Проверка экрана вывода
Посмотрите на параметры, которые выдала программа, и обратите особое внимание на следующее:
Убедитесь, что 3′-конец праймера содержит остаток C или G, поскольку остатки T и A легче связываются с ДНК неспецифическим образом.
Стремитесь к содержанию GC около 40-60% для обеспечения максимальной стабильности продукта.
Избегайте самокомплементарности, чтобы снизить вероятность образования праймер-димеров. В идеале праймер должен иметь почти случайный набор нуклеотидов.
Теперь выберите два-три лучших праймера и протестируйте их. Удачи!
Если у вас есть другие лучшие советы по разработке праймеров для qPCR, мы будем рады услышать вас в комментариях!
Правильный выбор последовательности праймеров является ключевым моментом в разработке реактивов. Гибкость в выборе праймеров в первую очередь определяется задачей. В случае определения однонуклеотидной мутации положение праймеров, например, 3′-конца строго задано, в то время как задача определения возбудителя инфекции может допускать выбор гена и даже мишени (геномной или плазмидной ДНК, РНК). Однако, в любом случае, нуклеотидная последовательность праймеров будет определять селективность, чувствительность анализа и робастность тест-системы.
Длина, Tm, ΔG, ΔH, ΔS, CG-контент
Эффективность реакции определяется эффективностью гибридизации праймеров. Под эффективностью гибридизации праймеров понимается доля целевых молекул ДНК, на которые гибридизовались праймеры. Для обеспечения максимальной эффективности праймеры должны гибридизоваться на каждую молекулу ДНК, т.е. доля ДНК с гибридизованными на нее праймерам должна стремиться к 100%.
Методики расчета температуры гибридизации можно разделить на две группы: эмпирические зависимости, основанные на длине праймеров или содержания CG, и термодинамические подходы, основанные на расчетах свободной энергии Гиббса, энтальпии и энтропии. Так как эмпирические зависимости основаны на практических знаниях, в определенных границах применимости их результаты всегда соответствуют практике. Существенным их недостатком является то, что они не могут оценить вероятность образования димеров праймеров и гибридизацию на неполностью комплементарную последовательность. Расчет термодинамических параметров процесса гибридизации позволяет количественно оценить селективность реактивов и подобрать оптимальную последовательность праймеров и условия ПЦР.
Выбор последовательности 3′-конца
Последовательность 3′-конца праймера имеет критическое значение для селективности анализа, так как именно с этого конца происходит синтез комплементарной последовательности. С одной стороны неполная гибридизация 3′-конца приводит к значительному снижению эффективности элонгации. С другой стороны, чрезмерная стабильность 3′-конца приводит к снижению роли 5′-конца на селективность гибридизации, снижая при этом общую селективность амплификации и увеличивая вероятность образования неспецифических продуктов.
На основе анализа базы данных по праймерам, авторами предложена последовательность шагов для выбора оптимального 3′-концевого триплета:
- Отдавать предпочтения триплетам TT(C/G), (C/G)(A/T)(C/G), (A/T)GG, (A/T)CC, (A/T)GC;
- Избегать триплеты (A/T)CG, (A/T)(A/T)(A/T), CG(A/T), GGG;
- Если шаги 1 и 2 не позволяют сделать однозначный выбор, то следует выбрать триплет с C или G на конце.
Образование побочных продуктов
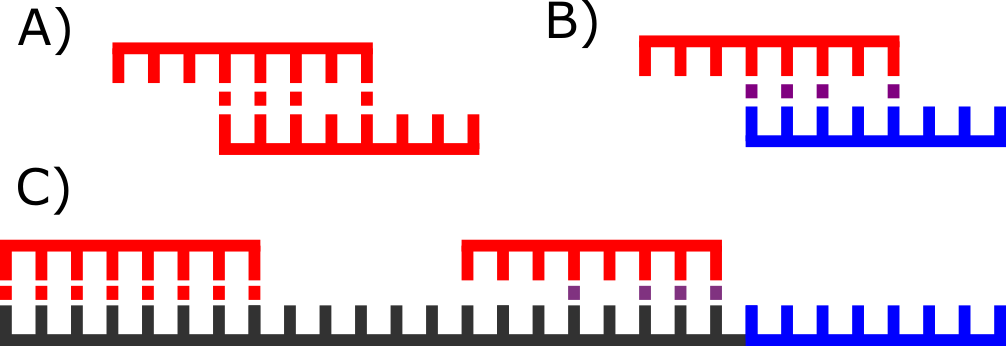
В процессе ПЦР, кроме целевого фрагмента ДНК, могут образовываться побочные продукты и их накопление приводит к снижению эффективности амплификации целевого продукта и, следовательно, к снижению чувствительности и селективности анализа. Есть несколько механизмов образования побочных продуктов:
- Образование димера между самим праймером (один праймер имеет участок самокомплементарной последовательности) (Рисунок 1. A));
- Гибридизация праймеров друг с другом (два праймера имеют комплементарный участок) (Рисунок 1. B));
- Неспецифическая гибридизация праймеров на целевой фрагмент ДНК (Рисунок 1. C)).
Полностью исключить процесс образования побочных продуктов невозможно, так как он зависит как от условий реакции (температура и длительность стадий гибридизации и элонгации), так и от самих реактивов (специфичность полимеразы, наличие вспомогательных веществ). При выборе праймеров необходимо иметь возможность ранжировать их по вероятности образования побочных продуктов. Одним из способов ранжирования является расчет свободной энергии Гиббса по методу ближайших соседей. В качестве вариации данного подхода возможно оценивать свободную энергию Гиббса не всей последовательности праймера, а 3′-конца.
Литература
Молекулярная биология. Практическое руководство — Великов В.А. 2013
ПЦР
Подбор праймеров
Праймеры — синтетические олигонуклеотиды, состоящие из 16-30 оснований. Они комплементарны участкам ДНК, между которыми находится последовательность-мишень. Праймер (англ. primer) является обязательным компонентом («затравка»), необходимым для работы ДНК-полимеразы: к его 3’-ОН концу фермент присоединяет нуклеотиды, комплементарные матрице.
Праймер к 5’-концу гена называют прямым (forward, For), к 3’-концу гена — обратным или встречным (reverse, Rev). В базах данных нуклеотидных последовательностей приведена только одна цепь ДНК — значащая, та, что транскрибируется в виде мРНК. По ней подбирают прямой праймер, т.е. тот праймер, от которого будет расти именно эта цепь. Обратный праймер подбирают для комплементарной цепи, но также в направлении 5’→3’.
В приведённой ниже работе требуется «вручную», без использования специальных программ подобрать праймеры для амплификации гена НАДН-дегидрогеназы гадюки Никольского (Vipera nikolskii) и составить режим ПЦР.
Ход работы
1. Найдите информацию о первичной структуре гена НАДН-дегидрогеназы гадюки обыкновенной, по которой можно подобрать праймеры для ПЦР- амплификации этого гена у других видов гадюк. Для этого откройте сайт US National Library of Medicine, базу GenBank (http://www.pubmed.com).
2. Введите латинское название организма и интересующий ген (Vipera berus NADH dehydrogenase).
3. Выберите вкладку «Nucleotide» и нажмите «Enter».
4. Скопируйте информацию в файл. Один из сиквенсов (англ. sequence — последовательность) для примера приведён на рис. 1.
5. Подберите праймеры для ПЦР, прямой и обратный. Для прямого праймера достаточно выбрать короткий отрезок гена вблизи его 5’-конца с оптимальной длиной около 20 нуклеотидов. Для подбора обратного праймера нужно восстанавливать комплементарную цепь ДНК. Любую нуклеотидную последовательность записывают в направлении 5’→3’ a.
6. Расчитайте температуру отжига ваших праймеров и составьте режим ПЦР.
Рис.1. Ген НАДН-дегидрогеназы гадюки обыкновенной V.berus
Правила подбора праймеров
— Размер праймера должен составлять 16-25(30) нуклеотидов.
— CG-состав должен лежать в пределах 50-60 %.
— Разница в температуре отжига обоих праймеров — не более 6°С.
— Праймеры не должны быть само- и взаимно-комплементарными.
— Нуклеотиды 3’-конца праймера должны быть строго комплементарны матрице (замены возможны на 5’-конце длинных праймеров б).
Расчёт температуры отжига праймера
Для точного расчёта оптимальной температуры существует множество программ и алгоритмов. Упрощенный расчёт можно провести по формулам:
Примечания
а Не забывайте об антипараллельности цепей ДНК при подборе обратного праймера. Если он будет иметь нужный состав, но другую полярность ПЦР-продукт получен не будет. Такой праймер (параллельный) не будет отжигаться на матрицу, т.е. образование гибридного комплекса олиго-/полинуклеотид невозможно.
Олигонуклеотид любого состава может быть по заказу синтезирован специализированной фирмой. По желанию заказчика в его состав введут флуоресцентную метку. На его 5’-конец при заказе можно добавить какие-либо нуклеотиды, к примеру, нуклеотиды сайта узнавания определённой рестриктазы. Компания примет заказ и на сиквенс полученного ПЦР-продукта: праймер для его секвенирования уже есть в наличии.
Праймеры являются важным компонентом в амплификации ДНК как in vivo, так и in vitro . In vivo фермент ДНК-полимераза требует праймера для инициации репликации ДНК. In vitro, праймеры в основном используются для инициирования полимеразной цепной реакции (ПЦР). Некоторые другие методы, включая секвенирование, клонирование, сайт-направленный мутагенез и т. Д., Требуют праймеров. Следовательно, разработка праймеров для методов in vitro становится довольно простой, но сложным процессом для молекулярных биологов. Поэтому обсуждаются основные правила конструирования праймеров как для ПЦР, так и для секвенирования.
Ключевые области покрыты
1. Что такое учебник для начинающих
— определение, типы, роль
2. Как работают праймеры в ПЦР
— Особенности ДНК, Процесс ПЦР
3. Как сделать праймеры для ПЦР
— Основные правила разработки праймеров для ПЦР
4. Как разработать учебник для начинающих
— Особенности секвенирования праймеров
Ключевые слова: синтез ДНК, прямые праймеры, длина, температура плавления, ПЦР, обратные праймеры, праймеры для секвенирования
Что такое учебник для начинающих
Праймер — это короткая цепь ДНК или РНК, которая служит отправной точкой для синтеза ДНК. Ферменты, которые катализируют репликацию ДНК, способны добавлять нуклеотиды к существующему 3′-концу. Следовательно, праймер закладывает основу для синтеза ДНК, служа праймером. РНК-праймеры используются внутри клетки для инициации репликации ДНК с помощью ДНК-полимеразы. Однако синтетические ДНК-праймеры можно использовать для амплификации ДНК, главным образом, с помощью ПЦР и других методов. Два типа праймеров используются в ПЦР, и они известны как прямой и обратный праймеры. Во время ПЦР миллионы копий желаемого фрагмента ДНК могут быть получены путем фланкирования этой конкретной последовательности ДНК в геномной ДНК прямым и обратным праймерами. Прямой и обратный праймеры, которые фланкируют определенную последовательность ДНК, показаны на фигуре 1 .
Рисунок 1: Прямой и обратный праймеры
Как работают праймеры в ПЦР
ДНК — это молекула, имеющая две цепи, которые удерживаются вместе. Образец базовой пары дополняет друг друга в обеих цепях. Две нити удерживаются вместе водородными связями между комплементарными азотистыми основаниями. Кроме того, каждая нить имеет свою направленность. Одна нить имеет направленность от 5 до 3, в то время как другая имеет направленность от 3 до 5. Следовательно, две нити антипараллельны. Нить с направлением от 5 ‘до 3’ называется смысловой цепью, а прядь с направлением от 3 ‘до 5’ называется антисмысловой цепью. Каждые две цепи должны быть синтезированы индивидуально во время ПЦР.
Три этапа ПЦР — денатурация, отжиг и удлинение. При денатурации две нити ДНК разделяются путем разрыва водородных связей при нагревании до 95 ° C. Прямой праймер связывается с смысловой цепью, тогда как обратный праймер связывается с антисмысловой цепью. Отжиг праймеров происходит при падении температуры от 95 ° С до 50-60 ° С. Следовательно, обе цепи могут быть синтезированы одновременно с помощью Taq- полимеразы. Усиление как смысловой, так и антисмысловой цепей происходит в направлении от 5 до 3. Поскольку ПЦР является экспоненциальной реакцией, три этапа повторяются в 25-35 циклах. Как прямой, так и обратный праймеры используются в каждом цикле для получения около 2 35 копий желаемого фрагмента ДНК. Роль праймеров в ПЦР показана на фигуре 2 .
Рисунок 2: ПЦР
Как сделать праймеры для ПЦР
Чтобы амплифицировать определенный фрагмент ДНК в геноме, этот конкретный фрагмент ДНК должен быть фланкирован как прямым, так и обратным праймерами. Следовательно, оба праймера должны быть комплементарны последовательностям, которые фланкируют фрагмент ДНК. Основные рекомендации для успешного конструирования праймеров для ПЦР описаны ниже.
- Направление как прямого, так и обратного праймера должно быть от 5 ′ до 3 ′.
- Длина каждого праймера должна составлять от 18 до 25 нуклеотидов в длину.
- Содержание GC в праймерах составляет от 40 до 60%, и присутствие C или G в 3′-конце праймера может способствовать связыванию.
- Температура плавления и Tm (температура, при которой половина праймера отжигается до матрицы) пары праймеров должны быть одинаковыми и выше 60 ° C. Максимальная разница должна составлять 5 ° C.
- 3′-конец праймера должен точно соответствовать матричной ДНК.
- По крайней мере 2G или C основания (GC зажим) должны присутствовать в последних 5 основаниях на 3′-конце праймера. Зажим GC способствует прочному связыванию с целевой последовательностью.
- Сайты рестрикции с 5-6 нуклеотидами могут быть добавлены к 5′-концу праймера.
- Следует избегать повторений динуклеотидов (ATATATAT) или повторов одного и того же нуклеотида более 4 раз (ACCCC) в последовательностях праймеров. Это вызывает неправильную заливку.
- Следует избегать гомологии внутри праймеров или вторичных структур праймеров. Следует избегать гомологии между праймерами или комплементарных последовательностей в прямом и обратном праймерах. Оба условия могут образовывать собственные димеры или праймеры-димеры.
- Значение ΔG для анализа димера должно составлять от 0 до -9 ккал / моль.
Для простоты дизайна праймеров доступно множество онлайн-инструментов, таких как Primer 3, Primer X, NetPrimer, DNAstrar и т. Д. Специфичность разработанных праймеров может быть определена такими инструментами, как NCBI Primer-BLAST или UCSC in-silico PCR.,
Рисунок 3: Интерфейс учебника для начинающих 3
Как разработать учебник для начинающих
Праймеры для секвенирования являются короткими цепями ДНК, как и праймеры для ПЦР. Однако праймеры для ПЦР предназначены для амплификации конкретного фрагмента ДНК, в то время как праймеры для секвенирования используются для выявления нуклеотидной последовательности амплифицированного фрагмента ДНК с помощью ПЦР. В отличие от праймеров для ПЦР, при секвенировании можно использовать один праймер, если длина только целевой последовательности составляет менее 500 п.н. В качестве примера, прямой праймер ПЦР может быть использован при секвенировании для амплификации только смысловой цепи. Более того, степень несоответствий, допускаемых во время реакции секвенирования, выше, чем ПЦР. Обычно ПЦР-праймеры являются комплементарными последовательности-мишени. Однако некоторые праймеры для секвенирования не связаны с последовательностью-мишенью. Они известны как универсальные праймеры. Универсальные праймеры, такие как T7 или SP6, отжигают с вектором, который несет целевую последовательность. Их можно использовать как для различных векторов, так и для различных типов фрагментов ДНК.
Вывод
Праймеры используются в ПЦР и секвенировании для инициации синтеза ДНК. Два типа праймеров для ПЦР могут быть идентифицированы как прямой и обратный праймеры. Прямые праймеры отжигают на смысловой цепи, тогда как обратные праймеры отжигают на антисмысловой цепи. При секвенировании, прямой или обратный праймер может быть использован для амплификации мишени. При разработке праймеров необходимо учитывать множество факторов, таких как длина праймера, Tm и содержание GC. Доступно много онлайн-инструментов, которые можно использовать для разработки праймеров для определенной последовательности.
Ссылка:
1. «Разработка учебника для начинающих: советы по эффективному процессу». Корпорация Genome Compiler, 3 ноября 2015 г., доступно здесь.
2. «Праймеры для секвенирования и дизайн праймеров». Праймеры для секвенирования и дизайн праймеров, Университет Калгари, доступно здесь.
Изображение предоставлено:
1. «Primers RevComp» от Zephyris — собственная работа (CC BY-SA 3.0) с помощью Commons Wikimedia
2. «Полимеразная цепная реакция» Энзоклопа — собственная работа (CC BY-SA 3.0) через Commons Wikimedia
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Кригер О.В.
1
Солдатова Л.С.
1
Кравченко А.Ю.
1
Новоселова М.В.
1
1 ФГБОУ ВПО «Кемеровский технологический институт пищевой промышленности»
В работе построена синтетическая последовательность длиной 194 п.н. (ДНК-матрица). Анализ данной последовательности в GenBank с помощью программы BLAST показал, что созданные нуклеотидные последовательности гомологов не имеют. Одними из ключевых компонентов реакции являются «праймеры» — синтетические олигонуклеотиды. Длина амплифицируемого фрагмента определяется расстоянием между праймерами. При амплификации с помощью полимеразной цепной реакции используют два олигонуклеотидных праймера. Рассмотрены теоретические аспекты конструирования праймеров. К синтезированному ДНК-хвосту подобраны 2 праймера размерами 20 п.н. С помощью программы Primer3 подобрана температура плавления (Тm) для соответствующих праймеров: для правого праймера Тm = 59,80°С, для левого праймера Тm = 60,25°С. Оптимальная температура соответствующего режима в программе амплификации (температура отжига) ta составляет: для левого праймера ta = 56,00°С, для правого праймера ta = 55,80°С.
олигонуклеотид
праймер
прионный белок
патоген
амплификация
1. Григорьев В. Б. Прионные болезни человека и животных // Вопросы вирусологии. – 2004. – Т. 6. – С. 4-12.
2. Завалишин И. А. Прионы и прионные болезни / И. А Завалишин, И. Е. Шитикова, Т. Д. Жученко // Клиническая микробиология. – 2000. – Т. 2. – №2. – С. 12-19.
3. Зуев В. А. Прионы – новый класс возбудителей инфекционных заболеваний // Анти-биотики и химиотерапия. – 1999. – № 10. – С. 33-38.
4. Инге-Вечтомов С. Г. Цитогены и прионы: цитоплазматическая наследственность без ДНК? // Соросовский образовательный журнал. – 1996. – №5. – С. 11-18.
5. Покровский В. И. Прионы и прионные болезни / В. И. Покровский, О. И. Киселев, Б. Л. Черкасский. – М.: РАМН, 2004. – 384 с.
6. Смелкова Н. В. Конструирование ДНК-матриц заданной структуры для синтеза РНК посредством полимеразных цепных реакций / Н. В. Смелкова, А. А. Елов, З. А. Шабарова // Биоорганическая химия. – 1992. – Т. 18. – №1. – С. 78-84.
7. Saiki R. K. Primer-directed enzymatic amplification of DNA with a thermostable DNA pol-ymerase // Science. – 1988. – V. 239. – №4839. – Р. 487-491.
8. Swarz K. // Nucl. Acids Res. – 1990. – V. 18. – №4. – Р. 1097.
Введение
Прионные болезни — это особый класс смертельных нейродегенеративных заболеваний человека и животных, возбудителем которых является прион — безнуклеиновый низкомолекулярный белок, устойчивый к инактивирующим воздействиям [1].
В последние годы проблема прионных болезней приобрела важное научно-практическое значение, поскольку открытие прионов в 80-е годы XX столетия явилось прорывом в изучении инфекционной патологии, микробиологии, молекулярной биологии, патоморфологии и философии живого в целом [2].
Рост практического интереса к прионным болезням в настоящее время связан со вспышкой спонгиформной энцефалопатии коров в Великобритании («коровье бешенство») [3]. Распространенность прионных заболеваний человека весьма различна в зависимости от конкретного вида патологии и исследуемого региона. Наиболее изучена распространенность болезни Кройцфельдта — Якоба (БКЯ), встречающейся почти во всех регионах с практически одинаковой частотой: 0,3-1 случай на 1 млн населения в год [4].
Основными методами диагностики данной патологии остаются следующие: иммунодиффузия в геле, изоэлектрическое фокусирование, радиоизотопный метод и иммуноферментный анализ [5]. Однако существующие методы определения видовой принадлежности животных белков оказываются малоэффективными, поскольку биологический материал зачастую проходит термическую обработку, ведущую к денатурации белков, следствием чего является потеря ими видовой специфичности. В отличие от белков, ДНК более устойчива к термической обработке и не утрачивает своей информативной функции.
Поэтому применение молекулярно-генетических методов является перспективным для определения видовой принадлежности ДНК. Учитывая отсутствие доступных и информативных методик, необходимых для мониторинга мяса животных, разработка ПЦР-тест-системы для определения видовой принадлежности мясных ингредиентов является весьма актуальной.
Цель исследования
Настоящее исследование направлено на изучение основных аспектов конструирования праймеров для определения видовой принадлежности ДНК крупного рогатого скота методом полимеразной цепной реакции.
Материалы и методы исследования
Конструирование ДНК-матрицы осуществляли с использованием метода полимеразной цепной реакции (ПЦР) [6], который позволяет не только получать индивидуальные копии выбранных фрагментов любых ДНК, но и соединять эти фрагменты в любом месте. Последнее в сочетании с химическим синтезом фрагментов ДНК дает возможность получать ДНК-матрицы заданной структуры. Их длина ограничена только возможностями ПЦР, которая позволяет получать ДНК длиной до 2900 п.н. [7] и более [8].
Анализ олигонуклеотидных последовательностей осуществляли в GenBank с помощью программы BLAST.
Выбор параметров праймеров проводили с помощью программы Primer 3.
Результаты исследования и их обсуждение
Праймер представляет собой короткий фрагмент нуклеиновой кислоты, который служит стартовой точкой при репликации ДНК в методе полимеразной цепной реакции (ПЦР).
Непосредственно проектированию праймеров предшествует предварительный этап построения подробной модели гена-мишени или иной последовательности нуклеиновой кислоты, которую планируется амплифицировать.
Для проведения иммуно-ПЦР анализа необходима ДНК-матрица (ДНК-хвост).
Чтобы снизить риск ложных срабатываний за счет экзогенных загрязнений ДНК, был разработан ДНК-хвост, неизвестный на данный момент.
Была построена синтетическая последовательность длиной 194 п.н. (учитывая, что наиболее оптимальной длиной считают фрагменты в диапазоне 150-300 пар оснований), полученная случайным образом:
ДНК-хвост:
AGGAGGTGGCCACGACTGCGAAGGAGGTGGCGTAGGATAGAGTCAGTCCTTGGCC
TCCTTGGCCCAGTTAAGAAGTTGCAGCCACACACGCTGTTGTTGGGTTCGGGGCGG
AGTTGCAGCCATCTACACAAACGATACCCTCGTGCAGCTGGAGAAGCAGCACGGCC
TATTACCTGGAGGAGGATCGAAACTGA
Созданная последовательность была проанализирована в GenBank с помощью программы BLAST. Используя данную программу, сравнили имеющуюся последовательность с последовательностями из базы данных и определили наличие гомологов. Проведенный анализ показал, что созданные нуклеотидные последовательности гомологов не имеют.
Одними из ключевых компонентов реакции являются «праймеры» — синтетические олигонуклеотиды. Праймеры комплементарны противоположным цепям ДНК в участках, ограничивающих выбранную область ДНК, и ориентированы З’-концами навстречу друг другу и в сторону той последовательности, которую необходимо амплифицировать. Длина амплифицируемого фрагмента определяется расстоянием между праймерами.
При амплификации с помощью ПЦР используют два олигонуклеотидных праймера (затравки). Праймеры подбираются таким образом, чтобы синтез с помощью полимеразы протекал только между ними, удваивая количество копий этого участка ДНК. В результате происходит экспоненциальное увеличение количества специфического фрагмента.
Конструирование праймеров — возможно, наиболее критический параметр для успешного проведения ПЦР. При прочих условиях, плохо сконструированный праймер может привести к ПЦР-реакции, которая не даст положительного результата. Последовательность праймера определяет целый ряд показателей, таких как позиция и длина продукта, его температура плавления и, безусловно, выход продукта. Плохо сконструированный праймер может привести к малому количеству продукта или его отсутствию вследствие неспецифической амплификации и/или образования димера праймера, который может стать конкурентным настолько, что будет подавлять образование продукта. Эти указания по применению проводятся для того, чтобы обозначить правила, которые следует принимать во внимание при конструировании праймеров для ПЦР.
При конструировании праймеров для ПЦР следует принимать во внимание несколько параметров. Среди них есть наиболее критические:
- длина праймера;
- температура плавления (Tm) и температура отжига;
- специфичность;
- комплементарная последовательность праймера;
- G/C содержание и полипиримидиновые (Т, С) или полипуриновые (A, G) протяженные участки;
- вторичная структура сайта-мишени;
- вторичная структура праймера;
- гомо- и гетеродимеризация праймеров.
Длина праймера. Поскольку специфичность, температура и время отжига частично зависят от длины праймера, этот параметр является критическим для успешного осуществления ПЦР. В идеале праймер должен иметь размер от 15 до 30 нуклеотидов. Длина праймера также пропорциональна эффективности отжига. Если меньше количество матриц на каждой стадии обеспечено праймерами, это может привести к значительному снижению выхода амплифицированного продукта. Праймеры, однако, не должны быть слишком короткими, если это только специально не требуется для особого применения.
Температура плавления. Оба олигонуклеотидных праймера следует конструировать таким образом, что бы они имели примерно одинаковую температуру плавления. Если праймеры не совпадают в отношении Tm, амплификация будет менее эффективной, или может вовсе не сработать, так как праймер с более высокой Tm будет неправильно работать при более низкой температуре.
Тm праймера — температура, при которой концентрация гетеродимеров праймера с матрицей равна половине от максимально возможной концентрации таких гетеродимеров в реакционной смеси.
Разница в Тm между двумя праймерами одной и той же пары не должна превышать 4-6 градусов. Если же Тm двух праймеров различается существенно, то праймер с наименьшей Тm может быть удлинен с 3′-конца (с сохранением размера конечного продукта) или 5′-конца (с эквивалентным увеличение размера конечного продукта).
Температура «отжига» праймера. Ta праймера — это температура, при которой происходит гибридизация праймера с матрицей. Ta на 4-5оС (а по мнению некоторых авторов, на 1-2 оС) ниже Тm праймера.
Специфичность. В идеале праймер должен обладать 100 %-ной комплементарностью по отношению к сайту-мишени и не распознавать другие, даже очень близкие по нуклеотидному составу, последовательности. Однако практика показывает, что эффективными могут быть и праймеры, не обладающие 100 %-ной комплементарностью и имеющие достаточно высокую степень гомологии (но не более 70 %) по отношению к другим нуклеотидным последовательностям.
Специфичность праймера, по крайней мере, частично, зависит от длины праймера. Очевидно, что существует гораздо больше уникальных олигонуклеотидов из 24 оснований, чем из 15 оснований. Таким образом, праймеры следует выбирать так, чтобы они имели уникальную последовательность, находящуюся внутри матричной ДНК, которую предполагается амплифицировать. Праймер, сконструированный так, что он содержит высокоповторяющуюся последовательность, в результате даст размазанное пятно при амплификации геномной ДНК. Однако тот же самый праймер может и единичную полосу, если амплифицируется единичный клон из геномной библиотеки. Вследствие того, что Taq-ДНК полимераза активна в широком диапазоне температур, удлинение праймера будет происходить при более низких температурах отжига. Если температура слишком низка, может происходить неспецифическое функционирование праймера, который может расти под действием полимеразы, если имеется короткая гомология у 3′-конца. В целом, температура плавления в 55-72 °С дает наилучшие результаты.
Комплементарная последовательность праймера. Праймер следует конструировать так, чтобы в нем абсолютно отсутствовала внутренняя гомология, превышающая 3 нуклеотидные пары. Если праймер имеет такой участок гомологии, могут создаваться частично двухцепочечные структуры, типа «обратного схлопывания» или «шпилек», которые будут мешать отжигу с матрицей. Другая относительная опасность — это гомология между праймерами. Частичная гомология встречается у 3′-конца любого праймера, будет происходить образование димера, который чаще всего будет противодействовать образованию желаемого продукта.
G/C cодержание и полипиримидиновые (Т,С) или полипуриновые (А, G) протяженные участки. Состав оснований в праймере должен быть между 45 % и 55 % содержанием GC. Последовательность праймера должна быть выбрана таким образом, чтобы не было поли-G или поли-С протяженных участков, которые могут способствовать неспецифическому отжигу. Поли-А и поли-Т протяженных участков тоже следует избегать, так как они будут «дышать» и раскрывать протяженные участки комплекса праймер-матрица. Это может снизить эффективность амплификации. Не следует допускать также образования полипиримидиновых (Т, С) или полипуриновых (А, G) протяженных участков. Идеально, праймер должен содержать почти случайную смесь нуклеотидов, иметь содержание GC-50-55 % и длину~20 оснований. Это даст Tm в пределах 56-62 °С.
Вторичная структура праймера. Праймер не должен укладываться во вторичную структуру, температура плавления которой была бы эквивалентна или выше Тm праймера. При наличии такой структуры эффективность связывания праймера с соответствующей нуклеотидной последовательностью сайта-мишени будет низкой.
Вторичная структура сайта-мишени. Сайт-мишень (область матрицы, комплементарная праймеру) не должен укладываться во вторичную структуру, температура плавления которой была бы эквивалентна или выше Тm праймера. При наличии такой структуры эффективность связывания праймера с сайтом-мишенью будет низкой.
Гомо- и гетеродимеризация праймеров. Возможность гомо- и гетеродимеризации праймеров при температуре, равной или выше температуры их «отжига», должна быть полностью исключена, особенно с 3′-конца, так как это может привести к снижению выхода конечного продукта ПЦР (вплоть до его полного отсутствия).
Учитывая представленные параметры, к синтезированному ДНК-хвосту подобрали следующие 2 праймера размерами 20 п.н.:
1) >>>>>> левый праймер — с 41 п.н.- AGTCAGTCCTTGGCCTCCTT
2) <<<<<< правый праймер — с 193 п.н.- CAGTTTCGATCCTCCTCCAG
1
AGGAGGTGGCCACGACTGCGAAGGAGGTGGCGTAGGATAGAGTCAGTCCTTGGCCTCCTT
>>>>>>>>>>>>>>>>>>>>
61
GGCCCAGTTAAGAAGTTGCAGCCACACACGCTGTTGTTGGGTTCGGGGCGGAGTTGCAGC
121
CATCTACACAAACGATACCCTCGTGCAGCTGGAGAAGCAGCACGGCCTATTACCTGGAGG
<<<<<<<
181 AGGATCGAAACTGA
<<<<<<<<<<<<<
С помощью программы Primer 3 была подобрана температура плавления (Тm) и другие параметры для соответствующих праймеров, представленные в табл. 1.
Таблица 1 Параметры праймеров
|
OLIGO |
Старт, п.н. |
СG |
Длина, п.н. |
Тm,°С |
seq |
|
Левый праймер |
41 |
55 |
20 |
60,25 |
AGTCAGTCCTTGGCCTCCTT |
|
Правый праймер |
193 |
55 |
20 |
59,80 |
CAGTTTCGATCCTCCTCCAG |
Соответственно, для правого праймера она равна tm =59,80 °С, для левого — tm = 60,25 °С.
Температуру отжига принимают на 4-5 градусов ниже, чем температура плавления.
Следовательно, оптимальная температура соответствующего режима в программе амплификации (температура отжига) ta будет составлять:
Для левого праймера: ta =56,00 °С.
Для правого праймера: ta=55,80 °С.
Представляется перспективным в последующей работе использовать выбранные праймеры для разработки тест-системы для идентификации ДНК крупного рогатого скота и выявления возбудителя прионных заболеваний в образцах мясного сырья.
Заключение
Таким образом, при выполнении работы построена синтетическая последовательность длиной 194 п.н., полученная случайным образом (ДНК-хвост). Анализ в GenBank с помощью программы BLAST показал, что созданная последовательность и последовательности базы данных гомологов не имеют.
К синтезированному ДНК-хвосту подобраны 2 праймера размерами 20 п.н.
С помощью программы Primer 3 подобраны параметры для соответствующих праймеров.
Результаты проведенных исследований целесообразно использовать при разработке тест-систем для идентификации ДНК крупного рогатого скота.
* Работа выполнена в рамках федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007-2013 годы» (государственный контракт №16.512.11.2077).
Рецензенты:
- Майоров Александр Альбертович, доктор технических наук, профессор, директор ГНУ СибНИИС СО Россельхозакадемии, 656016, г. Барнаул.
- Гаврилов Гавриил Борисович, доктор технических наук, директор Ярославского государственного института качества сырья и пищевых продуктов, г. Ярославль.
Библиографическая ссылка
Кригер О.В., Солдатова Л.С., Кравченко А.Ю., Новоселова М.В. ОСНОВНЫЕ АСПЕКТЫ КОНСТРУИРОВАНИЯ ПРАЙМЕРОВ ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВОЙ ПРИНАДЛЕЖНОСТИ ДНК КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ // Современные проблемы науки и образования. – 2012. – № 2.
;
URL: https://science-education.ru/ru/article/view?id=5964 (дата обращения: 24.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)







