1. Окислители и восстановители
2. Классификация окислительно–восстановительных реакций
3. Основные правила составления ОВР
4. Общие закономерности протекания ОВР
5. Основные схемы ОВР
5.1. Схема восстановления перманганатов
5.2. Схема восстановления хроматов/бихроматов
5.3. Разложение нитратов
5.4. Окислительные свойства азотной кислоты
5.5. Взаимодействие металлов с серной кислотой
5.6. Пероксид водорода
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
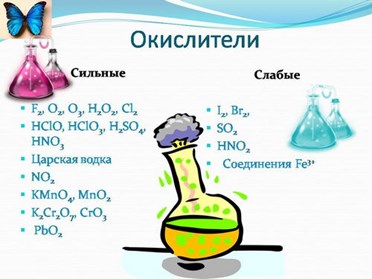
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN+5O3, HCl+7O4), соли (KN+5O3, KMn+7O4), оксиды (S+6O3, Cr+6O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4+, Fe3+, Au3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2+, Fe2+, Cr2+), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S+4O3)2–, (НР+3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители:
-
перманганат калия (KMnO4);
-
дихромат калия (K2Cr2O7);
-
азотная кислота (HNO3);
-
концентрированная серная кислота (H2SO4);
-
пероксид водорода (H2O2);
-
оксиды марганца (IV) и свинца (IV) (MnO2, PbO2);
-
расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов .
К восстановителям, которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
2Al0 + Fe+32O3 → Al+32O3 + 2Fe0,
C0 + 4HN+5O3(конц) = C+4O2 ↑ + 4N+4O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых элемент-окислитель и элемент-восстановитель входят в состав одного вещества:
(N-3H4)2Cr+62O7 → N20 ↑+ Cr+32O3 + 4 H2O,
2 NaN+5O-23 → 2 NaN+3O2 + O02↑.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
2H2S-2 + S+4O2 = 3S + 2H2O
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается, а восстановитель окисляется.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Рассмотрим подробно метод электронного баланса.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
K+2S-2 + 2K+Mn+7O-24 = 2K+2Mn+6O-24 + S0
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
S-2 -2e = S0
Mn+7 + 1e = Mn+6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций.
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn+7 в кислой среде восстанавливается до Mn+2, а в щелочной — до Mn+6);
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N+5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N-3);
- либо окислитель практически не подвержен изменениям среды.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Если среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ. Например, при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстанавливается азот N+5.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества. Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn2+. Оксид марганца в степени окисления +2 проявляет основные свойства, поэтому в кислой среде образуется соль. Соли марганца +2 бесцветны. В нейтральном растворе марганец восстанавливается до степени окисления +4, с образованием амфотерного оксида MnO2 — коричневого осадка, нерастворимого в кислотах и щелочах. В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления +6. Соединения марганца +6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты. Манганаты придают раствору зеленую окраску.
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S0.
5 K2S + 2 KMnO4 + 8 H2SO4 = 5 S + 2 MnSO4 + 6 K2SO4 + 8 H2O,
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
K2S + 2 KMnO4 –(KOH)= 2 K2MnO4 + S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
- неметаллы с отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк — до +5;
- неметаллы с промежуточной степенью окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 + неМе (низшая с.о.) = неМе0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме0 = Ме (стабильная с.о.) + др. продукты
KMnO4 + P-3, As-3= P+5, As+5 + др. продукты
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде.
Восстанавливаются соединения хрома (VI) до соединений хрома (III). Соединения хрома Cr+3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3, и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K3[Cr(OH)6].
Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As+5 + другие продукты
Разложение нитратов
Соли-нитраты содержат азот в степени окисления +5 — сильный окислитель. Такой азот может окислять кислород (О-2). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярного кислорода O2.
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород.
Например:
2NaNO3 → 2NaNO2 + O2.
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь), то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
2Zn(NO3)2 → 2ZnО + 4NO2 + O2.
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов, расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N+5, участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород.
Например, разложение нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2.
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония:
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления +5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 оС образуется оксид азота (I) («веселящий газ») и вода:
NH4NO3 → N2O + 2H2O
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N+3 и восстановителя N-3
NH4NO2 → N2 + 2H2O
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Mn(NO3)2 = MnO2 + 2NO2
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
2Fe(NO3)2 → 2FeO + 4NO2 + O2 при 60°C
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 при >60°C
Нитрат никеля (II) разлагается до нитрита при нагревании до 150оС под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород, в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N+4); оксид азота (II) NO (N+2); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3. Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются.
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например, взаимодействие цинка с очень разбавленной азотной кислотой:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
- концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe. При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платиной Pt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами и металлами средней активности азотная кислота восстанавливается до оксида азота (IV) NO2;
Например, окисление меди концентрированной азотной кислотой:
Cu+ 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота (I) N2O;
Например, окисление натрия концентрированной азотной кислотой:
8Na+ 10HNO3 = 8NaNO3 + N2O + 5H2O
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
NO2; NO; N2O; N2; NH4NO3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например, взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H+, которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальной степени окисления.
Например:
Fe + H2SO4(разб) = FeSO4 + H2
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S+4O2, молекулярная сера S либо сероводород H2S-2, в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Например, медь окисляется концентрированной серной кислотой:
Cu0 + 2H2S+6O4(конц) = Cu+2SO4 + S+4O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S2- (в зависимости от температуры, степени измельчения и активности металла).
Например, взаимодействие концентрированной серной кислоты с цинком:
8Na0 + 5H2S+6O4(конц) → 4Na2+SO4 + H2S—2 + 4H2O
Пероксид водорода
Пероксид водорода H2O2 содержит кислород в степени окисления -1. Такой кислород может и повышать, и понижать степень окисления. Таким образом, пероксид водорода проявляет и окислительные, и восстановительные свойства.
При взаимодействии с восстановителями пероксид водорода проявляет свойства окислителя, и восстанавливается до степени окисления -2. Как правило, продуктом восстановления пероксида водорода является вода или гидроксид-ион, в зависимости от условий проведения реакции. Например:
S+4O2 + H2O2-1 → H2S+6O4-2
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например:
2KMn+7O4 + 5H2O2-1 + 3H2SO4 → 5O20 + 2Mn+2SO4 + K2SO4 + 8H2O
…
Для протекания окислительно-восстановительных реакций (ОВР) необходимо одновременное присутствие веществ, взаимно противоположных по своей способности отдавать или присоединять электроны. Кроме этого, протекание некоторых реакций окисления-восстановления возможно лишь при определенных условиях (реакция среды, температура, катализатор, концентрация веществ и др).
Чтобы определить вероятность протекания ОВР обычно пользуются значениями ионизационных потенциалов, сродства к электрону и электроотрицательностей. При количественном определении направления окислительно-восстановительных реакций удобно пользоваться стандартными значениями энергии Гиббса образования исходных или конечных веществ, а также изменением энергии Гиббса или Гельмгольца реакции.
Мерой интенсивности реакций окисления-восстановления являются стандартные окислительно-восстановительные потенциалы.
Алгоритм cоставления уравнений реакций окисления-восстановления
При составлении уравнений реакций окисления-восстановления необходимо придерживаться определенной последовательности:
- Найти среди исходных веществ окислитель и восстановитель
- Записать продукты реакции
- Подобрать коэффициенты
1. Найти среди исходных веществ окислитель и восстановитель
Для этого прежде всего необходимо расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Например:
KBr + KMnO4 + H2SO4 =
Расставим степени окисления:
K+Br— + K+Mn+7O4-2
В кислой среде Br— окисляется до Br2, т.е. отдает 2 электрона и является восстановителем, а Mn+7 восстанавливается до Mn+2 и является окислителем.
2. Записать продукты реакции
Правильно определить продукты реакции помогут ваши знания о строении атомов элементов, их свойствах и свойствах их соединений.
Важно помнить, что в реакциях межатомного и межмолекулярного окисления-восстановления, свободный кислород, как правило, не выделяется.
Выделение кислорода
Выделение кислорода происходит при взаимодействии пероксидов с сильными окислителями, а также в некоторых реакциях с участием озона и фтора. Например,
2KMnO4 + 5Na2O2 + 8H2SO4 = 2MnSO4 + 5O2↑ + 5Na2SO4 + K2SO4 + 8H2O
SiO2 + 2F2 = SiF4 + O2↑
PbS + 4O3 = PbSO4 + 4O2↑
В других случаях атомы кислорода, входящие в состав молекул окислителя (или восстановителя) связываются в молекулы воды при участии ионов водорода H+, например
HNO2 + HI = NO + I2 + H2O
Характер среды
Кислая среда
При написании продуктов реакции необходимо учитывать характер среды. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов – хлориды, бромиды, сульфаты, нитраты.
Для создания кислой среды, как правило используют разбавленную серную кислоту. Соляная и азотная кислоты для подкисления используются реже, т.к. азотная кислота сама является окислителем, а соляная кислота в присутствии сильных окислителей обладает восстановительными свойствами.
Щелочная среда
Щелочную среду создают, как правило, растворами KOH или NaOH. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Чтобы не ошибиться при написании продуктов реакций, вначале следует написать продукты окисления и восстановления, а потом только другие вещества, степень окисления которых не изменяется в процессе реакции.
Итак, образуемые в результате реакции продукты, определяются условиями проведения реакции и природой окислителя и восстановителя. Ниже представлены схемы окислительно-восстановительных реакций соединений марганца и хрома в различных средах, а также азотной и серной кислот.
Азотная кислота
В результате реакции азотной кислоты с металлами, в зависимости от ее концентрации и активности металла, образуются нитраты, вода и различные продукты восстановления кислоты, указанные в таблице ниже. См. также химические свойства азотной кислоты
Разбавленная серная кислота не является окислителем и реагирует с металлами, как обычная кислота. Если металл стоит в электрохимическом ряду напряжения металлов до водорода, то при его взаимодействии с кислотой происходит выделение водорода. Если металл находится после водорода в этом ряду, то взаимодействия не происходит.
Концентрированная серная кислота активными металлами (до Zn) восстанавливается до S и H2S, а менее активными (расположенные после водорода и в непосредственной близости от него в ряду напряжения металлов) до SO2. См. также химические свойства серной кислоты
Благородные металлы — золото Au и платина Pt не окисляются даже концентрированной серной кислотой.
А такие достаточно активные металлы, как Al, Fe, Cr при обычных условиях пассивируются и не взаимодействуют с концентрированной H2SO4, однако при нагревании реакции становятся возможными.
3. Подобрать коэффициенты
Коэффициенты в ОВР подбирают, учитывая число отданных и принятых электронов. Следует помнить, что общее число электронов, отданных восстановителем, должно равняться общему числу электронов, принятых окислителем.
Существует несколько методов подбора коэффициентов, из которых чаще всего используют Метод электронного баланса и ионно-электронный метод (метод полуреакций). В соответствующих разделах, а также в разделе Задачи к разделу Окислительно-восстановительные реакции приведены примеры составления окислительно-восстановительных реакций.
Основные правила составления окислительно-восстановительных реакций
(скачать pdf файл)
Существует несколько основных правил, которые сильно упрощают составление окислительно-восстановительных реакций. Более подробно эти и другие правила рассматривается на других страницах этого раздела, но для ЕГЭ достаточно знать правила из этого списка.
Правило 1. Реакции простых веществ: металлов и неметаллов с щелочами, кислотами и солями:
1.1) Из металлов только Al, Zn и Be взаимодействуют со щелочами с выделением водорода:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
1.2) Из неметаллов только S, P, Si и галогены реагируют с щелочами:
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
P4 + 3NaOH + 3H2O → PH3
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2.1) Металлы (стоящие в ряду активности металлов до H2) реагируют с кислотами-неокислителями с выделением водорода:
2HCl + Fe → FeCl2 + H2
H2SO4(р) + Fe → FeSO4 + H2
2.2) Все металлы, кроме Pt и Au, реагируют с кислотами-окислителями без выделения водорода:
2H2SO4(к) + 2Ag → Ag2SO4 + SO2
6H2SO4(к) + 2Fe → Fe2(SO4)3 + 3SO2
2.3) Более сильные металлы вытесняют более слабые из растворов их солей:
Fe + CuSO4 → FeSO4 + Cu
3) Неметаллы не реагируют с кислотами-неокислителями:
C + HCl → реакция не идет
4) Такие неметаллы, как S, C, P могут реагировать с солями, проявляющими окислительные свойства (KClO3, KNO3 в расплавленном состоянии):
6P + 5KClO3 → 3P2O5 + 5KCl
C + 2KNO3 (расплав) → CO2
S + 2KNO3 (расплав) → SO2
5) Важная реакция получения фосфора:
5C + 3SiO2 + Ca3(PO4)2 → 5CO
6) Из неметаллов только S, C, и P реагируют с кислотами-окислителями (в рамках ЕГЭ), а также I2 с HNO3(к):
Правило 2. Фосфор
1) Наиболее устойчивая степень окисления фосфора +5, следовательно, любые другие соединения фосфора окисляются сильными окислителями до этой степени окисления (с образованием P2O5 или фосфат-иона):
PH3 + 8KMnO4 + 11KOH → K3PO4 + 8K2MnO4 + 7H2O
6P + 5KClO3 → 5KCl + 3P2O5
3P2O3 + 4HNO3 + 7H2O → 6H3PO4 + 4NO
Правило 3. Азот
1) Аммиак, как правило, окисляется до азота N2:
8NH3 + 3KBrO4 → 3KBr + 4N2
2NH3 + 3CuO → 3Cu + N2
Исключением является каталитическое окисление аммиака:
4NH3 + 5O2 → 4NO
Обычное горение аммиака протекает с образованием N2 (как и горение любых органических азотсодержащих соединений):
4NH3 + 3O2 → 2N2
2) Нитрит-ионы окисляются до нитрат-ионов:
3KNO2 + K2Cr2O7 + 4H2SO4 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2
3) Нитрит-ионы восстанавливаются до азота в реакциях с солями аммония:
NaNO2 + NH4Cl → N2
Ca(NO2)2 + (NH4)2SO4 → 2N2
4) Нитрит-ионы восстанавливаются до оксида азота (II) в реакциях с типичными восстановителями: HI, йодидами, солями Fe+2 и др.:
2KNO2 + 2KI + 2H2SO4 → 2NO
HNO2 + 2HI → 2NO
Следующий тип реакций встречается в вариантах Ю.Н. Медведева.
5) Нитрат-ионы являются сильными окислителями при сплавлении с соединениями Cr, Mn, Fe в щелочной среде и с некоторыми неметаллами (восстанавливаются до нитритов):
3NaNO3 + Cr2O3 + 4KOH → 3NaNO2 + 2K2CrO4 + 2H2O
KNO3 + MnO2 + K2CO3 → KNO2 + K2MnO4 + CO2
2NaNO3 + FeSO4 + 4NaOH → 2NaNO2 + Na2FeO4 + Na2SO4 + 2H2O
2KNO3(расплав) + C → 2KNO2 + CO2
2KNO3(расплав) + S → 2KNO2 + SO2
6) Нитрат-ионы являются сильными окислителями в кислотной среде:
2KNO3 + Cu + 2H2SO4 → CuSO4 + 2NO2
7) Восстановление нитратов до аммиака в реакциях с такими металлами, как Al, Zn, Mg (встречается очень редко):
3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3
NaNO3 + 4Zn + 7NaOH + 6H2O → NH3
KNO3 + 4Mg + 6H2O → NH3


Правило 4. Кислород
1) Перекись водорода окисляется до кислорода O2 типичными окислителями:
KMnO4, K2Cr2O7, галогены, соли кислородсодержащих кислот хлора (например, KClO3) и некоторыми другими.
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO

2) Перекись водорода восстанавливается до H2O типичными восстановителями:
KI (HI, йодиды), K2SO3 (SO2, сульфиты), KNO2 (нитриты), PbS (H2S, сульфиды), соединения Cr+3 в щелочной среде, соединения Fe+2, NH3 и некоторыми другими.
H2O2 + Na2SO3 → Na2SO4 + H2O
H2O2 + KNO2 → KNO3 + H2O
3H2O2 + 2NaCrO2 + 2NaOH → 2Na2CrO4 + 4H2O
Свойства пероксида водорода с примерами
Правило 5. Галогены
1) Галогены диспропорционируют в щелочах:
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2) Простые вещества галогены и соединения галогенов в любой положительной степени окисления восстанавливаются, как правило, до галогенид-ионов (т.е. до ст. ок. -1) в реакциях с типичными восстановителями:
5HClO3 + 6P + 9H2O → 5HCl + 6H3PO4
KClO3 + 6Fe(OH)2 + 18HCl → 6FeCl3 + KCl + 15H2O
2Cl2 + H3PO2 + 7KOH → K3PO4 + 4KCl + 5H2O
2Br2 + CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
3) Галогенид-ионы окисляются, как правило, до простых веществ: Cl2, Br2, I2:
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
16HCl + 2KMnO4 → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
4) Йодид меди восстанавливает серную кислоту до SO2, тогда как йодиды активных металлов до H2S:
2CuI + 4H2SO4(конц.) → I2 + 2SO2 + 2CuSO4 + 4H2O
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
5) Концентрированной серной кислотой окисляются только бромид- и йодид-ионы. В первом случае образуется SO2, во втором H2S.
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O.
6) Более сильные галогены вытесняют менее сильные из галогенидов. В ряду F2, Cl2, Br2, I2 окислительные свойства ослабевают.
Cl2 + 2NaI → I2 + 2NaCl
Cl2 + NaF → реакция не идет, так как Cl2 — более слабый окислитель чем F2.
Все галогены вытесняют серу из сульфидов:
(NH4)2S + Br2 → S + 2NH4Br.
Правило 6. Сера
1) Сульфид-ионы обычно окисляются до S типичными окислителями: Br2, I2, растворами солей K2Cr2O7, KMnO4 и др.:
3Na2S + K2Cr2O7 + 7H2SO4 → 3S
5Na2S + 2KMnO4 + 16HCl → 5S
H2S + Br2 → S
H2S + H2O2 → S
2) С H2SO4(к) сероводород и сульфиды реагируют с образованием SO2, аналогично реакции кислоты с серой:
S + H2SO4(конц.) → 3SO2
H2S + 3H2SO4(конц.) → 4SO2
K2S + 4H2SO4(конц.) → K2SO4 + 4SO2
В этой реакции сульфид-ион окисляется до SO2: S–2 -6e → S+4.
Часть сульфат-ионов восстанавливается также до SO2 и часть остается для образования соли K2SO4.
3) Окисление H2S и сульфидов до сульфат-ионов протекает в реакциях с такими окислителями, как Cl2 в воде, H2O2, HNO3(конц.) при нагревании:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
H2S + 8HNO3(конц.) → H2SO4 + 8NO2
PbS + 4H2O2 → PbSO4 + 4H2O (черный сульфид свинца превращается в белый сульфат)
4) Сульфит-ионы любыми окислителями окисляются до сульфат-иона:
3Na2SO3 + 2KMnO4 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
3K2SO3 + 2K2CrO4 + 5H2O → 2Cr(OH)3 + 3K2SO4 + 4KOH.
5) Взаимодействие серной кислоты с простыми и сложными веществами
Правило 7. Медь
1) Соединения Cu+2 окисляют соединения S+4 и I– (восстанавливаясь до Cu+1):
2CuCl2 + SO2 + 2H2O → 2CuCl
2Cu(NO3)2 + 4KI → 2CuI

В реакции с аммиаком выделяется металлическая медь:
3CuO + 2NH3 → N2
2) Йодиды меди реагируют с H2SO4(к) с образованием SO2, тогда как йодиды щелочных металлов с образованием H2S:
2CuI + 4H2SO4 → 2CuSO4 + I2 + 2SO2 + 4H2O
8KI + 5H2SO4(конц.) → 4K2SO4 + 4I2 + H2S + 4H2O
3) Медь по-разному реагирует с галогенами:
Cu + Cl2 → CuCl2
Cu + Br2 → CuBr2
2Cu + I2 → 2CuI (соль меди +1)
4) Медь в степени окисления +2 восстанавливается самой медью:
CuO + Cu → Cu2O (t)
CuCl2 + Cu → 2CuCl (t).
Правило 8. Железо
1) Соединения Fe+3 окисляют соединения S–2, S+4, I– и некоторые слабые металлы (восстанавливаясь до Fe+2):
Fe2O3 + 6HI → 2FeI2 + I2
2FeCl3 + 3Na2S → 2FeS

2FeCl3 + H2S → 2FeCl2 + S
2FeCl3 + Na2SO3 +H2O → 2FeCl2 + Na2SO4 + 2HCl
2FeCl3 + Cu → CuCl2 + 2FeCl2 (соль железа +2)
Fe2(SO4)3 + Cu → CuSO4 + 2FeSO4 (соль железа +2)
2Fe(NO3)3 + Fe → 3Fe(NO3)2 (соль железа +2)
2) В кислой среде соединения Fe+2 окисляются такими окислителями, как KMnO4, K2Cr2O7, Na2O2, HNO3, H2SO4(к) и др. до солей Fe+3:
6FeCl2 + Na2Cr2O7 + 14HCl → 6FeCl3 + 2CrCl3 + 2NaCl + 7H2O
2FeSO4 + Na2O2 + 2H2SO4 → Fe2(SO4)3 + Na2SO4 + 2H2O
3) В щелочной среде образуется гидроксид железа (III):
FeCl2 + KMnO4 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2FeSO4 + 2KMnO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
4) Железо по-разному реагирует с галогенами:
2Fe + 3F2 → 2FeF3
2Fe + 3Cl2 → 2FeCl3
2Fe + 3Br2 → 2FeBr3
Fe + I2 → FeI2 (соль железа +2)
5) Соединения Fe+2, Fe+3 также могут быть окислены до степени окисления +6 (до ферратов, например, Na2FeO4) очень сильными окислителями, но на ЕГЭ знание этих реакций не проверяется (источник: вебинары от разработчиков экзамена):
3FeSO4 + 2NaClO3 + 12NaOH → 3Na2FeO4 + 2NaCl + 3Na2SO4 + 6H2O.
Правило 9. Марганец
1) В кислой среде образуются соли Mn+2:
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
2) В щелочной среде образуется манганат-ион MnO42– (зеленого цвета):
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3
3) В нейтральной среде образуется осадок бурого цвета MnO2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2
2KMnO4 + 3K2S + 4H2O → 2MnO2

K2MnO4 + Na2S + 2H2O → S

Правило 10. Хром
1) Восстановление дихроматов в кислой среде протекает с образованием солей Cr+3:
Na2Cr2O7 + 6NaI + 7H2SO4 → Cr2(SO4)3 + 3I2
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
2) Окисление соединений Cr+2 в кислой среде протекает с образованием солей Cr+3:
6CrCl2 + K2Cr2O7 + 14HCl → 8CrCl3 + 2KCl + 7H2O
2CrCl2 + 4H2SO4(конц.) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
3) Окисление соединений Cr+3 очень сильными окислителями с щелочами или с карбонатами щелочных металлов протекает с образованием хроматов (типичные окислители: KNO3, Cl2, KClO3, H2O2 и др. в щел. среде):
Cr2O3 + 3KNO3 + 2K2CO3 → 2K2CrO4 + 3KNO2 + 2CO2
Cr2(SO4)3 + 3Cl2 + 16KOH → 2K2CrO4 + 6KCl + 3K2SO4 + 8H2O
2Cr(OH)3 + KClO3 + 4NaOH → 2Na2CrO4 + KCl + 5H2O
2Cr(OH)3 + 3H2O2 + 4KOH → 2K2CrO4 + 8H2O
4) Соединения Cr+6 в различных средах:
В щелочной среде устойчивы соли хромовой кислоты (хроматы, желтого цвета), например, Na2CrO4.
В кислой среде устойчивы соли дихромовой кислоты (дихроматы, оранжевого цвета), например, Na2Cr2O7.
CrO3 + 2KOH → K2CrO4 + H2O
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O (в кислотной среде желтая окраска переходит в оранжевую).
Na2Cr2O7 + 2NaOH → 2Na2CrO4 + H2O (в щелочной среде оранжевая окраска переходит в желтую).
Правило 11. Среда раствора
1) С карбонатами щелочных металлов реакции протекают аналогично щелочной среде реакции:
Cr2O3 + 3KNO3 + 2K2CO3 → 2K2CrO4 + 3KNO2 + 2CO2
MnO2 + KNO3 + K2CO3 → K2MnO4 + KNO2 + CO2
2) Если в реакцию вступает оксид серы (IV) SO2 в нейтральном растворе, то реакция протекает аналогично кислой среде раствора:
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4.
Поэтому очень важно не зубрить окислительно-восстановительные реакции, а знать какие соединения проявляют окислительные, а какие восстановительные свойства, и знать основные правила, приведенные выше.
1. Как определить окислительно-восстановительную реакцию?
Существуют различные классификации химических реакций. К одной из них относится такие, при которых вещества, вступающие во взаимодействие друг с другом (или само вещество) меняют степени окисления элементов.
В качестве примера рассмотрим две реакции:
Zn0 + 2Н+1С1-1 = Zn+2Cl2-1 + Н20 (1)
Н+1Cl-1 + К+1О-2Н+1 = К+1Cl-1 + H2+1O-2 (2)
В реакции (1) участвуют цинк и соляная кислота. Цинк и водород меняют свои степени окисления, хлор оставляет свою степень окисления неизменной:
Zn0 — 2е = Zn2+
2Н+1 + 2е = H20
2Сl-1 = 2 Сl-1
А в реакции (2), (реакция нейтрализации), хлор, водород, калий, и кислород не меняют свои степени окисления: Сl-1 = Cl-1, H+1 = H+1, К+1 = К+1, O-2 = O-2; Реакция (1) относится к окислительно-восстановительной, а реакция (2) принадлежит к другому типу.
Химические реакции, которые осуществляются с изменением степени окисления элементов, называются окислительно-восстановительными.
Для того чтобы определить окислительно-восстановительную реакцию необходимо установить степени окисления элементов в левой и в правой части уравнения. Для этого требуется знать, как определить степень окисления того или иного элемента.
В случае реакции (1) элементы Zn и Н меняют свои состояния, теряя или приобретая электроны. Цинк, отдавая 2 электрона, переходит в ионное состояние – становится катионом Zn2+. В данном случае происходит процесс восстановления и цинк окисляется. Водород приобретает 2 электрона, проявляет окислительные свойства, сам в процессе реакции восстанавливается.
2. Определение степени окисления элементов.
Степень окисления элементов в его соединениях определяется, исходя из положения, что общий суммарный заряд степеней окисления всех элементов данного соединения равен нулю. Например, в соединении Н3РО4 степени окисления у водорода +1, у фосфора +5, у кислорода -2; Составив математическое уравнение определим, что в сумме число частиц (атомов или ионов) составят заряд равный нулю: (+1)x3+(+5)+(-2)х4 = 0
Но в данном примере уже заданы степени окисления элементов. Каким же образом можно определить степень окисления cеры, например, в соединении тиосульфат натрия Na2S2O3, или марганца в соединении перманганат калия — КMnO4? Для этого необходимо знать постоянные степени окисления ряда элементов. Они имеют следующие значения:
1) Элементы I группы периодической системы (в том числе водород в соединении с неметаллами) +1;
2) Элементы II группы периодической системы +2;
3) Элементы III группы периодической системы +3;
4) Кислород (кроме в соединении со фтором или в перекисных соединениях) -2;
Исходя из этих постоянных значений степеней окисления (для натрия и кислорода) определим степень окисления серы в соединении Na2S2O3. Поскольку суммарный заряд всех степеней окисления элементов, состав которых отражает данная формула соединения, равен нулю, то обозначив неизвестный заряд у серы «2Х» (поскольку в формуле два атома серы), составим следующее математическое равенство:
(+1) х 2 + 2Х + (-2) х 3 = 0
Решая это уравнение относительно 2 х, получим
2Х= (-1) х 2 + (+2) х 3
или
Х = [(-2) + (+6)] : 2 = +2;
Следовательно, степень окисления серы в соединении Na2S2O3 равна (+2). Но неужели всегда будет необходимо пользоваться таким неудобным методом для определения степеней окисления тех или иных элементов в соединениях? Конечно же не всегда. К примеру, для бинарных соединений: оксидов, сульфидов, нитридов и т.д., можно пользоваться для определения степеней окисления так называемым методом «крест-на-крест». Допустим, дана формула соединения: оксид титана – Ti2O3. Используя простой математический анализ, исходя из того, что степень окисления кислорода нам известна и равна (-2): Ti2O3, нетрудно установить, что степень окисления у титана будет равна (+3). Или, к примеру, в соединении метан СН4 известно, что степень окисления водорода равна (+1), тогда не составляет труда определить степень окисления углерода. Она будет соответствовать в формуле этого соединения (-4). Так же, пользуясь методом «крест-на-крест», не сложно установить, что если дана следующая формула соединения Cr4Si3, то степень окисления хрома в неё равна (+3), а кремния (-4).
Для солей так же это не предоставляется затруднительным. Причём не имеет значения, дана или средняя соль или кислая соль. В данных случаях необходимо исходить из солеобразующей кислоты. К примеру, дана соль нитрат натрия (NaNO3). Известно, что она является производной азотной кислоты (НNO3), а в этом соединении степень окисления азота равна (+5), следовательно, и в её соли – нитрате натрия, степень окисления азота так же равна (+5). Гидрокарбонат натрия (NaHCO3) является кислой солью угольной кислоты (H2CO3). Так же, как и в кислоте, степень окисления углерода в этой соли будет равна (+4).
Следует отметить то обстоятельство, что степени окисления в соединениях: металлах и неметаллах (при составлении уравнения электронного баланса) равны нулю: К0, Са0, Аl0 , Н20, Cl20,N20В качестве примера приведём степени окисления наиболее типичных элементов:
Только окислителями являются вещества, имеющие максимальную, как правило положительную, степень окисления, например: КCl+7O4, H2S+6O4, K2Cr+6O4, HN+5O3, KMn+7O4. Это легко доказать. Если бы данные соединения могли быть восстановителями, то в данных состояниях они должны были бы отдавать электроны:
Cl+7– е = Cl+8
S+6 – е = S+7
Но элементы хлор и сера не могут существовать с такими степенями окисления. Аналогичным образом, только восстановителями являются вещества, имеющие минимальную, как правило, отрицательную степень окисления, например: H2S-2, HJ—, N-3H3. В процессе окислительно-восстановительных реакций такие соединения не могут быть окислителями, поскольку им пришлось бы присоединять электроны:
S-2 + е = S-3
J— + е = J-2
Но для серы и йода ионы с такими степенями окисления не характерны. Элементы с промежуточными степенями окисления, например N+1, N+4, S+4, Сl+3, С+2 могут проявлять как окислительные, так и восстановительные свойства.
3. Типы окислительно-восстановительных реакций.
Существует четыре типа окислительно-восстановительных реакций.
1) Межмолекулярные окислительно-восстановительные реакции.
Наиболее часто встречающийся тип реакций. При данных реакциях изменяются степени окисления элементов в разных молекулах, например:
2Bi+3Сl3 + 3Sn+2Cl2 = 2Bi0 + 3Sn+4Cl4
Bi+3 — 3е = Bi0
Sn+2 + 2е = Sn+4
2) Разновидностью межмолекулярных окислительно-восстановительных реакций является реакция конпропорционирования, в которой окислителем и восстановителем являются атомы одного и того же элемента: в данной реакции два атома одного элемента различными степенями окисления образуют один атом с иной степенью окисления:
SO2+4 + 2H2S-2 = 3S0 + 2Н2O
S-2 — 2е = S0
S+4 + 4е = S0
3) Реакции диспропорционирования осуществляются в случае, если окислителем и восстановителем являются атомы одного и того же элемента, или один атом элемента с одной степенью окисления образует соединение с двумя степенями окисления:
N+4O2 + NaOH = NaN+5O3+ NaN+3O2 + H2O
N+4 — е = N+5
N+4 + е = N+3
4) Внутримолекулярные окислительно-восстановительные реакции происходят в случаях, когда атом-окислитель и атом — восстановитель находятся в составе одного вещества, например:
N-3H4N+5O3 = N+12O + 2H2O
2N-3 — 8е =2N+1
2N+5 + 8е = 2N+1
4. Механизм окислительно-восстановительных реакций.
Окислительно-восстановительные реакции осуществляются за счет перехода электронов от атомов одного элемента к другому. Если атом или молекула теряет электроны, то такой процесс называется окислением, а данный атом является восстановителем, например:
Al0 — 3e = Al 3+
2Cl— — 2e = Cl20
Fe2+ — e = Fe3+
В данных примерах Al0, Cl—, Fe2+ являются восстановителями, а процессы их превращения в соединения Аl3+, Сl20, Fe3+ называются окислительными. Если атом или молекула приобретают электроны, то такой процесс называется восстановлением, а данный атом является окислителем, например:
Ca2++ 2e = Ca0
Cl20 + 2e = 2Cl—
Fe3+ + e = Fe2+
Окислителями, как правило, являются неметаллы (S, Cl2 ,F2, О2) или соединения металлов, имеющих максимальную степень окисления (Mn+7, Cr+6, Fe+3). Восстановителями являются металлы (К, Са, Аl) или соединения неметаллов, имеющих минимальную степень окисления (S-2, Сl-1 , N-3, P-3);
H2SO4 (конц.) + HJ → H2S + J2 + H2O
Прежде всего, установим, что степень окисления йода в йодистом водороде равна (-1), а серы в серной кислоте: (+6). В процессе реакции йод (-1) будет окисляться до молекулярного состояния, а сера (+6) восстанавливаться до степени окисления (-2) – сероводорода:
J—→ J02
S+6→ S-2
Чтобы составить уравнение электронного баланса необходимо учесть, что количество частиц атомов в левой и в правой частях полуреакций должно быть одинаковой
2J—→ J20
S+6 → S-2
Далее необходимо определить количество электронов, принявших участие в реакции:
2J— — 2e → J02
S+6 + 8e → S-2
Установив вертикальную черту, справа данной схемы полуреакции, определим коэффициенты реакции:
2J— — 2e → J02 |8
S+6 + 8e → S-2 |2
Сократив на «2», получим окончательные значения коэффициентов:
2J— — 2e → J02 |4
S+6 + 8e → S-2 |1
Подведем под данной схемой полуреакции горизонтальную черту и суммируем участвующее в реакции количество частиц атомов:
2J— — 2e → J02 |4
S+6 + 8e → S-2 |1
____________________
8J— + S+6 → 4 J02 + S-2
После этого необходимо расставить коэффициенты в уравнении реакции. Подставив полученные значения коэффициентов в молекулярное уравнение, приведем его к данному виду:
8HJ + H2SO4 = 4J2 + H2S + Н2O
Подсчитав количество атомов водорода в левой и правой частях уравнения, убедимся в необходимости коррекции коэффициента « 4 » перед водой, получим полное уравнение:
8HJ + H2SO4 = 4J2 + H2S + 4Н2O
Данное уравнение можно составить, используя метод электронно-ионного баланса. В этом случае отпадает необходимость в коррекции коэффициента перед молекулами воды. Уравнение составляется на основе диссоциации ионов соединений, участвующих в реакции: Например, диссоциация серной кислоты приводит к тому, что образуются два протона водорода и сульфат-анион:
H2SO4 ↔ 2H+ + SO42-
Аналогичным образом можно записать диссоциацию иодистого водорода и сероводорода:
HJ ↔ Н+ + J—
H2S ↔ 2Н+ + S2-
J2 не диссоциирует. Так же практически не диссоциирует Н2О. Составление уравнения методом полуреакции по йоду остается такой же:
2J— — 2e → J02
Полуреакция по атомам серы приобретет следующую форму:
SO4-2 → S-2
Поскольку в правой части полуреакции недостает четыре атома кислорода, то это количество необходимо сбалансировать за счет воды:
SO4-2 → S-2 + 4H2О
Тогда в левой части полуреакции необходимо компенсировать атомы водорода за счет протонов (т.к. реакция среды кислая):
SO42- + 8Н+ → S-2 + 4H2О
Подсчитав количество переходящих электронов, получим полную запись уравнения по методу полуреакций:
SO42- + 8Н+ + 8е → S-2 + 4H2О
Суммируя обе полуреакции, получим уравнение электронного баланса:
2J— — 2e → J02 |8 4
SO42- + 8Н+ + 8е → S-2 + 4H2О |2 1
_____________________________________
8J— + SO42- +8Н+ → 4J20 + S0 + 4H2O
Из данной записи следует, что метод электронно-ионного уравнения дает более полную картину окислительно-восстановительной реакции, чем метод электронного баланса.Количество электронов, участвующих в процессе, совпадает при обоих методах баланса, но в последнем случае как бы «автоматически» устанавливается количество протонов и молекул воды, участвующих в окислительно-восстановительном процессе.
Разберем несколько конкретных случаев окислительно-восстанови-тельных реакций, которые можно составить методом электронно-ионного баланса. Некоторые окислительно-восстановительные процессы осу-ществляются при участии щелочной среды, например:
KCrO2 + Br2 + KOH → KBr + K2CrO4 +H2O
В данной реакции восстановителем является хромит-ион (CrО2—), который окисляется до хромат-иона (CrO-24). Окислитель — бром (Br02) восстанавливается до бромид-иона (Br—):
СrO2— → CrO42-
Br02 → 2 Br—
Поскольку реакция происходит в щелочной среде, то первую полуреакцию необходимо составить с учетом гидроксид-ионов (OH—):
CrO2— + 4OH— — 3e = CrO2-4 + 2H2O
Вторую полуреакцию составляем уже известным способом:
CrO2— + 4OH— -3е = CrO42—+ 2H2O |2
Br02 + 2e = Br— |3
__________________________________________
2CrO2— + 3Br20 + 8OH— = 2CrO2-4 + 6Br— + 4H2O
После этого необходимо окончательно расставить коэффициенты в уравнении реакции и полностью молекулярное уравнение данного окислительно-восстановительного процесса примет вид:
2KCrO2 + 3Br2 + 8KOH = 2K2CrO4 + 6KBr + 4H2O.
В ряде случаев в окислительно-восстановительной реакции участвуют одновременно и недиссоциируемые вещества. Например:
AsH3 + HNO3 = H3AsO4 + NO2 + 4H2O
Тогда метод полуреакций составляется с учетом данного процесса:
AsH3 + 4H2O – 8e = AsO43- + 11H+ |1
NО3 + 2H+ + e = NO2 + H2O |8
________________________________________________
AsH3 + 8NО3 + 4H2O + 2H+ = AsO43- + 8NO2 + 11H+O
Молекулярное уравнение примет вид:
AsH3 + 8HNO3 = H3AsO4 + 8NO2 + 4H2O.
Окислительно-восстановительные реакции иногда сопровождаются одновременным процессом окисления-восстановления нескольких веществ. Например, в реакции с сульфидом меди взаимодействует концентрированная азотная кислота:
Cu2S + HNO3 = Cu(NO3)2 + H2SO4 + NO + H2O
D окислительно-восстановительном процессе участвуют атомы меди, серы и азота. При составлении уравнения методом полуреакций необходимо учитывать стадии данного процесса:
Cu+ → Cu2+
S2- → S+6
N5+ → N+2
В данной ситуации необходимо объединить в одну стадию окислительные и восстановительные процессы:
2Cu+ — 2e → 2Cu2+ |10e
S2- — 8e → S6+
_______________________
N5+ + 3e → N2+ |3e
При котором окислительно-восстановительная полуреакция примет вид:
2Cu+ — 2e → 2Cu2+
S2- — 8e → S6+ 3 (процессы восстановления)
_______________________
N5+ + 3e → N2+ 10 (процесс окисления)
_____________________________________
6Cu+ + 3S2- + 10N5+ → 6Cu2+ + 3S6+ + 10N2+
В итоге молекулярное уравнение реакции примет вид:
3Cu2S + 22HNO3 = 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O.
Особое внимание следует уделить окислительно-восстановительным реакциям с участием органических веществ. Например, при окислении глюкозы перманганатом калия в кислой среде происходит следующая реакция:
C6H12O6 +KMnO4 + H2SO4 > CO2 + MnSO4 + K2SO4 + H2O
При составлении баланса методом полуреакции превращения глюкозы учитывается отсутствие её диссоциации, но коррекцию количества атомов водорода осуществляется за счет протонов и молекул воды:
C6H12O6 + 6H2O — 24e = 6CO2 + 24H+
Полуреакция с участием перманганата калия примет вид:
MnO4—+ 8H+ + 5e = Mn2+ +4H2O
В итоге получим следующую схему окислительно-восствновительного процесса:
C6H12O6 + 6H2O — 24e = 6CO2 + 24H+ |5
MnО4— +8H+ + 5e = Mn+2 + 4H2O |24
___________________________________________________
5C6H12O6 + 30H2O + 24MnО4— + 192H+ = 30CO2 + 120H+ + 24Mn2+ + 96H2O
Сократив количества протонов и молекул воды в левой и правой части полуреакции, получим итоговое молекулярное уравнение:
5C6H12O6 + 24KMnO4 + 36H2SO4 = 30CO2 + 24MnSO4 + 12K2SO4 + 66H2O
5. Влияние среды на характер протекания окислительно-восстановительных реакций.
В зависимости от среды (избыток H+, нейтральной, избыток OH—) может изменяться характер протекания реакции между одними и теми же веществами. Для создания кислой среды обычно используется серная кислота (H2SO4), азотная кислота (HNO3), соляная кислота (HCl), в качестве среды OH— применяют гидроксид натрия (NaOH) или гидроксид калия (KOH). Например покажем, как среда влияет на переманганат калия (КMnO4). и продукты его реакции:
Для примера возьмём в качестве восстановителя Na2SO3, в качестве окислителя KMnO4
В кислой среде:
5Na2SO3 + 2KMnO4 + 3H2SO4 → 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
SO32- + H2O — 2e → SO42- + 2H+ |5
MnO4—+ 8H+ + 5e → Mn2+ + 4H2O |2
________________________________________________
5SO32- + 2MnO4— + 6H+ → 5SO42- + 2Mn2+ + 3H2O
В нейтральной (или слабощелочной):
3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
SO32- + H2O — 2e→ SO42- + 2H+ |3
MnO4— + 2H2O + 3e→ MnO2 + 4OН |2
_____________________________________
3SO32- + 2 MnO4— + H2O → 3SO42- + 2MnO2 + 2OН
В сильно щелочной среде:
Na2SO3 + 2KMnO4 + 2NaOH → Na2SO4 + K2MnO4 + Na2MnO + H2O
SO32- + 2 OН— — 2e → SO42- + H2O |1
MnO4— + e → MnO42 |2
____________________________________
SO32- + 2 MnO4— + 2OH → SO42- + 2MnO42- + H2O
Пероксид водорода (Н2О2) в зависимости от среды восстанавливается согласно схеме:
1) Кислая среда (H+) H2O2 + 2H+ + 2е → 2H2O
2) Нейтральная среда (Н2О) H2O2 + 2е → 2ОН
3) Щелочная среда (ОН—) H2O2 + 2е→ 2ОН
Пероксид водорода (Н2О2) выступает как окислитель:
2FeSO4 + H2O2 + H2SO4 → Fe2(SO4)3 + 2H2O
Fe2+ — е = Fe3+ |2
H2O2 + 2H+ + 2е = 2Н2О |1
________________________________
2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2 Н2О
Однако, встречаясь с очень сильными окислителями (KMnO4) Пероксид водорода (Н2О2) выступает как восстановитель:
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 8H2O
H2O2 – 2e → O2 + 2H+ |5
MnO4—+ 8H+ + 5e → Mn2+ + 4H2O |2
_________________________________
5H2O + 2 MnO4— + 6H+→ 5O2 + 2Mn2+ + 8H2O
6. Определение продуктов окислительно-восстановительных реакций.
В практической части данной темы рассматриваются окислительно-восстановительные процессы с указанием только исходных реагентов. Продукты реакций, как правило, необходимо определить. Например, в реакции участвуют хлорид железа (FeCl3) и иодид калия (KJ):
FeCl3 + KJ = A + B + C
требуется установить формулы соединений A, B, C, образующиеся в результате окислительно-восстановительного процесса.
Исходные степени окисления реагентов следующие: Fe3+, Cl—, K+, J—. Нетрудно предположить, что Fe3+, являясь окислителем (имеет максимальную степень окисления), может только снизить свою степень окисления до Fe2+:
Fe3+ + e = Fe2+
Хлорид-ион и ион калия в реакции не изменяют свою степень окисления, а иодид-ион может только повысить свою степень окисления, т.е. перейти в состояние J20:
2J— — 2e= J20
В результате реакции, помимо окислительно-восстановительного процесса, произойдет реакция обмена между FeCl3 и KJ, но с учетом изменения степеней окисления реакция определяется не по данной схеме:
FeCl3 + KJ = FeJ3 + KCl,
а примет вид
FeCl3 + KJ = FeJ2 + KCl,
где в качестве продукта C обозначается соединение J20:
FeCl3 + 6KJ = 2FeJ2 + 6KJ + J2
Fe3+ + e ═> Fe2+ |2
2J— — 2e ═> J20 |1
________________________________
2Fe+3 + 2J— = 2Fe2+ + J20
В дальнейшем, при определении продуктов окислительно-восстановительного процесса, можно применять так называемую «систему лифта». Принцип её заключается в том, что любую окислительно-восстановительную реакцию можно представить, как движение лифтов в многоэтажном строении в двух взаимно противоположных направлениях. Причём, «этажами» будут являться степени окисления соответствующих элементов. Поскольку любая из двух полуреакций в окислительно-восстановительном процессе сопровождается либо понижением, либо повышением степени окисления того или иного элемента, то простым рассуждением можно предположить о возможных их степенях окисления в образующихся продуктах реакции.
В качестве примера приведём реакцию, в которой сера реагирует с концентрированным раствором гидроксида натрия (NaOH):
S + NaOH(конц) = (А) + (В) + H2O
Поскольку в данной реакции изменения будут происходить только со степенями окисления серы, то для наглядности составим диаграмму её возможных состояний:
Соединениями (А) и (В) не могут быть одновременно состояния серы S+4 и S+6, поскольку в данном случае процесс происходил бы только с отдачей электронов, т.е. являлся бы восстановительным:
S0 — 4е=S+4
S0— 6е =S+6
Но это противоречило бы принципу окислительно-восстановительных процессов. Тогда следует полагать, что в одном случае процесс должен проходить с отдачей электронов, а в другом двигаться в противоположном направлении, т.е. быть окислительным:
S0 — 4е =S+4
S0+ 2е =S-2
С другой стороны, насколько вероятно, что процесс восстановления будет осуществляться до состояния S+4 или до S+6? Поскольку реакция протекает в щелочной, а не в кислой среде, то окислительная возможность её значительно ниже, поэтому образование соединения S+4 в этой реакции предпочтительнее, чем S+6. Следовательно, реакция в окончательном варианте примет вид:
4S + 6NaOH(конц) = Na2SO3 + 2Na2S + 3H2O
S0 +2e = S—2 | 4 | 2
S0 + 6OH— — 4e = SO32— + 3H2O | 2 | 1
3S0 + 6OH— = 2S—2 + SO32— + 3H2O
В качестве другого примера разберём следующую реакцию между фосфином и концентрированной азотной кислотой(HNO3):
PH3 + HNO3 = (А) + (В) + H2O
В данном случае имеем изменяющиеся степени окисления у фосфора и азота. Для наглядности приведём диаграммы состояния их степеней окисления.
Фосфор в состоянии степени окисления (-3) будет проявлять только восстановительные свойства, поэтому в реакции он будет повышать свою степень окисления. Азотная кислота сама по себе является сильным окислителем и создаёт кислую среду, поэтому фосфор от состояния (-3) достигнет своей максимальной степени окисления (+5).
В противоположность этому азот будет понижать свою степень окисления. В реакциях данного типа обычно до состояния (+4).
Далее нетрудно предположить, что фосфор в состоянии (+5), являясь продуктом (А), может быть только ортофосфорной кислотой H3PO4, поскольку среда реакции сильнокислая. Азот в таких случаях, обычно принимает степень окисления (+2) или (+4), чаще (+4). Поэтом продуктом (В) будет оксид азота NO2. Остаётся только решить это уравнение методом баланса:
P—3 – 8e = P+5 | 1
N+5 + e = N+4 | 8
P—3 + 8N+5 = P+5 + 8N+4
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Статья по химии для 11 класс на
тему «Определение продуктов в окислительно-восстановительных реакциях».
11
класс (подготовка к ЕГЭ)
учитель
химии МАОУ «Лицей 29» г. Тамбов
Дегтярева
Елена Эдуардовна.
Окислительно-восстановительными (ОВР)
называются реакции, в ходе которых происходит изменение степеней окисления
атомов, образующих вещества.
Для того, чтобы определить какое из
веществ является окислителем, а какое восстановителем необходимо определить
степени окисления атомов в данных веществах.
Соединения элементы, в которых проявляют
высокие положительные степени окисления, являются окислителями. Примеры
типичных окислителей приведены в таблице 1
Таблица
1
Типичные
окислители
|
Группа |
Химические |
Примеры |
|
Галогены |
Cl |
HClO4, |
|
Галогены |
Cl +1, Cl +3, Cl +5, Br+5, I+5 |
HClO, HClO3, HBrO43 |
|
Халькогены |
S+6, |
H2SO4, |
|
Неметаллы- |
F0, |
F2, |
|
Неметаллы |
O-1, |
H2O2, |
|
Металлы |
Mn+7, |
KMnO4, |
|
Металлы |
Fe+2, |
FeCl2, |
Соединения, с низшей отрицательной
степенью окисления проявляют только восстановительные свойства. Примеры
типичных окислителей приведены в таблице 2.
Таблица
2
Типичные
восстановители
|
Группа восстановителей |
Химические |
Примеры |
|
Металлы |
Na0, |
Na, Ca, Fe |
|
Неметаллы |
Cl -1, N -3, Sr-2 |
HCl, NH3, ZnS |
|
Металлы |
Fe+2, |
FeSO4, |
|
Неметаллы- |
F0, |
F2, |
|
Неметаллы |
O-1, |
H2O2, |
|
Неметаллы- |
S0, P0, |
KMnO4, |
|
неметаллы |
P+3, S+4, |
PCl3, |
Рассматривая типичные окислители и
восстановители, можно заметить, что многие вещества способны проявлять в
зависимости от условий как восстановительные, так и окислительные свойства,
т.е. обладают двойственностью окислительно-восстановительных свойств. Причин
такой двойственности несколько:
1) в состав вещества могут входить
элементы, один из которых проявляет свойства окислителя, а другой –
восстановителя. Например, хлороводород (и его водный раствор соляная кислота)
проявляют окислительные свойства при взаимодействии с металлами за счёт катиона
водорода Н+ и восстановительные – благодаря наличию атома галогена
в в минимальной степени окисления.
Сa0 +2H+1Cl
= Ca+2Cl2 +H20
2KMn+7O4 + 16HCl-1 =
2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O
2) вещество может содержать химический
элемент в промежуточной степени окисления. Этот элемент может выступить в
качестве восстановителя и повысить свою степень окисления, а может проявить и
окислительные свойства – понизить степень окисления.
Например: пероксид
водорода содержит кислород в промежуточной степени окисления, поэтому в
реакциях может выступать в роли окислителя, и в роли восстановителя, а так же
участвовать в реакции диспропорционирования. Пероксид
водорода восстанавливается в зависимости от среды:
H2+1O2-1
– и окислитель, и восстановитель:
H2O2
+ 2e–
→ 2OH–
(H2O2
– окислитель в нейтральной среде)
H2O2
+ 2e–
+ 2H+
→ 2H2O
(H2O2
– окислитель в кислой среде)
H2O2
– 2e–
→ O2↑
+ 2H+
(H2O2
– восстановитель)
2KI + H2O2 = I2 + 2KOH – нейтральная среда
восстановитель
окислитель
2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O – кислая
среда
восстановитель окислитель среда
5H2O2 + 2KMnO4 + 3H2SO4 = 5O2↑
+ 2MnSO4
+ K2SO4 + 8H2O
восстановитель
окислитель среда
2H2O2→2
H2O
+ O2↑
— реакция диспропорционирования.
В окислительно-восстановительных реакциях, сложным является,
определить продукт на выходе. Чтобы определить продукты
реакции в ОВР необходимо знать, до какой степени окисления восстанавливается
или окисляется данное соединение.
1). Кислородсодержащие
соединения галогенов при восстановлении переходят в соответствующие галогениды:
NaClO3
+ восст. → NaCl
KClO
+ восст. → KCl.
Исключение – если в роли восстановителя
выступает соответствующий галогенид-анион, то в ходе реакции выделяется
свободный галоген:
KBr+5O3
+ 5KBr-1 + 3H2SO4 → Br20
+ 3K2SO4 +3H2O
окислит.
восст. среда
2). Свободные галогены являются сильными
окислителями и в ходе ОВР, как правило, переходят в соответствующие
галогенид-анионы:
2Na3[Cr(OH)6]
+ 3Cl2 + 4NaOH → 2Na2CrO4 + 6NaCl +
8H2O
3)
KMnO4
– окислитель, – в зависимости от реакции среды при восстановлении переходит в
различные формы:
|
|
||||
|
|
||||
 |
||||
|
|
||||
Если в ходе ОВР катион остается один, его
соединяют с анионом среды.
Если в ходе ОВР анион остается один, его
соединяют с катионом среды.
2KMnO4 + 5Na2SO3 +
3H2SO4 → K2SO4 + 5Na2SO4 +2MnSO4+ 3H2O
2KMnO4 + 3Na2SO3 +
H2O → 3Na2SO4 + 2MnO2 +
3KOH
2KMnO4 + Na2SO3
+2NaOH → Na2SO4 + K2MnO4+ Na2MnO4+
H2O
4). Соединения серы.
Как сам сероводород, так и сульфиды
проявляют свойства восстановителей, переходя в зависимости от условий, в
соединения S0,
S+4,
S+6
H2S-2
(и его соли) – 8e–
+ окислит. → H2S+6O4
[окислители:
H2O2,
HNO3(конц.)
при t°,
Cl2
в растворе, O3
в растворе];
H2S + 4Cl2
+ 4H2O = H2SO4 +8 HCl
CuS + 8HNO3(конц.гор.)
=
СuSO4
+ 8NO2↑
+4 H2O
H2S-2
(и его соли) – 2e–
+ окислит. → S0↓
[окислители:
KMnO4,
K2Cr2O7,
HNO3(разб.),
H2SO4(конц.)
холодная и т.д.];
5H2S + 2KMnO4 + 3H2SO4
= 5S↓ +2MnSO4+
K2SO4+8H2O
H2S + H2SO4(конц.хол.) = S↓ + SO2↑ + 2H2O
H2S-2
(и его соли) – 6e–
+ окислит. → S+4O2↑
[окислитель:
H2SO4(конц.)
при t°];
H2S + 3H2SO4(конц.кип.) = 4SO2↑+
4H2O
SO2
– и окислитель, и восстановитель:
SO2 + окислитель
→ SO42–
SO2 + I2
+ 2H2O = H2SO4 +2HI
SO2
+ H2O2=
H2SO4
SO2
+ восстановитель → S0↓
(в реакции с H2S)
SO2
+2H2S = 3S↓ +2H2O
SO2 + C = S↓
+CO2
H2SO4(конц.)
– окислитель за счет серы в степени окисления +6
Чем левее в ряду
активности стоит металл, тем более вероятно образование H2S.
Чем правее стоит
металл, тем более вероятно образование SO2.
Концентрированная серная кислота не
окисляет фторид- и хлорид-ионы, окисляет только Br—
и I—:
1. KF(тв)
+ H2SO4(конц)
=HF
+ K2SO4
(фтор не окисляется концентрированной H2SO4)
2. KСl(тв)
+ H2SO4(конц)
=HCl +
K2SO4(хлор
не окисляется концентрированной H2SO4)
3. 2KBr
+ 2H2SO4(конц)
=Br2
+ SO2
+ K2SO4
+ 2H2O
(S+6
принимает 2 электрона)
4. 8KI
+ 5H2SO4(конц)
=4I2
+ H2S
+ 4K2SO4
+ 4H2O(S+6
принимает 8 электрона)
5). Соединения хрома.
Восстановители: Cr0,
Cr+2,
Cr+3;
окислители: K2Cr2+6O7
(устойчив в кислой среде); K2Cr+6O4
(устойчив в щелочной среде).
|
Среда |
Cr3+ |
Cr+6 |
|
|
|
CrCl3, зелёный |
K2Cr2O7, оранжевый |
|
|
|
Na3[Cr(OH)6] зелёный |
K2CrO4 жёлтый |
1. K2Cr2O7 + 3H2S
+ 4H2SO4 = 3S↓ +Cr2(SO4)3+
K2SO4+7H2O
2. 2CrCl3
+ 3Cl2 + 16NaOH → 2Na2CrO4 + 12NaCl + 8H2O
6). Соединения азота.
NH3
— восстановитель
N-3H3
+ окислитель N20
В большинстве реакций окисления азот ( N-3),
входящий в состав аммиака, выделяется в виде простого вещества N2.
а)
Горение аммиака:
4NH3 +3О2
= 2N2+6H2O
б) Взаимодействие с
оксидами малоактивных металлов и другими окислителями:
1. 3СuO + 2NH3 = 3Сu + N2↑+ 3H2O
2. 3H2O2 + 2NH3 = N2↑+ 6H2O
3. 2KMnO4 + 2NH4OH = 2MnO2↓ + N2↑ +2 KOH + 4H2O
в) Исключение: при каталитическом
окислении выделяется NO
4NH3 +5О2 = 2NO+6H2O
NO2 – окислитель.
Оба варианта верны. Продукты реакции
определяются количеством восстановителя (в избытке восстановителя – N2,
в недостатке — NO)
1. 2NO2 + 4Сu
= N2 + 4СuO
2. 2NO2
+ SO2
= NO
+ SO3
NO2
подвергается диспропорционированию в холодной воде:
3. 2NO2
+ 2H2O
→HNO2
+ HNO3
Или
возможно
4. 3NO2
+ H2O
= 2HNO3
+ NO
При
взаимодействии с растворами щелочей образуется смесь двух солей, нитрата и
нитрита:
5. 2NO2 + 2 NaOH = NaNO2 + NaNO3+H2O
HNO2
(и ее соли) – и окислитель, и восстановитель:
HN+3O2
(или KNO2)
+ окислитель → HN+5O3
(или KNO3);
HN+3O2
(или KNO2)
+ восстановитель → N+2O
(иногда N20);
1. HN+3O2
+ Сl2 +H2O = HN+5O3
+ 2HCl
2. 2KNO2 + 6FeCl2
+ 4H2SO4 = N2↑ +4FeCl3 +
Fe2(SO4)3 +K2SO4 +4 H2O
*** KNO2
+ H0
→ NH3
(атомарный водород H0
образуется при взаимодействии с Al или Zn в щелочной среде).
3. 3KNO2
+ 6Al + 3KOH + 15H2O→6K[Al(OH)4] +3NH3↑
HNO3 – окислитель.
Продукты восстановления HNO3
зависят от 2-х факторов: силы восстановителя и концентрации кислоты. Чем
сильнее восстановитель и чем более разбавлена кислота, тем более низкую степень
окисления имеет азот (N) в продуктах
восстановления HNO3:
|
восстановитель концентрация HNO3 |
щелочные |
тяжелые |
|
разбавленная кислота |
N–3H4NO3 |
N+2O |
|
концентрированная кислота |
N2+1O |
N+4O2 |
1. Zn0 + 4HN+5O3(конц.)
= Zn+2 (NO3)2 + 2N+4O2↑
+2H2O
2. Zn0 + 4HN+5O3(конц.)
= Zn+2 (NO3)2 + 2N+4O2↑
+2H2O
HNO3
не взаимодействует с Au, Pt,
Ir,
Os.
HNO3(конц.)
взаимодействует с Al, Cr,
Fe ТОЛЬКО при t°
[см. H2SO4(конц.)]
Нитраты выступают в роли окислителей в
реакциях с цинком или алюминием в щелочной среде; при этом азот (+5)
восстанавливается до аммиака (см. выше ***)
3KNO3
+8Al + 5KOH + 18H2O→8K[Al(OH)4] +3NH3↑
7)
Железо и его соединения железа.
Fe0
и Fe+2
– восстановитель.
а) С разбавленными H2SO4
и HCl:
Fe0+ 2H+Сl
→Fe+2Cl2 + H2↑
б) Fe0+
соль→Fe+2
+ катион из соли:
Fe0+
CuSO4
→FeSO4
+ Cu
в) Fe2+
+ окислитель → Fe+3;
Fe+6.
2FeSO4 + 2KMnO4 +6 NaOH = 2Fe(OH)3↓
+ Na2MnO4 + 2Na2SO4
3FeSO4 + 2KClO3 +12KOH =3K2FeO4
+ 2KCl + 3K2SO4 + 6H2O
г) Fe3+
+ восстановитель → Fe2+;
восстановители – металлы, более активные,
чем Fe,
а также I–,
S2–
и т.д.
Металлы, более активные, чем Fe,
могут восстанавливать железо до степени окисления либо 0, либо +2:
1. 2FeCl3
+ 3Mg
(избыток) → 2Fe0
+ 3MgCl2;
2. 2FeCl3
+ 3Mg
(недостаток) → 2FeCl2
+ MgCl2;
3. 2FeCl3
+ 2HI
= 2FeCl2
+ I2
+ 2HCl
Менее активные металлы:
4. 2FeCl3
+ Сu
→ 2FeCl2
+ CuCl2
Алгорит решения задания №30
Пример задания №30: Для выполнения задания
используйте следующий перечень веществ: гипохлорит калия, аммиак, гидроксид
калия, хлорид алюминия, хлорид калия. Допустимо использование водных растворов.
Из предложенного перечня веществ выберите вещества между которыми возможна ОВР.
В ответе запишите уравнение только одной из возможных ОВР реакций.
Алгоритм решения задания №30
• запишем химические формулы веществ по
его названию;
КСlO,
NH3,
KOH,
AlCl3,KCl
• определим степени окисления элементов в
веществе.
К+1Сl+1O-2,
N-3H+13, K+1OH—, A+3lCl—3,
K+Cl—
• выберим вещества между которыми возможна
ОВР
КСl+1O
(является окислителем) и N-3H3(является
восстановителем, т.к. атом азота имеет низшую степень окисления)
• запишем ОВР реакцию (продукты ОВР см.
выше).
КСl+1O
+ N-3H3
= N20
+ КСl—
+ H2O
• составляем ОВР баланс
Сl+1
+2е = Сl-1
3 окислитель
2N-3—
6е = N20
1 восстановитель
• расставляем коэффициенты
3КСlO
+ 3NH3
= N2
+ 3КСl +
3H2O
Используемая литература:
1. О.С. Габриелян Химия. Материалы для
подготовки к единому государственному экзамену вступительным экзаменам в вузы /
О.С. Габриелян, И.Г. Остроумов. – М. Дрофа, 2008. – С. 412- 414.
2. В.Н. Доронькин Химия. Большой
справочник для подготовки к ЕГЭ: учебно-методическое пособие / В.Н. Доронькин,
А.Г. Бережная, Т.В. Сажнева, В.А. Февралева. – Ростов н/Д Легион, 2015.
Приведены основные окислители и восстановители и продукты их
реакции. Рассмотрены вещества, которые обладают двойственностью окислительно-восстановительных
свойств в зависимости от условий.
Окислительно-восстановительные свойства соединений галогенов,
свободных галогенов, соединений марганца, хрома, азота, серы, железа.
Рассмотрено влияние среды, концентрации и катализатора
на продукты в окислительно-восстановительных реакциях. Приведены примеры ОВР.
Описан алгоритм решения задания № 30 (ЕГЭ).






















