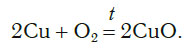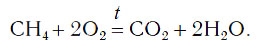В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
В
реакциях соединения, в отличие от реакций разложения, происходит
образование одного сложного вещества из одного или нескольких исходных.
Рассмотрим
эти реакции с помощью цепочек переходов. Запишем схему перехода: S
→ SO2
→ H2SO3.
Сера превращается в оксид серы (IV),
который затем превращается в сернистую кислоту. Число стрелок в цепочке
превращений показывает число химических реакций.
Первый
процесс – это превращение серы в оксид серы (IV).
Для этого запишем реакцию соединения серы с кислородом: S
+ O2
→ SO2.
Если в ложечке сжечь серу, то она горит синим пламенем с образованием
сернистого газа, об этом можно судить по появлению запаха жженой серы. Если в
колбу с образовавшимся сернистым газом добавить воды, то дым исчезает. К этому
раствору можно добавить лакмуса, и он окрасится в красный цвет, что является
доказательством образования сернистой кислоты: SO2
+ H2O
→ H2SO3.
Все
рассмотренные реакции протекали без участия катализатора, поэтому их
называют некаталитическими. Кроме того, все эти реакции протекают в
одном направлении, т.е. они являются необратимыми.
В
первой реакции из двух простых веществ образовалось одно сложное, во второй
реакции – из двух сложных веществ – одно сложное. Одно сложное вещество может
образоваться и при взаимодействии одного сложного и одного простого, как в
реакции образования оксида серы (VI)
и оксида серы (IV): 2SO2
+ O2
↔ 2SO3.
Эта реакция является обратимой, т.е. протекает как в прямом
направлении с образованием продукта реакции и в обратном направлении, когда
из конечного продукта образуются исходные вещества. Условно обратимые
реакции обозначают с помощью знака обратимости.
Поэтому
реакции, протекающие одновременно в двух противоположных направлениях, называют
обратимыми.
В
реакции образования оксида серы (VI)
участвует катализатор V2O5,
который указывают над знаком обратимости, поэтому эта реакция является
каталитической.
Поэтому,
если реакции протекают с участием катализатора, то они называются каталитическими,
если реакции протекают без участия катализатора, то такие реакции называются некаталитическими,
если реакции протекают с участием биологических катализаторов – ферментов, то
такие реакции называются ферментативными.
В
реакциях соединения сложное вещество может образоваться не только из двух
веществ, но и из трех, как в реакции получения азотной кислоты:
NO2
+ O2
+ H2O
→ HNO3.
Расставим
коэффициенты в этом уравнении. Атомов азота одинаковое число в левой и правой
части уравнения, поэтому азот не нужно уравнивать. Атомов водорода до реакции
2, а после реакции один атом, поэтому перед формулой азотной кислоты ставим
коэффициент 2. Теперь необходимо и перед формулой оксида азота (IV)
поставить коэффициент 2. Считаем число атомов кислорода: до реакции 5 атомов,
после реакции – 6 атомов. Следовательно, нужно удвоить все коэффициенты. Перед
оксидом азота (IV) ставим коэффициент 4,
перед формулой воды – 2, перед формулой азотной кислоты – 4. Теперь осталось
поставить коэффициент перед формулой кислорода. Для этого подсчитаем число
атомов кислорода в правой части уравнения, их 12. В левой тоже, следовательно,
вместо стрелки можно поставить знак равенства.
4NO2
+ O2
+ 2H2O
→ 4HNO3.
Гимельфарб
К. Ю.
Учитель
химии, биологии, экологии
ГБОУ
СОШ №402
ХИМИЧЕСКИЕ
РЕАКЦИИ
(алгоритм
составления)
8
КЛАСС
Цель урока. Повторить
классификацию веществ повторитьтипы химических реакций и признаки их
классификации; научить учащихся применять полученные знания о типах химических
реакций на практике – составлять уравнения химических реакций, определять типы
химических реакций.
Задачи. Образовательные:
систематизировать знания учащихся о классификации веществ, типах химических
реакций; продолжить формирование умений наблюдать, записывать уравнения и
предвидеть продукты химических реакций; сформировать умения при написании
реакций обмена, применения условий течения реакций между растворами до конца;
подготовить учащихся к пониманию обратимых и необратимых реакций, теории
электролитической диссоциации.
Развивающие: совершенствовать
умения учащихся при составлении химических уравнений, при выполнении
лабораторных опытов; совершенствовать умения учащихся сравнивать и обобщать;
развивать память, устойчивое внимание, самостоятельное мышление, умение слушать
и слышать другого человека; развивать аналитическое мышление.
Воспитательные:продолжить
формирование диалектико-материалистического мышления учащихся.
Форма учебного процесса: классный
урок.
Тип урока:урок получения
новых знаний.
Вид урока: урок
игра-путешествие
Структура
урока:
|
Орг. момент |
1 мин. |
|
Актуализация |
2мин. |
|
Целепологание |
1 мин. |
|
Изучение |
25мин. |
|
рефлексия |
10 мин |
|
Домашнее задание |
1 мин. |
Оборудование:
—
Доска;
—
проектор;
—
компьютер;
-раздаточный
материал;
Способ
предоставления информации: Текстовой, структурно-логический,
информационно-технологический.
Метод обучения: частично-поисковый
Технология:
Личностно-ориентированная, игровая.
Ход
урока.
|
Этап. |
Деятельность |
Деятельность |
|
Приветствие. Настраивает |
Готовятся к уроку. |
|
Фронтальный опрос: Чем отличаются физические явления от химических? Чем отличается простое вещество от сложного? КАКИЕ ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ Вы |
Отвечают на вопрос:Физические Химические явления –это… Простые вещества–состоят из Сложные вещества состоят— из 2-х и более Реакция замещения –это реакция А+ ВС= АС+В – реакция замещения Реакция обмена–это АВ + СD= АD+ СВ Реакция более вещест получается одно. Реакция разложения –это этореакция АВ=В+С -Реакция разложения |
|
Что такое валентность и как она обозначается? Помните на Теоретически мы ВСТАЕТ «Многоуважаемые коллеги-химики Недавно я познакомился с типами Р. S. Вместе с письмом высылаю Давайте проведем практический КТО МНЕ НАПОМНИТ ПРАВИЛА ТЕХНИКИ Пробирка № 1. H2SO4 + Zn —>ЗАПИШИТЕ Пробирка № 2. H2SO4 +CaCO3—>ЗАПИШИТЕ Пробирка № 3. NaCl +H2O—>ЗАПИШИТЕ На доске H2SO4 + Zn —>ZnSO4+ H2 H2SO4 +CaCO3—>CaSO4 + H2CO3 (H2O+CO2) NaCl +H2O—>NaOH + HCl Напоминается |
Записывают тему:ХИМИЧЕСКИЕ Отвечают на вопрос: Отличие физических явлений от химических. Строение Валентность –этоспособность атомов Отвечают «ДА» Вспоминают текст письма Учащиеся рассказывают технику Выполняют эксперимент в месте с Определяют тип химической реакции Отвечают на |
|
Сегодня на уроке Сразу возникает На доске записывается исходные Al + O2 = С помощь. Схем на ваших столах попробуйте ПОДСКАЗКА: КОЛЛИЧЕСТВО АТОМОВ При составлении химических уравнений следует ВСПОМНИТЕ ВАЛЛЕНТНОСТЬ, ДЛЯ ПРАВИЛЬНОСТИ ФОРМУЛЫ. Давайте проверим наши результаты. Задаются вопросы: 1. 2. 3. Давайте ответим |
Записывают проблемный вопрос. Приступают Ca 4Al + 3O2 =2Al2O3 (так как валентность 3.Алгоритм 1. 2. Индекс-это ……. 3.Алгоритм Подсчитать Определить, Разделить Поставить Пересчитать Начинать Записывают в тетради алгоритм составления химических |
|
Вопрос: С какими проблемами на уроке мы столкнулись и Давайте закрепим В реакции Ca + Cl2→ CaCl2 коэффициенты не В реакции Zn + HCl → ZnCl2 + H2 коэффициент у В реакции Ca + O2 → CaO коэффициент у оксида В реакции CH4 → C + H2 коэффициенты не нужны. В реакции CuO + H2 → Cu + H2O коэффициент у В реакции C + O2 → CO коэффициент 2 надо В реакции CuCl2 + Fe → Cu + FeCl2 коэффициенты |
Отвечают на поставленные вопросы: Выполняют задание,а послеидет самопроверка В реакции Ca + Cl2→ CaCl2 коэффициенты не нужны. В реакции Zn + HCl → ZnCl2 + H2 коэффициент у цинка В реакции Ca + O2 → CaO коэффициент у оксида кальция В реакции CH4 → C + H2 коэффициенты не нужны. (Нет) В реакции CuO + H2 → Cu + H2O коэффициент у меди 2. В реакции C + O2 → CO коэффициент 2 надо поставить и В реакции CuCl2 + Fe → Cu + FeCl2 коэффициенты не |
|
Составьте уравнения Ag + O = Mg + O= Y P + O= IY S + O= II S + O = Al + O = YII Mn + O =ЕСЛИ НЕ УСПЕЛИ СДЕЛАТЬ В КЛАССЕ: В реакции Ca + Cl2→ CaCl2 коэффициенты не В реакции Zn + HCl → ZnCl2 + H2 коэффициент у В реакции Ca + O2 → CaO коэффициент у оксида В реакции CH4 → C + H2 коэффициенты не нужны. В реакции CuO + H2 → Cu + H2O коэффициент у В реакции C + O2 → CO коэффициент 2 надо В реакции CuCl2 + Fe → Cu + FeCl2 коэффициенты |
Записывают в тетрадь. |
Алгоритм расстановки коэффициентов в
уравнении химической реакции.
1.
Подсчитать
количество атомов каждого элемента в правой и левой части.
2.
Определить,
у какого элемента количество атомов меняется, найти Н.О.К.
3.
Разделить
Н.О.К. на индексы – получить коэффициенты. Поставить коэффициенты перед
формулами.
4.
Пересчитать
количество атомов, при необходимости действия повторить.
5.
Начинать
лучше с атомов О или любого другого неметалла (если только О не находится в
составе нескольких веществ).
Алгоритм
расстановки коэффициентов в уравнении химической реакции.
1.
Подсчитать
количество атомов каждого элемента в правой и левой части.
2.
Определить,
у какого элемента количество атомов меняется, найти Н.О.К.
3.
Разделить
Н.О.К. на индексы – получить коэффициенты. Поставить коэффициенты перед
формулами.
4.
Пересчитать
количество атомов, при необходимости действия повторить.
5.
Начинать
лучше с атомов О или любого другого неметалла (если только О не находится в
составе нескольких веществ).
Алгоритм
расстановки коэффициентов в уравнении химической реакции.
1.
Подсчитать
количество атомов каждого элемента в правой и левой части.
2.
Определить,
у какого элемента количество атомов меняется, найти Н.О.К.
3.
Разделить
Н.О.К. на индексы – получить коэффициенты. Поставить коэффициенты перед
формулами.
4.
Пересчитать
количество атомов, при необходимости действия повторить.
5.
Начинать
лучше с атомов О или любого другого неметалла (если только О не находится в
составе нескольких веществ).
Алгоритм
расстановки коэффициентов в уравнении химической реакции.
1.
Подсчитать
количество атомов каждого элемента в правой и левой части.
2.
Определить,
у какого элемента количество атомов меняется, найти Н.О.К.
3.
Разделить
Н.О.К. на индексы – получить коэффициенты. Поставить коэффициенты перед формулами.
4.
Пересчитать
количество атомов, при необходимости действия повторить.
5.
Начинать
лучше с атомов О или любого другого неметалла (если только О не находится в
составе нескольких веществ).
Алгоритм
расстановки коэффициентов в уравнении химической реакции.
1.
Подсчитать
количество атомов каждого элемента в правой и левой части.
2.
Определить,
у какого элемента количество атомов меняется, найти Н.О.К.
3.
Разделить
Н.О.К. на индексы – получить коэффициенты. Поставить коэффициенты перед
формулами.
4.
Пересчитать
количество атомов, при необходимости действия повторить.
5.
Начинать
лучше с атомов О или любого другого неметалла (если только О не находится в
составе нескольких веществ).
Д,Р.
Составьте уравнения
реакции и расставьте коэффициенты:
Ag + O =
Mg + O=
Y
P + O=
IY
S + O=
II
S + O =
Al + O =
YII
Mn + O =
В реакции Ca + Cl2→ CaCl2 коэффициенты не нужны.
В реакции Zn + HCl → ZnCl2 + H2 коэффициент у
цинка 2.
В реакции Ca + O2 → CaO коэффициент у оксида
кальция 2.
В реакции CH4 → C + H2 коэффициенты не нужны.
В реакции CuO + H2 → Cu + H2O коэффициент у меди
2.
В реакции C + O2 → CO коэффициент 2 надо
поставить и у оксида углерода (II) , и у углерода.
В реакции CuCl2 + Fe → Cu + FeCl2 коэффициенты
не нужны.
 |
 |
 |
||||||||||||||||||||||||||||||||||||||
 |
 |
|||||||||||||||||||||||||||||||||||||||
 |
 |
|||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||
 |
 |
 |
 |
|||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||
 |
 |
|||||||||||||||||||||||||||||||||||||||
 |
 |
|||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||
 |
 |
|||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||
Технологическая карта урока
по теме «Типы химических реакций.
Реакции соединения».
Разработала: Барабанова Н.Д.
учитель химии
Технологическая карта урока
Предмет: химия
Класс: 8 класс
Автор учебника: Габриелян О. С.
Тема урока: «Типы химических реакций. Реакции соединения».
Тип урока: урок изучения и первичного закрепления нового материала.
Дидактическая цель: создание условий для усвоения учащимися знаний о реакциях соединения.
Задачи урока:
- Способствовать усвоению понятий «реакции соединения», научить учащихся писать уравнения реакций соединения, отличать реакции соединения среди других типов химических реакций (предметный результат).
- Продолжить развивать внимательность, наблюдательность, пытливость, инициативу, выявлять причинно-следственные связи, искать аналогии и работать в команде (метапредметный результат).
- Формировать умения управлять своей учебной деятельностью (личностный результат).
Методы обучения: проблемный, эвристический, экспериментальный.
Формы организации познавательной деятельности обучающихся: индивидуальная, парная,
Средства обучения: учебник, хим.реактивы: оксид кальция, вода, индикатор-фенолфталеин; химическая посуда- химические станы, стеклянные палочки, компьютер, презентация, видеоролик
|
Деятельность учителя |
Деятельность учащихся |
УУД |
Средства |
|
Этап 1. Организационный |
|||
|
— Добрый день, ребята! Мы как всегда рады видеть друг друга и готовы к совместной творческой работе. Психологический настрой. Организация познавательной деятельности 1) В чем отличие физического явления от химического? 2) По каким признакам можно определить, что произошла химическая реакция? 3) Какому закону, связанному с массой веществ, подчиняются все химические реакции? |
Приветствуют учителя, настраиваются на урок. Учащиеся отвечают на поставленные вопросы т.1 |
Личностные (смыслообразование) Регулятивные (оценка, саморегуляция) Познавательные анализ явлений с целью выделения признаков |
Слайд №1 |
|
Этап 2. Актуализация субъектного опыта |
|||
|
Предлагает выполнение упражнений по теме «Химические уравнения». |
Выполняют задание у доски и в раб тетради H2 + O2 → H2O Al(OH)3 →Al2O3 + H2O цинк + соляная кислота → хлорид цинка +водород Карбонат кальция = оксид кальция + оксид углерода (4) |
Личностные (самоопределение) Регулятивные (оценка, саморегуляция) Коммуникативные (взаимоконтроль по ходу выполнения задний) |
. |
|
Создание проблемной ситуации. Из уравнений химических реакций выделить ту, которая является «антонимом» реакции разложения |
Учащиеся выделяют из предложенных УХР реакцию соединения . |
Познавательные (анализ химических реакций с целью выявления отличий) |
|
|
Этап 3. Этап изучения новых знаний и способов деятельности |
|||
|
С — Учитель подводит учащихся к определению темы урока, — просит учащихся сформулировать задачи урока. Предлогает, используя прием противопоставления , дать определение понятия «Реакция соединения». Создание проблемной ситуации: Что необходимо прибавить к кальцию, чтобы получить его оксид? Как из оксида получить гидроксид7 Как доказать, что получили основание(щелочь)? Лабораторный опыт. Проводит краткий инструктаж по технике безопасности. |
Пример на шарико-стержневых моделях, моделирование на учениках класса Составляют цепь превращения: Ca CaO Ca(ОH)2 Взаимодействие оксида кальция с водой, действие индикатора на раствор щелочи наблюдение изменение окраски Записывают уравнения химических реакций. |
Познавательные (постановка и решение проблемы, логические универсальные действия, наблюдение, проведение эксперимента) Коммуникативные (сотрудничество в поиске и сборе информации) Регулятивные ( формирование умения слушать собеседника, проявлять познавательную инициативу в учебном сотрудничестве) |
шарико-стержневые модели Реактивы и оборудование к лабораторному опыту: оксид кальция, вода, индикатор-фенолфталеин, химическая посуда |
|
Этап 4.Первичная проверка понимания изученного материала |
|||
|
Предлагает творческая задачу, организует самопроверку |
Выполняют задания, составляют в тетрадях ухр, определяют тип реакции, . 4Al + 3O2 = 2Al2O3 2Mg + O2 = 2MgO Осуществляют самопроверку , сравнивая с эталоном |
Познавательные- анализ явлений, описанных в тексте явлений. Составление ухр на основе проведенного анализа |
Слайд 11 |
|
Этап 5. Закрепление изученного материала |
|||
|
Учитель предлагает выполнить тестовое задание №, стр Организует коллективную проверку выполненного задания |
Выполняют задания с целью самооценки, обсуждают результаты |
Познавательные ( анализ объектов с целью выделения признаков) Регулятивные ( контроль и коррекция) |
Ким, тест№12, вариант2, задания№1,3, В1В2 |
|
Этап 6. Информация о домашнем задании |
|||
|
Предлагает разноуровневые домашние задания по выбору, 1 уровень: § 30 упр.1 на с. 159 2 уровень |
Ученики выбирают задания по уровням |
Личностные (самоопределение) Регулятивные (оценка, саморегуляция) |
учебник |
|
Этап 7 Подведение итогов учебного занятия Рефлексия |
|||
|
Подводит итоги, предлагает уч высказать свое мнение о раскрытии темы урока и достижение его цели. Выставляет оценки. |
Делают вывод о необходимости умения наблюдать, проводить эксперимент, изучать вещества и происходящие с ними явления. |
Регулятивные (оценка, саморегуляция) |
|
|
Учитель инициирует рефлексию (Приложение 3. Анкета для учеников. Учитель благодарит за урок. |
Для самооценки работы учащиеся заполняют карточку № |
Регулятивные (оценка,) После таблицы |
Приложение 3. |
Слайд № 1.
Задание: Среди данных явлений определите, какие явления относятся к физическим, а какие к химическим.
1) При нагревании вода превращается в пар.
2) При сильном измельчении кусочек мела превращается в белый порошок.
3) Плавление металла.
4) Многие металлы в чистом виде хорошо отражают свет и блестят.
5) Горение природного газа.
6) После прокаливания медной проволоки на ней появился черный налет.
7) Перегонка нефти.

Приложение 1.
Анкета для учеников.
- Твое отношение к сегодняшнему уроку (выбери вариант ответа):
А) отличный, интересный, захватывающий;
Б) Хороший, содержательный, заставляющий работать;
В) нормальный, обычный;
Г) Скучный, работал без интереса;
Д) Бесполезный, совсем не интересный;
Е) твой вариант ответа ———————————————————————————.
- Вспомни тему урока ——————————————————————————————.
- Какая цель стояла перед тобой на уроке? —————————————————————————————————————————————————————————————-.
- Какие события, факты, явления, формулы, правила ты усвоил на уроке?———————————————————————————————————————————————————————————————————————————————————————.
- Чему новому ты научился на уроке? ————————————————————————————————————————————————————————————————.
- Какую оценку за работу на уроке ты бы поставил себе? —————————————
- Какую оценку за работу на уроке ты бы поставил учителю? ———————————
Типы реакций
Определение: Определение:
Примеры: Примеры:
Урок 12. Составление уравнений химических реакций
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
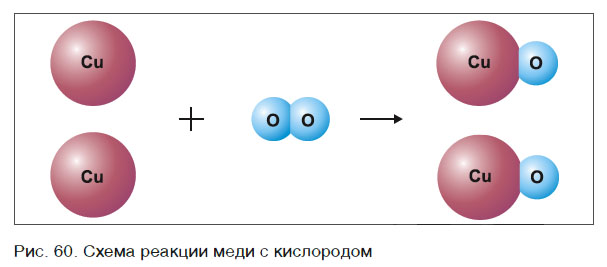
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
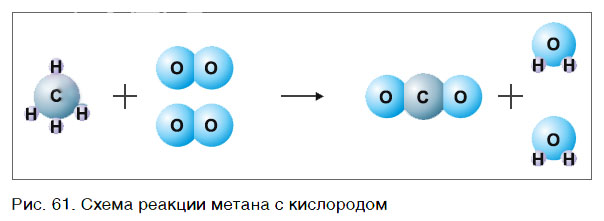
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Как написать уравнение реакций 8 класс
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Составление уравнений химических реакций
Урок посвящен изучению алгоритма составления уравнения химической реакции. В ходе урока вы научитесь составлять схему и уравнение химической реакции, зная формулы исходных веществ и продуктов реакции.
I. Схема химической реакции
Сущность химической реакции с позиции атомно-молекулярной теории заключается в том, что продукты реакции образуются из тех же атомов, которые входили в состав исходных веществ.
Пример 1. При разложении воды образуются простые вещества – водород и кислород (Рис.1.).
Рис. 1. Разложение воды под действие электрического тока
Запишем формулу исходного вещества воды слева, а формулы продуктов реакции — водорода и кислорода – справа. Между ними поставим стрелку:
Эта запись является схемой реакции.
Схема реакции показывает только состав исходных веществ и продуктов реакции, но не может полностью отражать сущность реакции. В состав молекулы воды входит один атом кислорода, а в состав простого вещества кислорода входят два атома. Это значит, что не выполняется закон сохранения массы веществ.
II. Химические уравнения реакций
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Запишем протекающую реакцию в виде уравнения химической реакции:
Рассмотрим еще один пример: 2Н2О = 2Н2 + О2
Чтобы не было противоречий с законом сохранения массы веществ, нужно уравнять число атомов каждого химического элемента слева и справа от стрелки.
Чтобы образовалась одна молекула кислорода, в реакцию должны вступить две молекулы воды. Поставив коэффициент «2» перед формулой воды. Теперь уравняем количество атомов водорода, поставив коэффициент «2» перед формулой Н2, вместо стрелки поставим знак равенства:
Эта запись является уравнением химической реакции. В отличие от схемы реакции, уравнение учитывает, что число атомов каждого химического элемента в реакции не меняется.
Цифры, стоящие перед формулой вещества, называются коэффициентами. Коэффициент показывает количество молекул вещества.
Прочитать записанное уравнение можно так: «Из двух молекул воды образуется две молекулы водорода и 1 молекула кислорода».
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
- Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
- В данном случае это атомы кислорода.
- Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
http://kardaeva.ru/88-dlya-uchenika/8-klass/124-sostavlenie-uravnenij-khimicheskikh-reaktsij
http://nauka.club/khimiya/khimicheskie-uravneniya.html