Реакция каталитического дегидрирования углеводородов
Дегидирирование – химический процесс, в основе которого лежит реакция отщепления водорода от органического соединения. Наиболее распространенными в промышленности процессами являются дегидрирование спиртов, алкилароматических соединений и парафинов.
Процессы дегидрирования характеризуются следующими свойствами:
- Реакция обратима и протекает с увеличением объема. Для того чтобы максимально сместить равновесие в сторону образования продуктов реакции, необходимо снижать давление и увеличивать температуру.
- Реакция эндотермическая, то есть сопровождается поглощением тепла, ввиду чего процессы дегидрирования так же проводят при высоких температурах (до 800 °С).
- В промышленности процессы дегидрирования протекают в адиабатических реакторах при высоком разбавлении паром. Роль пара так же сводится и к снижению парциальных давлений компонентов.
- В качестве катализаторов используются такие металлы как серебро, медь, платина, никель, палладий, а так же оксиды железа, хрома, цинка и молибдена.
Основная проблема процессов дегидрирования заключается в наличии жестких термодинамических ограничений, связанных с установлением термодинамического равновесия. Это связано с тем, что реакции протекают с увеличением числа молей, а также в ходе процесса происходит поглощение тепла, что в конечном итоге приводит к нехватке свободной энергии, сопровождающей реакцию. На основании этого процессы дегидрирования проводят при таких температурах, при которых активизируются следующие побочные реакции:
- Коксообразование — дезактивируют катализатор;
- Скелетная изомеризация;
- Крекинг — наряду со скелетной изомеризацией снижает избирательность процесса.
В качестве альтернативы был разработан метод окислительного дегидрирования, в котором реакция дегидрирования осуществляется в присутствии кислорода. Данный процесс характеризуется необратимостью, экзотермичностью, а так же отсутствием термодинамических ограничений. Это позволяет проводить процесс при более низких температурах в условиях отсутствия вышеописанных побочных реакций. Например, благодаря отсутствию коксообразования отпадает потребность в проведении периодической регенерации катализатора. Несмотря на все плюсы, процесс обладает низкой избирательностью по целевым продуктам и характеризуется побочным образованием кислородосодержащих соединений.
Процессы дегидрирования:
- Дегидрирование спиртов
- Дегидрирование алканов
- Дегидрирование алкилароматических соединений
Реакторы дегидрирования:
- Контроль температуры и давления в зоне реакции, скорости перемешивания
- Объем сосуда: 10 мл – 1000 л
- Расчетное давление: 1– 400 бар
- Расчетная температура: -30 – 600 оС
- Материал сосуда: нержавеющая сталь, Hastelloy C-276, титан, стекло
- Мешалка: магнитная, 0 — 3500 об/мин
- Обогрев: рубашка, электрический/керамический нагреватель
Узнайте цену
- Объем загрузки катализатора: от 3 мл
- Рабочая температура: до 950 оС
- Рабочее давление: до 400 атм.
- Материал реактора и линий: SS 316, Hastelloy C-276, Inconel, кварцевое стекло
- Возможность установки нескольких реакторов: последовательно, параллельно
Узнайте цену
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Содержание
- Конспект по химии на тему Гидрирование и дегидрирование углеводородов
- Процесс гидрирования
- Процесс дегидрирования органических веществ
- Процесс дегидрирования
- Дегидрирование бутана в бутены
- Особенности технологии
- Упрощенный вариант
- Схема производства
- Особенности процесса
- Условия протекания
- Продолжительность использования катализатора
- Сырье для производства
- Химические свойства бутана
- Специфика дегидрирования
- Вариант одностадийного процесса
- Заключение
Конспект по химии на тему Гидрирование и дегидрирование углеводородов
Гидрирование или гидрогенизация (от позднелатинского hydrogenium – водород), деструктивная гидрогенизация, – совокупность химических процессов, происходящих при воздействии водорода на органическое вещество.
В топливоперерабатывающей промышленности гидрогенизацию применяют для получения из твёрдых горючих ископаемых (угли, сланцы), а также низкосернистых нефтей и тяжёлых нефтяных остатков моторного горючего, смазочных масел и химических продуктов.
Гидрогенизация твёрдого топлива является универсальным методом получения из него синтетического жидкого топлива. Также важный резерв для замены сырой нефти горючими сланцами, битумами, углями [5,6].
Развитие исследований в области гидрогенизации относится к 1897-1900 гг., когда П. Сабатье (Франция) и Н.Д. Зелинский (Россия) со своими учениками разработали основы гидрогенизации катализа органических соединений.
Влияние давления водорода на ускорение реакций гидрогенизации органических соединений было установлено вначале XX в. В.Н. Ипатьевым. Промышленное применение гидрогенизации твёрдого топлива впервые было получено в 30-40-х гг., в Германии.
Перед 2-й мировой войной (1939-1945) установки по гидрогенизации угля и угольных смол работали также в Великобритании, Италии, Корее; в СССР были построены два опытных завода. В послевоенный период в основе переработки нефти сырья применяли гидрогенизацию. Начиная с 60-х гг.
[attention type=yellow]
ведутся работы по гидрогенизации твёрдого топлива с целью создания экономически эффективных процессов производства синтетических жидких топлив.
[/attention]
В СССР был разработан процесс гидрогенизации угля для получения моторного горючего, котельного топлива и химикатов.
Процесс осуществляется при температуре 420-430 °С, давлении водорода 10 Па, в присутствии активных катализаторов, растворителя и органических добавок-ингибиторов реакций радикальной полимеризации.
В зависимости от исходного сырья выход жидких продуктов 85-95% (технологическая схема процесса дана на рис.1.).
Рис.1. Процесс гидрогенизации угля для получения моторного горючего, котельного топлива и химикатов.
В США, Великобритании, ФРГ разрабатывается ряд процессов по гидрогенизации угля с катализатором и без катализатора, под давлением водорода 1-7 и 15-30 Па, температура 400-500 °С, а также экстракции угля растворителями с последующей гидрогенизации экстрактов. Исследования по гидрогенизации твёрдого топлива и тяжёлых нефти остатков ведутся в Японии, Индии, Австралии, Польше и др. [3,5].
Процесс гидрирования
Реакцию гидрирования ненасыщенных соединений водородом можно рассматривать как реакцию восстановления. При этом атомы углерода кратной связи восстанавливаются, а молекулярный водород окисляется. Присоединение водорода к алкенам происходит только в присутствии катализаторов:
В качестве катализаторов применяют тонкоизмельченные металлы – платину, палладий, никель. Наиболее часто используются никель Ренея и катализатор Адамса.
Никель Ренея получают обработкой никель-алюминиевого сплава гидроксидом натрия, в результате чего получают тонко измельченный никель, насыщенный водородом. Катализатор Адамса – это платиновая чернь, получаемая восстановлением оксида платины(IV) водородом непосредственно в процессе реакции.
[attention type=red]
Палладий для увеличения поверхности наносят на инертный материал – уголь. Все эти катализаторы не растворяются в органических растворителях.
[/attention]
Водород и алкен адсорбируются на большой поверхности тонкоизмельченного металла, где и происходит реакция. Оба атома водород присоединяются с одной стороны π-связи, т.е. процесс идет как син-присоединение:
Молекула ненасыщенного соединения может содержать другие функциональные группы, способные к восстановлению. Во многих случаях удается подобрать условия, при которых происходит селективное восстановление двойной связи. В приведенных ниже примерах восстановление не затрагивает бензольное кольцо и карбонильную группу:
Гидрирование является экзотермической реакцией. Значения теплот гидрирования дают ценную информацию об относительной устойчивости ненасыщенных соединений. На основании этих данных было установлено, что чем более замещенным является алкен, тем он термодинамически стабильнее [7,8].
Процесс дегидрирования органических веществ
Дегидрирование или дегидрогенизация – это химическая реакция отщепления водорода от молекул органических соединений; одна из фаз процесса биологического окисления. Осуществляется в присутствие катализаторов или под действием акцепторов водорода.
Каталитическое дегидрогенизация и обратная реакция – гидрирование – связаны подвижным термодинамическим равновесием. Протеканию дегидрогенизация способствует повышение температуры и понижение давления.
Осуществляют дегидрогенизация обычно при температуре > 300 °С и давлении 0,1-5 МПа; при необходимости применение более высоких давлений сочетают с соответствующим повышением температуры. Катализаторы дегидрогенизации – обычно многокомпонентные системы, содержащие переходные металлы, их оксиды или сульфиды.
При дегидрогенизации молекула реагирующего соединений образует комплекс с катализатором, распадающийся затем на Н2 и продукт, десорбируемые с поверхности катализатора [3,5].
Дегидрогенизация парафинов в ароматических соединениях (дегидроциклизация) – одна из стадий каталитического риформинга; осуществляется на оксиднохромовом катализаторе при 330-400 °С, давление 0,2-0,8 МПа. Каталитическая дегидрогенизации используют в промышленности для получения 1,3-бутадиена, изопрена, стирола и др.
В СССР в 1984 путем дегидрогенизация было получено более 2 млн. бутадиена и около 11 млн. стирола. К каталитической дегидрогенизации относят также так называемая окислительная дегидрогенизации, протекающее в газовой фазе под действием окислителей (например: О2, SO2, H2O2, I2, Вr2 и др.).
[attention type=green]
Реакция практически необратима, что способствует увеличению выхода целевых продуктов. Так, метанол в присутствии серебра (Ag) окисляется О2 воздуха при ≈ 400 °С в формальдегид с выходом около 80%.
[/attention]
Окислительное дегидрогенизация олефинов и алкилбензолов осуществляют в присутствие фосфатов алюминия, молибдатов висмута, цеолитoв, активированного угля и др.
В качестве акцепторов водорода при дегидрогенизация используют обычно 2,3-дициано-1,4-бензохинон, пероксиды Ni, SeO2, Se, S, а также металлы, способные образовывать гидриды (Zr, Ti, интерметаллиды и др.). Выше указаны некоторые примеры [5].
Процесс дегидрирования
Отщепление водорода от алканов (дегидрирование) является обратимым высокотемпературным каталитическим процессом и используется главным образом в промышленности. Ввиду сложности протекания гетерогенных каталитических реакций будут рассмотрены только некоторые общие закономерности.
В качестве катализаторов дегидрирования применяют оксиды металлов (Сr2Оэ, Fe2O3, ZnO и др.), а также металлы (Pt, Pd, Ni, Fe); при катализе оксидами температура процесса 450-650 °С, при катализе металлами – около 300 оС.
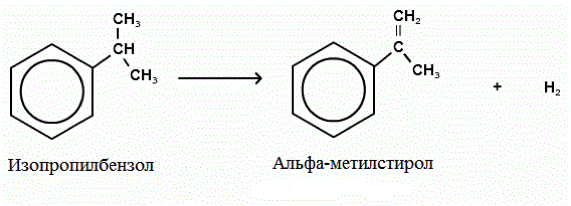
Низшие алканы (С2–С4) при дегидрировании превращаются в алкены, а из бутана, в зависимости от применяемого катализатора и условий реакции, может получаться и бутадиен-1,3:
Алканы, содержащие пять атомов углерода в цепи (но не более), подвергаются дегидроциклизации с образованием циклопентанового углеводорода:
Если в цепи алкана содержится шесть и более атомов углерода, то образующийся в подобных условиях циклогексан (или его гомологи) подвергается дальнейшему дегидрированию с образованием энергетически выгодного ароматического кольца:
В процессах промышленной переработки нефтяного сырья реакции дегидроциклизации приводят к ароматизации насыщенных углеводородов и составляют основу каталитического риформинга.
Дегидрирование алканов – реакция, обратная гидрированию ненасыщенных углеводородов. Положение равновесия определяется температурой и давлением. Обычно дегидрирование проводят при более высоких температурах, а гидрирование – при сравнительно низких (до 200 °С), согласно принципу Лe Шателье.
[attention type=yellow]
Принцип Ле Шателье-Брауна (1884) – если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
[/attention]
Анри Ле Шателье (Франция) сформулировал этот термодинамический принцип подвижного равновесия, позже обобщённый Карлом Брауном.
Принцип устойчивости применим к равновесию любой природы: механическому, тепловому, химическому, электрическому (эффект Ленца, явление Пельтье) [3].
Дегидрированию благоприятствует пониженное давление; на практике используют давление 1-10атм (1атм = 101,3 кПа.), а иногда – ниже атмосферного. Кроме того, для каждого соединения существует довольно узкий диапазон температур, в котором протекает прямой или обратный процесс [6,7,8].
Дегидрирование бутана в бутены
Дегидрирование бутана осуществляется в кипящем либо движущемся слое хромового и алюминиевого катализатора. Процесс проводится при температуре в диапазоне от 550 до 575 градусов. Среди особенностей протекания реакции отметим непрерывность технологической цепочки.
Особенности технологии
Дегидрирование бутана в основном производится в контактных адиабатических реакторах. Реакция осуществляется в присутствии водяного пара, который существенно понижает парциальное давление взаимодействующих газообразных веществ. Компенсация в поверхностных реакционных аппаратах эндотермического теплового эффекта осуществляется путем подвода через поверхность тепла дымовыми газами.
Упрощенный вариант
Дегидрирование бутана самым простым способом предполагает пропитку оксида алюминия раствором хромового ангидрида либо хромовокислым калием.
Полученный катализатор способствует быстрому и качественному протеканию процесса. Данный ускоритель химического процесса является доступным по ценовому диапазону.
Схема производства
Дегидрирование бутана — это реакция, в которой не предполагается существенного расхода катализатора. Продукты дегидрирования исходного вещества попадают на блок экстрактивной ректификации, где осуществляется выделение необходимой олефиновой фракции. Дегидрирование бутана до бутадиена в трубчатом реакторе, имеющем внешний вариант обогрева, позволяет обеспечивать неплохой выход продукта.
Специфика реакции в ее относительной безопасности, а также в минимальном применении сложных автоматических систем и приборов. Среди преимуществ этой технологии можно упомянуть простоту конструкций, а также незначительный расход недорогого катализатора.
Особенности процесса
Дегидрирование бутана является обратимым процессом, причем наблюдается увеличение объема смеси. По принципу Ле-Шателье, для смещения химического равновесия в данном процессе в сторону получения продуктов взаимодействия, необходимо понизить давление в реакционной смеси.
Оптимальным считается атмосферное давление при температуре до 575 градусов, при использовании смешанного хромоалюминиевого катализатора.
По мере отложения ускорителя химического процесса на поверхности углеродсодержащих веществ, которые образуются при протекании побочных реакций глубокой деструкции исходного углеводорода, его активность снижается.
Чтобы вернуть ему первоначальную активность, катализатор регенерируют путем продувки его воздухом, который смешан с топочными газами.
Условия протекания
При дегидрировании бутана образуется в цилиндрических реакторах непредельный бутен. В реакторе есть специальные газораспределительные решетки, установлены циклоны, которые позволяют улавливать катализаторную пыль, уносимую потоком газа.
Дегидрирование бутана в бутены является основой для модернизации промышленных процессов получения непредельных углеводородов. Помимо данного взаимодействия, подобная технология применяется для получения иных вариантов парафинов. Дегидрирование н-бутана стало основой производства изобутана, н-бутилена, этилбензола.
Между технологическими процессами есть некоторые отличия, например, при дегидрировании всех углеводородов ряда парафинов используют аналогичные катализаторы. Аналогия между производством этилбензола и олефинов не только в применении одного ускорителя процесса, но и в использовании аналогичного оборудования.
Продолжительность использования катализатора
Чем характеризуется дегидрирование бутана? Формула катализатора, используемого для данного процесса — это оксид хрома (3). Его осаждают на амфотерной окиси алюминия. Для повышения стабильности и избирательности ускорителя процесса, его проимитируют оксидом калия. При правильном использовании средняя продолжительность полноценной работы катализатора составляет год.
По мере его эксплуатации наблюдается постепенное отложение на смеси оксидов твердых соединений. Их необходимо своевременно выжигать, используя специальные химические процессы.
Отравление катализатора происходит водяным паром. Именно на этой смеси катализаторов происходит дегидрирование бутана. Уравнение реакции рассматривается в школе в курсе органической химии.
[attention type=red]
В случае повышения температуры наблюдается ускорение химического процесса. Но при этом снижается и избирательность процесса, наблюдается оседание на катализаторе слоя кокса. Кроме того, в старшей школе часто предлагается такое задание: напишите уравнение реакции дегидрирования бутана, горения этана. Особых сложностей данные процессы не предполагают.
[/attention]
Напишите уравнение реакции дегидрирования, и вы поймете, что данная реакция протекает в двух взаимообратных направлениях. На один литр объема ускорителя реакции приходится примерно 1000 литров бутана в газообразном виде за час, так происходит дегидрирование бутана.
Реакция соединения непредельного бутена с водородом является обратным процессом дегидрированию нормального бутана. Выход бутилена в прямой реакции составляет в среднем 50 процентов.
Из 100 килограммов исходного алкана после дегидрирования образуется около 90 килограммов бутилена в том случае, если процесс осуществляется при атмосферном давлении и температуре около 60 градусов.
Сырье для производства
Рассмотрим подробнее дегидрирование бутана. Уравнение процесса основывается на применении исходного сырья (смеси газов), образующихся при нефтепереработке. На начальном этапе происходит тщательная очистка бутановой фракции от пентенов и изобутенов, которые мешают нормальному протеканию реакции дегидрирования.
Как происходит дегидрирование бутана? Уравнение данного процесса предполагает несколько ступеней. После очистки происходит дегидрирование очищенных бутенов до бутадиена 1, 3. В концентрате, содержащем четыре углеродных атома, который получен в случае каталитического дегидрирования н-бутана, присутствует бутен-1, н-бутан, а также бутены-2.
Провести идеальное разделение смеси достаточно проблематично. При использовании экстракционной и фракционной перегонки с растворителем можно осуществить подобное разделение, повысить эффективность данного разделения.
При проведении фракционной перегонки на аппаратах, имеющих большую разделительную способность, появляется возможность полноценного отделения от бутена-1 нормального бутана, а также бутена-2.
С экономической точки зрения процесс дегидрирования бутана до непредельных углеводородов считается недорогим производством. Подобная технология позволяет получать моторный бензин, а также огромное количество разнообразных химических продуктов.
В основном данный процесс осуществляется только в тех районах, где необходим непредельный алкен, и бутан имеет низкую стоимость. Благодаря удешевлению и совершенствованию процедуры дегидрирования бутана, существенно расширились сферы использования диолефинов и монолефинов.
Процедура дегидрирования бутана осуществляется в одну либо две стадии, наблюдается возврат непрореагировавшего сырья в реактор. Впервые в Советском Союзе было проведено дегидрирование бутана в слое катализатора.
Химические свойства бутана
Помимо процесса полимеризации, есть у бутана реакция горения. Этана, пропана, иных представителей насыщенных углеводородов достаточно содержится в природном газе, поэтому именно он является сырьем для всех превращений, включая и горение.
В бутане углеродные атомы находятся в sp3-гибридном состоянии, поэтому все связи одинарные, простые. Подобное строение (тетраэдрическая форма) обуславливает химические свойства бутана.
Он не способен вступать в реакции присоединения, для него характерны только процессы изомеризации, замещения, дегидрирования.
[attention type=green]
Замещение с двухатомными молекулами галогенов осуществляется по радикальному механизму, причем для осуществления данного химического взаимодействия необходимы достаточно жесткие условия (ультрафиолетовое облучение).
[/attention]
Практическое значение из всех свойств бутана имеет его горение, сопровождающееся выделением достаточного количества теплоты.
Кроме того, особый интерес для производства представляет и процесс дегидрирования предельного углеводорода.
Специфика дегидрирования
Процедура дегидрирования бутана выполняется в трубчатом реакторе, имеющем на неподвижном катализаторе внешний обогрев. В таком случае повышается выход бутилена, упрощается автоматика производства.
Среди основных преимуществ такого процесса можно выделить минимальный расход катализатора. Среди недостатков отмечают существенный расход легированных сталей, высокие капиталовложения. Кроме того, каталитическая дегидратация бутана предполагает использование существенного количества агрегатов, так как они имеют невысокую производительность.
Производство имеет низкую производительность, так как часть реакторов ориентирована на дегидрирование, а вторая их часть базируется на регенерации.
Кроме того, минусом данной технологической цепочки считают и многочисленность сотрудников на производстве.
Нужно помнить о том, что реакция является эндотермической, поэтому процесс протекает при повышенной температуре, в присутствии инертного вещества.
Но в такой ситуации появляется риск возникновения аварий. Это возможно в том случае, если нарушаются уплотнения в оборудовании. Воздух, который проникает в реактор, при смешивании с углеводородами образует взрывоопасную смесь. Для того чтобы не допустить подобной ситуации, химическое равновесие смещают вправо путем внесения в реакционную смесь водяного пара.
Вариант одностадийного процесса
Например, в курсе органической химии предлагается такое задание: составьте уравнение реакции дегидрирования бутана. Для того чтобы справиться с подобной задачей, достаточно вспомнить основные химические свойства углеводородов класса предельных углеводородов. Проанализируем особенности получения бутадиена путем одностадийного процесса дегидрирования бутана.
https://www.youtube.com/watch?v=eRua6aFG91Q
Батарея дегидрирования бутана включает в себя несколько отдельных реакторов, их численность зависит от цикла работы, а также от объема секций. В основном в батарею включено от пяти до восьми реакторов.
Процесс дегидрирования и обратной регенерации составляет 5-9 минут, на стадию продувки паром уходит от 5 до 20 минут.
Благодаря тому что дегидрирование бутана осуществляется в непрерывно движущемся слое, процесс является устойчивым. Это способствует улучшению эксплуатационных показателей производства, повышает производительность реактора.
[attention type=yellow]
Проводится процесс одностадийного дегидрирования н-бутана при низком давлении (до 0,72 Мпа), при температуре выше той, что используется для производства, проводимого на алюмохромовом катализаторе.
[/attention]
Так как технология предполагает использование реактора регенеративного вида, исключено применение водяного пара. Помимо бутадиена в смеси образуются бутены, их заново вводят в реакционную смесь.
Одна стадия рассчитывается через отношение бутанов, находящихся в контактном газе, к их числу в загрузке реактора.
Среди достоинств такого способа дегидрирования бутана отметим упрощенную технологическую схему производства, понижение расходного количества сырья, а также уменьшение затрат электрической энергии на проведение процесса.
Отрицательные параметры данной технологии представлены короткими периодами контакта реагирующих компонентов. Для исправления этой проблемы требуется сложная автоматика. Даже с учетом подобных проблем одностадийное дегидрирование бутана является более благоприятным процессом, чем двухстадийное производство.
При дегидрировании бутана в одну стадию, происходит подогревание исходного сырья до температуры 620 градусов. Смесь направляется в реактор, осуществляется ее непосредственный контакт с катализатором.
Для создания в реакторах разрежения, применяются вакуум-компрессоры. Контактный газ идет из реактора на охлаждение, далее он направляется на разделение.
После завершения цикла дегидрирования сырье передается в следующие реакторы, а из тех, где уже прошел химический процесс, удаляют путем продувки углеводородные пары.
Продукты эвакуируются, а реакторы снова используются для дегидрирования бутана.
Заключение
Основной реакцией дегидрирования бутана нормального строения является каталитическое получение смеси водорода и бутенов. Помимо главного процесса, возможно наличие множества побочных, которые существенно затрудняют технологическую цепочку.
Продукт, который получают в результате дегидрирования, считается ценным химическим сырьем. Именно востребованность производства является основной причиной поиска новых технологических цепочек превращения углеводородов предельного ряда в алкены.
From Wikipedia, the free encyclopedia
In chemistry, dehydrogenation is a chemical reaction that involves the removal of hydrogen, usually from an organic molecule. It is the reverse of hydrogenation. Dehydrogenation is important, both as a useful reaction and a serious problem. At its simplest, it is useful way of converting alkanes, which are relatively inert and thus low-valued, to olefins, which are reactive and thus more valuable. Alkenes are precursors to aldehydes (R−CH=O), alcohols (R−OH), polymers, and aromatics.[1] As a problematic reaction, the fouling and inactivation of many catalysts arises via coking, which is the dehydrogenative polymerization of organic substrates.[2]
Enzymes that catalyze dehydrogenation are called dehydrogenases.
Heterogeneous catalytic routes[edit]
Styrene[edit]
Dehydrogenation processes are used extensively to produce aromatics in the petrochemical industry. Such processes are highly endothermic and require temperatures of 500 °C and above.[1][3] Dehydrogenation also converts saturated fats to unsaturated fats. One of the largest scale dehydrogenation reactions is the production of styrene by dehydrogenation of ethylbenzene. Typical dehydrogenation catalysts are based on iron(III) oxide, promoted by several percent potassium oxide or potassium carbonate.[4]
Other alkenes[edit]
The importance of catalytic dehydrogenation of paraffin hydrocarbons to olefins has been growing steadily in recent years. Light olefins, such as butenes, are important raw materials for the synthesis of polymers, gasoline additives and various other petrochemical products. The cracking processes especially fluid catalytic cracking and steam cracker produce high-purity mono-olefins, such as 1-butene or isobutene. Despite such processes, currently more research is focused on developing alternatives such as oxidative dehydrogenation (ODH) for two reasons: (1) undesired reactions take place at high temperature leading to coking and catalyst deactivation, making frequent regeneration of the catalyst unavoidable, (2) it consumes a large amount of heat and requires high reaction temperatures. Oxidative dehydrogenation (ODH) of n-butane is an alternative to classical dehydrogenation, steam cracking and fluid catalytic cracking processes.[5]
Propane[6]
Dehydrogenation of paraffins and olefins — paraffins such as n-pentane and isopentane can be converted to pentene and isopentene using chromium (III) oxide as a catalyst at 500 °C.
Formaldehyde[edit]
Formaldehyde is produced industrially by the catalytic oxidation of methanol, which can also be viewed as a dehydrogenation using O2 as the acceptor. The most common catalysts are silver metal, iron(III) oxide,[7] iron molybdenum oxides [e.g. iron(III) molybdate] with a molybdenum-enriched surface,[8] or vanadium oxides. In the commonly used formox process, methanol and oxygen react at ca. 250–400 °C in presence of iron oxide in combination with molybdenum and/or vanadium to produce formaldehyde according to the chemical equation:[9]
Homogeneous catalytic routes[edit]
A variety of dehydrogenation processes have been described for organic compounds. These dehydrogenation is of interest in the synthesis of fine organic chemicals.[10] Such reactions often rely on transition metal catalysts.[11][12] Dehydrogenation of unfunctionalized alkanes can be effected by homogeneous catalysis. Especially active for this reaction are pincer complexes.[13][14]
Stoichiometric processes[edit]
Dehydrogenation of amines to nitriles using a variety of reagents, such as Iodine pentafluoride (IF
5).
In typical aromatization, six-membered alicyclic rings, e.g. cyclohexene, can be aromatized in the presence of hydrogenation acceptors. The elements sulfur and selenium promote this process. On the laboratory scale, quinones, especially 2,3-Dichloro-5,6-dicyano-1,4-benzoquinone (DDQ) are effective.
Main group hydrides[edit]
The dehydrogenative coupling of silanes has also been developed.[15]
The dehydrogenation of amine-boranes is related reaction. This process once gained interests for its potential for hydrogen storage.[16]
References[edit]
- ^ a b Wittcoff, Harold A.; Reuben, Bryan G.; Plotkin, Jeffrey S. (2004). Industrial Organic Chemicals, Second Edition — Wittcoff — Wiley Online Library. doi:10.1002/0471651540. ISBN 9780471651543.
- ^ Guisnet, M.; Magnoux, P. (2001). «Organic chemistry of coke formation». Applied Catalysis A: General. 212 (1–2): 83–96. doi:10.1016/S0926-860X(00)00845-0.
- ^ Survey of Industrial Chemistry | Philip J. Chenier | Springer. ISBN 9780471651543.
- ^ Denis H. James William M. Castor, “Styrene” in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- ^ Ajayi, B. P.; Jermy, B. Rabindran; Ogunronbi, K. E.; Abussaud, B. A.; Al-Khattaf, S. (2013-04-15). «n-Butane dehydrogenation over mono and bimetallic MCM-41 catalysts under oxygen free atmosphere». Catalysis Today. Challenges in Nanoporous and Layered Materials for Catalysis. 204: 189–196. doi:10.1016/j.cattod.2012.07.013.
- ^ Polypropylene Production via Propane Dehydrogenation part 2, Technology Economics Program. by Intratec. 2012. ISBN 978-0615702162.
- ^ Wang, Chien-Tsung; Ro, Shih-Hung (2005-05-10). «Nanocluster iron oxide-silica aerogel catalysts for methanol partial oxidation». Applied Catalysis A: General. 285 (1): 196–204. doi:10.1016/j.apcata.2005.02.029. ISSN 0926-860X.
- ^ Dias, Ana Paula Soares; Montemor, Fátima; Portela, Manuel Farinha; Kiennemann, Alain (2015-02-01). «The role of the suprastoichiometric molybdenum during methanol to formaldehyde oxidation over Mo–Fe mixed oxides». Journal of Molecular Catalysis A: Chemical. 397: 93–98. doi:10.1016/j.molcata.2014.10.022. ISSN 1381-1169.
- ^ Günther Reuss, Walter Disteldorf, Armin Otto Gamer, Albrecht Hilt “Formaldehyde” in Ullmann’s Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a11_619
- ^ Yeung, Charles S.; Dong, Vy M. (2011). «Catalytic Dehydrogenative Cross-Coupling: Forming Carbon−Carbon Bonds by Oxidizing Two Carbon−Hydrogen Bonds». Chemical Reviews. 111 (3): 1215–1292. doi:10.1021/cr100280d. PMID 21391561.
- ^ Dobereiner, Graham E.; Crabtree, Robert H. (2010). «Dehydrogenation as a Substrate-Activating Strategy in Homogeneous Transition-Metal Catalysis». Chemical Reviews. 110 (2): 681–703. doi:10.1021/cr900202j. PMID 19938813.
- ^ Choi, Jongwook; MacArthur, Amy H. Roy; Brookhart, Maurice; Goldman, Alan S. (2011). «Dehydrogenation and Related Reactions Catalyzed by Iridium Pincer Complexes». Chemical Reviews. 111 (3): 1761–1779. doi:10.1021/cr1003503. PMID 21391566.
- ^ «1». Alkane C-H Activation by Single-Site Metal Catalysis | Pedro J. Pérez | Springer. pp. 1–15.
- ^ Findlater, Michael; Choi, Jongwook; Goldman, Alan S.; Brookhart, Maurice (2012-01-01). Pérez, Pedro J. (ed.). Alkane C-H Activation by Single-Site Metal Catalysis. Catalysis by Metal Complexes. Springer Netherlands. pp. 113–141. doi:10.1007/978-90-481-3698-8_4. ISBN 9789048136971.
- ^ Aitken, C.; Harrod, J. F.; Gill, U. S. (1987). «Structural studies of oligosilanes produced by catalytic dehydrogenative coupling of primary organosilanes». Can. J. Chem. 65 (8): 1804–1809. doi:10.1139/v87-303.
- ^ Staubitz, Anne; Robertson, Alasdair P. M.; Manners, Ian (2010). «Ammonia-Borane and Related Compounds as Dihydrogen Sources». Chemical Reviews. 110 (7): 4079–4124. doi:10.1021/cr100088b. PMID 20672860.

1. Гидрирование (гидрогенизация) – присоединение H2. Обратная реакция называется дегидрированием. Гидрирование и дегидрирование взаимосвязаны подвижным равновесием, положение которого определяется температурой и давлением H2. Гидрирование обычно происходит при сравнительно низких температурах (20 – 200 °С), дегидрирование – при более высоких. Повышение давления способствует гидрированию. Реакции осуществляются в присутствии катализаторов: Ni, Pt и др. металлов платиновой группы, Cu, Cr, оксидов и сульфидов металлов, а также многокомпонентных катализаторов. Достаточно легко гидрируются алкины, алкены, нитросоединения, труднее – ароматические углеводороды, альдегиды, кетоны, карбоновые кислоты и их производные.
Примеры:
|
RC |
CR |
H2 |
H2 |
RCH2 |
CH2R |
||||||||||||||||||||||||||||||
|
RCH |
CHR |
||||||||||||||||||||||||||||||||||
|
o |
|||||||||||||||||||||||||||||||||||
|
o |
|||||||||||||||||||||||||||||||||||
|
kat, 20 C |
kat, 20 C |
||||||||||||||||||||||||||||||||||
|
R |
3H2 |
R |
|||||||||||||||||||||||||||||||||
|
kat, 50-100oC, P |
|||||||||||||||||||||||||||||||||||
|
RCOOH |
2H2 |
RCH2OH + H2O |
|||||||||||||||||||||||||||||||||
|
kat, t, P |
|||||||||||||||||||||||||||||||||||
|
RC |
O |
H2 |
RCH2OH |
||||||||||||||||||||||||||||||||
|
H |
kat, t, P |
||||||||||||||||||||||||||||||||||
|
O |
H2 |
OH |
|||||||||||||||||||||||||||||||||
|
R |
C |
R |
RCHR |
||||||||||||||||||||||||||||||||
|
kat, t, P |
|||||||||||||||||||||||||||||||||||
|
RC |
N |
2H2 |
RCH2NH2 |
||||||||||||||||||||||||||||||||
|
kat, t, P |
|||||||||||||||||||||||||||||||||||
|
RNO2 |
3H2 |
RNH2 + 2H2O |
|||||||||||||||||||||||||||||||||
|
kat |
|||||||||||||||||||||||||||||||||||
В органическом синтезе широко используется и некаталитическое гидрирование (восстановление). В этом случае донорами водорода являются металлы в спиртах (например, Na + C2H5OH), кислотах (например, Fe + HCl); комплексные гидриды металлов (например, Na[BH4], Li[AlH4]). В упрощенном виде в уравнении реакции записывается [H].
132

2. Дегидрирование (дегидрогенизация) – отщепление водорода (см. п.1). Катализаторы – обычно многокомпонентные системы, содержащие переходные металлы, их оксиды или сульфиды.
Примеры:
|
CH3CH2CH2CH3 |
kat, t |
CH3CH |
CHCH3 |
kat, t |
CH2 |
CHCH |
CH2 |
||||||
|
— H |
|||||||||||||
|
2 |
CH2 |
CHCH2CH3 |
— H2 |
||||||||||
|
CH2CH3 |
kat, t |
CH |
CH2 |
||||||
|
— H2 |
|||||||||
Дегидрирование может осуществляться и без катализатора при высокотемпературном пиролизе (крекинге) углеводородов, например:
1500 oC
2CH4 

0,1 c
Образование бензола и его ближайших гомологов из алканов называется де-
гидроциклизацией, а превращение циклических соединений в ароматические на-
зывается дегидроароматизацией, например:
|
C7H16 |
kat, t |
CH3 |
|
— 4H2 |
||
-3H2
Дегидрирование спиртов на медном или смешанном (Cu–CrO3) катализаторе
– наиболее общий способ получения альдегидов, объясняющий суть названия альдегид (от лат. al(cohol)dehyd(rogenatum) – алкоголь, лишённый водорода):
|
RCH2OH |
kat, t |
RC |
O |
+ H2 |
|
H |
||||
3. Галогенирование – введение галогена в молекулу органического соединения. Осуществляют путём реакций замещения или присоединения.
Реакции замещения на галоген (Cl или Br) атомов H в алканах и алкильных боковых цепях циклических и ароматических соединений инициируются светом и протекают по свободнорадикальному цепному механизму:
|
CH4 |
Cl2 |
, hν |
CH3Cl |
Cl2 |
, hν |
CH2Cl2 |
Cl2 |
, hν |
CHCl3 |
Cl2 |
, hν |
CCl4 |
|
|
— HCl |
— HCl |
— HCl |
— HCl |
||||||||||
|
CH3 |
Cl2 |
, hν |
CH2Cl |
||
|
— HCl |
|||||
133

Замещение атома водорода на галоген легче всего идёт у третичного атома углерода, затем − у вторичного и в последнюю очередь − у первичного, например:
|
CH3 |
CH |
CH2 |
CH3 |
Cl2 |
, hν |
CH3 |
CCl |
CH2 |
CH3 |
||||||||||
|
— HCl |
|||||||||||||||||||
|
CH3 |
CH3 |
||||||||||||||||||
Эта закономерность объясняется различной энергией связи С−H у первичного, вторичного и третичного атомов углерода, но определяет лишь главное направление реакции; на практике же всегда получается смесь разных продуктов.
При высоких температурах реакции замещения становятся возможными и для непредельных углеводородов:
|
CH |
CH |
CH |
+ Cl |
2 |
500 oC |
CH |
2 |
CH |
CH Cl + HCl |
||||
|
2 |
3 |
2 |
Заместительное галогенирование бензольного ядра протекает по механизму электрофильного замещения при использовании катализаторов, главным образом, тригалогенидов алюминия и железа. Используют также железные стружки
– галогенид железа образуется в ходе реакции:
|
C6H6 + Cl2 |
FeCl3/Fe |
C6H5Cl + HCl |
||
|
хлорбензол |
||||
|
C6H6 + 6Cl2 |
AlCl3 |
C6Cl6 + 6HCl |
||
гексахлорбензол
В органической химии большую роль играет взаимное влияние атомов в молекулах, которое выражается в частичной поляризации химических связей вследствие смещения электронной плотности от функциональной группы, или к ней.
Смещение электронной плотности по цепи σ-связей получило название индукционного (I) эффекта (+I—эффект, если смещение электронной плотности идёт от заместителя − функциональной группы, и −I—эффект, если смещение идёт к заместителю):
|
δ3+ δ2+ δ1+ |
δ− |
CH3 |
δ+ |
δ+ |
δ+ |
|||||||||||||||||||||
|
CH3 |
CH2 |
CH2 |
Br (δ1 |
> δ2 > δ3); |
CH2 |
C |
O |
H |
||||||||||||||||||
|
Oδ− |
||||||||||||||||||||||||||
|
CH3CH2C |
O |
Br2, kat |
CH3CHC |
O |
H2O |
CH3CHC |
O |
|||||||||||||||||||
|
OH |
— H2O |
Br |
— HBr |
OH |
||||||||||||||||||||||
|
Br |
Br |
|||||||||||||||||||||||||
|
пропионовая |
бромангидрид |
α-бромпропионовая к-та |
||||||||||||||||||||||||
|
(пропановая) к-та |
α-бромпропионовой к-ты |
134

Смещение электронной плотности по цепи сопряжённых π-связей (например, в бензольном ядре) называется мезомерным или М-эффектом.
Электронодонорные группы (-OH, -NH2, -CH3, -C2H5, -Cl, -Br, -I) повышают электронную плотность в цепи π-связей бензольного кольца (+М-эффект), особенно в орто- и пара-положении по отношению к атому углерода, у которого расположена такая группа. Эти группы направляют последующее замещение преимущественно в орто- и пара-положение и получили название заместителей (ориентантов) первого рода. Все эти группы (кроме галогенов) увеличивают активность бензольного кольца и облегчают вступление второго заместителя:
|
δ+ |
OH |
OH |
|
|
OH |
|||
|
δ− |
δ− |
Br |
Br |
|
+ 3Br2 |
+ 3HBr |
||
|
δ− |
Br |
||
|
. |
Электроноакцепторные группы (-NO2, -COOH, -CHO, -SO3H) понижают электронную плотность в цепи π-связей (–М-эффект). При этом наиболее заметное понижение электронной плотности происходит у атомов углерода в орто- и пара-положениях, а в мета-положении электронная плотность, напротив, повышается. Такие группы направляют последующее замещение преимущественно в мета-положение и получили название заместителей (ориентантов) второго рода. Все эти заместители уменьшают активность бензольного кольца и затрудняют вступление второго заместителя:
|
δ− |
δ− |
|||
|
O N |
O |
NO2 |
NO2 |
|
|
δ− |
δ− |
+ Br2 |
Br |
+ HBr |
|
. |
||||
Замещение на галоген атомов, отличных от водорода, или групп атомов протекает чаще всего по нуклеофильному механизму. Атом углерода, связанный с электроотрицательным атомом функциональной группы и несущий, поэтому, избыточный положительный заряд, подвергается атаке со стороны нуклеофильной (имеющей избыток электронов) частицы (Cl−, Br−). В качестве галогенирующих агентов используются галогеноводороды, галогениды фосфора, серы и другие галогенсодержащие соединения. Фтор- и иодорганические соединения часто получают замещением атомов Cl и Br в хлор- и бромпроизводных.
Примеры:
CH3OH + HBr 
Данная реакция обратима. Избыток HBr и присутствие H2SO4 увеличивает выход бромметана.
135

|
CH3C |
O |
+ PCl5 |
CH3CHCl2 + POCl3 |
|
|
H |
||||
Реакции присоединения галогенов характерны для непредельных органических соединений. Их осуществляют в мягких условиях, используя свободные галогены, их растворы в воде (хлорная и бромная вода) и четырёххлористом углероде (CCl4), а также галогеноводороды (гидрогалогенирование).
Примеры:
|
CH3 |
CH |
CH2 + Br2 |
CH3 |
CH |
CH2 |
|||||
|
Br |
Br |
|
Br2 |
Br2 |
Br |
Br |
|||||||||||||||||||||||||||||||||||||||||
|
CH3 |
||||||||||||||||||||||||||||||||||||||||||||
|
CH3 |
C |
CH |
CH3 |
C |
CH |
C |
CH |
|||||||||||||||||||||||||||||||||||||
|
Br |
Br |
Br |
Br |
|||||||||||||||||||||||||||||||||||||||||
|
CH3 |
CH |
CH2 + HBr |
CH3 |
CH |
CH3 |
|||||||||||||||||||||||||||||||||||||||
|
Br |
||||||||||||||||||||||||||||||||||||||||||||
|
HBr |
Br |
|||||||||||||||||||||||||||||||||||||||||||
|
CH3 |
C |
CH |
HBr |
CH3 |
C |
CH2 |
CH3 |
|||||||||||||||||||||||||||||||||||||
|
C |
CH3 |
|||||||||||||||||||||||||||||||||||||||||||
|
Br |
Br |
. |
Присоединение галогеноводородов (и других полярных молекул) происхо-
дит по правилу Марковникова: атом водорода присоединяется к более гидрогенизированному атому углерода. Однако если непредельное органическое соединение содержит группы с сильными электроноакцепторными свойствами,
реакция идёт против правила Марковникова:
|
CH2 |
CHX + HBr |
CH2BrCH2X (X — CF3, CN, COOH). |
||
Присоединение против правила Марковникова наблюдается также при свободнорадикальном механизме реакции (инициируется, например, добавкой пероксидов).
В жёстких условиях для бензола также характерны реакции присоединения (с нарушением ароматичности):
|
C6H6 + 3Cl2 |
hν |
C6H6Cl6. |
|
гексахлорциклогексан |
136
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #









![{displaystyle {ce {{mathit {n}} PhSiH3->{}[PhSiH]_{mathit {n}}{}+{mathit {n}} H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1443719eac5da0af7286b8d1df50acf314b17f7e)
