Электронное строение атома калия
Электронное строение нейтрального атома калия в основном состоянии.
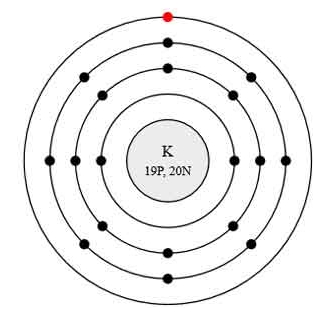
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме калия.
K
+19
2
8
8
1
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме калия.
| 4 | ↑ | |||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома калия выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома калия.
19K 1s2 2s2 2p6 3s2 3p6 4s1
Сокращённая электронная конфигурация атома калия.
19K [Ar] 4s1
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома калия.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 4s | 4 | 0 | 0 | +½ |
Содержание
- Строение атома калия
- Общие сведения о строении атома калия
- Электронное строение атома калия
- Примеры решения задач
- Калий, свойства атома, химические и физические свойства
- Калий, свойства атома, химические и физические свойства.
- Атом и молекула калия. Формула калия. Строение калия:
- Изотопы и модификации калия:
- Свойства калия (таблица): температура, плотность, давление и пр.:
Строение атома калия
Общие сведения о строении атома калия
Относится к элементам s — семейства. Металл. Элементы-металлы, входящие в эту группу, носят общее название щелочных. Обозначение – K. Порядковый номер – 19. Относительная атомная масса – 39,102 а.е.м.
Электронное строение атома калия
Атом калия состоит из положительно заряженного ядра (+19), внутри которого есть 19 протонов и 20 нейтронов, а вокруг, по 4-м орбитам движутся 19 электронов.
Рис.1. Схематическое строение атома калия.
Распределение электронов по орбиталям выглядит следующим образом:
Внешний энергетический уровень атома калия содержит 1 электрон, который является валентным. Степень окисления калия равна +1. Энергетическая диаграмма основного состояния принимает следующий вид:
Возбужденного состояния, несмотря на наличие вакантных 3p— и 3d-орбиталей нет.
Примеры решения задач
| Задание | Атом элемента имеет следующую электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 . Укажите: а) заряд ядра; б) число завершенных энергетических уровней в электронной оболочке этого атома; в) максимально возможную степень окисления; г) валентность атома в соединении с водородом. |
| Решение | Для того, чтобы ответить на поставленные вопросы, сначала нужно определить общее число электронов в атоме химического элемента. Это можно сделать, сложив все электроны, имеющиеся в атоме, не учитывая их распределения по энергетическим уровням: |
Это мышьяк (As). Теперь ответим на вопросы:
б) атом имеет четыре уровня, из которых завершенными являются три;
в) запишем энергетическую диаграмму для валентных электронов атома мышьяка в основном состоянии.
Мышьяк способен переходит в возбужденное состояние: электроны s-подуровня распариваются и один из них переходит на вакантную d-орбиталь.
Пять неспаренных электронов свидетельствуют о том, что максимально возможная степень окисления мышьяка равна +5;
г) Валентность мышьяка в соединении с водородом равна III (AsH3).
| Задание | Напишите электронные формулы атомов: а) третьегоp-элемента четвертого периода; б) второго s-элемента пятого периода; в) девятого d-элемента четвертого периода. |
| Ответ | а) Третийp-элемент четвертого периода – это мышьяк 33 As. |
б) Второй s-элемент пятого периода – это стронций 38 Sr.
в) Девятый d-элемент четвертого периода – это медь 29 Cu.
Источник
Калий, свойства атома, химические и физические свойства
Калий, свойства атома, химические и физические свойства.
39,0983(1) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
Калий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 19. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), четвертом периоде периодической системы.
Физические свойства калия
Атом и молекула калия. Формула калия. Строение калия:
Калий (лат. Kalium, от араб. аль-кали – «поташ») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением K и атомным номером 19. Расположен в 1-й группе (по старой классификации – главной подгруппе первой группы), четвертом периоде периодической системы.
Калий – металл. Относится к группе щелочных металлов.
Калий обозначается символом K.
Как простое вещество калий при нормальных условиях представляет собой мягкий металл серебристо-белого цвета.
Молекула калия одноатомна.
Химическая формула калия K.
Электронная конфигурация атома калия 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 . Потенциал ионизации (первый электрон) атома калия равен 418,81 кДж/моль (4,34066369(9) эВ).
Строение атома калия. Атом калия состоит из положительно заряженного ядра (+19), вокруг которого по четырем оболочкам движутся 19 электронов. При этом 18 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку калий расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и третья – внутренние оболочки представлена s- и р-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома калия – на 4s-орбитали находится один неспаренный электрон. В свою очередь ядро атома калия состоит из 19 протонов и 20 нейтронов. Калий относится к элементам s-семейства.
Радиус атома калия (вычисленный) составляет 243 пм.
Атомная масса атома калия составляет 39,0983(1) а. е. м.
Калий – седьмой по распространённости элемент в земной коре. Содержание его в земной коре составляет 1,5 %, в океанах и морях – 0,042 %.
Калий очень легко вступает в химические реакции.
Изотопы и модификации калия:
Свойства калия (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Калий |
| 102 | Прежнее название | |
| 103 | Латинское название | Kalium |
| 104 | Английское название | Potassium |
| 105 | Символ | K |
| 106 | Атомный номер (номер в таблице) | 19 |
| 107 | Тип | Металл |
| 108 | Группа | Щелочной металл |
| 109 | Открыт | Хемфри Дэви, Великобритания, 1807 г. |
| 110 | Год открытия | 1807 г. |
| 111 | Внешний вид и пр. | Мягкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | 39 K, 41 K |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 1,5 % |
| 120 | Содержание в морях и океанах (по массе) | 0,042 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,0003 % |
| 122 | Содержание в Солнце (по массе) | 0,0004 % |
| 123 | Содержание в метеоритах (по массе) | 0,07 % |
| 124 | Содержание в организме человека (по массе) | 0,2 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 39,0983(1) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 203 | Электронная оболочка | K2 L8 M8 N1 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 243 пм |
| 205 | Эмпирический радиус атома* | 220 пм |
| 206 | Ковалентный радиус* | 203 пм |
| 207 | Радиус иона (кристаллический) | K +
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 275 пм |
| 209 | Электроны, Протоны, Нейтроны | 19 электронов, 19 протонов, 20 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 1-ая группа (по старой классификации – главная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1 |
| 302 | Валентность | I |
| 303 | Электроотрицательность | 0,82 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 418,81 кДж/моль (4,34066369(9) эВ) |
| 305 | Электродный потенциал | K + + e – → K, E o = -2,924 В |
| 306 | Энергия сродства атома к электрону | 48,383(2) кДж/моль (0,501459(13) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,862 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело),
0,828 г/см 3 (при температуре плавления 63,5 °C и иных стандартных условиях , состояние вещества – жидкость) |
| 402 | Температура плавления* | 63,5 °C (336,7 K, 146,3 °F) |
| 403 | Температура кипения* | 759 °C (1032 K, 1398 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 2,33 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 76,9 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 29,6 Дж/(K·моль) |
| 411 | Молярный объём | 45,675584 см³/моль |
| 412 | Теплопроводность | 102,5 Вт/(м·К) (при стандартных условиях ),
79,0 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 5,332 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 100 К |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-09-7 |
205* Эмпирический радиус атома калия согласно [1] и [3] составляет 227 пм и 235 пм соответственно.
206* Ковалентный радиус калия согласно [1] составляет 203±12 пм.
401* Плотность калия согласно [3] составляет 0,856 г/см 3 (при 0 °C и иных стандартных условиях , состояние вещества – твердое тело), согласно [4] 0,826 г/см 3 (при 64 °C и иных стандартных условиях , состояние вещества – жидкость).
402* Температура плавления калия согласно [3] и [4] составляет 63,65 °C (336,8 K, 146,57 °F) и 63,55 °C (336,7 K, 146,39 °F) соответственно.
403* Температура кипения калия согласно [3] и [4] составляет 773,85 °C (1047 K, 1424,93 °F) и 776 °C (1049,15 K, 1428,8 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) калия согласно [4] составляет 2,38 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) калия согласно [4] составляет 79,2 кДж/моль.
Источник
Калий в таблице менделеева занимает 19 место, в 4 периоде.
| Символ | K |
| Номер | 19 |
| Атомный вес | 39.0983000 |
| Латинское название | Kalium, Calium |
| Русское название | Калий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема калия
K: 1s2 2s2 2p6 3s2 3p6 4s1
Короткая запись:
K: [Ar]4s1
Одинаковую электронную конфигурацию имеют
атом калия и
Cl-2, Sc+2, Ti+3, V+4, Mn+6
Порядок заполнения оболочек атома калия (K) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Калий имеет 19 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
1 электрон на 4s-подуровне
Степень окисления калия
Атомы калия в соединениях имеют степени окисления 1, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы калия
Валентность K
Атомы калия в соединениях проявляют валентность I.
Валентность калия характеризует способность атома K к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа K
Квантовые числа определяются последним электроном в конфигурации,
для атома K эти числа имеют значение N = 4, L = 0, Ml = 0, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации K:
Eo = 419 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где K в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
K (калий) — элемент с прядковым номером 19 в периодической системе.
Находится в IV периоде. Температура плавления: 63.7 ℃. Плотность: 0.86 г/см3.
Электронная формула атома калия:
1s2 2s2 2p6 3s2 3p6 4s1
Сокращенная электронная конфигурация K:
[Ar] 4s1
Ниже приведена электронно-графическая схема атома калия
Распределение электронов по энергетическим уровням в атоме K
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 8
4-й уровень (N): 1
Валентные электроны калия
Количество валентных электронов в атоме калия — 1.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | 0 | 0 | +1/2 |
Степени окисления, которые может проявлять калий: +1
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,660 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,971 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.