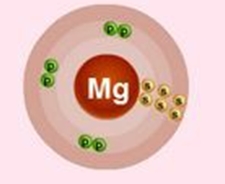
Электронное строение атома магния
Электронное строение нейтрального атома магния в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме магния.
Mg
+12
2
8
2
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме магния.
| 3 | ↑↓ | |||||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома магния выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома магния.
12Mg 1s2 2s2 2p6 3s2
Сокращённая электронная конфигурация атома магния.
12Mg [Ne] 3s2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома магния.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3s | 3 | 0 | 0 | +½ |
| -½ |
Магний в таблице менделеева занимает 12 место, в 3 периоде.
| Символ | Mg |
| Номер | 12 |
| Атомный вес | 24.3040000 |
| Латинское название | Magnesium |
| Русское название | Магний |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема магния
Mg: 1s2 2s2 2p6 3s2
Короткая запись:
Mg: [Ne]3s2
Одинаковую электронную конфигурацию имеют
атом магния и
Na-1, Al+1, Si+2, P+3, S+4, Cl+5
Порядок заполнения оболочек атома магния (Mg) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Магний имеет 12 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
Степень окисления магния
Атомы магния в соединениях имеют степени окисления 2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы магния
Валентность Mg
Атомы магния в соединениях проявляют валентность II.
Валентность магния характеризует способность атома Mg к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Mg
Квантовые числа определяются последним электроном в конфигурации,
для атома Mg эти числа имеют значение N = 3, L = 0, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Mg:
Eo = 738 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Mg в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Содержание
- Строение атома магния
- Общие сведения о строении атома магния
- Электронное строение атома магния
- Примеры решения задач
- Магний, свойства атома, химические и физические свойства
- Магний, свойства атома, химические и физические свойства.
- Атом и молекула магния. Формула магния. Строение магния:
- Изотопы и модификации магния:
- Свойства магния (таблица): температура, плотность, давление и пр.:
- Физические свойства магния:
- Химические свойства магния. Взаимодействие магния. Реакции с магнием:
Строение атома магния
Общие сведения о строении атома магния
Порядковый номер равен 12. Заряд ядра равен +12. Атомный вес – 24,132 а.е.м.
Электронное строение атома магния
Магний расположен в третьем периоде, значит, он имеет три оболочки, одна из которых внешняя, содержащая валентные электроны. Атом магния имеет положительно заряженное ядро (+12), в котором имеется 12 протонов и 12 нейтронов (разница между атомным весом и порядковым номером). По орбитам вокруг ядра движутся 12 электронов.
Рис. 1. Схематичное изображение строения атома магния.
Электронную конфигурацию атома магния можно записать двояко:
Магний относится к семейству s-элементов. Энергетическая диаграмма атома магния (на ней изображаются только валентные электроны) имеет вид:
В результате химического взаимодействия магний теряет свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион (Mg 2+ ):
В соединениях магний проявляет степень окисления +2.
Примеры решения задач
| Задание | Химическому элементу главной подгруппы соответствует высший оксид состава RO3. Какова электронная конфигурация внешнего энергетического уровня атома этого элемента? |
| Ответ | Необходимо определить к какой группе Периодической системы относится элемент, образующий высший оксид состава RO3. Поскольку в оксидах кислород проявляет постоянную валентность равную II, то высшая валентность элемента в оксиде R VI O II 3 равна VI. |
Отсюда следует, что это элемент VIA группы, в его атоме 6 валентных электронов. Этому требованию соответствует элемент с электронной формулой ns 2 np 4 .
| Задание | Исходя из строения внешнего уровня атома меди, объясните, какие значения степени окисления могут быть характерны для меди. |
| Решение | Напишем электронную формулу атома меди в основном состоянии, учитывая, что для меди характерен проскок электрона с 4s –подуровня на 3d-подуровень, который объясняется тем, что завершенный подуровень энергетически более выгоден: |
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 .
4s-электрон является валентным.
В возбужденном состоянии один из d-электронов возвращается на 4-й уровень, таким образом там оказывается 2 валентных электрона.
Итак, для меди характерны два значения степени окисления: +1 и +2.
Источник
Магний, свойства атома, химические и физические свойства
Магний, свойства атома, химические и физические свойства.
24,304-24,307 1s 2 2s 2 2p 6 3s 2
Магний — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 12. Расположен во 2-й группе (по старой классификации — главной подгруппе второй группы), третьем периоде периодической системы.
Физические свойства магния
Атом и молекула магния. Формула магния. Строение магния:
Магний (лат. Magnesium, от др.-греч. βαρύς – «тяжёлый») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Mg и атомным номером 12. Расположен в 2-й группе (по старой классификации — главной подгруппе второй группы), третьем периоде периодической системы.
Магний – щёлочноземельный металл. Относится к группе цветных металлов.
Магний обозначается символом Mg.
Как простое вещество магний при нормальных условиях представляет собой лёгкий, ковкий металл серебристо-белого цвета.
Молекула магния одноатомна.
Химическая формула магния Mg.
Электронная конфигурация атома магния 1s 2 2s 2 2p 6 3s 2 . Потенциал ионизации (первый электрон) атома магния равен 737,75 кДж/моль (7,646236(4) эВ).
Строение атома магния. Атом магния состоит из положительно заряженного ядра (+12), вокруг которого по трем атомным оболочкам движутся 12 электронов. При этом 10 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку магний расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома магния – на 3s-орбитали находится два спаренных электрона. В свою очередь ядро атома магния состоит из 12 протонов и 12 нейтронов. Магний относится к элементам s-семейства.
Радиус атома магния (вычисленный) составляет 145 пм.
Атомная масса атома магния составляет 24,304-24,307 а. е. м.
Изотопы и модификации магния:
Свойства магния (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Магний |
| 102 | Прежнее название | |
| 103 | Латинское название | Magnesium |
| 104 | Английское название | Magnesium |
| 105 | Символ | Mg |
| 106 | Атомный номер (номер в таблице) | 12 |
| 107 | Тип | Металл |
| 108 | Группа | Цветной, щёлочноземельный металл |
| 109 | Открыт | Джозеф Блэк, Шотландия, 1755 г., Хемфри Дэви, Великобритания, 1808 г., Антуан Александр Брутус Бюсси, Франция, 1829 г. |
| 110 | Год открытия | 1755 г. |
| 111 | Внешний вид и пр. | Лёгкий, ковкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 2,9 % |
| 120 | Содержание в морях и океанах (по массе) | 0,13 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,06 % |
| 122 | Содержание в Солнце (по массе) | 0,07 % |
| 123 | Содержание в метеоритах (по массе) | 12 % |
| 124 | Содержание в организме человека (по массе) | 0,027 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 24,304-24,307 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 |
| 203 | Электронная оболочка | K2 L8 M2 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 145 пм |
| 205 | Эмпирический радиус атома* | 150 пм |
| 206 | Ковалентный радиус* | 141 пм |
| 207 | Радиус иона (кристаллический) | Mg 2+
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 173 пм |
| 209 | Электроны, Протоны, Нейтроны | 12 электронов, 12 протонов, 12 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 2-ая группа (по старой классификации – главная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +2 |
| 302 | Валентность | II |
| 303 | Электроотрицательность | 1,31 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 737,75 кДж/моль (7,646236(4) эВ) |
| 305 | Электродный потенциал | Mg 2+ + 2e – → Mg, E o = -2,363 В |
| 306 | Энергия сродства атома к электрону | -40(19) кДж/моль (-0,4(2) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность | 1,738 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело),
1,584 г/см 3 (при температуре плавления 650 °C и иных стандартных условиях , состояние вещества – жидкость), 1,57 г/см 3 (при 651 °C и иных стандартных условиях , состояние вещества –жидкость) |
| 402 | Температура плавления | 650 °C (923 K, 1202 °F) |
| 403 | Температура кипения | 1090 °C (1363 K, 1994 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 8,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 128 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,983 Дж/г·K (при 25 °C), 1,6 Дж/г·K (при 100 °C), 1,31 Дж/г·K (при 650 °C) |
| 410 | Молярная теплоёмкость* | 24,869 Дж/(K·моль) |
| 411 | Молярный объём | 13,984 см³/моль |
| 412 | Теплопроводность | 156 Вт/(м·К) (при стандартных условиях ),
156 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Гексагональная плотноупакованная
|
| 513 | Параметры решётки | a = 3,2029 Å, c = 5,2000 Å |
| 514 | Отношение c/a | 1,624 |
| 515 | Температура Дебая | 318 К |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-95-4 |
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атома магния согласно [1] составляет 160 пм.
206* Ковалентный радиус магния согласно [1] и [3] составляет 141±7 пм и 136 пм соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) магния согласно [3] составляет 9,20 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) магния согласно [3] составляет 131,8 кДж/моль.
410* Молярная теплоемкость магния согласно [3] составляет 24,90 Дж/(K·моль).
Физические свойства магния:
Химические свойства магния. Взаимодействие магния. Реакции с магнием:
1. Реакция взаимодействия магния и водорода:
В результате реакции образуются гидрид магния. Реакция протекает при избыточном давлении.
2. Реакция окисления кислородом магния:
2Mg + O2 → 2MgO (t = 600-650 °C).
В результате реакции образуется оксид магния . В ходе реакции сгорает магний на воздухе.
3. Реакция взаимодействия магния и хлора:
В результате реакции образуются хлорид магния.
4. Реакция взаимодействия магния и кремния:
В результате реакции образуются силицид магния. Реакция протекает при сплавлении реакционной смеси.
5. Реакция взаимодействия магния и азота:
В результате реакции образуются нитрид магния.
6. Реакция взаимодействия магния и фосфора:
В результате реакции образуются фосфид магния.
7. Реакция взаимодействия бора и магния:
В результате реакции образуются борид магния.
8. Реакция взаимодействия висмута и магния:
В результате реакции образуются висмутид магния.
9. Реакция взаимодействия сурьмы и магния:
В результате реакции образуются стибид магния.
10. Реакция взаимодействия магния и воды:
В результате реакции образуются гидроксид магния и водород. В ходе реакции используется горячая вода.
11. Реакция взаимодействия оксида бериллия и магния:
BeO + Mg → MgO + Be (t = 700-800 °C).
В результате реакции образуются оксид магния и бериллий.
12. Реакция взаимодействия оксида азота (I) и магния:
В результате реакции образуются азот и оксид магния.
13. Реакция взаимодействия оксида азота (II) и магния:
2NO + 2Mg → N2 + 2MgO (t ≈ 500 °C).
В результате реакции образуются азот и оксид магния.
14. Реакция взаимодействия магния и тетраоксида диазота:
В результате реакции образуются нитрат магния и оксид азота.
15. Реакция взаимодействия оксида лития и магния:
Li2O + Mg → 2Li + MgO (t = 800 °C).
В результате реакции образуются литий и оксид магния.
16. Реакция взаимодействия оксида лития , магния и водорода:
Li2O + Mg + H2 → 2LiH + MgO (t = 450-500 °C).
В результате реакции образуются гидрид лития и оксид магния.
17. Реакция взаимодействия оксида бора и магния:
В результате реакции образуются в первом случае – борид магния и оксид магния, во втором – бор и оксид магния.
Вторая реакция представляет собой метод получения аморфного бора. Полученный бор – бор Муассана, чистота 95-98 %.
18. Реакция взаимодействия оксида углерода и магния:
CO2 + 2Mg → 2MgO + C (t ≈ 500 °C).
В результате реакции образуются оксид магния и углерод. В ходе реакции происходит сжигание магния в среде углекислого газа.
19. Реакция взаимодействия оксида кремния и магния:
SiO2 + 2Mg → Si + 2MgO (t ≈ 1000 °C),
SiO2 + 4Mg → Mg2Si + 2MgO (t = 800 °C).
В результате реакции образуются в первом случае – кремний и оксид магния. Первая реакция представляет собой лабораторный метод получения кремния осуществляют следующем образом: смесь сухого песка и измельченного магния зажигают магниевой лентой.
Во втором случае в результате реакции образуются силицид магния и оксид магния. Реакция протекает при температуре не более 800°C в атмосфере водорода.
20. Реакция взаимодействия оксида кальция , водорода и магния:
CaO + H2 + Mg → CaH2 + MgO (t = 800-900 °C).
В результате реакции образуются гидрид кальция и оксид магния.
21. Реакция взаимодействия магния и бромоводорода:
В результате реакции образуются бромид магния и водород. В ходе реакции используется разбавленный раствор бромоводорода.
22. Реакция взаимодействия магния и фтороводорода:
В результате реакции образуются фторид магния и водород. В ходе реакции используется разбавленный раствор фтороводорода.
23. Реакция взаимодействия магния и сероводорода:
В результате реакции образуются сульфид магния и водород.
24. Реакция взаимодействия магния и азотной кислоты:
В результате реакции образуются в первом случае – нитрат магния, азот и вода, во втором – нитрат магния, оксид азота (I) и вода, в третьем – нитрат магния, оксид азота (I), оксид азота (II) и вода. В ходе реакции в первом и втором случае применяется разбавленная азотная кислота, в третьем – 30%-й раствор азотной кислоты.
25. Реакция взаимодействия магния и ортофосфорной кислоты:
В результате реакции образуются ортофосфат магния и водород. При этом в ходе реакции используется разбавленный раствор ортофосфорной кислоты.
Аналогичные реакции проходят и с другими кислотами.
26. Реакция взаимодействия магния и аммиака:
В результате реакции образуются нитрид магния и водород.
27. Реакция взаимодействия фторида бериллия и магния:
BeF2 + Mg → MgF2 + Be (t = 700-750 °C).
В результате реакции образуются фторид магния и бериллий.
28. Реакция взаимодействия фторида кремния и магния:
SiF4 + 2Mg → Si + 2MgF2 (t = 500-600 °C).
В результате реакции образуются кремний и фторид магния. В ходе реакции применяется примесь – силицид магния Mg2Si.
29. Реакция взаимодействия карбоната лития и магния:
В результате реакции образуются литий, оксид магния и оксид углерода .
30. Реакция взаимодействия магния и карбоната рубидия:
В результате реакции образуются рубидий, оксид магния и углерод . Этим методом добывают рубидий.
31. Реакция взаимодействия карбида кремния и магния:
2SiC + 5Mg → 2Mg2Si + MgC2 (t ≈ 700°C).
В результате реакции образуются силицида магния и карбида магния.
32. Реакция взаимодействия хлорида олова и магния:
SnCl2 + Mg → MgCl2 + Sn (t = 200-300 °C).
В результате реакции образуются хлорид магния и олово.
33. Реакция взаимодействия хлорида ванадия и магния:
В результате реакции образуются ванадий и хлорид магния.
34. Реакция взаимодействия хлорида железа и магния:
2FeCl3 + 3Mg → 2Fe + 3MgCl2 (t = 300-400 °C).
В результате реакции образуются железо и хлорид магния.
35. Реакция взаимодействия хлорида титана и магния:
TiCl4 + 2Mg → Ti + 2MgCl2 (t = 800-850 °C).
В результате реакции образуются титан и хлорид магния. В ходе реакции используется магний в виде расплава. Реакцию проводят при температуре в отсутствие воздуха в атмосфере аргона.
36. Реакция взаимодействия хлорида гафния и магния:
HfCl4 + 2Mg → Hf + 2MgCl2 (t = 650-700 °C).
В результате реакции образуются гафний и хлорид магния.
37. Реакция взаимодействия хлорида циркония и магния:
ZrCl4 + 2Mg → Zr + 2MgCl2 (t ≈ 700 °C).
В результате реакции образуются цирконий и хлорид магния.
38. Реакция взаимодействия хлорида тантала и магния:
2TaCl5 + 5Mg → 2Ta + 5MgCl2 (t ≈ 750°C).
В результате реакции образуются тантал и хлорид магния.
39. Реакция взаимодействия хлорида ванадия, оксида углерода и магния:
В результате реакции образуются гексакарбонилванадат магния и хлорид магния. Реакция протекает в пиридине при температуре около 135°C и избыточном давлении.
40. Реакция взаимодействия сульфата бериллия, воды и магния:
В результате реакции образуются гидроксосульфат бериллия, сульфат магния и водород.
41. Реакция взаимодействия сульфида титана и магния:
TiS2 + 2Mg → 2MgS + Ti (t ≈ 1000 °C).
В результате реакции образуются сульфид магния и титан. Реакция протекает в атмосфере аргона.
42. Реакция взаимодействия тетрабората натрия и магния:
В результате реакции образуются аморфный бор, оксид магния и оксид натрия .
43. Реакция взаимодействия магния и пентана :
В результате реакции образуются карбид магния и водород. Реакция протекает при нагревании до температуры не более 700°C.
44. Реакция взаимодействия магния и циклопентадиена:
В результате реакции образуются циклопентадиенил магния и водород.
45. Реакция взаимодействия магния и ацетилена:
В результате реакции образуются карбид магния и водород.
Источник
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,662 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,985 -
разное
16,906
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Содержание материала
- Степень окисления магния
- Основное и возбужденное состояние атома
- Физические свойства
- Получение
- Получение в промышленности
- Применение
- Сплавы
- Электронное строение атома магния
- Магний в организмах
Степень окисления магния
Атомы магния в соединениях имеют степени окисления 2.
Степень окисления – это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Основное и возбужденное состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома. Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи, атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов. А химические связи энергетически очень для атома выгодны. Следовательно, чем больше в атоме неспаренных электронов — тем больше связей он может образовать, и, как следствие, перейдёт в более выгодное энергетическое состояние.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться, и один из электронов спаренной пары может переходить на вакантную орбиталь. Таким образом число неспаренных электронов увеличивается, и атом может образовать больше химических связей, что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии бор имеет следующую конфигурацию энергетического уровня:
+5B 1s22s22p1 1s 

На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s22s12p2 1s 

Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Физические свойства
Магний — очень легкий, довольно хрупкий металл, постепенно окисляется на воздухе, превращаясь в белый оксид магния. Кристаллическая решетка α-формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая, а = 5,56Å. Атомный радиус 1,97Å, ионный радиус Ca2+, 1,04Å. Плотность 1,74 г/см³(20 °C). Выше 464 °C устойчива гексагональная β-форма. tпл = 650 °C, tкип = 1105 °C; температурный коэффициент линейного расширения 22•10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м•К) или 0,3 кал/(см•сек•°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг•К) или 0,149 кал/(г•°C); удельное электросопротивление при 20 °C 4,6•10-8 ом•м или 4,6•10-6ом•см; температурный коэффициент электросопротивления 4,57•10-3 (20 °C). Модуль упругости 26 Гн/м² (2600 кгс/мм²); предел прочности при растяжении 60 Мн/м² (6 кгс/мм²); предел упругости 4 Мн/м² (0,4 кгс/мм²), предел текучести 38 Мн/м² (3,8 кгс/мм²); относительное удлинение 50 %; твердость по Бринеллю 200—300 Мн/м² (20-30 кгс/мм²). Магний достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
- MgCl2 → Mg + Cl2
Расплавленный металл периодически отбирают из электролизной ванны, а в неё добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые удаляют примеси из магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
- MgO + C → Mg + CO
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции, вначале производят обжиг доломита:
- CaCO3 ⋅ MgCO3 → CaO + MgO + 2CO2
Затем сильный нагрев с кремнием:
- 2MgO + CaO + Si → CaSiO3 + 2Mg
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Получение в промышленности
В промышленных условиях для получения магния чаще всего применяют электролиз безводного хлорида или обезвоженного карналлита. Процесс проходит следующим образом:
- Электролиз проходит при температуре от 720 до 750 °C.
- По мере выделения элементов состав ванны корректируется, часть электролита при этом удаляется, а сырьё добавляется.
- Расплавленный искомый металл всплывает на поверхность, и его регулярно извлекают.
- Полученное вещество содержит много примесей. Для очистки элемент проходит рафинирование в специальных печах под слоем флюсов.
- Очищенный металл разливают в изложницы.
- Следующая очистка заключается в том, что реагент сублимируют несколько раз в вакууме.
Кроме этого метода, на производстве применяются металлотермический и углетермический способы получения магния. В первом случае брикеты из раскалённого и разложившегося доломита смешивают с восстановителем и нагревают в вакууме при температуре 1300 °C. Полученные в результате магниевые пары образуют конденсат, когда температура опускается до 400−500 °С. Чтобы очистить металл, применяют переплавку под флюсом или в вакууме. Чистый элемент разливают в изложницы.
При использовании второго метода брикеты, состоящие из угля и магниевой окиси, разогревают в электрических печах до 2100 °C. Превратившийся в пар металл отгоняют и конденсируют.
Также вещество добывают из морской воды. Для этого сырьё в очень больших баках смешивают с суспензией гидроксида кальция, который получают, перемалывая морские раковины. В результате происходящей химической реакции образуется особая суспензия, которая после высыхания становится хлоридом магния. После этого продукт подвергают электролитическим процессам.
Кроме морской воды, для выгонки магния может использоваться вода некоторых соленых озер. В Российской Федерации такие озёра находятся в Крыму, Поволжье и других регионах.
Применение
Используется для получения лёгких и сверхлёгких литейных сплавов (самолётостроение, производство автомобилей), а также в пиротехнике и военном деле для изготовления осветительных и зажигательных ракет. Со второй половины XX века магний в чистом виде и в составе сплава кремния с железом — ферросиликомагния, стал широко применяться в чугунолитейном производстве благодаря открытию его свойства влиять на форму графита в чугуне, что позволило создать новые уникальные конструкционные материалы для машиностроения — высокопрочный чугун (чугун с шаровидным графитом — ЧШГ и чугун с вермикулярной формой графита — ЧВГ), сочетающие в себе свойства чугуна и стали.
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в космической, авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Из магниевого сплава изготавливались картеры двигателей бензопилы «Дружба» и автомобиля «Запорожец», ряда других машин. Сейчас из этого сплава производятся легкосплавные колёсные диски.
Электронное строение атома магния
Магний расположен в третьем периоде, значит, он имеет три оболочки, одна из которых внешняя, содержащая валентные электроны. Атом магния имеет положительно заряженное ядро (+12), в котором имеется 12 протонов и 12 нейтронов (разница между атомным весом и порядковым номером). По орбитам вокруг ядра движутся 12 электронов.
Рис. 1. Схематичное изображение строения атома магния.
Электронную конфигурацию атома магния можно записать двояко:
+12Mg)2)8)2;
1s22s22p63s2.
Магний относится к семейству s-элементов. Энергетическая диаграмма атома магния (на ней изображаются только валентные электроны) имеет вид:
В результате химического взаимодействия магний теряет свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион (Mg2+):
Mg –2e → Mg2+;
В соединениях магний проявляет степень окисления +2.
Магний в организмах
Магний содержится во всех растениях и животных. Вещество концентрируется в некоторых морских организмах. Максимальное количество металлического элемента содержится в известковых губках — до 4%.
Входит этот реагент и в состав хлорофилла зелёных растений. В общей сложности на их долю приходится 100 миллиардов тонн вещества. Учёные обнаружили магний во всех компонентах, необходимых клеткам живых организмов для существования. Этот элемент запускает многие ферменты и позволяет хромосомам и коллоидным системам растений сохранять стабильность. Кроме того, реагент поддерживает в клетках тургорное давление. Благодаря магнию растения лучше поглощают и усваивают находящийся в земле фосфор.
Люди и животные получают металлический элемент с пищей. Суточная норма потребления для человека составляет от 0,3 до 0,5 г. У детей и беременных женщин потребность в веществе несколько выше. У здорового человека в крови должно содержаться около 4,3 мг/% магния. В организме основным потребителем реагента является печень, но большая часть поглощённого ею металла постепенно переходит в кости и мышцы.