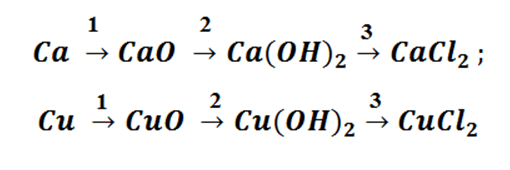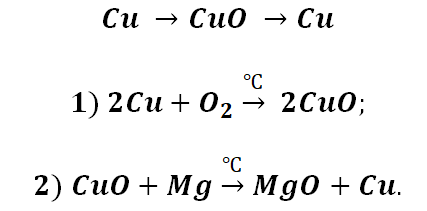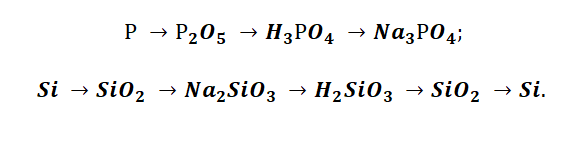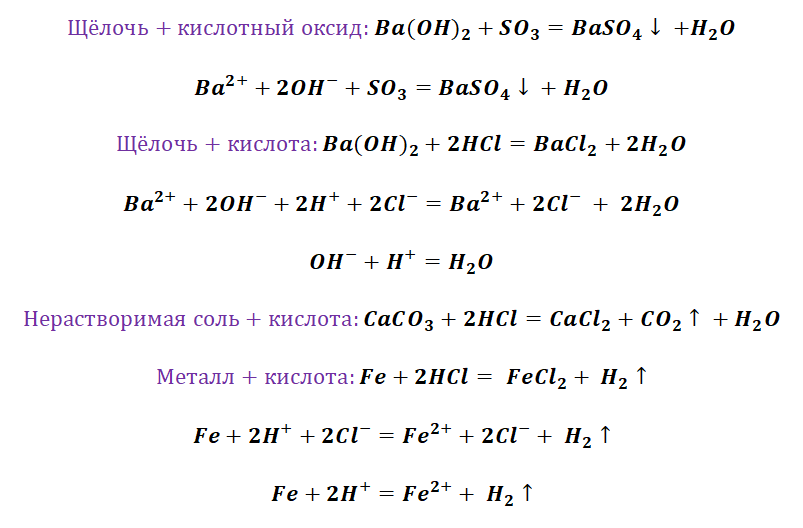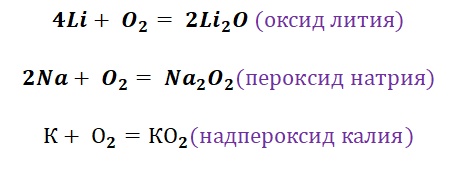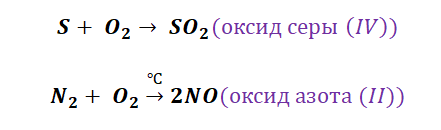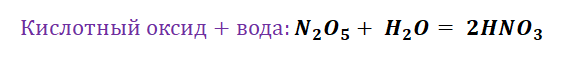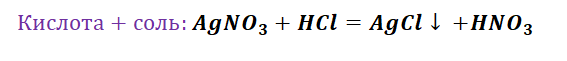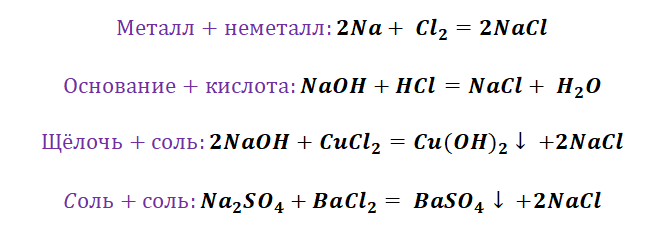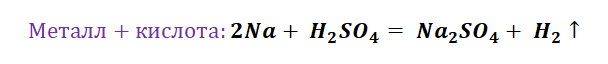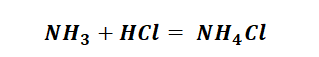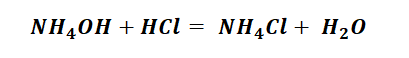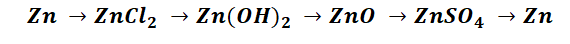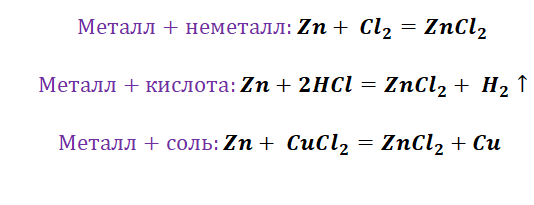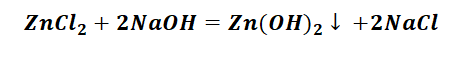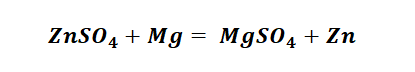Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних
веществ в другие, которые характеризуют генетическую связь между основными
классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений».
Для выполнения этих заданий необходимо знать основные
классы соединений, их номенклатуру, химические свойства, механизм
осуществления реакций.
Алгоритм решения
«цепочки превращений»
1 шаг. Перепишите
цепочку, которую необходимо решить
Ca → CaO → Ca(OH)2
→ Ca3(PO4)2
2 шаг. Пронумеруйте
количество реакций для удобства решения
1
2 3
Ca → CaO → Ca(OH)2
→ Ca3(PO4)2
Таким
образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1
уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним,
что данное превращение происходит, когда металлы окисляются на воздухе, вступая
в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте
уравнивать реакции!
1) 2Сa + O2 2Ca+2O-2
4 шаг.
Осуществляем второе превращение. Из оксида кальция (CaO) нужно
получить гидроксид кальция (Ca(OH)2). Это уравнение
возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в
итоге получается щелочь – растворимое в воде основание). Записываем
уравнение и уравниваем его.
2) 2Ca+2O-2 + H2O → Ca 2+(OH)2—
5 шаг. Осуществляем
3 превращение. Из гидроксида кальция (Ca(OH)2)
необходимо получить соль – фосфат кальция (Ca3(PO4)2).
Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода.
Значит, для этой реакции подойдет фосфорная кислота – H3PO4, так как
именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3Ca2+(OH)2—
+ 2H3+PO43- → Ca32+(PO4)23-
+ 6H2O
Содержание
- Химические цепочки превращений: примеры и способы решения
- Общие принципы решения химических цепочек превращений
- Пример решения цепочки превращений
- Полезные советы
- Алгоритм решения «цепочек превращений».
- Химия
- Почему связь между классами веществ считается генетической
- Родственные связи между металлами и неметаллами
- Взаимопревращение между классами веществ
Химические цепочки превращений: примеры и способы решения
Химические цепочки превращений — это один из наиболее часто встречающихся в школьных учебниках, а также на самостоятельных, проверочных и контрольных типов задач по химии. Чтобы успешно их решать, нужно понимать, как именно они устроены и каким образом стоит подходить к ним. Рассмотрим, как решать цепочки превращений в общем и на конкретных примерах.
Общие принципы решения химических цепочек превращений
Для начала нужно внимательно прочитать условие задачи и изучить цепочку. Четко поняв, что требуется в задаче, можно переходить непосредственно к ее решению.
- Выписав отдельно цепочку химических превращений, пронумеруйте количество необходимых реакций (они обозначены стрелочками от одного вещества к другому).
- Определите, к какому классу веществ относится каждый член цепочки и, если необходимо, выпишите на черновике отдельно в столбик каждое вещество из цепочки и его класс. В случае когда имеются неназванные вещества и их класс неизвестен, проанализируйте, какие вещества могут быть получены из исходного и какого класса вещество должно выступить исходным для следующего после неназванного вещества элемента цепочки.
- Проанализируйте, каким образом можно получить вещество этого класса из исходного для каждого элемента цепочки. В случае если прямая реакция невозможна, подумайте, какие классы веществ можно получить из исходного вещества и из каких получаемых веществ можно позже синтезировать конечное требуемое вещество.
- Составьте схему уравнения первой из необходимых реакций. Не забудьте расставить коэффициенты в уравнении.
- Последовательно осуществите цепочку химических превращений, рассматривая каждую реакцию в отдельности. Проверьте себя, уделяя внимание оформлению реакций.
Пример решения цепочки превращений
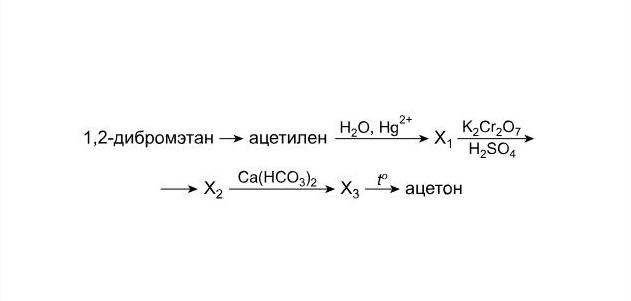
Допустим, в задаче имеется химическая цепочка превращений следующего вида:
Необходимо найти вещества, обозначенные как Х1, Х2 и Х3, и осуществить указанные реакции. Рассмотрим, какие реакции необходимо выполнить для решения этой цепочки после того, как вы пронумеруете стрелки и определите классы веществ.
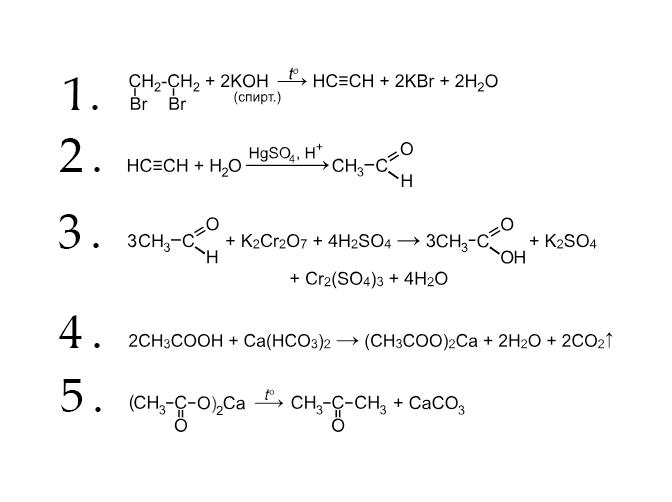
- Для того чтобы из 1,2-дибромэтана получить ацетилен, нужно воздействовать на него спиртовым раствором щелочи при нагревании. В ходе этой реакции от одной из молекул 1,2-дибромэтана отщепятся две молекулы бромоводорода. Эти молекулы будут нейтрализованы щелочью.
- Далее, исходя из условий протекания реакции, вы делаете вывод, что это реакция М. Г. Кучерова. Она приводит к образованию ацетальдегида.
- Ацетальдегид, реагируя в присутствии серной кислоты с дихроматом калия, дает уксусную кислоту.
- Гидрокарбонат вступает в реакцию обмена с раствором кислоты.
- Полученный ацетат щелочноземельного металла при нагревании разлагается, образуя карбонат металла и кетон.
Таким образом, записанное поэтапно решение данной химической цепочки превращений будет выглядеть так:
Полезные советы
Решая цепочки химических уравнений, важно помнить, что конечный результат зависит от каждой последовательно верно решенной реакции в этой цепочке. Следовательно, проверяя себя на последнем этапе, нужно перепроверить возможность каждой реакции и правильность составления и решения уравнения.
Кроме того, если вы сомневаетесь, верно ли вывели ту или иную формулу вещества, вы можете заглянуть на этапе обучения в справочник химических веществ. Важно при этом помнить, что надо не просто сверяться с ним, а запоминать формулы и стараться в дальнейшем самостоятельно воспроизводить их.
Источник
Алгоритм решения «цепочек превращений».
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений » .
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
Ca → CaO → Ca ( OH ) 2 → Ca 3 ( PO 4 ) 2
2 шаг. Пронумеруйте количество реакций для удобства решения
Ca → CaO → Ca(OH) 2 → Ca 3 (PO 4 ) 2
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (С a ) надо получить оксид кальция ( CaO ). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2Сa + O2 
4 шаг. Осуществляем второе превращение. Из оксида кальция ( CaO ) нужно получить гидроксид кальция ( Ca ( OH ) 2 ). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2 Ca +2 O -2 + H 2 O → Ca 2+ ( OH ) 2 —
5 шаг . Осуществляем 3 превращение. Из гидроксида кальция ( Ca ( OH ) 2 ) необходимо получить соль – фосфат кальция ( Ca 3 ( PO 4 ) 2 ). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H 3 PO 4 , так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3 Ca 2+ ( OH ) 2 — + 2 H 3 + PO 4 3- → Ca 3 2+ ( PO 4 ) 2 3- + 6 H 2 O
Источник
Химия
Почему связь между классами веществ считается генетической
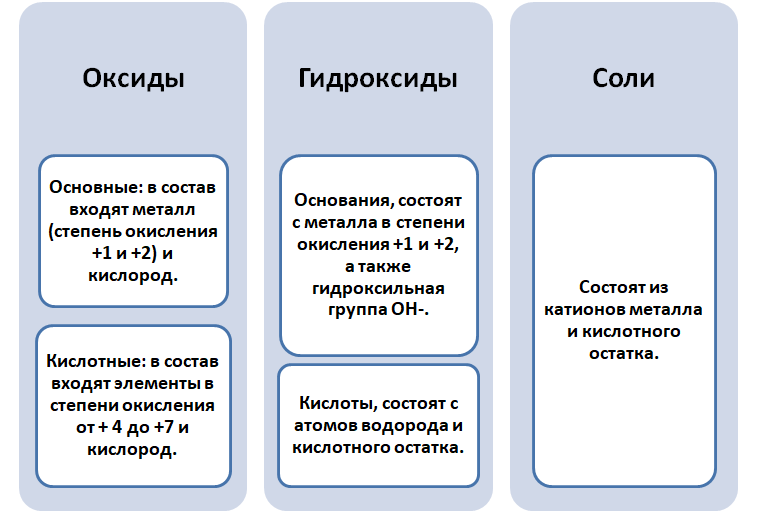
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
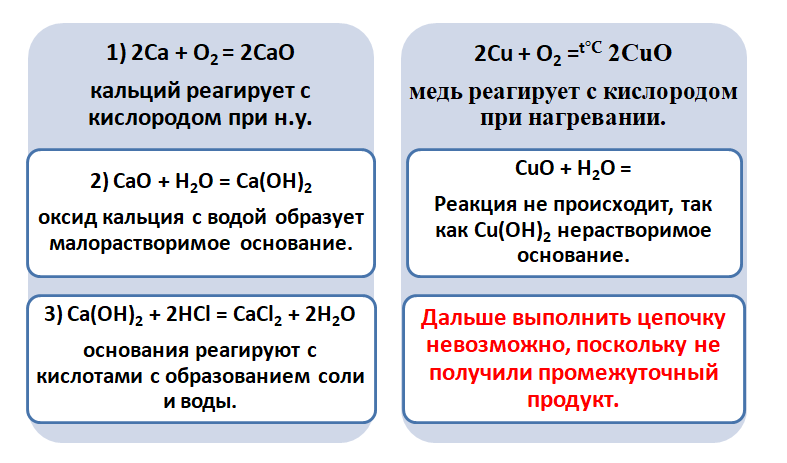
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
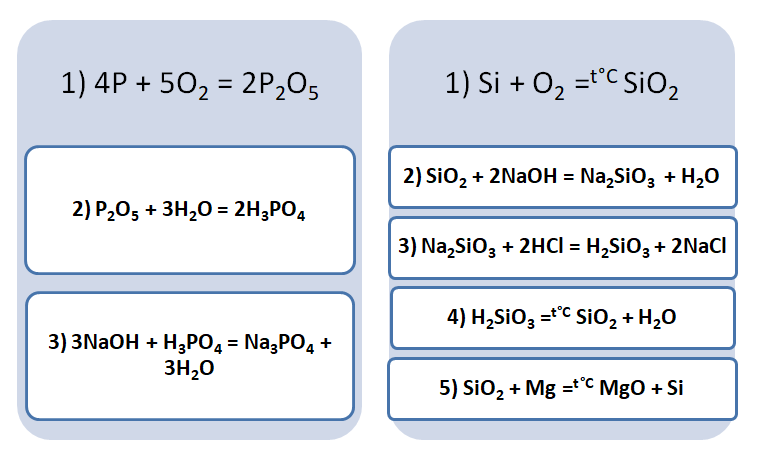
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
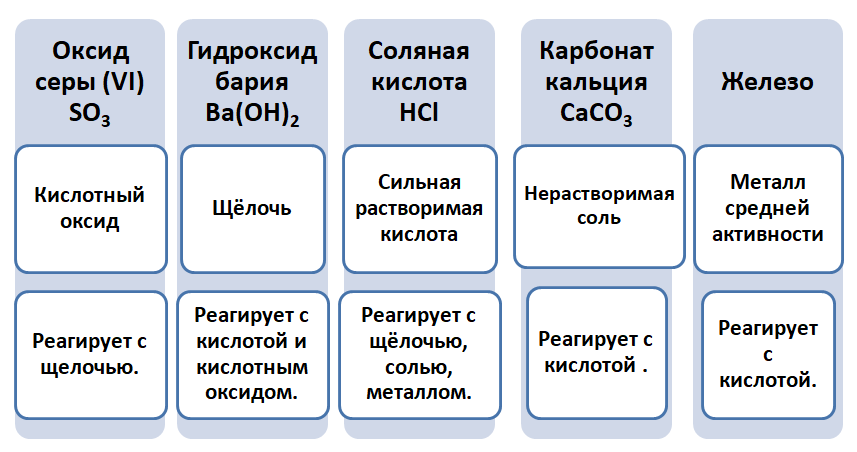
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
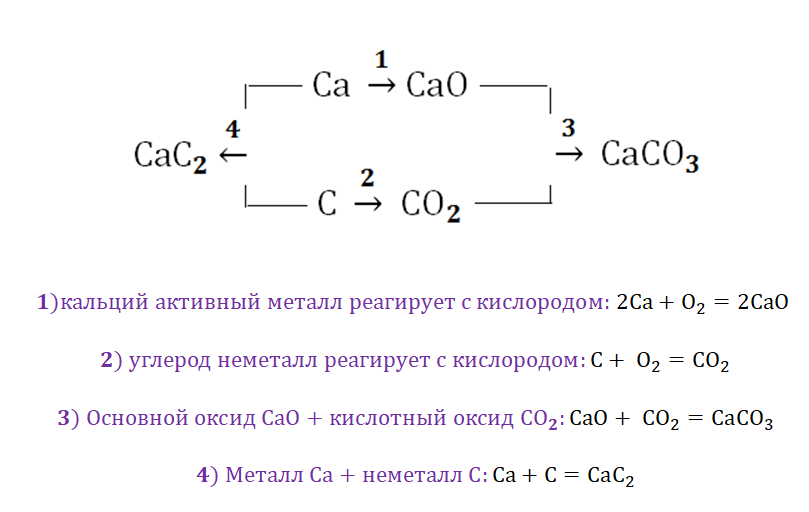
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
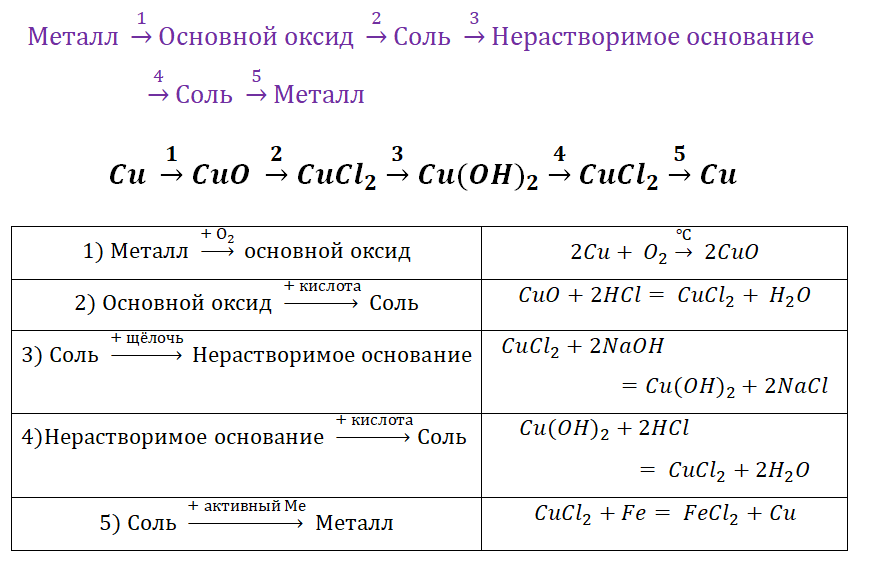
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Источник
-
5. 1. Непосредственные умозаключения
Умозаключение
–
это третья
(после понятия и суждения) форма мышления,
в которой из одного, двух или нескольких
суждений, называемых посылками, вытекает
новое суждение, называемое заключением,
или выводом.
Превращением
называется преобразование суждения в
суждение, противоположное по качеству
с предикатом,
противоречащим предикату исходного
суждения.
Чтобы превратить
суждение, нужно изменить его связку на
противоположную, а предикат – на
противоречащее понятие.
S
есть Р
S
не есть не-Р
Схемы превращения:
(А) Все S
есть Р
(I)
Некоторые S
есть Р
(Е) Ни одно S
не есть не-Р (О) Некоторые S
не есть не-Р
(Е) Ни одно S
не есть Р
(О)
Некоторые S
не есть Р
(А) Все S
есть не-Р (I)
Некоторые S
есть не-Р
Обращение (также
часто называемое конверсией) – это
преобразование простого суждения,
при котором его субъект и предикат
меняются местами.
S
есть Р
Р есть S
Обращение зависит
от вида простого суждения и характера
отношений между его субъектом и
предикатом.
Схемы обращения
суждений:
(А) Все S
есть P
(I)
Некоторые S
есть P
(I)
Некоторые P
есть S
(I)
Некоторые P
есть S
(Е) Ни одно S
не есть P
(Е) Ни одно P
не есть S
Суждения типа I
могут обращаться с приращением.
(I)
Некоторые S
есть P
(А) Все Р есть S
Частноотрицательные
суждения (О) не обращаются.
Противопоставление
предикату
– это преобразование простого суждения,
при котором субъектом становится
понятие, противоречащее предикату, а
предикатом – субъект исходного суждения.
Схемы выводов:
(А) Все S
есть P
(О)
Некоторые S
не есть Р
(Е) Ни одно не-Р не
есть S
(I)
Некоторые не-P
есть S
(Е) Ни одно S
не есть P
(I)
Некоторые не-P
есть S
Частноутвердительное
суждение (I)
путем противопоставления предикату не
преобразуется.
Упражнение 1.
Сделайте вывод путем превращения,
составьте схему вывода.
-
Все дороги ведут
в Рим. -
Не все преступления
являются умышленными. -
Некоторые жители
нашего города верующие. -
Некоторые дети
непоседливы. -
Существуют
сверхмощные звезды. -
Некоторые
произведения искусства не относятся
к классическим. -
Некоторые горы
невысокие. -
Труд закаляет.
-
Некоторые ягоды
несъедобны. -
Шила в мешке не
утаишь. -
Не все юристы –
адвокаты. -
Некоторые люди
страдают бессонницей. -
Каждый воин должен
понимать свой маневр. -
Некоторые
свидетельские показания недостоверны. -
Темза – река
Англии.
Упражнение 2.
Проверьте правильность превращения. В
неправильном превращении сделайте
правильный вывод. Составьте схему
вывода.
1. Все
акулы являются рыбами.
Ни одна акула
не есть не рыба.
2. Некоторые
правонарушители несовершеннолетние.
Некоторые
правонарушители не являются
несовершеннолетними.
3. Некоторые
студенты – отличники.
Некоторые
студенты не отличники.
4. Не
всякое новое ведет к прогрессу.
Все, что не ведет
к прогрессу, не новое.
-
Государство
существовало не всегда.
Государство не
существовало всегда.
-
Ни один день на
прошлой неделе не был дождливым.
Все дни на
прошлой неделе были недождливыми.
-
Некоторые науки
являются прикладными.
Некоторые
науки не являются прикладными.
-
Не все решения
этой проблемы удачны.
Некоторые
решения этой проблемы можно считать
неудачными.
-
Не все кадровые
решения нового начальника обдуманы.
Некоторые
кадровые решения нового начальника
необдуманны.
-
Все киты –
млекопитающие.
Некоторые
млекопитающие являются китами.
11. Некоторые
спортсмены не являются мастерами спорта.
Некоторые
спортсмены не являются не мастерами
спорта.
12.
Ни один
слон не дышит жабрами.
Все слоны дышат
не жабрами.
13. Всякая
лесть лицемерна.
Не все лицемерное
является лестью.
14. Искусство
относится к вечным ценностям.
Не относящееся
к искусству не может представлять вечной
ценности.
15. Не
все народы земного шара являются
цивилизованными.
Некоторые народы
земного шара нецивилизованны.
Упражнение 3.
Сделайте вывод (если это возможно) путем
обращения, составьте схему вывода.
-
Некоторые законы
не имеют обратной силы. -
Все студенты нашей
группы являются успевающими. -
Некоторые люди –
флегматики. -
Не всякий солдат
сможет стать генералом. -
Некоторые рыбы
живут до ста лет. -
Некоторые
произведения искусства не относятся
к классическим. -
Не всякая привычка
полезна. -
Некоторые люди
плохо воспитаны. -
Кислород необходим
для жизни. -
Некоторые авторы
детективных романов – англичане. -
Незаконное
предпринимательство является
преступлением. -
Не всякий менеджер
эффективен. -
Все актеры –
лицедеи. -
Высокая цена не
гарантия качества товара. -
Не все птицы
перелетные.
Упражнение 4.
Проверьте
правильность обращения. В неправильном
обращении сделайте правильный вывод.
Составьте схему вывода.
1. Некоторые
писатели – авторы исторических романов.
Некоторые авторы
исторических романов – писатели.
2. Некоторые
европейские государства являются
унитарными.
Все унитарные
государства являются европейскими.
3. Некоторые
военнослужащие – контрактники.
Все контрактники
– это военнослужащие.
-
Ни один невиновный
не должен быть осужден.
Ни один осужденный
не должен быть невиновен.
-
Все люди разумны
и смертны.
Ни одно неразумное
и бессмертное существо не является
человеком.
6. Все
квадраты – равносторонние прямоугольники.
Некоторые
равносторонние прямоугольники –
квадраты.
7. Все
дельфины – млекопитающие.
Некоторые
млекопитающие не дельфины.
8. Все
планеты не являются звездами.
Некоторые звезды
не являются планетами.
9.
Некоторые
мастера спорта – фигуристы.
Некоторые
фигуристы – мастера спорта.
10. Некоторые
музыканты – композиторы.
Некоторые
композиторы – музыканты.
-
Ни один человек
не имеет права нарушать закон.
Среди тех, кто
имеет право нарушать закон, нет людей.
-
Ни один настоящий
мужчина не обидит женщину.
Среди тех, кто
может обидеть женщину, нет настоящих
мужчин.
-
Семьи, где царит
домострой, нельзя назвать счастливыми.
Среди несчастливых
семей есть такие, где царит домострой.
-
Некоторые
художники не были признаны при жизни.
Значит, есть
непризнанные художники.
-
Всякая книга
имеет своего автора.
Все творения,
имеющие автора, являются книгами.
Упражнение 5.
Сделайте вывод (если это возможно) путем
противопоставления предикату.
-
Некоторые
местоимения обозначают предметы. -
Некоторые
подозреваемые не имеют алиби. -
Не боги горшки
обжигают. -
Профессиональный
рост – фактор успешной карьеры. -
Среди чисел
натурального ряда есть многозначные. -
Всякое правило
имеет исключения. -
Некоторые дети
хорошо рисуют. -
Ни один здравомыслящий
человек не станет гулять
под дождем без зонта. -
Все государства
имеют суверенную власть. -
Многие популярные
книги написаны в жанре фэнтези. -
В геометрии
Евклида прямые не пересекаются. -
Настоящий друг
не оставит в беде. -
Некоторые растения
не требует частого полива. -
Совершеннолетние
россияне имеют право голоса. -
Этот руководитель
очень принципиален.
Упражнение 6.
Проверьте
правильность противопоставления
предикату. В неправильном противопоставлении
предикату сделайте правильный вывод.
Составьте схему вывода.
-
Все трудолюбивые
люди берутся за самую сложную работу.
Ни один из тех,
кто не берется за самую сложную работу,
не может считаться трудолюбивым
человеком.
-
Амперметр –
прибор для измерения силы тока.
Прибор, не
измеряющий силу тока, не является
амперметром.
-
Некоторые книги
являются учебниками.
Ни один не-учебник
не является книгой.
4. Некоторые
животные не являются хищниками.
Некоторые
хищники – животные.
5.
Все актеры самолюбивы.
Несамолюбивый
человек не может быть актером.
6. Не
все золото, что блестит.
Не-золото может
и блестеть.
-
Книга – источник
знаний.
Не-источник
знаний не является книгой.
-
Все мои друзья
хорошо знают мой характер.
Кто не знает
мой характер, то не мой друг.
-
Хороший следователь
имеет развитую интуицию.
Некоторые из
тех, кто имеет развитую
интуицию,
являются
следователями.
-
Ни один
материалист не отрицает познаваемости
мира.
Среди тех, кто
не отрицает познаваемость мира, есть
материалисты.
-
«Мастер и
Маргарита» М. Булгакова – один из лучших
романов рос сийской литературы.
Ни один неудачный
роман российской литературы не является
романом М. Булгакова «Мастер и Маргарита».
12. Все
счастливые семьи похожи друг на друга.
Ни
одно, не имеющее аналогов,
явление не относится к счастливым
семьям.
13. Без
труда не вытянешь и рыбку из пруда.
Тот, кто вытянул
рыбку из пруда, является тружеником.
14. Не
все люди – интересные собеседники.
Все интересные
собеседники – люди.
15. Дисциплина
и ответственность – качества хорошего
работника.
Среди качеств
нерадивого работника нет дисциплинированности
и ответственности.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Урок 12. Составление уравнений химических реакций
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Алгоритм решения «цепочек превращений» веществ. Инструкция для учащихся 8 класса
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений » .
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
2 шаг. Пронумеруйте количество реакций для удобства решения
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (С a ) надо получить оксид кальция ( CaO ). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2 С a + O 2 2Ca +2 O -2
4 шаг. Осуществляем второе превращение. Из оксида кальция ( CaO ) нужно получить гидроксид кальция ( Ca ( OH ) 2 ). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2 Ca +2 O -2 + H 2 O → Ca 2+ ( OH ) 2 —
5 шаг . Осуществляем 3 превращение. Из гидроксида кальция ( Ca ( OH ) 2 ) необходимо получить соль – фосфат кальция ( Ca 3 ( PO 4 ) 2 ). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H 3 PO 4 , так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 956 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 51 человек из 29 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 573 202 материала в базе
Материал подходит для УМК
«Химия», Габриелян О.С.
§ 43. Генетическая связь между классами веществ
Другие материалы
- 16.05.2020
- 204
- 3
- 14.04.2020
- 306
- 6
- 28.03.2020
- 863
- 5
- 14.03.2020
- 374
- 7
- 11.02.2020
- 1145
- 1
- 05.02.2020
- 1539
- 100
- 16.01.2020
- 1307
- 14
- 13.01.2020
- 362
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 17.05.2020 31488
- DOCX 19.5 кбайт
- 217 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Светлова Елена Александровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 7 лет и 1 месяц
- Подписчики: 3
- Всего просмотров: 65535
- Всего материалов: 42
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Профессия педагога на третьем месте по популярности среди абитуриентов
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
В России могут объявить Десятилетие науки и технологий
Время чтения: 1 минута
В школах Хабаровского края введут уроки спортивной борьбы
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А12 теста ЕГЭ по химии — «Взаимосвязь неорганических веществ»
Если посмотрите это задание в вариантах ЕГЭ, то там дана схема превращений неорганических веществ и в ответах даны варианты реагентов. Как решать такие задачи?
Темы, которые нужно знать:
Составить уравнения реакций по схеме превращений
На самом деле это не так и сложно. Для этого необходимо знать типы реакций и основные условия их протекания.
1. Химические реакции соединения
- Реакция горения — одна из самых распространенных химических реакций соединения — все вещества горят — и металлы, и неметаллы:
- Химические реакции соединения металла и неметалла — приводят к образованию солей:
(а вот этот момент надо запомнить (или выучить) — железо при взаимодействии с соляной кислотой дает хлорид железа (II), а с хлором — простым веществом — хлорид железа (III))
- Неметаллы также могут взаимодействовать между собой:
2. Составление уравнений реакций по схеме — реакции разложения
- Обычно уравнения реакций разложения солей дают соответствующие основные и кислотные оксиды:
Исключения:
- по-другому разлагаются нитраты — в зависимости от металла, входящего в состав соли. Это можно прочитать >;
- хлорид аммония — NH4Cl — разлагается до аммиака и соляной кислоты: NH4Cl = NH3 + HCl;
- не разлагаются сульфаты
- соли, образованные сильными окислителями:
- Разлагаются некоторые основания:
3. Составление уравнений реакций по схеме — п римеры реакций замещения
- реакция замещения водорода в кислотах:
когда нам дана реакция замещения металлом водорода в кислотах, нужно учитывать электрохимический ряд напряжений металлов: металлы, находящиеся в ряду ДО водорода, вытесняют его из кислот:
2Na + 2HCl = 2NaCl + H2
- реакции замещения в солях:
Ca + 2NaCl = CaCl2 +2 Na
Правило: предыдущий металл вытесняет последующий из его солей
(т.е. реакция Na + CaCl2 не будет идти)
4. Составление уравнений реакций по схеме — р еакции обмена веществ
Здесь следующие правила — обменные реакции идут в сторону образования продуктов при:
- выпадении осадка: NaCl + AgNO3 = AgCl↓ + NaNO3
- выделении газа: Na2CO3 + HCl = NaCl + CO2 + H2O ;
- образовании малодиссоциирующего вещества (H2O, NH4OH, органические кислоты и соли и т.д.): NaOH + H2SO3 = Na2SO3 + H2O
Взаимосвязь неорганических веществ можно отобразить такой таблицей:
Теория, это, конечно, хорошо, но давайте попрактикуемся — попробуем составить уравнения реакций по схемам превращений
В первой реакции к меди можно прибавить либо AgNO3, либо HNO3 — в ряду напряжений медь стоит до серебра, а азотная кислота будет давать окислительно-восстановительную реакцию.
Во второй части схемы нам подходит K2S или H2S, т.к. сульфид меди — осадок.
Ответ: 1)
Составим уравнения реакций для данной схемы превращений:
Первая реакция — переход фосфора в фосфорную кислоту — такое под силу только мощным окислителям — либо серной, либо азотной кислоте.
Вторая реакция — обменная — K2SO4 даст растворимые продукты, а вот KOH — в самый раз! Получится вода — малодиссоциирующее вещество.
http://infourok.ru/algoritm-resheniya-cepochek-prevrashenij-veshestv-instrukciya-dlya-uchashihsya-8-klassa-4304493.html
http://distant-lessons.ru/sostavit-uravneniya-reakcij-po-sxeme-prevrashhenij.html
Материал опубликовала
| Светлова Елена Александровна1655
Высшее образование. Педагогический стаж 26 лет. Высшая квалификационная категория. Победитель ПНПО «Лучших учителей России» 2014 и 2022 г.г. Руководитель школьного объединения «Эколог». Россия, Ивановская обл., Приволжск |
4
Алгоритм решения «цепочек превращений».
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений».
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
2 шаг. Пронумеруйте количество реакций для удобства решения
1 2 3
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2Сa + O2 
4 шаг. Осуществляем второе превращение. Из оксида кальция (CaO) нужно получить гидроксид кальция (Ca(OH)2). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2Ca+2O-2 + H2O → Ca 2+(OH)2—
5 шаг. Осуществляем 3 превращение. Из гидроксида кальция (Ca(OH)2) необходимо получить соль – фосфат кальция (Ca3(PO4)2). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H3PO4, так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3Ca2+(OH)2— + 2H3+PO43- → Ca32+(PO4)23- + 6H2O
Опубликовано 17.05.20 в 10:05
Размер файла: 19.52 Кбайт