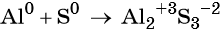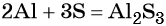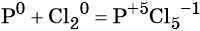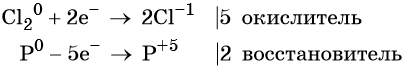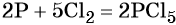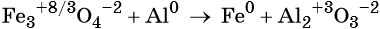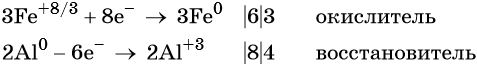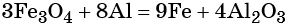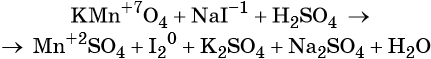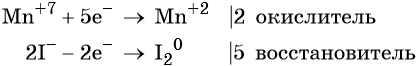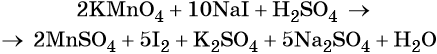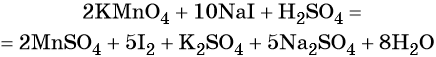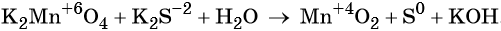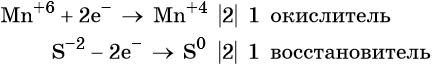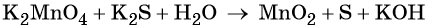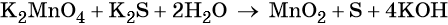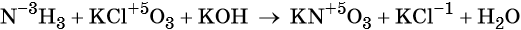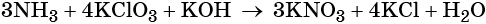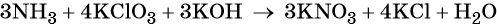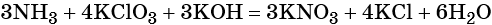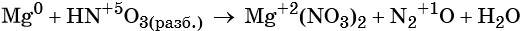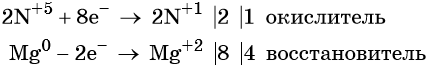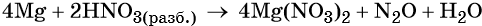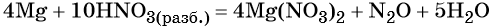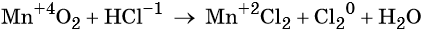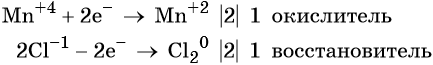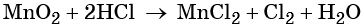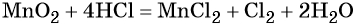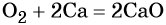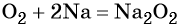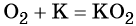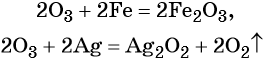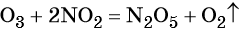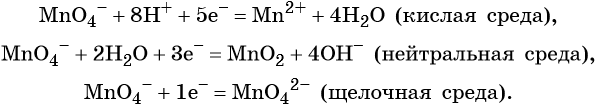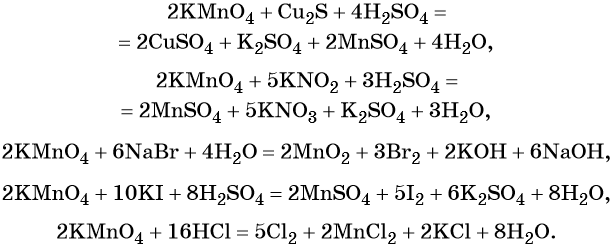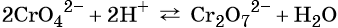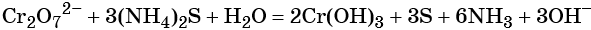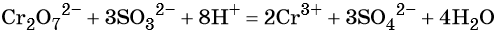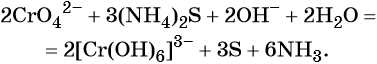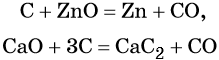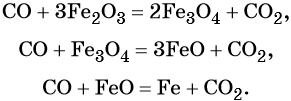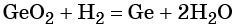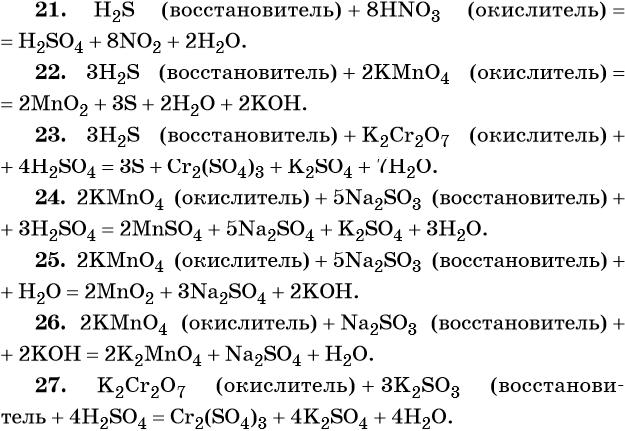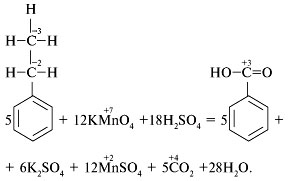Окислительно-восстановительные реакции. Окислитель и восстановитель
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I20. Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S0. Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Основные коэффициенты в уравнении реакции равны единице:
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:
Проставляем найденные основные коэффициенты в уравнение реакции:
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl20, хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn2+, в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO42–. Данные переходы описываются следующими уравнениями
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr3+:
В щелочной — производные анионного комплекса [Cr(OH)6]3–:
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:
Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
2. KNO3 + Al → KAlO2 + Al2O3 + N2.
3. Na2O2 + H2SO4 + KMnO4 → O2↑ + MnSO4 + Na2SO4 + K2SO4 + H2O.
4. NaCl + H2SO4 + MnO2 → Cl2 + MnSO4 + Na2SO4 + H2O.
5. NaCl + H2SO4 + KMnO4 → Cl2 + MnSO4 + Na2SO4 + K2SO4 + H2O.
6. KNO2 + H2SO4 + MnO2 → MnSO4 + KNO + H2O.
7. KI + H2SO4 + KMnO4 → I2 + MnSO4 + K2SO4 + H2O.
8. KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O.
9. C + K2Cr2O7 + H2SO4 → CO2 + Cr2(SO4)3 + K2SO4 + H2O.
10. PbO2 + HNO3 + KI → Pb(NO3)2 + I2 + KNO3 + H2O.
11. PbO2 + HNO3 + Mn(NO3)2 → Pb(NO3)2 + HMnO4 + H2O.
12. NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + H2O.
13. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O.
14. KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O.
15. KNO2 + KI + H2SO4 → NO + I2 + K2SO4 + H2O.
16. KNO2 + FeSO4 + H2SO4 → NO + Fe2(SO4)3 + K2SO4 + H2O.
17. Ca3(PO4)2 + C + SiO2 → CaSiO3 + P + CO.
18. Sb + HNO3 → Sb2O5 + NO2 + H2O.
19. H2O2 + H2SO4 + KMnO4 → MnSO4 + O2 + H2O + K2SO4.
20. S + HNO3 → H2SO4 + NO2 + H2O.
21. H2S + HNO3 → H2SO4 + NO2 + H2O.
22. H2S + KMnO4 → MnO2 + S + H2O + KOH.
23. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
24. KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
25. KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH.
26. KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O.
27. K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
28. H2SO4 + C → SO2 + CO2 + H2O.
29. H2SO4 + Zn → ZnSO4 + H2S + H2O.
30. H2SO4 + KBr → SO2 + Br2 + KHSO4 + H2O.
31. H2SO4 + KI → H2S + I2 + K2SO4 + H2O.
32. PbO2 + HCl → PbCl2 + Cl2 + H2O.
33. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O.
34. KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O.
35. KClO3 + HCl → KCl + Cl2 + H2O.
36. HClO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + HCl + H2O.
37. NaBrO3 + NaBr + H2SO4 → Br2 + Na2SO4 + H2O.
38. HNO3 + I2 → HIO3 + NO2 + H2O.
39. HNO3 + I2 → HIO3 + NO + H2O.
40. H2SO4 + HI → I2 + H2S + S + H2O.
41. Fe2(SO4)3 + HI → FeSO4 + I2 + H2SO4.
42. HIO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + I2 + H2O.
43. NaIO3 + NaI + H2SO4 → I2 + Na2SO4 + H2O.
44. KMnO4 + Cu2O + H2SO4 → MnSO4 + CuSO4 + K2SO4 + H2O.
45. HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + NO2 + H2O.
46. H2SO4 + Cu2S → CuSO4 + SO2 + H2O.
47. Ag + HNO3 → AgNO3 + NO + H2O.
48. Zn + HNO3 → Zn(NO3)2 + N2O + H2O.
49. PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O.
50. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
51. H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
52. Ca3P2 + KMnO4 + H2SO4 → CaSO4 + H3PO4 + MnSO4 + K2SO4 + H2O.
Ответы
Цель урока: повторить и углубить знания учащихся о валентности и степени окисления атомов, познакомить с понятием валентные возможности атомов.
Задачи урока:
- дать понятия «валентность», «валентные электроны»;
- научить определять валентность атома в основном состоянии;
- закрепить знания о возбужденном состоянии атома и научить определять его валентные возможности;
- закрепить знание понятия «степень окисления», научить определять С.О. в бинарных соединениях и более сложного состава;
- убедиться в существенном различии понятий «степень окисления» и «валентность атома»;
- дать представление об атомах-донорах и атомах-акцепторах.
Скачать видеоурок «Валентные возможности атомов. Степень окисления»
Данный материал будет полезен учащимся 11 классов при подготовке к ЕГЭ, при закреплении и повторении изученного материала в предыдущих классах.
Как вы знаете, атомы большинства химических элементов взаимодействуют с другими атомами и образуют множество соединений. Но почему так происходит? Ответ на этот вопрос долгое время оставался неизвестен.
Первой попыткой объяснить химическое взаимодействие была теория Бертолле. Атомы должны притягиваться друг к другу тем сильнее, чем больше их массы. А по электрохимической теории Берцелиуса, каждый атом имеет два противоположно заряженных полюса. Теория делила все элементы на два класса — металлы с преобладанием положительного заряженного полюса и металлоиды с отрицательным заряженным полюсом. Причём считалось, что соединяться друг с другом могли лишь атомы противоположной электрической природы.
Эта теория была отвергнута, когда выяснилось, что элементы одного и того же класса также могут соединяться друг с другом. И только лишь в 20 столетии возникли два направления теории химического взаимодействия на основе электронных представлений, основные положения которых были сформулированы Косселем и Льюисом. С точки зрения Косселя, движущей причиной химического взаимодействия является «стремление» атомов к достижению наиболее устойчивых электронных конфигураций. Основной недостаток теории Косселя в том, что не все соединения могут рассматриваться с ионной точки зрения. Между тем идея Льюиса об образовании электронной пары позволяет охватить самые разнообразные случаи валентной связи и сохраняет свое значение до сих пор.
Впервые понятие «валентности» как соединительной силы ввел Э. Франкланд. Он считал, что взаимодействие разнообразных атомов происходит благодаря валентным силам.
Из всего вышесказанного приходим к выводу, валентность — это мера способности атомов притягиваться друг к другу посредством общих электронных пар. Валентность, как правило, обозначается римской цифрой. Рассмотрим электронные конфигурации атомов, чтобы разобраться, как возникают валентные взаимодействия между атомами.
В основном состоянии на внешних энергетических уровнях, а иногда и на предвнешних уровнях атомов, могут находиться спаренные и неспаренные электроны. Валентность атома определяется числом неспаренных электронов, принимающих участие в образовании химической связи.
У s- и p-элементов валентные электроны расположены на s- и p-подуровнях внешнего энергетического уровня.
Например, литий, у которого заряд ядра +3, 3 электрона, это s-элемент, атом имеет один неспаренный s-электрон, значит валентность лития I.
Рассмотрим другой пример, азот. Заряд его атома +7, у него 7 электронов. Это p-элемент. Соответственно, азот имеет 5 валентных электронов — два спаренных s- электрона и 3 неспаренных p-электрона.
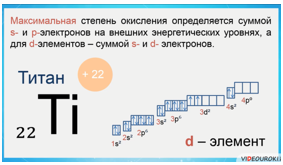
У d-элементов валентные электроны находятся на s-подуровне последнего энергетического уровня и d-подуровне предвнешнего энергического уровня.
Например, у атома титана заряд ядра +22, соответственно столько же электронов — 22. Титан имеет 4 валентных электрона, 2 спаренных s-электронов и два неспаренных d-электронов.
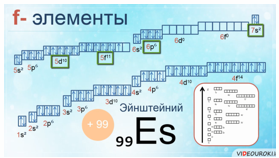
У f-элементов валентные электроны располагаются на s-подуровне последнего энергетического уровня и d-подуровне предпоследнего энергетического уровня и f- подуровня, третьего с края энергетического уровня.
Например, у атома эйнштейния заряд ядра +99, столько же у него и электронов. Эйнштейний имеет 13 валентных электронов, 12 спаренных и 1 неспаренный на 5f-подуровне. Этому элементу было присвоено название эйнштейний в честь выдающегося ученого двадцатого столетия Альберта Эйнштейна, внесшего большой вклад в науку об атоме и атомном ядре.
Следует усвоить, что основные свойства элементов определяются валентными электронами, а уровни, подуровни, на которых располагаются валентные электроны, называются валентными. Самыми первыми вступают в реакцию неспаренные электроны, расположенные на внешнем энергетическом уровне. Количеством этих неспаренных электронов и определяет валентность. Если на спаренные электроны, при имеющейся свободной орбитали в атоме, подействует энергия извне, эти электроны распариваются и атом переходит из основного состояния в возбужденное. Энергия, затраченная на переход электронов, компенсируется при образовании новых связей.
Валентные возможности атомов также определяются числом пустых орбиталей и числом неподеленных электронных пар. Атом-донор предоставляет неподеленную электронную пару атому-акцептору, который имеет свободные орбитали.
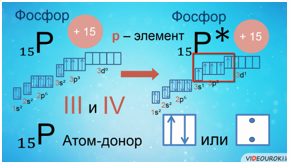
Например, заряд ядра атома фосфора +15, число электронов 15. В основном состоянии атом фосфора, который относится к p-элементам, на внешнем уровне содержит 1 пару спаренных электронов и 3 неспаренных электрона. Поэтому, он проявляет валентность III, так как у него 3 неспаренных p-электрона. Валентность азота IV, так как атом фосфора это атом-донор, который может предоставить пару электронов для образования химической связи.
При имеющихся вакантных орбиталях на 3d-подуровне и паре спаренных электронов на 3s-подуровне атом фосфора может переходить в возбужденное состояние. Это происходит за счёт распаривания и перехода электрона на свободную орбиталь другого подуровня. В атоме появляется 5 неспаренных электронов, что и обеспечивает возможность существования валентности атома фосфора — V.
Поэтому, если у элементов на внешнем энергетическом уровне есть неспаренные электроны, то они являются активными элементами или реакционноспособными. А если на внешнем уровне электроны находятся только в спаренном состоянии, тогда эти элементы относят к малоактивным.
Например, к малоактивным химическим элементам относят VIIIA группу химических элементов Периодической системы. Их так и называют — благородные или инертные (малоактивные) химические элементы — так как на внешнем слое этих элементов все электроны находятся в спаренном состоянии. Нет свободных или неспаренных электронов, которые образовывали связи с электронами других химических элементов.
Следует запомнить, что s-, d-, f-элементы — это металлические элементы, кроме некоторых исключений. Так как на последнем уровне у них электронов меньше, чем 3; у неметаллических элементов, наоборот, на последнем уровне электронов больше, чем 4.
P-элементы могут быть металлические и неметаллические. Рассмотрим Периодическую систему химических элементов. По диагонали от бора к астату все p-элементы выше диагонали — неметаллические, ниже — металлические. По строению элементы, у которых на внешнем энергетическом уровне 3 или 4 электрона, считаются переходными элементами; многие d-элементы — металлические с переходными свойствами.
У элементов в соединении можно определить не только валентность, но и степень окисления. Степень окисления — это условный заряд атома — положительный или отрицательный, в зависимости от смещения электронов от атома или к нему, если считать все связи в веществе ионными. Степень окисления и валентность это не одно и тоже понятие. Например, атом углерода в органических соединениях четырёхвалентен, однако степени окисления имеет различные.
Запомним, если в соединении атом не проявляет валентность как донор, то степень окисления численно совпадает с валентностью. Например, в молекуле аммиака валентность азота равна III и степень окисления равна тоже -3. И наоборот, если в соединении атом проявляет валентность как донор, то степень окисления численно не совпадает с валентностью. У катиона аммония атом азота проявляет валентность IV, а степень окисления -3.
Степень окисления может быть минимальной, промежуточной и максимальной.
Минимальная степень окисления для неметаллических элементов определяется числом валентных мест в незавершенном энергетическом уровне. У атома углерода она равна -4, так как до устойчивости внешнего энергетического уровня атома углерода (до 8 электронов) число валентных мест — 4. Соответственно, у атома азота минимальная степень окисления -3, у кислорода — -2.
Максимальная степень окисления определяется суммой s- и p-электронов на внешних энергетических уровнях, а для d-элементов — суммой s- и d-электронов.
Например, атом титана — это d-элемент, металлический. На внешнем электронном слое у него находится 4 электрона. Значит, максимальная степень окисления титана +4.
Промежуточными степенями окисления считаются значения между минимальной и максимальной степенями окисления в атомах химических элементов.
Определим степень окисления в бинарных соединениях на примере оксидов азота. Более электроотрицательным элементом, к которому смещаются электроны во всех оксидах, является кислород. Как мы помним, минимальная степень окисления кислорода равнa -2, а молекула всегда электронейтральна. Следовательно, произведение степени окисления электроотрицательного элемента на количество атомов по абсолютной величине равно произведению его электроположительного элемента на количество атомов. Таким образом, определяется валентность в соединениях, состоящих из двух элементов, то есть бинарных.
В соединениях более сложного состава необходимо расставить известные степени окисления химических элементов, а неизвестную степень окисления обозначить, например, за «x». Далее так же, как и в бинарных соединениях решаем уравнение с одной неизвестной и получаем ответ по абсолютной величине.
В простых веществах с неполярной ковалентной связью степень окисления равна 0. Степень окисления углерода в органических соединениях определяется у каждого в отдельности, учитывая степень окисления элементов, связанных с ним.
М.А.АХМЕТОВ
Конспект лекций
по общей химии
Продолжение. Начало см. в № 8, 12, 13, 20, 23, 25-26, 40/2004
Глава 5.
Окислительно-восстановительные
реакции
5.1. Определение степени окисления
Окислительно-восстановительными называют
реакции, сопровождающиеся переходом электронов
от одних атомов к другим. О переходе электронов
судят по изменениям степеней окисления атомов.
Если степень окисления атома изменилась, то
изменилось и его электронное окружение.
Существуют два способа определения степеней
окисления атомов: первый – по
брутто-формуле, второй – по
структурной формуле.
При определении степеней окисления атомов
первым способом используют правило: сумма
степеней окисления всех атомов, образующих
частицу, равна заряду частицы. Для молекулы
такая сумма равна нулю, а для иона – его заряду.
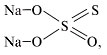
В качестве иллюстрации определим первым
способом степени окисления атомов в тиосульфате
натрия Na2S2О3. Среди элементов,
образующих частицу, наиболее
электроотрицательным является кислород – он и
будет принимать электроны. Поскольку кислород
находится в главной подгруппе VI группы, то для
завершения электронного слоя ему не хватает двух
электронов. Следовательно, атом кислорода примет
два электрона и обретет степень окисления –2.
Самый электроположительный атом – натрий, у
которого на внешнем электронном уровне всего
один электрон (его натрий и отдаст). Эти
рассуждения с учетом формулы тиосульфата натрия
позволяют составить уравнение:
2•(+1) + 2х + 3•(–2) = 0,
решение которого даст значение степени
окисления атома серы (+2).
Можно определить степени окисления атомов в
сложных ионах. В качестве примера рассмотрим
анион . В нем
наиболее электроотрицательный атом кислорода
принимает два электрона и обладает степенью
окисления –2. Степень окисления атома хрома
определяется из уравнения:
2х + 7•(–2) = –2
и равна +6.
Второй способ нахождения степеней окисления
атомов – по структурной формуле – основывается
на определении: степень окисления – это
условный целочисленный заряд, который был бы на
атоме, если бы все его полярные ковалентные связи
стали ионными. Изобразив структурную
формулу тиосульфата натрия
определим степени окисления его атомов.
Атомы натрия, соединенные одинарными связями с
более электроотрицательными атомами кислорода,
естественно, отдадут им свои внешние электроны,
обретя каждый степень окисления +1. Атомы
кислорода, имеющие по две связи с более
электроположительными атомами, условно примут
по два электрона и будут обладать степенью
окисления –2. Из структурной формулы видно, что в
соединении находятся два атома серы в разном
окружении. Один из атомов S соединен только
двойной связью с другим атомом S, и его степень
окисления равна нулю. Второй атом серы имеет
четыре связи с тремя более
электроотрицательными атомами кислорода и,
следовательно, обладает степенью окисления +4.
Средняя степень окисления атомов серы, как и при
определении ее первым способом, равна +2 ((+4+0)/2).
Атом кислорода не всегда имеет степень окисления
–2. Например, в его соединении с атомами фтора он
обладает положительной степенью окисления . В пероксидах
степень окисления каждого атома кислорода равна , в надпероксидах –
лишь , а в
озонидах – даже .
Также у атома серы степень окисления может быть
равна –1, например в дисульфидах . В некоторых оксидах, например Fe3О4
и Pb3O4, cтепени окисления атомов
определяют, исходя из того, что эти оксиды
смешанные: Fe2O3•FeO и PbO2•2PbO
соответственно.
5.2. Составление уравнений
окислительно-восстановительных реакций
Подбор коэффициентов в уравнениях
окислительно-восстановительных реакций
осуществляют, составляя электронный баланс.
Метод подбора, сводящийся к подсчету количеств
атомов в правой и левой частях уравнения, не
всегда гарантирует правильное определение
коэффициентов. Так, в трех приведенных ниже
уравнениях окисления триэтиламина азотной
кислотой содержатся равные количества атомов
углерода, водорода, кислорода и азота в левой и
правой частях, но реализуется только одно из них:
4(С2Н5)3N + 36НNО3 = 24СО2
+ 48Н2О + 6NO2 + 17N2,
2(С2Н5)3N + 78НNО3 = 12СО2
+ 54Н2О + 78NO2 + N2,
(С2Н5)3N + 11НNО3 =
6СО2 + 13Н2О + 4NO2 + 4N2.
Теория окислительно-восстановительного
процесса предполагает передачу электронов от
атомов восстановителя атомам окислителя.
Согласно закону сохранения материи суммарное
количество электронов, отданных
восстановителем, равно суммарному количеству
электронов, принятых окислителем. Этой простой
идеей руководствуются при составлении уравнений
окислительно-восстановительных реакций. Задача
состоит в подборе коэффициентов
пропорциональности, при которых достигается
электронный баланс.
Разберем пример окисления молекулы этилбензола
перманганатом калия в кислой среде при
нагревании. Запишем уравнение реакции и укажем
степени окисления тех атомов, которые изменили
ее, причем их степени окисления в молекулах
этилбензола и бензойной кислоты определим,
пользуясь соответствующими структурными
формулами:
Атом углерода, непосредственно связанный с
бензольным кольцом, изменит степень окисления от
–2 до +3 (отдаст 5 электронов). Атом углерода
метильной группы поменяет степень окисления от
–3 до +4 в диоксиде углерода (отдаст 7 электронов).
В сумме молекула этилбензола отдаст 12
электронов. Атом марганца изменит степень
окисления от +7 до +2 (примет 5 электронов). В таком
случае имеем уравнение:
12х = 5y,
минимальные положительные целочисленные
решения которого равны х = 5, у = 12.
Подбор коэффициентов в уравнениях реакцией
диспропорционирования методом электронного
баланса необходимо осуществлять по правой их
части. В качестве примера разберем
диспропорционирование бертолетовой соли (без
катализатора):
Из изменений степеней окисления атомов в ходе
реакции вытекает, что принял 6 электронов, а
якобы отдал 2 электрона.
Тогда
(КСl) = 3
(КClО4).
Следовательно, необходимо перед перхлоратом
калия KClO4 поставить коэффициент 3:
4КClО3 = КСl + 3КClO4.
5.3. Электролиз
Разложение электролита (в растворе или
расплаве) при прохождении через него
электрического тока называют электролизом.
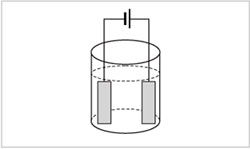
Приборное оформление процесса электролиза
сводится к тому, что два электрода, подключенные
к источнику тока, опускают в сосуд с раствором
или расплавом электролита (рис. 5.1).
|
|
Рис. 5.1.
|
Отрицательно заряженный электрод
называется катодом (к нему притягиваются
катионы), а положительно заряженный электрод – анодом
(он притягивает анионы). Электрическая цепь
замыкается за счет
окислительно-восстановительных процессов,
проходящих на электродах. На катоде происходит
восстановление катионов, а на аноде – окисление
анионов.
Начнем рассмотрение процесса с наиболее
простого случая – электролиза расплавов. При
электролизе расплавов на катоде
восстанавливаются катионы металла до чистого
металла, а на аноде простые анионы окисляются
до простого вещества, например:
2Сl– – 2е = Сl2,
S2– – 2е = S.
Если анион имеет сложное строение, то в этом
случае протекает процесс, требующий наименьших
затрат энергии. Если соль устойчива к нагреванию
и атом элемента в анионе находится в наивысшей
степени окисления, то обычно окисляется кислород
до простого вещества:
– 2е
= SO3 + 1/2О2.
Если атом элемента находится в промежуточной
степени окисления, то наиболее вероятно, что в
этом случае будет окисляться не кислород, а атом
другого элемента в анионе, например:
– e
= NO2.
Электролиз в растворах более сложен с точки
зрения определения продуктов. Связано это с
появлением еще одного компонента – воды. Металлы
со стандартными электродными потенциалами от
–1,67 В (Al) и ниже (находящиеся левее марганца в
ряду напряжений металлов) из водных растворов,
как правило, не восстанавливаются. В таких
системах на катоде выделяется водород. Связано
это прежде всего с тем, что указанные металлы (в
том числе магний и алюминий без защитной окисной
пленки) реагируют с водой. Но это отнюдь не
означает, что электродные процессы типа
Na+ + e = Na
в водных растворах не происходят. Один из
способов получения металлического натрия –
электролиз водного раствора NаСl (рассола). Секрет
данного процесса кроется в использовании
ртутного катода. Восстановившиеся атомы натрия
поглощаются слоем ртути, предохраняющим их от
контакта с водой. Последующее разделение на
компоненты образовавшейся амальгамы натрия
(амальгама – сплав, один из компонентов которого
ртуть) достигается ректификацией.
Освободившаяся ртуть затем возвращается в
рабочий цикл.
О невозможности получения взаимодействующих с
водой металлов посредством электролиза водных
растворов соответствующих электролитов
свидетельствует также следующее рассуждение.
Пусть при электролизе водного раствора на катоде
произошло восстановление кальция:
Са2+ + 2e = Ca.
Металл, восстановившись, вступит в реакцию с
водой:
Са + 2Н2О = Са(ОН)2 + Н2.
Следовательно, вместо металла на катоде
выделится водород.
Металлы со стандартными электродными
потенциалами в интервале от –1,05 В до 0 В
(находящиеся в электрохимическом ряду между
алюминием и водородом) из водных растворов
восстанавливаются параллельно с водородом.
Соотношение продуктов (металл и водород)
определяется концентрацией раствора, его
кислотностью и некоторыми другими факторами
(наличие других, особенно комплексных, солей в
растворе; материал, из которого изготовлен
электрод). Чем выше концентрация соли, тем больше
доля выделившегося металла. Чем более кислая
среда, тем более вероятно выделение
водорода.Металлы с положительными стандартными
электродными
потенциалами (находящиеся в ряду напряжений
металлов правее водорода) выделяются при
электролизе растворов в первую очередь.
Например:
Ag+ + e = Ag.
На аноде при электролизе водных растворов
окисляются все простые анионы, за исключением
фторида. Например:
2I– – 2e = I2.
Фтор нельзя получить электролизом водных
растворов, т.к. он реагирует с водой:
F2 + Н2O = 2НF + 1/2О2.
Если соль, подвергающаяся электролизу,
содержит сложный анион, в котором гетероатом (не
кислород) находится в наивысшей степени
окисления, то в этом случае на аноде образуется
кислород, т.е. происходит разложение воды:
H2O – 2e = 2H+ + 1/2O2.
Источником кислорода может также служить сам
сложный анион:
– 2е
= SO3 + 1/2О2.
Образовавшийся при этом ангидрид кислоты тут
же прореагирует с водой:
SО3 + Н2О = Н2SO4.
Когда гетероатом находится в промежуточной
степени окисления, окисляется он, а не атом
кислорода. Примером такого процесса является
окисление сульфит-иона под действием
электрического тока:
Образующийся при этом серный ангидрид SО3
тут же реагирует с водой.
Анионы карбоновых кислот в результате
электролиза декарбоксилируются, образуя
углеводороды:
2R–COO– – 2e = R–R + 2CO2.
5.4. Направление окислительно-
восстановительных процессов
и влияние на него кислотности среды
Мерой окислительно-восстановительной
способности веществ в водных растворах служат
окислительно-восстановительные или стандартные
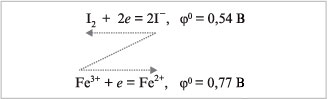
электродные потенциалы. Определим, например,
может ли катион железа Fe3+ окислить анионы
галогенов в KCl, KBr и KI. Зная стандартные
электродные потенциалы (0), можно вычислить
электродвижущую силу (ЭДС) процесса. Она
определяется как разность таких потенциалов
окислителя и восстановителя, причем реакция
протекает при положительном значении ЭДС:
Таблица 5.1
Определение возможности протекания
окислительно-восстановительных процессов
на основе стандартных электродных потенциалов
Табл. 5.1 показывает, что только один из
исследуемых процессов возможен. Действительно,
из всех указанных выше галогенидов калия с
трихлоридом железа реагирует только КI:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl.
Существует и другой простой способ определения
направления процеccа. Если записать одно под
другим два уравнения полуреакций процесса так,
чтобы стандартный электродный потенциал верхней
полуреакции был меньше, чем нижней, то написанная
между ними буква Z (рис. 5.2) укажет своими концами
направления стадий разрешенного процесса
(правило Z).
|
|
Рис. 5.2.
|
Из одних и тех же веществ, изменяя рН
среды, можно получить различные продукты.
Например, перманганат-анион в кислой среде восстанавливается
с образованием соединения марганца(II):
2KMnO4 + 5Na2SO3 + 3H2SO4
= K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
В нейтральной среде образуется диоксид
марганца МnО2:
2КМnО4 + 3Nа2SO3 + H2О
= 2КОН + 2МnО2 + 3Na2SO4.
В щелочной среде перманганат-анион
восстанавливается до манганат-аниона:
2КМnО4 + Nа2SO3 + 2KOH = 2К2MnO4
+ Na2SО4 + H2O.
5.5. Упражнения
1. Определите степени окисления атомов в
следующих соединениях: BaO2, CsO2, RbO3,
F2O2, LiH, F2, C2H5OH,
толуол, бензальдегид, уксусная кислота.
2. Подберите коэффициенты в следующих
уравнениях химических реакций:
КMnО4 + FeSO4 + H2SO4 K2SO4 + MnSО4 +
Fe2(SO4)3 + H2О,
Br– + IO3– +
H+ Br2 + I2 + HO,
PbS + H2O2 PbSO4 + H2О,
NaOCl + KI + H2SO4 I2
+ NaCl + K2SO4 + H2O,
H2S + HNO3 H2SO4 + NO + H2О,
CH2O + К2Сr2O7 + H2SO4
K2SO4 + Cr2(SO4)3
+ CO2 + H2O,
Hg2O Hg + HgO.
3. Запишите уравнения электролиза водных
растворов следующих соединений: хлорида кальция,
сульфита железа(III), бромида меди, ацетата натрия,
гидроксида калия.
4. Закончите составление уравнений
следующих окислительно-восстановительных
реакций:
CuBr + Сl2 … ,
Ca3P2 + Сl2 + H2O … ,
P2O3 + AgNO3 (тв.) … ,
NaHS + NO2 + H2O …
,
толуол + KMnO4 + KOH …
.
Материалы портала onx.distant.ru
ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ
Периодический закон и периодическая система Д. И. Менделеева
Примеры решения задач
Задачи для самостоятельного решения
- почему водород помещают одновременно в первой и в седьмой группах периодической системы;
- почему у некоторых элементов (например, Cr и Cu) происходит «провал» внешнего s – электрона на предвнешнюю d – оболочку;
- что является основным различием в свойствах элементов главных и побочных подгрупп;
- какие электроны являются валентными для элементов главных и побочных подгрупп;
- чем обусловлено неравномерное увеличение энергии ионизации при переходе от Li к Ne;
- какое основание является более сильным: LiOH или KOH; какая кислота сильнее: HCl или HI.
В результате изучения данной темы вы научитесь:
- записывать электронные конфигурации элементов;
- устанавливать электронную структуру атома элемента по его положению в соответствующем периоде и подгруппе периодической системы, а значит, и его свойства;
- из рассмотрения электронной структуры невозбужденных атомов определять число электронов, которые могут участвовать в образовании химических связей, а также возможные степени окисления элементов;
- сравнивать относительную силу кислот и оснований.
Учебные вопросы:
1. Периодический закон Д.И. Менделеева
2. Периодическая система Д.И. Менделеева
3. Периодическая система и электронные конфигурации атомов
4. Типы химических элементов
5. Периодичность свойств атомов элементов
6. Кислотно-основные свойства соединений; схема Косселя
7. Окислительно-восстановительные свойства элементов и их соединений
1. Периодический закон Д.И. Менделеева
Периодический закон – величайшее достижение химической науки, основа всей современной химии. С его открытием химия перестала быть описательной наукой, в ней стало возможным научное предвидение.
Периодический закон открыт Д. И. Менделеевым в 1869 г. Ученый сформулировал этот закон так: «Свойства простых тел, также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
Более детальное изучение строения вещества показало, что периодичность свойств элементов обусловлена не атомной массой, а электронным строением атомов.
Заряд ядра является характеристикой, определяющей электронное строение атомов, а следовательно, и свойства элементов. Поэтому в современной формулировке Периодический закон звучит так: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от порядкового номера (от величины заряда ядра их атомов).
Выражением Периодического закона является периодическая система элементов.
2. Периодическая система Д. И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра. Периоды 1, 2, 3, 4, 5, 6 содержат соответственно 2, 8, 8, 18, 18, 32 элемента. Седьмой период не завершен. Периоды 1, 2 и 3 называют малыми, остальные — большими.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородным газом (Ne, Ar, Kr, Xe, Rn), которому предшествует типичный неметалл. В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства, поскольку с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне.
В первом периоде, кроме гелия, имеется только один элемент — водород. Его условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Сходство водорода со щелочными металлами проявляется в том, что водород, как и щелочные металлы является восстановителем и, отдавая один электрон, образует однозарядный катион. Больше общего у водорода с галогенами: водород, как и галогены неметалл, его молекула двухатомна, он может проявлять окислительные свойства, образуя с активными металлами солеподобные гидриды, например, NaH, CaH2.
В четвертом периоде вслед за Са расположены 10 переходных элементов (декада Sc — Zn), за которыми находятся остальные 6 основных элементов периода (Ga — Кг). Аналогично построен пятый период. Понятие переходный элемент обычно используется для обозначения любого элемента с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположена вставная декада d–элементов (La — Hg), причем после первого переходного элемента La следуют 14 f–элементов — лантаноидов ( Се — Lu). После Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Таким образом, каждый элемент в периодической системе занимает строго определенное положение, которое отмечается порядковым, или атомным, номером.
В периодической системе по вертикали расположены восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные, или подгруппы А и побочные, или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Сходство элементов внутри каждой подгруппы — наиболее заметная и важная закономерность в периодической системе. В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические. При этом происходит увеличение устойчивости соединений элементов в низшей для данной подгруппы степени окисления. В побочных подгруппах – наоборот – сверху вниз металлические свойства ослабевают и увеличивается устойчивость соединений с высшей степенью окисления.
3. Периодическая система и электронные конфигурации атомов
Поскольку при химических реакциях ядра реагирующих атомов не изменяются, то химические свойства атомов зависят от строения их электронных оболочек.
Заполнение электронных слоев и электронных оболочек атомов происходит в соответствии с принципом Паули и правилом Хунда.
Принцип Паули (запрет Паули)
Два электрона в атоме не могут иметь четыре одинаковых квантовых числа (на каждой атомной орбитали может находиться не более двух электронов).
Принцип Паули определяет максимальное число электронов, обладающих данным главным квантовым числом n (т.е. находящихся на данном электронном слое): Nn = 2n2. На первом электронном слое (энергетическом уровне) может быть не больше 2 электронов, на втором – 8, на третьем – 18 и т. д.
В атоме водорода, например, имеется один электрон, который находится на первом энергетическом уровне в 1s – состоянии. Спин этого электрона может быть направлен произвольно (ms = +1/2 или ms = –1/2). Следует подчеркнуть еще раз, что первый энергетический уровень состоит из одного подуровня – 1s, второй энергетический уровень – из двух подуровней – 2s и 2р, третий – из трех подуровней – 3s, 3p, 3d и т.д. Подуровень, в свою очередь, содержит орбитали, число которых определяется побочным квантовым числом l и равно (2l + 1). Каждая орбиталь условно обозначается клеткой, находящийся на ней электрон – стрелкой, направление которой указывает на ориентацию спина этого электрона. Значит, состояние электрона в атоме водорода можно представить как 1s1 или изобразить в виде квантовой ячейки, рис. 1:
1s
Рис. 1. Условное обозначение электрона в атоме водорода на 1s орбитали
Для обоих электронов атома гелия n = 1, l = 0, ml = 0, ms = +1/2 и –1/2. Следовательно, электронная формула гелия 1s2. Электронная оболочка гелия завершена и очень устойчива. Гелий — благородный газ.
Согласно принципу Паули, на одной орбитали не может быть двух электронов с параллельными спинами. Третий электрон в атоме лития занимает 2s-орбиталь. Электронная конфигурация Li: 1s22s1, а у бериллия 1s22s2. Поскольку 2s-орбиталь заполнена, то пятый электрон у атома бора занимает 2р-орбиталь. При n = 2 побочное (орбитальное) квантовое число l принимает значения 0 и 1. При l = 0 (2s-состояние) ml = 0, а при l = 1 (2p – состояние) ml может быть равным +1; 0; –1. Состоянию 2р соответствуют три энергетические ячейки, рис. 2.
1s 2s
2p
Рис. 2. Расположение электронов атома бора на орбиталях
Для атома азота (электронная конфигурация 1s22s22p3 два электрона на первом уровне, пять — на втором) возможны два следующих варианта электронного строения, рис. 3:
1s 2s
2p
1s
2s
2p
а б
Рис. 3. Возможные варианты расположения электронов атома азота на орбиталях
В первой схеме, рис. 3а, суммарный спин равен 1/2 (+1/2 –1/2 +1/2), во второй (рис. 3б) суммарный спин равен 3/2 (+1/2 +1/2 +1/2).
Расположение спинов определяется правилом Хунда, которое гласит: заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным.
Таким образом, из двух приведенных схем строения атома азота устойчивому состоянию (с наименьшей энергией) отвечает первая, где все р-электроны занимают различные орбитали. Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами.
Начиная с натрия, заполняется третий энергетический уровень с n = 3.
В атоме каждый электрон занимает свободную орбиталь с наиболее низкой энергией, отвечающей его наибольшей связи с ядром. В 1961 г. В.М. Клечковский сформулировал общее положение, согласно которому энергия электронных орбиталей возрастает в порядке увеличения суммы главного и побочного квантовых чисел (n + l), причем в случае равенства этих сумм, меньшей энергией обладает орбиталь с меньшим значением главного квантового числа n .
Последовательность энергетических уровней в порядке возрастания энергии примерно следующая:
1s < 2s < 2p < 3s < 3р < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4f < 6p
Можно представить энергетический ряд орбиталей в виде схемы:
Рассмотрим распределение электронов на орбиталях атомов элементов четвертого периода. Строение атома калия:
+19K 1s22s22p63s23p64s1 1s 2s
2p
3s
3p
4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s2 [Ar] 4s
После калия (электронная конфигурация 1s22s22p63s23p64s1) и кальция (электронная конфигурация 1s22s22p63s23p64s2) происходит заполнение электронами внутренней 3d-оболочки (переходные элементы Sc — Zn). Следует отметить существование двух аномалий: у атомов Сr и Сu на 4 s -оболочке находятся не два электрона, а один, т.е. происходит так называемый «провал» внешнего 4s-электрона на предшествующую 3d-оболочку. Электронное строение атома хрома можно представить следующим образом (рис. 4).
+24Cr [Ar]3d54s1 [Ar] 4s 3d
Рис. 4. Распределение электронов по орбиталям для атома хрома
Физическая причина «нарушения» порядка заполнения связана с различной проникающей способностью электронных орбиталей к ядру, особой устойчивостью электронных конфигураций d5 и d10, f7 и f14, отвечающих заполнению электронных орбиталей одним или двумя электронами, а также экранирующим действием внутренних электронных слоев заряда ядра.
Электронные конфигурации атомов Mn, Fe, Co, Ni, Cu и Zn отражены следующими формулами:
25Mn 1s22s22p63s23p63d54s2
26Fe 1s22s22p63s23p63d64s2
27Co 1s22s22p63s23p63d74s2
28Ni 1s22s22p63s23p63d84s2
29Cu 1s22s22p63s23p63d104s1
30Zn 1s22s22p63s23p63d104s2
После цинка, начиная с 31 элемента — галлия вплоть до 36 элемента — криптона продолжается заполнение четвертого слоя (4р – оболочки). Электронные конфигурации этих элементов имеют следующий вид:
31Ga 1s22s22p63s23p63d104s24p1
32Ge 1s22s22p63s23p63d104s24p2
33As 1s22s22p63s23p63d104s24p3
34Se 1s22s22p63s23p63d104s24p4
35Br 1s22s22p63s23p63d104s24p5,
36Kr 1s22s22p63s23p63d104s24p6
Следует отметить, что если не нарушается запрет Паули, в возбужденных состояниях электроны могут располагаться на других орбиталях атомов.
4. Типы химических элементов
Все элементы периодической системы подразделяются на четыре типа:
1. У атомов s–элементов заполняются s–оболочки внешнего слоя (n). К s–элементам относятся водород, гелий и первые два элемента каждого периода.
2. У атомов р–элементов электронами заполняются р–оболочки внешнего уровня (np). К р -элементам относятся последние 6 элементов каждого периода (кроме первого).
3. У d–элементов заполняется электронами d–оболочка второго снаружи уровня (n–1) d . Это элементы вставных декад больших периодов, расположенных между s– и p– элементами.
4. У f–элементов заполняется электронами f–подуровень третьего снаружи уровня (n–2) f . К семейству f–элементов относятся лантаноиды и актиноиды.
Из рассмотрения электронной структуры невозбужденных атомов в зависимости от порядкового номера элемента следует:
-
Число энергетических уровней (электронных слоев) атома любого элемента равно номеру периода, в котором находится элемент. Значит, s–элементы находятся во всех периодах, р–элементы – во втором и последующих, d–элементы – в четвертом и последующих и f–элементы – в шестом и седьмом периодах.
-
Номер периода совпадает с главным квантовым числом внешних электронов атома.
-
s– и p–элементы образуют главные подгруппы, d–элементы – побочные подгруппы, f–элементы образуют семейства лантаноидов и актиноидов. Таким образом, подгруппа включает элементы, атомы которых обычно имеют сходное строение не только внешнего, но и предвнешнего слоя (за исключением элементов, в которых имеет место «провал» электрона).
-
Номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом состоит физический смысл номера группы. У элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних оболочек. Это является основным различием в свойствах элементов главных и побочных подгрупп.
Элементы с валентными d– или f–электронами называются переходными.
Номер группы, как правило, равен высшей положительной степени окисления элементов, проявляемой ими в соединениях. Исключением является фтор – его степень окисления равна –1; из элементов VIII группы только для Os, Ru и Xe известна степень окисления +8.
5. Периодичность свойств атомов элементов
Такие характеристики атомов, как их радиус, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронным строением атома.
Различают радиусы атомов металлов и ковалентные радиусы атомов неметаллов. Радиусы атомов металлов вычисляются на основе межатомных расстояний, которые хорошо известны для большинства металлов на основе экспериментальных данных. При этом радиус атома металла равен половине расстояния между центрами двух соседних атомов. Аналогичным образом вычисляются ковалентные радиусы неметаллов в молекулах и кристаллах простых веществ. Чем больше атомный радиус, тем легче отрываются от ядра внешние электроны (и наоборот). В отличие от атомных радиусов, радиусы ионов – условные величины.
Слева направо в периодах величина атомных радиусов металлов уменьшается, а атомных радиусов неметаллов изменяется сложным образом, так как она зависит от характера химической связи. Во втором периоде, например, радиусы атомов сначала уменьшаются, а затем возрастают, особенно резко при переходе к атому благородного газа.
В главных подгруппах радиусы атомов увеличиваются сверху вниз, так как возрастает число электронных слоев.
Радиус катиона меньше радиуса соответствующего ему атома, причем с увеличением положительного заряда катиона его радиус уменьшается. Наоборот, радиус аниона всегда больше радиуса соответствующего ему атома. Изоэлектронными называют частицы (атомы и ионы), имеющие одинаковое число электронов. В ряду изоэлектронных ионов радиус снижается с уменьшением отрицательного и возрастанием положительного радиуса иона. Такое уменьшение имеет место, например в ряду: O2–, F–, Na+, Mg2+, Al3+.
Энергия ионизации– энергия, необходимая для отрыва электрона от атома, находящегося в основном состоянии. Она обычно выражается в электронвольтах (1 эВ = 96,485 кДж/моль). В периоде слева направо энергия ионизации возрастает с увеличением заряда ядра. В главных подгруппах сверху вниз она уменьшается, т. к. увеличивается расстояние электрона до ядра и возрастает экранирующее действие внутренних электронных слоев.
В таблице 1 приведены значения энергий ионизации (энергий отрыва первого, второго и т.д. электронов) для некоторых атомов.
Во втором периоде при переходе от Li к Ne энергия отрыва первого электрона возрастает (см. таблицу 1). Однако, как видно из таблицы, энергия ионизации возрастает неравномерно: у следующих за бериллием и азотом соответственно бора и кислорода наблюдается ее некоторое уменьшение, что обусловлено особенностями электронного строения атомов.
Внешняя s–оболочка бериллия полностью заполнена, поэтому у следующего за ним бора электрон поступает на р-орбиталь. Этот р-электрон менее прочно связан с ядром, чем s–электрон, поэтому отрыв р–электронов требует меньшей затраты энергии.
Таблица 1.
Энергии ионизации I атомов некоторых элементов
|
Атом |
I , эВ |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
Н Не Li Be В С N О F Ne Na Mg Al Si P S Cl Ar К Ca |
13,595 24,581 5,390 9,320 8,296 11,256 14,53 13,614 17,418 21,559 5,138 7,644 5,984 8,149 10,484 10,357 13,01 15,755 4,339 6,111 |
54,403 75,619 18,206 25,149 24,376 29,593 35,146 34,98 41,07 47,29 15,031 18,823 16,34 19,72 23,4 23,80 27,62 31,81 11,868 |
122,419 153,850 37,920 47,871 47,426 54,934 62,646 63,5 71,65 80,12 28,44 33,46 30,156 35,0 39,90 40,90 46,0 51,21 |
217,657 259,298 64,48 77,450 77,394 87,23 97,16 98,88 109,29 119,96 45,13 51,354 47,29 53,5 59,79 60,90 67,0 |
340,127 392,00 97,863 113,873 114,214 126,4 138,60 141,23 153,77 166,73 65,007 72,5 67,80 75,0 82,6 84,39 |
На каждой р-орбитали атома азота имеется по одному электрону. У атома кислорода электрон поступает на р-орбиталь, которая уже занята одним электроном. Два электрона, находящиеся на одной и той же орбитали, сильно отталкиваются, поэтому оторвать электрон от атома кислорода легче, чем от атома азота.
Наименьшее значение энергии ионизации имеют щелочные металлы, поэтому они обладают ярко выраженными металлическими свойствами, наибольшая величина энергии ионизации у инертных газов.
Сродство к электрону– энергия, выделяющаяся при присоединении электрона к нейтральному атому. Сродство к электрону, как и энергию ионизации, обычно выражают в электронвольтах. Наибольшее сродство к электрону – у галогенов, наименьшее – у щелочных металлов. В таблице 2 приведены значения сродства к электрону для атомов некоторых элементов.
Таблица 2.
Сродство к электрону атомов некоторых элементов
|
Атом |
Е, эВ |
Атом |
Е, эВ |
Атом |
Е, эВ |
Атом |
Е, эВ |
|
Н Не Li Be В |
0,754 0 0,620 0 0,28 |
С N О F Ne |
1,268 -0,07 1,46 3,398 0 |
Na Mg Al Si P |
0,546 0 0,46 1,385 0,074 |
S Cl Br I Se |
2,077 3,615 3,364 3,061 2,020 |
Электроотрицательность – способность атома в молекуле или ионе притягивать к себе валентные электроны других атомов. Электроотрицательность (ЭО) как количественная мера – приближенная величина. Предложено около 20 шкал электроотрицательностей, наибольшее признание из которых получила шкала, разработанная Л. Полингом. На рис. 5 приведены значения ЭО по Полингу.
Рис. 5. Электроотрицательность элементов (по Полингу)
Наиболее электроотрицательным из всех элементов по шкале Полинга является фтор. Его ЭО принята равной 4. Наименее электроотрицательный – цезий. Водород занимает промежуточное положение, поскольку при взаимодействии с одними элементами он отдает электрон, а при взаимодействии с другими – приобретает.
6. Кислотно-основные свойства соединений; схема Косселя
Для объяснения характера изменения кислотно-основных свойств соединений элементов Коссель (Германия) предложил использовать простую схему, основанную на предположении о том, что в молекулах существует чисто ионная связь и между ионами имеет место кулоновское взаимодействие. Схема Косселя описывает кислотно-основные свойства соединений, содержащих связи Э-Н и Э-О-Н, в зависимости от заряда ядра и радиуса образующего их элемента.
Схема Косселя для двух гидроксидов металлов, например, LiOH и KOH показана на рис. 7.
Рис. 7. Схема Косселя для LiOH и KOH
Как видно из представленной схемы, радиус иона Li+ меньше радиуса иона К+ и ОН— –группа связана прочнее с катионом лития, чем с катионом калия. В результате КОН будет легче диссоциировать в растворе и основные свойства гидроксида калия будут выражены сильнее.
Аналогичным образом можно проанализировать схему Косселя для двух оснований CuOH и Cu(OH)2. Поскольку радиус иона Cu2+ меньше, а заряд – больше, чем у иона Cu+, ОН— -группу будет прочнее удерживать ион Cu2+. В результате основание Cu(OH)2 будет более слабым, чем CuOH.
Таким образом, сила оснований возрастает при увеличении радиуса катиона и уменьшении его положительного заряда .
В главных подгруппах сверху вниз сила оснований увеличивается, поскольку в этом направлении возрастают радиусы ионов элементов. В периодах слева направо происходит уменьшение радиусов ионов элементов и увеличение их положительного заряда, поэтому в этом направлении сила оснований уменьшается.
Схема Косселя для двух бескислородных кислот, например, HCl и HI показана на рис. 8
Рис. 8. Схема Косселя для HCl и HI
Поскольку радиус хлорид-иона меньше, чем иодид-иона, ион Н+ прочнее связан с анионом в молекуле хлороводородной кислоты, которая будет слабее, чем иодоводородная кислота. Таким образом, сила бескислородных кислот возрастает с увеличением радиуса отрицательного иона .
Сила кислородсодержащих кислот изменяется противоположным образом. Она увеличивается с уменьшением радиуса иона и увеличением его положительного заряда. Рассмотрим схему Косселя для двух кислот HClO и HClO4.
| Кислота | Заряд хлора | Сила кислоты |
| HClO | +1 | Слабая кислота |
| HClO4 | +7 | Сильная кислота |
Ион Сl7+ прочно связан с ионом кислорода, поэтому протон легче будет отщепляться в молекуле НСlО4. В то же время связь иона Сl+ с ионом О2- менее прочная, и в молекуле НСlО протон будет сильнее удерживаться анионом О2-. В результате HClO4 будет более сильной кислотой, чем HClO.
Достоинством схемы Косселя является то, что она с использованием простой модели позволяет объяснить характер изменения кислотно-основных свойств соединений в ряду сходных веществ. Вместе с тем эта схема является чисто качественной. Она позволяет лишь сравнивать свойства соединений и не дает возможность определить кислотно-основные свойства произвольно выбранного одного соединения. Недостатком этой модели является то, что в ее основу положены только электростатические представления, в то время как в природе не существует чистой (стопроцентной) ионной связи.
7. Окислительно-восстановительные свойства элементов и их соединений
Изменение окислительно-восстановительных свойств простых веществ легко установить, рассматривая характер изменения электроотрицательности соответствующих элементов. В главных подгруппах сверху вниз электроотрицательность уменьшается, что приводит к уменьшению окислительных и увеличению в этом направлении восстановительных свойств. В периодах слева направо электроотрицательность возрастает. В результате в этом направлении восстановительные свойства простых веществ уменьшаются, а окислительные – возрастают. Таким образом, сильные восстановители располагаются в левом нижнем углу периодической системы элементов (калий, рубидий, цезий, барий), в то время как сильные окислители находятся в правом верхнем ее углу (кислород, фтор, хлор).
Окислительно-восстановительные свойства соединений элементов зависят от их природы, величины степени окисления элементов, положения элементов в периодической системе и ряда других факторов.
В главных подгруппах сверху вниз окислительные свойства кислородсодержащих кислот, в которых атомы центрального элемента имеют одинаковую степень окисления, уменьшаются. Сильными окислителями являются азотная и концентрированная серная кислоты. Окислительные свойства проявляются тем сильнее, чем больше положительная степень окисления элемента в соединении. Сильные окислительные свойства проявляют перманганат калия и дихромат калия.
В главных подгруппах восстановительные свойства простых анионов увеличиваются сверху вниз. Сильными восстановителями являются HI, H2S, иодиды и сульфиды.
Примеры решения задач
Пример 1. Составьте электронные формулы атомов в основном состоянии для следующих элементов: фосфор(15), кальций(20) и титан(22). В скобках указан порядковый номер элемента.
Решение. Фосфор находится в главной подгруппе пятой группы и в третьем периоде. Общее число электронов у этого атома равно 15, и они расположены на трех электронных слоях. Первые два электронных слоя атома фосфора заполнены полностью (электронная конфигурация атома Ne: 1s22s22p6 ), число электронов на третьем слое у фосфора равно номеру группы. Из этих электронов два располагаются на 3s-орбитали, а 3 – на 3р. Таким образом, электронная формула атома фосфора имеет вид:
15Р 1s22s22p63s23p3
Для составления электронной формулы атома кальция к электронной конфигурации атома Ar (1s22s22p63s23p6) необходимо добавить два электрона, которые располагаются на 4s–орбитали. В результате получаем следующую электронную формулу:
20Ca 1s22s22p63s23p64s2
Элемент титан расположен в побочной подгруппе 4 группы элементов и в четвертом периоде. Он относится к переходным элементам четвертого периода, у которых происходит заполнение 3d–оболочки, на которой находятся 2 электрона. Общее число электронов у атома титана равно 22. Для составления электронной формулы титана к электронной формуле кальция необходимо добавить два d–электрона ( 3d2 ):
22Ti 1s22s22p63s23p63d24s2
Пример 2. Определите тип (s, p, d, f) следующих элементов: марганец (25), стронций(38), церий(58) и свинец(82). В скобках указан порядковый номер элемента.
Решение. К s-элементам относятся первые два элемента — водород и гелий, а также элементы, находящиеся в главных подгруппах 1-й и 2-й групп элементов (подгруппа лития и подгруппа бериллия). Среди представленных элементов в эту категорию попадает стронций(38) . В главных подгруппах третьей-восьмой групп находятся р-элементы. В нашем случае это свинец(82) . Вставные декады элементов, образующие побочные подгруппы, относятся к типу d-элементов. Среди рассматриваемых элементов к этому типу относится марганец(25) . Наконец, находящиеся в шестом и седьмом периодах вставки из 14 элементов, следующие за лантаном(57) и актинием(89), относятся к f–элементам. Таким образом, f-элементом является церий(58) . Полученные данные представляем в виде таблицы.
|
Элемент |
Тип элемента |
|
Стронций (38) |
s |
|
Свинец (82) |
p |
|
Марганец (25) |
d |
|
Церий (58) |
f |
Пример 3. Расположите элементы в порядке увеличения их радиусов: Mg (12), Al (13), K (19), Ca (20). В скобках указан порядковый номер элемента.
Решение. Для элементов главных подгрупп радиусы атомов увеличиваются сверху вниз. В периодах же слева направо происходит уменьшение радиусов атомов. Таким образом, наименьший радиус будет иметь атом алюминия, а наибольший – атом калия. Радиус атома кальция меньше атома калия, но больше атома магния. В результате получаем следующий ряд, в котором элементы расположены в порядке увеличения радиуса: Al (13), Mg (12), Ca (20), K (19).
Пример 4. Используя схему Косселя определите, какое основание сильнее CsOH или Ba(OH)2.
Решение. Согласно схеме Косселя у более сильного основания радиус катиона должен быть больше, а заряд – меньше. В этом случае гидроксильная группа слабее удерживается катионом и легче происходит разрыв связи Э–ОН. В рассматриваемом случае радиус иона Cs+ больше, а заряд меньше чем у иона Ba2+ . Таким образом CsOH сильнее, чем Ba(OH)2 .
Пример 5. Используя схему Косселя определите, какая кислота является более сильной H2S или H2Se.
Решение. Сила бескислородных кислот увеличивается с ростом радиуса отрицательного иона, поскольку более крупному иону труднее удержать ион водорода. Поскольку радиус иона Se2– больше, чем иона S2– , H2Se сильнее, чем H2S.
Задачи для самостоятельного решения
| 1. | Составьте электронные формулы следующих элементов: магний (12), хлор (17) и железо (26). В скобках указан порядковый номер элемента.
12Mg: 1s22s22p63s2, |
||||||||||
| 2. | Определите тип (s, p, d, f) следующих элементов: галлий (31), технеций (43), европий (63) и радий (88). В скобках указан порядковый номер элемента.
|
||||||||||
| 3. | Расположите атомы элементов в порядке увеличения их радиусов: B (5), N (7), Si (14), P (15). В скобках указан порядковый номер элемента.
Радиусы атомов увеличиваются в ряду: N (7), B (5), P (15), Si (14). |
||||||||||
| 4. | Используя схему Косселя определите, какое основание сильнее Fe(OH)2 или Fe(OH)3.
Fe(OH)2 более сильное основание, чем Fe(OH)3. |
||||||||||
| 5. | Используя схему Косселя определите, какая кислота является более сильной H2SO3 или H2SeO3.
H2SO3 более сильная кислота, чем H2SeO3 |
Валентность
Валентность (лат. valere — иметь значение) — мера «соединительной способности» химического элемента, равная числу индивидуальных
химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы

Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю
вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.

В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном
состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для
полного понимания.

Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди,
железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие
элементы — с постоянной валентностью.

Запомните, что у некоторых простых веществ валентность принимает значения: III — у азота, II — кислорода. Подведем итог полученным знаниям,
написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.

Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N — III
- O — II
- H, Na, K, Li — I
- S — VI
- C — III (в угарном газе CO, так как одна связь образована по донорно-акцепторному механизму), IV (в углекислом газе CO2 и карбонате натрия Na2CO3)
- Fe — II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной
реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны,
образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд «+», а другим «-«. Это связано с электроотрицательностью —
способностью атома притягивать к себе электроны. Знак «+» означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное
понятие.

Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент
принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток —
получает знак «+».

Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2,
KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 
степеней окисления должно заменить даже самую развитую интуицию 

Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких
электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют
разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.