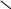В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
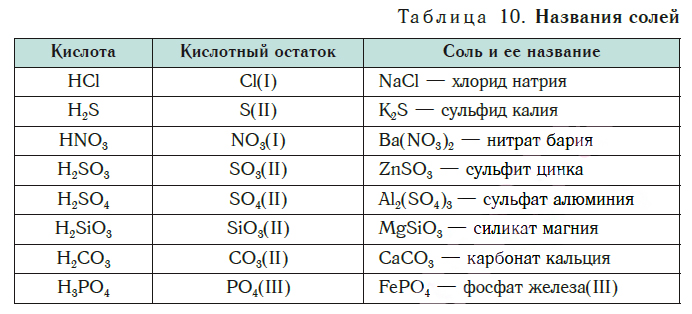
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Соли можно рассматривать как продукты, полученные путём замещения атомов водорода в кислотах на металлы или ионы аммония, или гидроксогрупп в основаниях на кислотные остатки. В зависимости от этого выделяют средние, кислые и основные соли. Рассмотрим, как составить формулы этих солей.
Средние соли
Средними или нормальными называют те соли, в которых присутствуют только атомы металлов и кислотные остатки. Их рассматривают как продукты полного замещения атомов H в кислотах или ОН− групп в основаниях.
Составим формулу средней соли, образованной фосфорной кислотой H3PO4 и основанием Ca(OH)2. Для этого на первом месте запишем формулу металла, а на втором — кислотного остатка. Металл в данном случае — Ca, остаток — PO4.
Далее определим валентности этих частиц. Кальций, будучи металлом второй группы, двухвалентен. Валентность остатка трёхосновной фосфорной кислоты равна трём. Запишем эти значения римскими цифрами над формулами частиц: для элемента Ca – а II, а для PO4 –III.
Если полученные значения сокращаются на одно и то же число, то предварительно производим сокращение, если нет — сразу записываем их арабскими цифрами накрест. То есть индекс 2 пишем у фосфата, а 3 — у кальция. Получаем: Ca3(PO4)2
Ещё проще воспользоваться значениями зарядов этих частиц. Они записаны в таблице растворимости. У Ca – 2+, а у PO4 – 3-. Остальные действия будут теми же, что и при составлении формул по валентности.
Кислые и основные соли
Теперь составим формулу кислой соли, образованной этими же веществами. Кислыми называют соли, в которых не все атомы H из соответствующей кислоты замещены металлами.
Предположим, что из трех атомов H в фосфорной кислоте только два замещены катионами металлов. Составление формулы вновь начинаем с записи металла и кислотного остатка.
Валентность остатка HPO4 равна двум, так как в кислоте H3PO4 заместили два атома H. Записываем значения валентностей. В этом случае II и II сокращаются на 2. Индекс 1, как уже было сказано выше, в формулах не указывают. Получаем в итоге формулу CаHPO4
Можно воспользоваться и значениями зарядов. Величину заряда частицы HPO4 определяем следующим образом: заряд H равен 1+, заряд PO4 — 3-. Итого в сумме +1 + (-3) = -2. Запишем полученные значения над символами частиц: 2 и 2 сокращаются на 2, индекс 1 в формулы солей не записывают. В итоге получается формула CaHPO4 — гидрофосфат кальция.
Если при образовании соли не все группы ОН- в основании замещены на кислотные остатки, соль называют основной.
Запишем формулу основной соли, образованной серной кислотой (H2SO4) и гидроксидом магния(Mg(OH)2).
Из определения следует, что в состав основной соли входит кислотный остаток. В данном случае это SO4. Валентность его равна II, заряд 2-. Вторая частица — это продукт неполного замещения групп ОН в основании, то есть MgOH. Его валентность равна I (убрали одну одновалентную группу ОН), заряд +1 ( сумма зарядов Mg 2+ и ОН −.
Обратите внимание на названия кислых и основных солей. Их называют так же, как и нормальные, только с добавлением приставки «гидро» к названию кислой соли и «гидроксо» к основной.
Двойные и комплексные соли
Двойными называют соли, в которых один кислотный остаток соединен с двумя металлами. Например, в составе алюмокалиевых квасцов на один сульфат-ион приходится ион калия и ион алюминия. Составим формулу:
- Запишем формулы всех металлов и кислотного остатка: KAl SO4.
- Проставим заряды: K (+), Al (3+) и SO4 (2-). В сумме заряд катионов 4+, а анионов — 2-. Сокращаем 4 и 2 на 2.
- Записываем итог: KAl(SO4)2 — сульфат алюминия-калия.
Комплексные соли содержат комплексный анион или катион: Na[Al(OH)4] — тетрагидроксоалюминат натрия, [Cu(NH3)2]Cl — хлорид диамминмеди (II). Подробнее комплексные соединения будут рассмотрены в отдельной главе.
Подведем итог. Формулы солей, так же, как и формулы кислот, содержат в своем составе кислотный остаток. Обязательно в составе соли должны присутствовать катионы металлов или аммония. В формулах кислых или средних солей содержатся катионы Н+ или анионы ОН- соответственно. В комплексных солях катион либо анион представляют собой комплекс из металла и лигандов. Здесь можно прочитать также про химические свойства солей и химические свойства кислот.
Методическая
разработка:
«Алгоритм
составления названий и формул солей».
При изучении химии в 8
классе учащиеся сталкиваются с затруднениями в названии химических веществ и
составления формул химических соединений. Для лучшего усвоения данного
материала им помогут «Алгоритмы» — краткая запись последовательности действий.
При составлении
названий и формул солей необходимо знать состав и название кислот, и
соответственно название кислотных остатков, входящих в эти кислоты. Для
удобства, они указаны в данной разработке.
Названия
кислот и кислотных остатков этих кислот, образующих соли.
—
HCl соляная
кислота Cl хлорид
—
HF фтороводородная
кислота F фторид
—
HBr бромоводородная
кислота Br бромид
—
HI иодоводородная
кислота I иодид
2-
H2S
сероводородная кислота S сульфид
2-
H2SO3
сернистая кислота SO3
сульфит
2-
H2SO4
серная
кислота SO4
сульфат
—
HNO3
азотная кислота NO3 нитрат
—
HNO2
азотистая кислота NO2
нитрит
2-
H2CO3
угольная
кислота CO3
карбонат
2-
H2SiO3
кремниевая
кислота SiO3 силикат
3-
H3PO4
фосфорная кислота PO4
фосфат
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные
химические соединения, состоящие из ионов металла, связанного с ионами
кислотного остатка.
При составлении
названия соли, совершаются поочередно следующие шаги:
1. Называется
кислотный остаток, который стоит в формуле соли в конце.
2. Называется
металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если
заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4
сульфат меди (II) NaCl хлорид
натрия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем
химические символы металла и кислотного остатка, образующих соль. Металл
записываем перед кислотным остатком.
2. Над
хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим
Наименьшее Общее Кратное между зарядами ионов.
4. НОК
делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим
полученные при расчете индексы справа, внизу возле химических элементов. Если
кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за
скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe
NO3
2.
3+
_
Fe NO3
3.
3
3+
—
Fe NO3
4. 3
: 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат
алюминия
1. Al
SO4
2. 3+
2-
Al
SO4
3.
6
3+
2-
Al SO4
4. 6
:3 = 2 , 6 :2 = 3
5. Al2(SO4)3
Правила
составления формул кислых солей по
названию.
Чтобы
научиться составлять формулы кислых
солей необходимо уметь составлять
формулы средних солей по кислотным
остаткам соответствующих кислот (см. §
1).
Пример
1:
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидрофосфат
калия
KHPO4
Приставка
ГИДРО означает, что соль кислая,
поэтому, в составе кислотного остатка
1 атом Н (атом водорода).Название
ФОСФАТ означает, что это соль фосфорнойкислоты,
поэтому, в составе кислотного остатка
группаPO4
2)
Проставьте валентность над символами
металла и кислотного остатка, например,
для указанных выше веществ:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидрофосфат
калия
I
IIKHPO4
Валентность
калия равна I , так как калий элементI
группы главной подгруппы.Валентность
кислотного остатка HPO4
определяетсяпо
разности атомов водорода в кислоте
и кислотномостатке:
H3PO4
HPO43
-1 = II
3)
Найдите наименьшее общее кратное (НОК)
— самое маленькое число, которое можно
разделить на обе валентности и получить
целые числа. Наименьшее общее кратное
(НОК) разделите на каждую из валентностей
и проставьте ИНДЕКСЫ ( цифры внизу справа
у символа элемента) в формулу.
-
Выполненное
действие:Пояснения:
НОК
= 2I
IIK2HPO4
2
: I = 2 2 : II = 1единицу не
пишутСамое
маленькое число, делящаеся на обе
валентностит.е.
на II и на I это 2.Разделив
2 на обе валентности, получаем индексы,которые
записываем справа внизу от знака
элементаи
кислотного остатка.
¾
10 ¾
Пример
2:
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:
дигидрофосфат
кальция
СаH2PO4
Приставка
ДИГИДРО означает, что соль кислая и
имеетв
составе кислотного остатка 2 атома Н“ДИ”
означает ДВА (атома водорода)Название
ФОСФАТ означает, что это соль фосфорнойкислоты,
поэтому, в составе кислотного остатка
группаPO4
2)
Проставьте валентность над символами
металла и кислотного остатка, например,
для указанных выше веществ:
-
Название
вещества:
Выполненное
действие:
Пояснения:
дигидрофосфат
калия
II
IСаH2PO4
Валентность
кальция равна II , так как кальций
элементII
группы главной подгруппы.Валентность
кислотного остатка H2PO4
определяетсяпо
разности атомов водорода в кислоте
и кислотномостатке:
H3PO4
H2PO43
-2 = I
3)
Найдите наименьшее общее кратное (НОК)
— самое маленькое число, которое можно
разделить на обе валентности и получить
целые числа. Наименьшее общее кратное
(НОК) разделите на каждую из валентностей
и проставьте ИНДЕКСЫ ( цифры внизу справа
у символа элемента) в формулу.
-
Выполненное
действие:Пояснения:
НОК
= 2II
IСа(H2PO4)2
2
: II = 1 2 : I = 2кислотный
остатокнадо
взять в скобки, т.к.результат
делениябольше
1Самое
маленькое число, делящаеся на обе
валентности,т.е.
на II и на I это 2.Разделив
2 на обе валентности, получаем индексы,которые
записываем справа внизу от знака
элементаи
кислотного остатка.
¾
11 ¾
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Соли: классификация, номенклатура, способы получения
«Не в количестве знаний заключается образование,
а в полном понимании и искусном применении того, что знаешь»
А. Дистервег (немецкий педагог)
Мы живем с вами в мире веществ и их превращений, поэтому должны знать не только состав и применение веществ, но и влияние их на организм человека и окружающий нас мир.
С некоторыми классами веществ вы уже знакомы и сегодня приступим к изучению соединений нового класса –солей.
I. Понятие о солях
Такие вещества, как мрамор, известняк, сода, поташ, поваренная соль, адский камень, квасцы и нашатырь, известны людям ещё с древних времён. Однако первые теоретические представления о сходстве их состава возникли только в XVII веке. Именно в это время такие учёные, как Я. Ван Гельмонт (1580–1644), О. Тахений (1620–1699) и Г. Руэль (1703–1770), развили представление о том, что существует отдельный класс веществ — соли, которые можно рассматривать как продукт взаимодействия кислот с основаниями.
Соли — сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков.
Составление формул солей:
II. Классификация солей
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля (1703–1770). Именно он в 1754 г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
|
Средние |
Кислые |
Основные |
Двойные |
Смешанные |
Комплексные |
|
Соли, в состав которых входят металл и кислотный остаток |
Соли, в состав которых, кроме металла и кислотного остатка, входят атомы водорода |
Соли, в состав которых, кроме металла и кислотного остатка, входят гидроксогруппы ОН |
Продукты полного замещения атомов водорода двух- или многоосновной кислоты двумя различными металлами |
||
|
Na2SO4 |
NaHSO4 |
Mg(OH)Cl |
K2NaPO4 |
Ca-OCl2 |
Na[Al(OH)4] |
III. Названия солей
- Для средней соли — название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью. В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония NH4(валентность I).
Na2SO4— сульфат натрия,
CuSO4— сульфат меди (II)
- Для кислой соли – «гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обратите внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
NaHSO4 – гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
- Для основной соли –«гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
Mg(OH)Cl — гидроксохлорид магния
Fe(OH)(NO3)2 — гидроксонитрат железа(III);
Fe(OH)2NO3 — дигидроксонитрат железа(III).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди(II) (CuOH)2CO3, образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Кроме принятых в науке названий, для многих солей в широком обиходе сохраняются тривиальные названия, то есть названия, которые были присвоены веществам до того, как учёные установили единую номенклатуру.
Тривиальные названия большей частью связаны либо с какими-то особыми свойствами веществ, либо с областями их применения. Многие из этих названий были присвоены солям алхимиками. В таблице приведены обобщённые сведения о наиболее часто встречающихся в литературе тривиальных названиях солей.
|
Тривиальное название соли |
Химическая формула соли |
Систематическое название соли |
| Адский камень | AgNO3 | нитрат серебра |
| Алебастр | CaSO4⋅0,5H2O | гемигидрат сульфата кальция |
| Берлинская лазурь | KFe[Fe(CN)6] | гексацианоферрат(II) железа(III)-калия |
| Бланфикс | BaSO4 | сульфат бария |
| Бура | Na2B4O7⋅10H2O | декагидрат тетрабората натрия |
| Бура ювелирная | Na2B4O7⋅5H2O | пентагидрат тетрабората натрия |
| Гипс | CaSO4⋅2H2O | дигидрат сульфата кальция |
| Гипс жжёный | CaSO4⋅0,5H2O | полугидрат сульфата кальция |
| Гипс строительный | CaSO4⋅0,5H2O | гемигидрат сульфата кальция |
| Золото сусальное | SnS2 | сульфид олова(IV) |
| Квасцы железоаммонийные | NH4Fe(SO4)2⋅12H2O | додекагидрат сульфата железа(III)-аммония |
| Купорос медный | CuSO4⋅5H2O | пентагидрат сульфата меди(II) |
| Ляпис | AgNO3 | нитрат серебра |
| Марганцовка | KMnO4 | перманганат калия |
| Мел | CaCO3 | карбонат кальция |
| Нашатырь | NH4Cl | хлорид аммония |
| Патина | (CuOH)2CO3 | гидроксокарбонат меди(II) |
| Поташ | K2CO3 | карбонат калия |
| Преципитат | CaHPO4⋅2H2O | дигидрат гидрофосфата кальция |
| Растворимое стекло | Na2SiO3⋅9H2O | нонагидрат силиката натрия |
| Свинцовый сахар | (CH3COO)2Pb⋅3H2O | тригидрат ацетата свинца(II) |
| Селитра аммиачная (аммонийная) | NH4NO3 | нитрат аммония |
| Селитра калийная (индийская) | KNO3 | нитрат калия |
| Селитра кальциевая (норвежская) | Ca(NO3)2 | нитрат кальция |
| Селитра натриевая (чилийская) | NaNO3 | нитрат натрия |
| Сода кальцинированная (стиральная) | Na2CO3 | карбонат натрия |
| Сода кристаллическая | Na2CO3⋅10H2O | декагидрат карбоната натрия |
| Сода питьевая | NaHCO3 | гидрокарбонат натрия |
| Сода пищевая | NH4HCO3 | гидрокарбонат аммония |
| Соль Мора | (NH4)2Fe(SO4)2⋅6H2O | гексагидрат сульфата железа(II)-диаммония |
| Соль английская (горькая) | MgSO4⋅7H2O | гептагидрат сульфата магния |
| Соль бертолетова | KClO3 | хлорат калия |
| Соль глауберова | Na2SO4⋅10H2O | декагидрат сульфата натрия |
| Соль жёлтая кровяная | K4[Fe(CN)6]⋅10H2O | декагидрат гексацианоферрата(II) калия |
| Соль поваренная | NaCl | хлорид натрия |
| Соль красная кровяная | K3[Fe(CN)6] | гексацианоферрат(III) калия |
| Сулема | HgCl2 | хлорид ртути |
| Суперфосфат двойной | Ca(H2PO4)2⋅H2O | моногидрат дигидрофосфата кальция |
| Суперфосфат простой | Ca(H2PO4)2⋅2CaSO4 | |
| Турнбулева синь | KFe[Fe(CN)6] | гексацианоферрат(III) железа(II)-калия |
| Хлорная известь | CaOCl2 | гипохлорит-хлорид кальция |
| Хромпик | K2Cr2O7 | дихромат калия |
| Щёлок | K2CO3 | карбонат калия |
IV. Получение
|
1. Из металлов: металл + неметалл = соль Fe + S = FeS металл (металлы до Н2) + кислота (р-р) = соль + Н2 Zn +2 HCl = ZnCl2 + H2 Металл1 + соль1 = металл2 + соль2 Видео: «Взаимодействие металлов с солями» Примечание: (металл2 стоит в ряду активности правее) Fe + CuCl2 = FeCl2 + Cu |
|
2.Из оксидов: кислотный оксид + щелочь = соль + вода SO3 + 2 NaOH = Na2SO4 + H2O основный оксид + кислота = соль + вода CuO + H2SO4 = CuSO4 + H2O основный оксид + кислотный оксид = соль Na2O + CO2 = Na2CO3 |
|
3. Реакция нейтрализации: кислота + основание = соль + вода HCl + NaOH = NaCl + H2O |
|
4. Из солей: соль1 + соль2 = соль3 + соль4↓ NaCl + AgNO3 = NaNO3 +AgCl↓ соль1 + щелочь = нерастворимое основание + соль 2 CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4 соль1 + кислота1 = кислота2 + соль2 2NaCl + H2SO4 = 2HCl + Na2SO4 Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде (осадок), газ или вода. |
Это интересно
“Зеркало мира”

V. Тренажеры
Тренажёр №1. «Классы неорганических соединений»
Тренажёр №2. «Классификация солей по растворимости в воде»
Тренажёр №3. «Составление названий солей по формуле»
Тренажёр №4. «Составление формул солей»
Тренажёр №5. Задачи на тему «Расчеты с использованием формул солей»
Проверь себя: “Соотнесите формулы солей, расположенных слева с их названиями”
VI. Задания для закрепления
Задание №1. Дайте названия следующим солям:
NaCl, KNO3, FeCl3, Li2SO4, KHSO4, BaOHCl, CaSO3, NaH2PO4, CuCl2
Задание №2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
Задание №3. Как двумя способами из оксида кальция можно получить:
а) сульфат кальция; б) ортофосфат кальция.
Составьте уравнения реакций.
ЦОРы
Видео: “Составление формул солей”
Видео: «Взаимодействие металлов с солями»
Тренажёр №1. «Классы неорганических соединений»
Тренажёр №2. «Классификация солей по растворимости в воде»
Тренажёр №3. «Составление названий солей по формуле»
Тренажёр №4. «Составление формул солей»
Тренажёр №5. Задачи на тему «Расчеты с использованием формул солей»