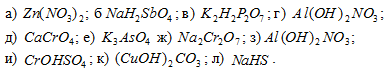Натрий и калий образуют соли почти со всеми известными кислотами.
Соли можно получить при взаимодействии оксидов или гидроксидов металлов с соответствующими кислотами:
Соли бескислородных кислот образуются при непосредственном взаимодействии простых веществ:
Важнейшие соли натрия:
хлорид натрия (NaCl) (каменная соль, поваренная соль),
карбонат натрия
Na2CO3
(сода, кальцинированная сода) и его кристаллогидрат
Na2CO3⋅10H2O
(кристаллическая сода),
гидрокарбонат натрия
NaHCO3
(питьевая сода),
сульфат натрия
Na2SO4
и его кристаллогидрат
Na2SO4⋅10H2O
(глауберова соль),
нитрат
NaNO3
(натриевая селитра).
Важнейшие соли калия:
хлорид калия (KCl) (сильвин),
карбонат калия
K2CO3
(поташ),
нитрат калия
KNO3
(калийная селитра),
Соединения щелочных металлов окрашивают пламя в характерные цвета.
Рис. (1). Окраска пламени ионами металлов
Соли лития придают ему карминово-красный цвет, соли натрия — жёлтый, калия — фиолетовый, рубидия и цезия — светло-фиолетовый.
Источники:
Рис. 1. Окраска пламени ионами металлов © ЯКласс
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Номенклатура и способы получения минеральных солей
Задача 159.
Составить формулы нормальных и кислых солей калия и кальция, образованных: а) угольной кислотой; б) мышьяковистой кислотой.
Решение:
а) Соли угольной кислоты Н2СО3:
К2СО3— карбонат калия; КНСО3 — гидрокарбонат калия; СаСО3 — карбонат кальция; СаНСО3 — гидрокарбонат кальция.
б) Соли мышьяковистой кислоты H3As2O3:
K3As2O3 — ортоарсенит (арсенит) калия; KH2As2O3 — дигидроортоарсенит (дигидроарсенит) калия; K2HAs2O3 — гидроарсенит (гидроарсенит) калия; Ca3As2O3 — ортоарсенит (арсенит) кальция; Ca(H2As2O3)2 — дигидроортоарсенит (дигидроарсенит) кальция; CaHAs2O3 — гидроортоарсенит (кидроарсенит) кальция.
Задача 160.
Назвать соли: SbONO3, [Fe(OH)2]2CrO4, (AlOH)SO4, Cd(HS)2, Ca(H2PO4)2.
Решение:
SbONO3 — нитрат стибрила (антимонила); [Fe(OH)2]2CrO4 — хромат дигидроксожелеза(III); (AlOH)SO4 — сульфат гидроксоалюминия; Cd(HS)2 — гидросульфид кадмия; Ca(H2PO4)2 — дигидроортофосфат кальция.
Задача 161.
При взаимодействии каких веществ можно получить дигидроортоантимонат натрия, метахромит натрия, гидроортоарсенат калия, сульфат гидроксоалюминия? Составить уравнения реакций.
Решение:
а) Дигидроортоантимонат натрия NaHSbO4 можно получить действием на раствор ортосурьмяной (сурьмяной) кислоты гидроксидом натрия NaOH:
HSbO4 + NaOH = NaHSbO4 + H2O
б) Метахромит NaCrO2 натрия можно получит сплавлением оксида хрома (III) с оксидом натрия или едким натром:
Cr2O3 + Na2O = 2NaCrO2;
Cr2O3 + NaOH = 2NaCrO2 + H2O
в) Гидроортоарсенат KHASO4 калия можно получить при действии мышьяковой кислоты на гидроксид калия :
H3ASO4 + 2KOH = KHAsO4 + 2H2O
г) Сульфат гидроксоалюминия (AlOH)SO4 можно получить действием на гидроксид алюминия раствором серной кислоты:
Al(OH)3 + H2SO4 = (AlOH)SO4 + 2H2O
Задача 162.
Написать уравнения реакций образования Mg2P2O7, Ca3(PO4)2, Mg(ClO4)2, Ba(NO3)2 в результате взаимодействия: а) основного и кислотного оксидов; б) основания и кислотного оксида; в) основного оксида и кислоты; г) основания и кислоты.
Решение:
1. Уравнения реакций получения Mg2P2O7:
а) из основного и кислотного оксидов:
MgO + P2O5 = Mg2P2O7
б) из основания и кислотного оксида:
Mg(OH)2 + P2O5 = Mg2P2O7 + H2O
в) из основного оксида и кислоты
2MgO + H4P2O7 = Mg2P2O7 + 2H2O
г) из основания и кислоты:
2Mg(OH)2 + H4P2O7 = Mg2P2O7 + 4H2O
2. Уравнения реакций образования Ca3(PO4)2:
а) из основного и кислотного оксидов:
CaO + P2O5 = Ca3(PO4)2
б) из основания и кислотного оксида:
3Ca(OH)2 + P2O5 = Ca3(PO4)2 + 3H2O
в) из основного оксида и кислоты:
2CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O
г) из основания и кислоты:
2Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
3. Уравнения реакций получения Mg(ClO4)2:
а) из основного и кислотного оксидов:
MgO + Cl2O7 = Mg(ClO4)2
б) из основания и кислотного оксида:
Mg(OH)2 + Cl2O7 = Mg(ClO4)2 + H2O
в) из основного оксида и кислоты:
MgO +2HClO4 = Mg(ClO4)2 + H2O
г) из основания и кислоты:
Mg(OH)2 +2HClO4 = Mg(ClO4)2 + 2H2O
4. Уравнения реакций образования Ba(NO3)2:
а) из основного и кислотного оксидов:
BaO + N2O5 = Ba(NO3)2
б) из основания и кислотного оксида:
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
в) из основного оксида и кислоты:
BaO + 2HNO3 + Ba(NO3)2 + H2O
г) из основания и кислоты:
Ba(OH)2 + 2HNO3 + Ba(NO3)2 + 2H2O
Задача 163.
Написать уравнения реакций, с помощью которых можно получить в лаборатории следующие вещества: а) хлороводород; б) сульфид свинца; в) сульфат бария; г) ортофосфат серебра; д) гидроксид железа (III) е) нитрат меди (II).
Решение:
а) В лаборатории хлороводород HCl можно получить действием концентрированной серной кислоты на твёрдый хлорид натрия:
2NaCl(кристал.) + H2SO4 = Na2SO4 + 2HCl
б) При сливании растворов сероводорода и нитрата свинца образуется малорастворимый сульфид свинца PbS чёрного цвета. Поэтому раствор соли свинца (II) используется для обнаружения сероводорода. Бумажка, смоченная раствором соли свинца (II), быстро темнеет, если в воздухе присутствует даже незначительное количество сероводорода:
Pb(NO3)2 + H2S = PbS↓ + 2HNO3
в) В лаборатории сульфат бария BaSO4 можно получить при сливании растворов хлорида бария и сульфата калия:
BaCl2 + K2SO4 = BaSO4↓ + 2KCl
Раствор BaCl2 служит для качественного и количественного определения сульфат-ионов SO42-. При наличии в растворе сульфат-ионов при приливании хлорида бария выпадает белый рыхлый осадок сульфата бария, нерастворимый ни в воде, ни в кислотах.
г) В лаборатории ортофосфат серебра Ag3PO4 можно получить при сливании растворов ортофосфата кальция и нитрата серебра, при этом образуется осадок:
Ca3(PO4)2 + 6AgNO3 = 2Ag3PO4↓ + 3Ca(NO3)2
д) Гидроксид железа (III) Fe(OH)3 в лаборатории можно получит при сливании растворов хлорида железа (III) и гидроксида натрия, при этом выпадает осадок:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
е) Нитрат меди (II) в лаборатории можно получить при растворении гидроксида меди (II) раствором азотной кислоты:
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Задача 164.
Назвать соли:
Решение:
Главная » Химия — 5 — 9 классы
Ответ №1
Ответ:
Объяснение:
K3PO4 — фосфат калия, K2CO3 — карбонат калия, K2SO4 — сульфат калия, K2SO3 — сульфит калия, K2S — сульфид калия
ZnCl2 — хлорид цинка, ZnF2 — фторид цинка, ZnBr2 — бромид цинка, ZnI2 — иодид цинка, Zn(NO3)2 — нитрат цинка
AlCl3 — хлорид алюминия, Al(NO3)3 — нитрат алюминия, AlPO4 — фосфат алюминия, Al2(SO4)3 — сульфат алюминия, AlI3 — иодид алюминия
Соли: классификация, номенклатура, способы получения
«Не в количестве знаний заключается образование,
а в полном понимании и искусном применении того, что знаешь»
А. Дистервег (немецкий педагог)
Мы живем с вами в мире веществ и их превращений, поэтому должны знать не только состав и применение веществ, но и влияние их на организм человека и окружающий нас мир.
С некоторыми классами веществ вы уже знакомы и сегодня приступим к изучению соединений нового класса –солей.
I. Понятие о солях
Такие вещества, как мрамор, известняк, сода, поташ, поваренная соль, адский камень, квасцы и нашатырь, известны людям ещё с древних времён. Однако первые теоретические представления о сходстве их состава возникли только в XVII веке. Именно в это время такие учёные, как Я. Ван Гельмонт (1580–1644), О. Тахений (1620–1699) и Г. Руэль (1703–1770), развили представление о том, что существует отдельный класс веществ — соли, которые можно рассматривать как продукт взаимодействия кислот с основаниями.
Соли — сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков.
Составление формул солей:
II. Классификация солей
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля (1703–1770). Именно он в 1754 г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
|
Средние |
Кислые |
Основные |
Двойные |
Смешанные |
Комплексные |
|
Соли, в состав которых входят металл и кислотный остаток |
Соли, в состав которых, кроме металла и кислотного остатка, входят атомы водорода |
Соли, в состав которых, кроме металла и кислотного остатка, входят гидроксогруппы ОН |
Продукты полного замещения атомов водорода двух- или многоосновной кислоты двумя различными металлами |
||
|
Na2SO4 |
NaHSO4 |
Mg(OH)Cl |
K2NaPO4 |
Ca-OCl2 |
Na[Al(OH)4] |
III. Названия солей
- Для средней соли — название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью. В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония NH4(валентность I).
Na2SO4— сульфат натрия,
CuSO4— сульфат меди (II)
- Для кислой соли – «гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обратите внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
NaHSO4 – гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
- Для основной соли –«гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
Mg(OH)Cl — гидроксохлорид магния
Fe(OH)(NO3)2 — гидроксонитрат железа(III);
Fe(OH)2NO3 — дигидроксонитрат железа(III).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди(II) (CuOH)2CO3, образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Кроме принятых в науке названий, для многих солей в широком обиходе сохраняются тривиальные названия, то есть названия, которые были присвоены веществам до того, как учёные установили единую номенклатуру.
Тривиальные названия большей частью связаны либо с какими-то особыми свойствами веществ, либо с областями их применения. Многие из этих названий были присвоены солям алхимиками. В таблице приведены обобщённые сведения о наиболее часто встречающихся в литературе тривиальных названиях солей.
|
Тривиальное название соли |
Химическая формула соли |
Систематическое название соли |
| Адский камень | AgNO3 | нитрат серебра |
| Алебастр | CaSO4⋅0,5H2O | гемигидрат сульфата кальция |
| Берлинская лазурь | KFe[Fe(CN)6] | гексацианоферрат(II) железа(III)-калия |
| Бланфикс | BaSO4 | сульфат бария |
| Бура | Na2B4O7⋅10H2O | декагидрат тетрабората натрия |
| Бура ювелирная | Na2B4O7⋅5H2O | пентагидрат тетрабората натрия |
| Гипс | CaSO4⋅2H2O | дигидрат сульфата кальция |
| Гипс жжёный | CaSO4⋅0,5H2O | полугидрат сульфата кальция |
| Гипс строительный | CaSO4⋅0,5H2O | гемигидрат сульфата кальция |
| Золото сусальное | SnS2 | сульфид олова(IV) |
| Квасцы железоаммонийные | NH4Fe(SO4)2⋅12H2O | додекагидрат сульфата железа(III)-аммония |
| Купорос медный | CuSO4⋅5H2O | пентагидрат сульфата меди(II) |
| Ляпис | AgNO3 | нитрат серебра |
| Марганцовка | KMnO4 | перманганат калия |
| Мел | CaCO3 | карбонат кальция |
| Нашатырь | NH4Cl | хлорид аммония |
| Патина | (CuOH)2CO3 | гидроксокарбонат меди(II) |
| Поташ | K2CO3 | карбонат калия |
| Преципитат | CaHPO4⋅2H2O | дигидрат гидрофосфата кальция |
| Растворимое стекло | Na2SiO3⋅9H2O | нонагидрат силиката натрия |
| Свинцовый сахар | (CH3COO)2Pb⋅3H2O | тригидрат ацетата свинца(II) |
| Селитра аммиачная (аммонийная) | NH4NO3 | нитрат аммония |
| Селитра калийная (индийская) | KNO3 | нитрат калия |
| Селитра кальциевая (норвежская) | Ca(NO3)2 | нитрат кальция |
| Селитра натриевая (чилийская) | NaNO3 | нитрат натрия |
| Сода кальцинированная (стиральная) | Na2CO3 | карбонат натрия |
| Сода кристаллическая | Na2CO3⋅10H2O | декагидрат карбоната натрия |
| Сода питьевая | NaHCO3 | гидрокарбонат натрия |
| Сода пищевая | NH4HCO3 | гидрокарбонат аммония |
| Соль Мора | (NH4)2Fe(SO4)2⋅6H2O | гексагидрат сульфата железа(II)-диаммония |
| Соль английская (горькая) | MgSO4⋅7H2O | гептагидрат сульфата магния |
| Соль бертолетова | KClO3 | хлорат калия |
| Соль глауберова | Na2SO4⋅10H2O | декагидрат сульфата натрия |
| Соль жёлтая кровяная | K4[Fe(CN)6]⋅10H2O | декагидрат гексацианоферрата(II) калия |
| Соль поваренная | NaCl | хлорид натрия |
| Соль красная кровяная | K3[Fe(CN)6] | гексацианоферрат(III) калия |
| Сулема | HgCl2 | хлорид ртути |
| Суперфосфат двойной | Ca(H2PO4)2⋅H2O | моногидрат дигидрофосфата кальция |
| Суперфосфат простой | Ca(H2PO4)2⋅2CaSO4 | |
| Турнбулева синь | KFe[Fe(CN)6] | гексацианоферрат(III) железа(II)-калия |
| Хлорная известь | CaOCl2 | гипохлорит-хлорид кальция |
| Хромпик | K2Cr2O7 | дихромат калия |
| Щёлок | K2CO3 | карбонат калия |
IV. Получение
|
1. Из металлов: металл + неметалл = соль Fe + S = FeS металл (металлы до Н2) + кислота (р-р) = соль + Н2 Zn +2 HCl = ZnCl2 + H2 Металл1 + соль1 = металл2 + соль2 Видео: «Взаимодействие металлов с солями» Примечание: (металл2 стоит в ряду активности правее) Fe + CuCl2 = FeCl2 + Cu |
|
2.Из оксидов: кислотный оксид + щелочь = соль + вода SO3 + 2 NaOH = Na2SO4 + H2O основный оксид + кислота = соль + вода CuO + H2SO4 = CuSO4 + H2O основный оксид + кислотный оксид = соль Na2O + CO2 = Na2CO3 |
|
3. Реакция нейтрализации: кислота + основание = соль + вода HCl + NaOH = NaCl + H2O |
|
4. Из солей: соль1 + соль2 = соль3 + соль4↓ NaCl + AgNO3 = NaNO3 +AgCl↓ соль1 + щелочь = нерастворимое основание + соль 2 CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4 соль1 + кислота1 = кислота2 + соль2 2NaCl + H2SO4 = 2HCl + Na2SO4 Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде (осадок), газ или вода. |
Это интересно
“Зеркало мира”

V. Тренажеры
Тренажёр №1. «Классы неорганических соединений»
Тренажёр №2. «Классификация солей по растворимости в воде»
Тренажёр №3. «Составление названий солей по формуле»
Тренажёр №4. «Составление формул солей»
Тренажёр №5. Задачи на тему «Расчеты с использованием формул солей»
Проверь себя: “Соотнесите формулы солей, расположенных слева с их названиями”
VI. Задания для закрепления
Задание №1. Дайте названия следующим солям:
NaCl, KNO3, FeCl3, Li2SO4, KHSO4, BaOHCl, CaSO3, NaH2PO4, CuCl2
Задание №2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
Задание №3. Как двумя способами из оксида кальция можно получить:
а) сульфат кальция; б) ортофосфат кальция.
Составьте уравнения реакций.
ЦОРы
Видео: “Составление формул солей”
Видео: «Взаимодействие металлов с солями»
Тренажёр №1. «Классы неорганических соединений»
Тренажёр №2. «Классификация солей по растворимости в воде»
Тренажёр №3. «Составление названий солей по формуле»
Тренажёр №4. «Составление формул солей»
Тренажёр №5. Задачи на тему «Расчеты с использованием формул солей»