Загрузить PDF
Загрузить PDF
В соответствии с законом сохранения массы, материя не может появиться или исчезнуть в ходе химической реакции, поэтому количество вещества на выходе реакции должно равняться количеству вступивших в нее реагентов. Это означает, что при химической реакции сохраняется число атомов каждого элемента. Стехиометрия является мерой участвующих в реакции химических элементов.[1]
При соответствующих расчетах учитывают массу реагентов и продуктов данной химической реакции. Нахождение стехиометрии наполовину состоит из математики, наполовину из химии, и при этом используется упомянутый выше принцип, согласно которому при химических реакциях материя никогда не исчезает и не возникает. При решении любой задачи по химии прежде всего следует сбалансировать химическое уравнение.
-
1
Запишите количество атомов, из которых состоит каждое соединение с обеих сторон уравнения. Количество атомов каждого участвующего в реакции элемента можно определить по уравнению химической реакции. Поскольку в ходе химической реакции материя никогда не возникает и не исчезает, уравнение реакции не сбалансировано, если количество (и вид) атомов по разные стороны уравнения не совпадает.
- Не забудьте умножить количество атомов на соответствующие коэффициенты и подстрочные символы, если они есть в уравнении.
- Рассмотрим в качестве примера реакцию H2SO4 + Fe —> Fe2(SO4)3 + H2.
- В данной реакции реагентами (левая часть уравнения) выступают 2 атома водорода H (H2), 1 атом серы S, 4 атома кислорода O (O4) и 1 атом железа Fe.
- К продуктам реакции (правая часть уравнения) относятся 2 атома водорода H (H2), 3 атома серы S (S3), 12 атомов кислорода O (O12) и 2 атома железа Fe (Fe2).
-
2
Добавьте коэффициент перед элементами, за исключением кислорода и водорода, чтобы сбалансировать обе стороны уравнения. Найдите наименьший общий знаменатель для всех элементов кроме кислорода и водорода (вы сбалансируете их позже), чтобы получить одинаковое число атомов с обеих сторон уравнения.
- Например, в случае железа (Fe) наименьший общий знаменатель для 2 и 1 равен 2. Поставьте 2 перед символом Fe в левой части уравнения, чтобы сбалансировать число атомов железа.
- Для серы (S) наименьший общий знаменатель для 3 и 1 равен 3. Поставьте коэффициент 3 перед H2SO4, чтобы сбалансировать количество атомов серы в левой и правой части.
- После этого уравнение примет следующий вид: 3 H2SO4 + 2 Fe —> Fe2(SO4)3 + H2.
-
3
Сбалансируйте количество атомов водорода и кислорода. Водород и кислород балансируются в последнюю очередь, поскольку они обычно входят в состав нескольких молекул с обеих сторон уравнения. Не забудьте на данном этапе пересчитать атомы, если вы добавили коэффициенты перед молекулами.
- В нашем примере мы добавили 3 перед H2SO4, и теперь у нас 6 атомов водорода слева и только 2 атома водорода в правой части уравнения. В то же время мы имеем 12 атомов кислорода слева и 12 атомов этого элемента справа, то есть кислород сбалансирован.
- Чтобы сбалансировать водород, можно добавить коэффициент 3 перед H2.
- В результате сбалансированное уравнение выглядит следующим образом: 3 H2SO4 + 2 Fe —> Fe2(SO4)3 + 3 H2.
-
4
Пересчитайте количество атомов с обеих сторон уравнения и убедитесь, что оно одинаково. После того как вы сбалансируете уравнение, желательно проверить, все ли правильно. Для этого еще раз сложите атомы каждого элемента по обе стороны уравнения и убедитесь, что их количество слева и справа одинаково.
- Проверим наше уравнение: 3 H2SO4 + 2 Fe —> Fe2(SO4)3 + 3 H2.
- Слева от стрелки стоят 6 H, 3 S, 12 O и 2 Fe.
- По правую сторону от стрелки стоят 2 Fe, 3 S, 12 O и 6 H.
- Таким образом, левая и правая части содержат одинаковое количество атомов каждого элемента, то есть уравнение сбалансировано.
Реклама
-
1
Рассчитайте молярную массу вещества, количество которого дано в граммах. Молярная масса — это масса (в граммах) одного моля химического соединения.[2]
С ее помощью можно легко перевести граммы в моли и наоборот.[3]
Чтобы рассчитать молярную массу, необходимо определить, сколько атомов каждого элемента содержится в молекуле данного вещества, и узнать атомную массу этих элементов.- Определите количество атомов каждого элемента в молекуле вещества. Например, молекула глюкозы имеет вид C6H12O6, то есть состоит из 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода.
- Определите атомную массу каждого элемента в граммах на моль (г/моль). Как правило, атомные массы указаны в периодической таблице химических элементов под символами соответствующих элементов в виде десятичного числа. Например, атомные массы входящих в молекулу глюкозы элементов составляют: углерод — 12,0107 г/моль, водород — 1,007 г/моль, кислород — 15,9994 г/моль.
- Умножьте атомную массу каждого элемента на количество атомов в молекуле. Углерод: 12,0107 x 6 = 72,0642 г/моль; водород: 1,007 x 12 = 12,084 г/моль; кислород: 15,9994 x 6 = 95,9964 г/моль.
- Сложите полученные произведения, и вы найдете молярную массу химического соединения: 72,0642 + 12,084 + 95,9964 = 180,1446 г/моль. Таким образом, один моль глюкозы весит 180,14 грамма.
-
2
Переведите граммы вещества в моли с помощью молярной массы. Используя молярную массу в качестве коэффициента пересчета, можно найти количество молей, которое соответствует определенной массе вещества в граммах. Поделите известное количество граммов (г) на молярную массу (г/моль).[4]
[5]
Простой способ проверить правильность вычислений заключается в том, чтобы убедиться, что единицы измерения (граммы) сокращаются и остаются одни моли.- Например, найдем, сколько молей содержится в 8,2 грамма хлороводорода (HCl).
- Атомная масса H равна 1,007, а Cl — 35,453. Таким образом, молярная масса вещества составляет 1,007 + 35,453 = 36,46 г/моль.
- Поделим количество граммов на молярную массу вещества и получим: 8,2 г / (36,46 г/моль) = 0,225 моля HCl.
-
3
Определите молярное соотношение реагентов. Чтобы определить выход продукта реакции, необходимо найти молярное соотношение. Эта величина показывает, в каком соотношении реагенты вступают в реакцию друг с другом, она определяется отношением коэффициентов перед веществами в сбалансированном уравнении реакции.[6]
- Например, найдем молярное соотношение KClO3 и O2 в реакции 2 KClO3 —> 2 KCl + 3 O2.
- Сначала проверим, сбалансировано ли уравнение. Никогда не забывайте об этом шаге, иначе получится неправильное соотношение. В данном случае с обеих сторон уравнения содержится равное количество атомов каждого элемента, то есть уравнение реакции сбалансировано.
- Отношение KClO3 к O2 составляет 2/3. Если не менять местами рассматриваемые вещества в ходе решения, неважно, какое из двух чисел стоит в числителе, а какое в знаменателе.[7]
-
4
Решите пропорцию с молярным соотношением, чтобы найти количество молей второго реагента. Чтобы вычислить число молей продуктов реакции или реагентов, следует использовать молярное соотношение.[8]
В задачах обычно требуется найти необходимое для реакции количество молей исходного вещества или число молей продукта реакции по известной массе реагента.- Рассмотрим в качестве примера реакцию N2 + 3 H2 —> 2 NH3 и определим, сколько молей NH3 получится из 3,00 граммов N2 и достаточного количества H2.
- В данном случае достаточное количество H2 означает, что при решении задачи количество водорода можно не учитывать, так как его хватает для того, чтобы прореагировал весь азот.
- Сначала переведем данное в граммах количество N2 в моли. Атомная масса азота составляет 14,0067 г/моль, поэтому молярная масса N2 равна 28,0134 г/моль. Поделим массу на молярную массу и получим 3,00 г/28,0134 г/моль = 0,107 моль.
- Запишем соотношение веществ в уравнении: NH3: N2 = x/0,107 моль.
- Приравняем эту дробь к молярному соотношению NH3 и N2, которое составляет 2:1. x/0,107 моль = 2/1; (2 x 0,107) = 1x = 0,214 моль.
-
5
Переведите моли обратно в граммы, используя молярные массы веществ. В этом случае вновь следует использовать молярную массу, но на этот раз на нее необходимо умножить, чтобы перевести моли обратно в граммы. Используйте молярные массы соответствующих веществ.
- Молярная масса NH3 равна 17,028 г/моль. Таким образом, получаем: 0,214 моль x (17,028 г/моль) = 3,647 грамма NH3.
Реклама
-
1
Узнайте, протекает ли реакция при стандартных условиях (температуре и давлении). При стандартных условиях 1 моль идеального газа занимает объем 22,414 литра (л).[9]
Стандартная температура составляет 273,15 кельвина (K), а стандартное давление равно 1 атмосфере (атм).[10]
- Обычно подразумевается, что реакция протекает при нормальных условиях, то есть при 1 атм и 273 K.
-
2
Используйте множитель 22,414 л/моль, чтобы перевести литры газа в моли. Если реакция протекает при нормальных условиях, количество молей газа можно найти с помощью коэффициента 22,414 л/моль.[11]
Поделите объем газа в литрах на данный коэффициент, чтобы определить число молей.- Например, если дано 3,2 литра азота N2, находим: 3,2 л/22,414 л/моль = 0,143 моль.
-
3
Используйте уравнение состояния идеального газа, чтобы перевести литры в моли в том случае, если реакция протекает не при нормальных условиях. Если в условии задачи указано, что реакция протекает не при нормальных условиях, для определения количества молей газа следует использовать уравнение состояния идеального газа PV = nRT,[12]
где P — давление в атмосферах, V — объем в литрах, n — количество молей, Т — температура в кельвинах, R — универсальная газовая постоянная, равная 0,0821 л-атм/моль-градус.[13]
- Данное уравнение можно переписать так, чтобы выразить количество молей через остальные величины: n = RT/PV.
- Единицы измерения универсальной газовой постоянной сокращаются с единицами измерения других величин, в результате остаются моли.
- Например, найдем, сколько молей содержится в 2,4 литрах O2 при 300 К и 1,5 атм. Подставляя данные значения в формулу, получаем: n = (0,0821 x 300)/(1,5 x 2,4) = 24,63/3,6 = 6,842 моля O2.
Реклама
-
1
Вычислите плотность жидкости. Иногда в химических уравнениях указан объем жидкого реагента и требуется найти необходимое для реакции количество граммов или молей. Чтобы перевести объем в граммы, необходимо знать плотность жидкости. Плотность равна массе, поделенной на объем.[14]
- Если в условии задачи не указана плотность, ее можно найти в справочниках или интернете.
-
2
Переведите объем в миллилитры (мл). Чтобы перевести объем жидкости в массу (г), необходимо знать плотность жидкости. Плотность выражается в граммах на миллилитр (г/мл), поэтому объем жидкости следует перевести в миллилитры.
- Определите данный объем. Предположим, в условии задачи сказано, что имеется 1 литр H2O. Чтобы перевести объем в миллилитры, просто умножьте эту величину на 1000. В одном литре содержится 1000 миллилитров.
-
3
Умножьте объем на плотность. При умножении объема (мл) на плотность (г/мл) жидкости миллилитры сократятся, и останутся граммы вещества.[15]
- Например, плотность H2O составляет около 1,0 г/мл.[16]
- Например, плотность H2O составляет около 1,0 г/мл.[16]
-
4
Вычислите молярную массу реагента. Молярная масса показывает, сколько граммов (г) весит один моль вещества. Она позволяет легко перевести граммы в моли и обратно. Чтобы найти молярную массу, необходимо определить, сколько молекул того или иного элемента содержится в соединении, а также атомную массу каждого элемента.
- Определите количество атомов каждого элемента в соединении. Например, молекула глюкозы имеет вид C6H12O6, то есть содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода.
- Определите атомную массу каждого элемента в граммах на моль (г/моль). Входящие в молекулу глюкозы элементы имеют следующие атомные массы: углерод — 12,0107 г/моль, водород — 1,007 г/моль, кислород — 15,9994 г/моль.
- Умножьте атомную массу каждого элемента на число атомов этого элемента в молекуле. Углерод: 12,0107 x 6 = 72,0642 г/моль; водород: 1,007 x 12 = 12,084 г/моль; кислород: 15,9994 x 6 = 95,9964 г/моль.
- Сложите полученные значения, чтобы найти молярную массу соединения: 72,0642 + 12,084 + 95,9964 = 180,1446 г/моль. Таким образом, один моль глюкозы весит 180,14 грамма.
-
5
Переведите граммы вещества в моли с помощью молярной массы. Используя молярную массу в качестве коэффициента пересчета, по известной массе вещества в граммах можно найти количество молей. Просто поделите количество граммов (г) на молярную массу (г/моль).[17]
[18]
Чтобы проверить, все ли правильно, убедитесь, что граммы сокращаются и остаются одни моли.- Например, найдем, сколько молей содержится в 8,2 грамма хлороводорода (HCl).
- Атомная масса H равна 1,007, а атомная масса Cl составляет 35,453. Отсюда находим молярную массу соединения: 1,007 + 35,453 = 36,46 г/моль.
- Поделим количество граммов вещества на его молярную массу и получим число молей: 8,2 г / (36,46 г/моль) = 0,225 моля HCl.
Реклама
Об этой статье
Эту страницу просматривали 3387 раз.
Была ли эта статья полезной?
Стехиометрия – это раздел химии, который изучает количественные соотношения между веществами, вступившими в реакцию и образовавшимися в ходе нее (от др.-греч. «стехион» – «элементный состав», «мейтрен» – «измеряю»).
Стехиометрия является важнейшей теоретической основой для материальных и энергетических расчетов, без которых невозможно организовать ни одно химическое производство. Химическая стехиометрия позволяет рассчитать количество сырья, необходимого для конкретного производства, с учетом нужной производительности и возможных потерь. Ни одно предприятие не может быть открыто без предварительных расчетов.
Немного истории
Само слово «стехиометрия» — это изобретение немецкого химика Иеремии Бениамина Рихтера, предложенное им в своей книге, в которой впервые была описана идея возможности расчетов по химическим уравнениям. Позднее идеи Рихтера получили теоретическое обоснование с открытием законов Авогадро (1811), Гей-Люссака (1802), закона постоянства состава (Ж.Л. Пруст, 1808), кратных отношений (Дж. Дальтон, 1803), развитием атомно-молекулярного учения. Сейчас эти законы, а также закон эквивалентов, сформулированный самим Рихтером, называют законами стехиометрии.
Понятие «стехиометрия» используют в отношении и веществ, и химических реакций.
Стехиометрические уравнения
Стехиометрические реакции – реакции, в которых исходные вещества взаимодействуют в определенных соотношениях, а количество продуктов соответствует теоретическим расчетам.
Стехиометрические уравнения – уравнения, которые описывают стехиометрические реакции.
Стехиометрические коэффициенты (коэффициенты уравнений) показывают количественные соотношения между всеми участниками реакции, выраженные в молях.
Большинство неорганических реакций – стехиометрические. Например, стехиометрическими являются три последовательные реакции получения серной кислоты из серы.
S + O2 → SO2
SO2 + ½O2 → SO3
SO3 + H2O → H2SO4
Расчетами по этим уравнениям реакций можно определить, сколько необходимо взять каждого вещества, чтобы получить определенное количество серной кислоты.
Большинство органических реакций являются нестехиометрическими. Например, уравнение реакции крекинга этана выглядит так:
C2H6 → C2H4 + H2.
Однако на самом деле в ходе реакции всегда будут получаться разные количества побочных продуктов – ацетилена, метана и других, рассчитать которые теоретически невозможно. Некоторые неорганические реакции тоже не поддаются расчетам. Например, реакция разложения нитрата аммония:
NH4NO3 → N2O + 2H2O.
Она идет по нескольким направлениям, поэтому невозможно определить, сколько нужно взять исходного вещества, чтобы получить определенное количество оксида азота (I).
Стехиометрия – это теоретическая основа химических производств
Все реакции, которые используются в химическом анализе или на производстве, должны быть стехиометрическими, то есть подвергаться точным расчетам. Будет ли завод или фабрика приносить выгоду? Стехиометрия позволяет это выяснить.
На основании стехиометрических уравнений составляют теоретический баланс. Необходимо определить, какое количество исходных веществ потребуется для получения нужного количества интересующего продукта. Далее проводятся эксплуатационные опыты, которые покажут реальный расход исходных веществ и выход продуктов. Разница между теоретическими расчетами и практическими данными позволяет оптимизировать производство и оценить будущую экономическую эффективность предприятия. Стехиометрические расчеты, кроме того, дают возможность составить тепловой баланс процесса с целью подбора оборудования, определить массы образующихся побочных продуктов, которые нужно будет удалять, и так далее.
Стехиометрические вещества
Согласно закону постоянства состава, предложенному Ж.Л. Прустом, любое химически чистое вещество имеет постоянный состав, вне зависимости от способа получения. Это означает, что, например, в молекуле серной кислоты H2SO4 независимо от способа, которым она была получена, на два атома водорода всегда будет приходиться один атом серы и четыре атома кислорода. Стехиометрическими являются все вещества, имеющие молекулярную структуру.
Однако в природе широко распространены вещества, состав которых может отличаться в зависимости от метода получения или источника происхождения. Подавляющее большинство из них – это кристаллические вещества. Можно даже сказать, что для твердых веществ стехиометрия – это скорее исключение, чем правило.
Для примера рассмотрим состав хорошо изученных карбида и оксида титана. В оксиде титана TiOx X=0.7–1.3, то есть на один атом титана приходится от 0,7 до 1,3 атомов кислорода, в карбиде TiCx X=0.6–1.0.
Нестехиометричность твердых тел объясняется дефектом внедрения в узлах кристаллической решетки либо, наоборот, появлением вакансий в узлах. К таким веществам относятся оксиды, силициды, бориды, карбиды, фосфиды, нитриды и другие неорганические вещества, а также высокомолекулярные органические.
И хотя доказательства существования соединений с переменным составом были представлены только в начале 20-го века И. С. Курнаковым, такие вещества часто называют бертоллидами по фамилии ученого К.Л. Бертолле, предполагавшего, что состав любого вещества меняется.
Для
описания химических реакций, лежащих
в основе промышленных химико-технологических
процессов, используют основные законы
химии – законы стехиометрии, химического
равновесия, химической кинетики. В гл.
2 и 3 рассмотрены основные принципы
использования законов химической
термодинамики и химической кинетики в
технологии. В этом параграфе кратко
изложены основы использования законов
стехиометрии.
Стехиометрия
– это учение о соотношениях масс или
объемов реагирующих веществ. В основе
стехиометрии лежат законы Авогадро,
Гей-Люссака, а также сохранения массы,
эквивалентов, постоянства состава,
кратных соотношений.
Соотношения, в
которых вещества вступают в реакцию,
называют стехиометрическими. Законы
стехиометрии в химии могут быть
использованы в расчетах, связанных с
формулами веществ, а также с нахождением
теоретически возможных масс получающихся
продуктов реакции.
Стехиометрическое
уравнение реакции отвечает законам
сохранения. Оно может быть записано как
в привычном виде (слева – реагенты,
справа – продукты)
аА + bВ
= rR + sS, (I)
так и в соответствии с
алгебраическими правилами в виде
–аА
– bВ
+ rR + sS = 0 (II)
или еще в более общем виде
. (1.1)
В такой
записи знак стехиометрического
коэффициента ji позволяет
определить, является ли данное вещество
реагентом (тогда стехиометрический
коэффициент отрицателен: ji
< 0) или продуктом реакции (тогда ji
> 0).
Если
реакция сложная и состоит из п
независимых последовательных или
параллельных стадий, то стехиометрия
реакции может быть выражена системой
из п уравнений типа уравнения (1.1):
;
; (1.2)
.
В
соответствии с алгебраическими правилами
каждое из этих уравнений может быть
умножено на любую константу (кроме нуля)
и смысл этих уравнений не изменится.
Если
при стехиометрических расчетах количество
вещества выражают в молях, то они сводятся
к сравнительно простым стехиометрическим
балансам. Например, если протекает
реакция
2А
+ В
2R, (III)
то в соответствии с законами
стехиометрии всегда на каждые 2 моль
вступившего в реакцию вещества А
одновременно вступит в реакцию 1 моль
вещества В
и образуется 2 моль продукта R.
Если
исходные количества участников реакции
(I) составляют nA,0,
nB,0 и nR,0,
а текущие количества пА,
пB и nR,
то для любого момента времени будут
справедливы как стехиометрические
соотношения
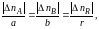
так и другие вытекающие из
них соотношения, называемые
стехиометрическими
балансами,
например
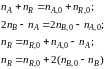
и др.
Следует
иметь в виду, что для стехиометрических
расчетов и составления стехиометрических
балансов не имеет значения, является
реакция обратимой или необратимой.
Стехиометрический расчет ведется в
предположении, что реакция может пройти
до конца.
Стехиометрические
балансы позволяют решить задачу о
количестве независимых реакций в случае
протекания сложных многостадийных
реакций. При анализе механизма протекания
таких реакций важно выделить независимые
реакции, которые не могут быть получены
простым алгебраическим суммированием
двух или большего количества отдельных
стадий.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #