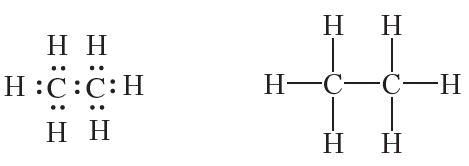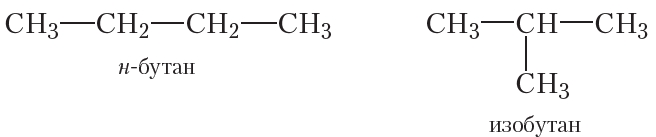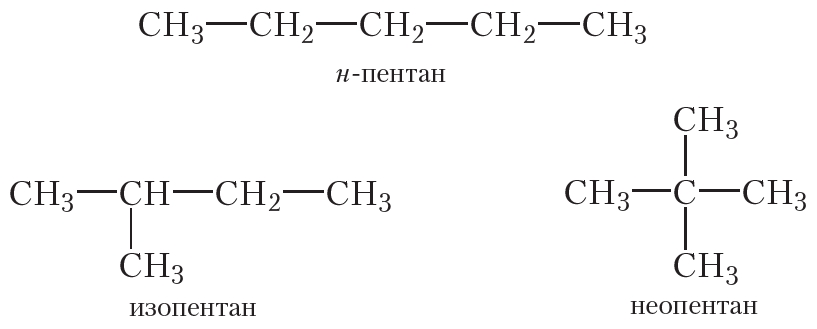Структурные формулы простейших углеводородов. Алканы. Изомерия алканов
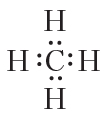
Простейшими по составу органическими соединениями являются углеводороды. Молекулы углеводородов состоят только из двух элементов: углерода и водорода. Простейшим углеводородом является метан. Молекулярная формула метана — CH4. Молекулярная формула отражает только состав молекулы метана. Рассмотрим строение молекулы метана.
Атом углерода имеет четыре валентных электрона, атом водорода — один. Это можно наглядно отобразить при помощи электронных формул:
Очевидно, что один атом углерода может образовать четыре ковалентные связи с четырьмя атомами водорода:
При этом атомы приобретают завершённые внешние электронные оболочки, углерод — восьмиэлектронную, водород — двухэлектронную.
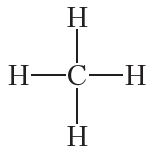
Приведённая электронная формула отражает строение молекулы метана CH4, в которой центральный атом углерода связан с четырьмя атомами водорода посредством четырёх общих электронных пар (четырёх ковалентных связей). На практике при отображении строения молекул органических веществ удобнее пользоваться структурными формулами. Структурная формула метана:
Структурные формулы, в отличие от молекулярных, отражают не только состав, но и последовательность соединения атомов в молекуле.
Метан представляет собой бесцветный горючий газ без запаха, нерастворимый в воде. Температура кипения метана очень низка и составляет –162 °С. Метан является основным компонентом природного газа. Кроме этого, он встречается в месторождениях каменного угля и его внезапные выбросы бывают причиной пожаров в угольных шахтах. Отсюда происходит название метана «рудничный газ». Выделения метана наблюдаются на торфяных болотах, этим обусловлено ещё одно его название — «болотный газ».
Составим структурную формулу следующего углеводорода — этана. Молекула этана содержит два атома углерода, соединённых одинарной связью. Учитывая, что углерод в органических веществах четырёхвалентен, легко составить электронную и структурную формулы молекулы этана:
Молекулярная формула этана — C2H6. Этан, как и метан, бесцветный горючий, нерастворимый в воде газ, имеющий температуру кипения –89 °С. Этан встречается в природе в составе природного газа.
В органической химии обычно пользуются структурными, а не молекулярными формулами веществ. Для того чтобы структурные формулы не были слишком громоздкими, отдельные связи в них, как правило, не указывают. В этом случае структурная формула этана будет выглядеть гораздо компактнее:
.
Следующий углеводород — пропан. Молекула пропана содержит цепь из трёх атомов углерода, соединённых одинарными связями. Структурные формулы молекулы пропана:
Подсчитав число атомов углерода и водорода в структурной формуле пропана, можно записать его молекулярную формулу — С3Н8. Пропан так же, как метан и этан, является бесцветным горючим газом, входит в состав природного газа.
Из четырёх атомов углерода можно построить два вида цепей: нормальную (неразветвлённую) и разветвлённую. Структурные формулы соответствующих углеводородов:

Как вы уже знаете из § 5, н-бутан и изобутан являются изомерами. Молекулы этих веществ имеют одинаковый качественный и количественный состав (молекулярная формула C4H10), но разное строение.
Изомерные н-бутан и изобутан при нормальных условиях — бесцветные газы без запаха, присутствуют в природном газе. Смесями пропана и изомерных бутанов, выделенными из природного газа, заполняют газовые баллоны, использующиеся в быту (рис. 6.1).
Из пяти атомов углерода, соединённых одинарными связями, можно построить молекулы трёх углеводородов:
Состав всех трёх углеводородов одинаков и соответствует молекулярной формуле С5Н12. То есть приведённые углеводороды являются изомерами.
Очевидно, что для углеводородов с бóльшим числом атомов углерода в молекуле число изомеров будет значительным. Так, например, изомерных углеводородов состава С20Н42 насчитывается более 300 000, а число возможных изомерных веществ состава С40Н82 составляет более чем 1012.
Явление изомерии во многом обусловливает многообразие органических соединений, делает органическую химию поистине неисчерпаемой.
Мы рассмотрели строение углеводородов, в которых атомы углерода связаны между собой только одинарными связями, остальные связи углерод образует с атомами водорода. Состав таких углеводородов описывается молекулярными формулами СН4, С2Н6, С3Н8, С4Н10, С5Н12 и т. д. Легко видеть, что для этих углеводородов можно предложить общую формулу:
СnH2n+2
Все углеводороды нециклического строения, в молекулах которых имеются лишь одинарные связи, будут соответствовать данной общей формуле. Такие углеводороды называются алканами.
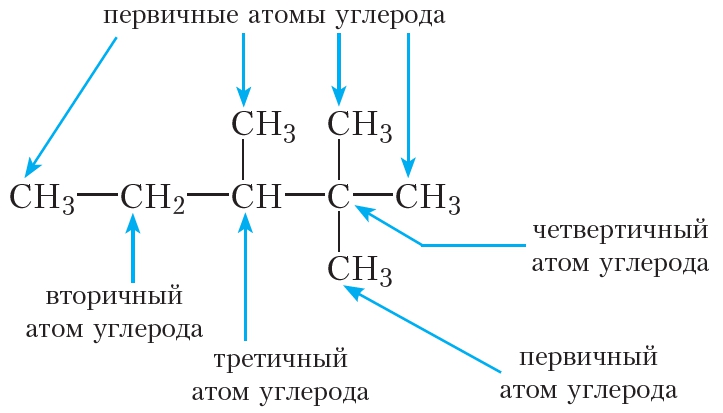
Атом углерода, связанный в углеродной цепи только с одним атомом углерода, называется первичным. Первичные атомы углерода являются концевыми элементами углеродной цепи. В молекуле этана оба атома углерода первичные.
Вторичный атом углерода связан с двумя атомами углерода. В молекуле пропана первый и третий атомы углерода являются первичными, второй атом — вторичным.
Третичный атом углерода связан с тремя атомами углерода; четвертичный — с четырьмя атомами углерода. Третичные и четвертичные атомы углерода являются точками разветвления углеродной цепи. Такие атомы углерода имеются в молекулах изопентана и неопентана (укажите их самостоятельно).
Углеводороды нециклического строения, в молекулах которых имеются только одинарные связи, называются алканами.
Общая формула алканов CnH2n+2.
Существуют два изомерных алкана состава С4Н10 и три изомерных алкана состава С5Н12.
Сервисы
этан
Carbon is special in its compound properties since it shapes various parts more prevalent than the absolute expansion of the relative multitude of different components in the mix with one another. The greatest gathering of this large number of parts is the one shaped via carbon and hydrogen. We know at least around 1 million natural parts and this number increments quickly consistently. Albeit the grouping isn’t severe, carbon shapes one more series of mixtures considered inorganic, in a much lower number than that of the natural mixtures.
Basic carbon exists in two distinct allotropic translucent structures: jewel and graphite. Different structures with little crystallinity are vegetal carbon and dark smoke. Synthetically unadulterated carbon can be ready by termic deterioration of sugar (sucrose) without any air. The physical and substance properties of carbon rely upon the glass-like construction of the component.
Ethane
It is the second individual from the homologous series of alkanes. It very well might be viewed as gotten from methane by supplanting one H molecule with a methyl group and may hence be named methyl methane. Being comprised of two methyl groups. CH3CH3, it could be called dimethyl. It dissolves in the regular mineral oil and is developed into a vaporous state when the oil rises to the top. Natural gas contains little amounts (10-21 %) of ethane alongside methane. To a little degree, it is additionally present in coal gas and in ‘cracked petroleum’.
Based on arrangement naming is additionally done and as it is realized that naming is as indicated by the IUPAC nomenclature since it is a standard set in science. This IUPAC standard is utilized all over the place. In like manner, as there are single bonds present between the carbon atoms along these lines the suffix “ane” is utilized, and as there are two carbon particles accordingly prefix “eth” is utilized which totally makes it ethane, and its equation becomes C2H6.
Structure of Ethane
Since isomerism in hydrocarbons relies upon the various structures of the carbon chains, the number of isomeric types of a specific hydrocarbon can be worked out by developing the conceivable carbon chains of that hydrocarbon. Beginning from the principal hydrocarbon methane which contains just a single carbon atom(C), the chain of ethane can be developed in a straightforward manner by adding to it another carbon molecule (C-C).
Preparation of Ethane
For the removal of various impurities, oil and natural gas should be handled at first creation. The handling of natural gas eliminates hydrocarbons, for example, ethane, butane, propane, and different hydrocarbons from the gas stream, as well as water and different impurities.
- Ethane is likewise ready by Wurtz reaction. Whenever methyl bromide or methyl iodide and sodium are warmed within the sight of dry ether ethane is formed.
CH3I + 2Na + CH3I → CH3-CH3 + 2NaI
- Pure ethane is obtained in the laboratory by the reduction of ethyl iodide with zinc-copper couple and ethanol mixed with about 5 per cent water.
CH3CH2I + 2[H] → C2H6 + HI
- Bypassing a mixture of ethylene and hydrogen overheated nickel (Sabatier and Sendet’ens).
CH2 = CH2 + H2 → C2H6
- Preparation of ethane from sodium propionate. When sodium propanoate reacts with soda lime ethane is obtained. Here we are talking about the soda-lime so we must know that soda lime is a mixture of NaOH and CaO.
CH3CH2COONa + NaOH → C2H6 + Na2CO3
Physical Properties of Ethane
- Ethane is a colorless and odorless gas at customary temperature.
- The nature of the compound is Saturated compound.
- It tends to be more handily condensed than methane. Fluid ethane boils at – 88.3°C and solidifies at – 172°C. It is sparingly soluble in water however breaks down promptly in ethanol.
- The molar mass of ethane it is 30.070g/mol.
- Then, at that point, the thickness of ethane is 1.3562kg/m3 when the gas is at 0°C. Further when the fluid is at – 88.5°C the thickness must be 544.0kg/m3.
- The liquefying point of ethane is – 182.8°C(- 297.0°F)
- The edge of boiling over of ethane is – 88°C (- 127.3°F)
- The fume tension of ethane is 3.8453MPa.
Chemical Properties of Ethane
In its chemical behavior ethane closely resembles methane,
- Stability: It is extremely stable to most reagents. Thus strong oxidizing agents like potassium permanganate and chromic acid, alkalis, concentrated nitric and sulphuric acids have no action on ethane.
- Halogenation: Ethane reacts with chlorine in diffused daylight when all the 6 “H” atoms are replaced in turn by chlorine atoms yielding a mixture of various chloro- derivatives.
CH3.CH3 + Cl2 → CH3.CH2Cl
CH3.CH2Cl + Cl2 → CH2Cl.CH2Cl + HCl → CH3CHCl2 + HCl
- Nitration: Ethane reacts with nitric acid vapor at 400°C to form nitroethane.
C2H6 + HONO2 → C2H5NO2 + H2O
Some nitromethane is also produced by cleavage of the carbon bonds at elevated temperatures.
- Oxidation: Ethane burns in air or oxygen with a slightly luminous flame, yielding carbon dioxide and water.
2C2H6 + 7O2 → 4CO2 + 6H2O + 736.8 Cals
Uses/Applications of Ethane
- Ethane is primarily used as the raw material for the production of ethylene for everything from antifreeze to further production of plastics, fruit ripening, and detergent making.
- Used in the preparation of ethanol, acetaldehyde, and acetic acid which find use in paints, varnishes, adhesive, plastic, etc
- In scientific research, it is used in liquid form for vitrifying water-rich materials.
- Used in the petrochemical industry as a fraction of that produced in the natural gas liquids plants as liquefied for use as fuel for automobiles.
- It is also used to form ethyl chloride which is used to make tetraethyl lead.
- Used as the most specific volatile marker for the investigation of lipid peroxidation. So, these are some of the basic or we can say common uses of ethane.
Conclusion
As we have discussed so much about ethane then we should know its common name which is dimethyl as it has two methyl groups present. Also in everyday life, we must have listened to the ethane gas then what is it? It is the ethane itself as we have already discussed that ethane is a colorless, odorless, and compressible gas.
Sample Questions
Question 1: How is the naming done according to IUPAC nomenclature?
Answer:
Based on arrangement naming is additionally done and as it is realized that naming is as indicated by the IUPAC nomenclature since it is standard set in science. This IUPAC standard is utilized all over the place. In like manner to this, as there are single bonds present between the carbon atoms along these lines the suffix “ane” is utilized and as there are two carbon particles accordingly prefix “eth” is utilized which totally makes it ethane, and its equation becomes C2H6.
Question 2: Can ethane be classified as a hydrocarbon?
Answer:
Many homes nowadays make use of natural gas as fuel for warming up our homes and for cooking. There are actually several gases present in natural gas, and ethane has the second largest percentage in natural gas. Ethane is a colorless, odorless, and flammable gas with a chemical formula of C2H6; it has two carbon (C) atoms and six hydrogen (H) atoms. It’s only composed of carbon and hydrogen atoms, so it is classified as a hydrocarbon. The two carbon atoms are bonded together and there are three hydrogen atoms attached to each carbon atom. All of the bonds that we see here are single bonds. For this reason, ethane is classified as an alkane. An alkane is a chemical compound that consists of hydrogen and carbon atoms and is only made of single bonds.
Question 3: What are the uses of ethane?
Answer:
The uses of ethane are as follows: Ethane is primarily used as the raw material for the production of ethylene for further production of plastics, fruit ripening and detergent making scientific research, it is used in liquid form for vitrifying water-rich materials can also be used for producing ethyl alcohol, acetic acids or other similar organic compounds can also be liquefied for use as fuel for automobiles.
Question 4: How is ethane produced?
Answer:
For the removal of various impurities, oil and natural gas must be processed at first production. The processing of natural gas removes hydrocarbons such as ethane, butane, propane and other hydrocarbons from the gas stream, as well as water and other impurities.
- Ethane is also prepared by Wurtz reaction. When methyl bromide or methyl iodide and sodium are heated in the presence of dry ether ethane is formed.
- Ethane is synthesized by reduction of ethyl iodide using zinc + copper couple in alcohol.
Question 5: What happens when ethane reacts with halogens?
Answer:
Ethane reacts with chlorine in diffused daylight when all the 6 “H” atoms are replaced in turn by chlorine atoms yielding a mixture of various chloro- derivatives.
CH3.CH3 + Cl2 → CH3.CH2Cl
CH3.CH2Cl + Cl2 → CH2Cl.CH2Cl + HCl → CH3CHCl2 + HCl
Question 6: How to prepare Ethane from Potassium acetate?
Answer:
Ethane can also be prepared conveniently by the electrolysis of a concentrated solution of potassium acetate.
2CH3COOK → C2H6 + 2CO2 + 2K
Last Updated :
18 Apr, 2022
Like Article
Save Article
Этан C2H6 – это предельный углеводород, содержащий два атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Гомологический ряд этана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение этана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле этана C2H6 атомы водорода располагаются в пространстве в вершинах двух тетраэдров, центрами которых являются атомы углерода
Изомерия этана
Для этана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства этана
Этан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для этана характерны радикальные реакции.
Этан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Этан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании этана сначала образуется хлорэтан:
CH3-CH3 + Cl2 = CH3-CH2Cl + HCl
Хлорэтан может взаимодействовать с хлором и дальше с образованием дихлорэтана, трихлорэтана, тетрахлорметана и т.д.
1.2. Нитрование этана
Этан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в этане замещается на нитрогруппу NO2.
CH3-CH3 + HNO3 = CH3-CH2NO2 + H2O
2. Дегидрирование этана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
3. Окисление этана
Этан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Этан горит с образованием углекислого газа и воды. Реакция горения этана сопровождается выделением большого количества теплоты.
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении этана в недостатке кислорода может образоваться угарный газ СО или сажа С.
Получение этана
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения этана из хлорметана или бромметана. При этом происходит удвоение углеродного скелета.
2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии пропионата натрия с гидроксидом натрия при сплавлении образуется этан и карбонат натрия:
CH3–CH2–COONa + NaOH → CH3–CH2–H + Na2CO3
3. Гидрирование алкенов и алкинов
Этан можно получить из этилена или ацетилена:
При гидрировании этилена образуется этан:
При полном гидрировании ацетилена также образуется этан:
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (3n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
Синтезом Фишера-Тропша можно получить этан:
2CO + 5H2 = C2H6 + 2H2O
5. Получение этана в промышленности
В промышленности этан получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Общее число найденных записей: 1.
Показано записей: 1.
Этан
Брутто-формула:
C2H6
CAS# 74-84-0
Названия
Русский:
English:
- Bimethyl
- Dimethyl
- Ethane(IUPAC)(CAS) [Wiki]
- Ethyl hydride
- Methylmethane
- R 170
Варианты формулы:
H`|C/C`|H;H_(A15,w-)#2_(A-105,d+)H;H_(A-105,w-)#3_(A15,d+)H
Реакции, в которых участвует Этан
-
H3C-CH3 + Br2 «hv»—> H3C-CH2-Br + HBr
-
C2H6 «575-650^oC»—> C2H4 + H2
-
LiCH2CH3 + H2O -> LiOH + C2H6″|^»
-
Mg(C2H5)2 + H2O -> MgO»|v» + 2C2H6″|^»
-
Mg(C2H5)2 + 2HN3 «<0^oC»—> Mg(N3)2″|v» + 2C2H6″|^»