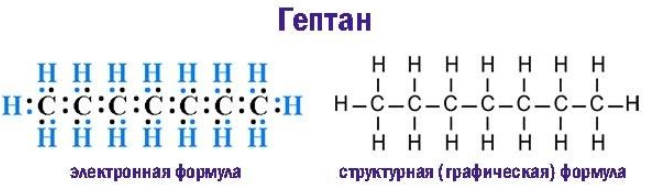
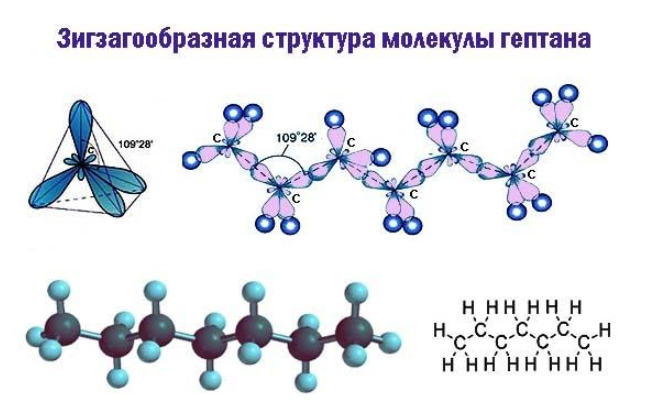
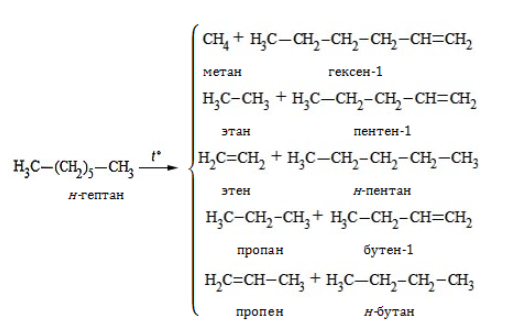
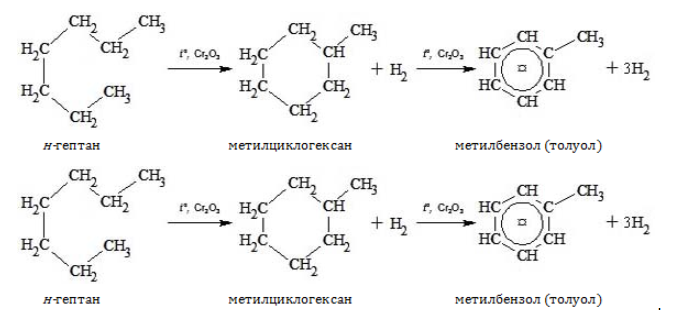
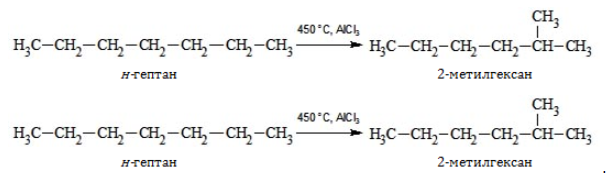
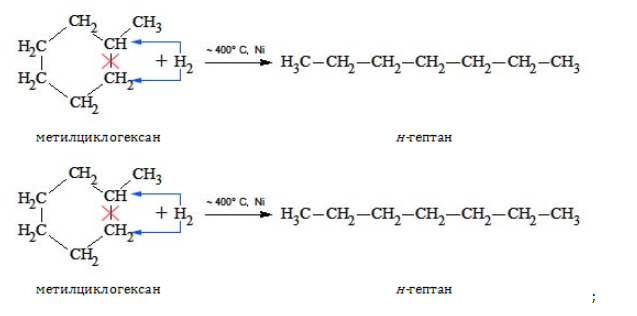
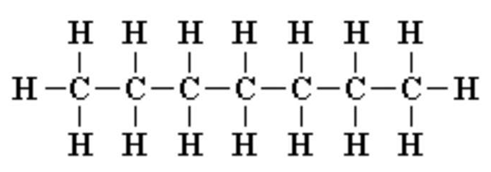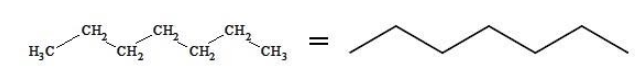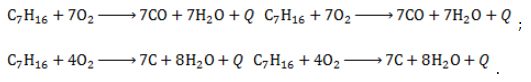Формула гептана
Определение и формула гептана
В обычных условиях представляет собой бесцветную подвижную жидкость, нерастворимую в воде и хорошо растворимую в органических растворителях. Плотность – 0,6795 г/см3.
Химическая формула гептана
Химическая формула гептана C7H16. Она показывает, что в состав данной молекулы входят семь атомов углерода (Ar = 12 а.е.м.) и шестнадцать атомов водорода (Ar = 1 а.е.м.). По химической формуле можно вычислить молекулярную массу гептана:
Mr(C7H16) = 7×Ar(C) + 16×Ar(H);
Mr(C7H16) = 7×12 + 16×1 = 84 + 16 = 100.
Графическая (структурная) формула гептана
Структурная (графическая) формула гептана является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы (рис. 1).
Рис. 1. Графическая формула гептана.
В молекуле гептана можно выделить первичные (т.е. связанные одной связью) и вторичные (т.е. связанные двумя связями)атомы углерода.Атомы углерода в гептане находятся в sp3 –гибридизации.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Содержание
- 1 Химическое строение и формула гептана
- 2 Изомеры гептана
- 2.1 Структурная изомерия
- 2.2 Оптическая изомерия
- 2.3 Список изомеров
- 3 Физические свойства
- 3.1 Свойства изомеров гептана
- 4 Химические свойства
- 5 Получение гептана и его изомеров
- 6 Применение гептана и его изомеров
- 7 Заключение
Гептан – седьмой член гомологического ряда алканов. Вследствие различий в порядке соединения и пространственного расположения атомов в молекуле гептан образует несколько изомеров, проявляющих разные свойства. Источником получения гептана служат нефть и нефтепродукты, попутный и природный газ.
Химическое строение и формула гептана
Предельные углеводороды, к числу которых относится гептан, характеризуются полным насыщением всех валентностей углерода. Располагая каждый четырьмя свободными валентностями, sp3-гибридизованные углеродные атомы в молекулах алканов образуют насыщенные водородом цепочки состава .Молекула гептана, скелет которой составлен семью атомами углерода, описывается химической формулой С7H16.
Каждая общая электронная пара, возникающая при взаимодействии атомов, соответствует одинарной (простой) ковалентной -связи. Строение молекулы графически выражают электронная и структурная формулы:
Скелетная формула представляет строение гептана в компактном виде как зигзагообразную линию. Атомы, формирующие углеродный скелет, находятся в вершинах и на концах линии; при записи их обозначения обычно опускают:
В двумерной форме зигзаг более точно показывает строение молекулы, так как ориентация связей C-C соответствует углу , который образуется между валентными орбиталями при sp3-гибридизации.
Изомеры гептана
Благодаря возможности ветвления углеродного скелета и пространственным различиям в положении одинаковых алкильных радикалов соединениям состава свойственна изомерия. Всего у гептана насчитывается 11 изомерных вариантов.
Структурная изомерия
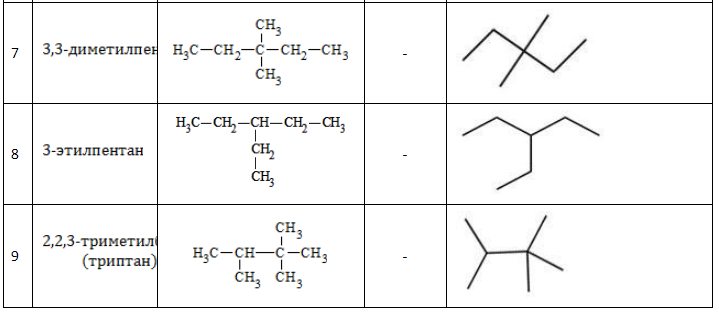
Существует девять изомеров с химической формулой C7H16, различающихся строением молекулы. По длине главной углеродной цепочки, по типу и числу радикалов они подразделяются следующим образом:
Оптическая изомерия
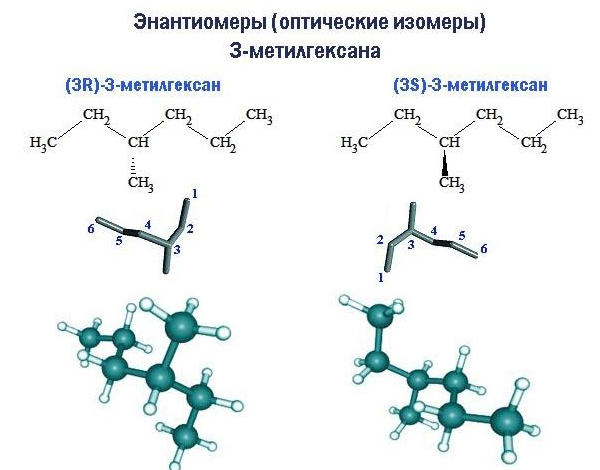
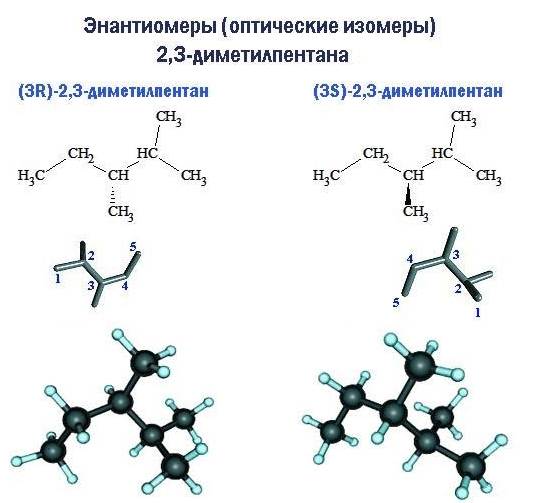
Если при одинаковой структуре молекулы расположение радикалов таково, что молекула не имеет зеркальной симметрии, возникает пространственная изомерия оптического типа.
Молекулы оптических изомеров (иначе называемых энантиомерами) обладают свойством хиральности: зеркально отображая друг друга, они при вращении не становятся идентичными. Примером хиральности является отличие правой ладони от левой. Центром хиральности молекулы является тот атом углерода, к которому у энантиомеров присоединены радикалы, по-разному ориентированные в пространстве.
Хиральность свойственна двум из девяти структурных изомеров гептана. Каждое из этих соединений – 3-метилгексан и 2,3-диметилпентан – существует в форме двух энантиомеров, обозначаемых как правый (R) и левый (S) изомеры. При этом указывается номер центра хиральности в углеродной цепи.
В среде с оптической активностью или в химической реакции с другим хиральным соединением энантиомеры ведут себя различно. В других случаях их свойства одинаковы.
Список изомеров
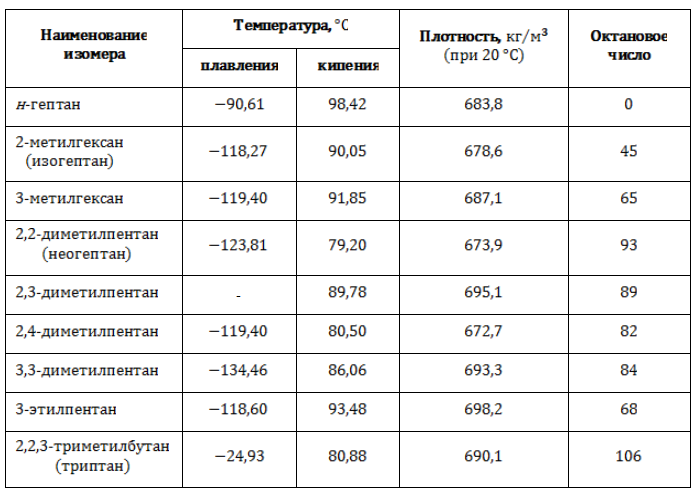
Все изомеры гептана с названиями и формулами, с учетом наличия энантиомеров, перечислены в таблице:

Физические свойства
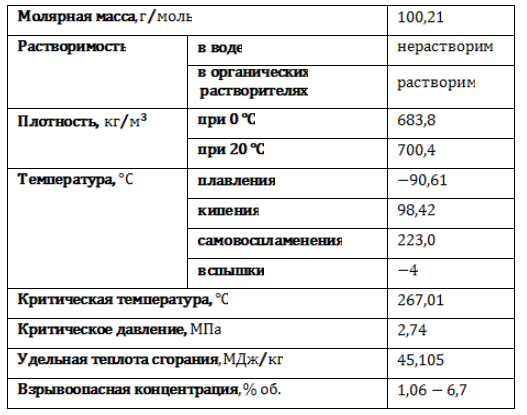
Гептан в обычных условиях представляет собой легкую подвижную жидкость с резким специфическим запахом, без цвета. Пары гептана тяжелее воздуха и образуют с ним взрывоопасную смесь. Основные физические свойства н-гептана приведены в таблице:
Свойства изомеров гептана
Различия в строении молекулы являются причиной неодинаковости плотностных и термических характеристик изомеров, в том числе и такой важной, как детонационные свойства.
Устойчивость горючего к взрыву при сжатии выражают через октановое число, сравнивая топливо с эталоном. В состав эталонной смеси входят н-гептан, который крайне склонен к детонации, и чрезвычайно устойчивый к ней изооктан. Процентное содержание изооктана в эталонной смеси называется октановым числом.
Существует зависимость между степенью разветвленности молекулы и стойкостью углеводорода к детонации. Чем больше алкильных радикалов и, соответственно, третичных и четвертичных углеродных атомов содержит молекула, тем выше антидетонационная характеристика и качество топлива.
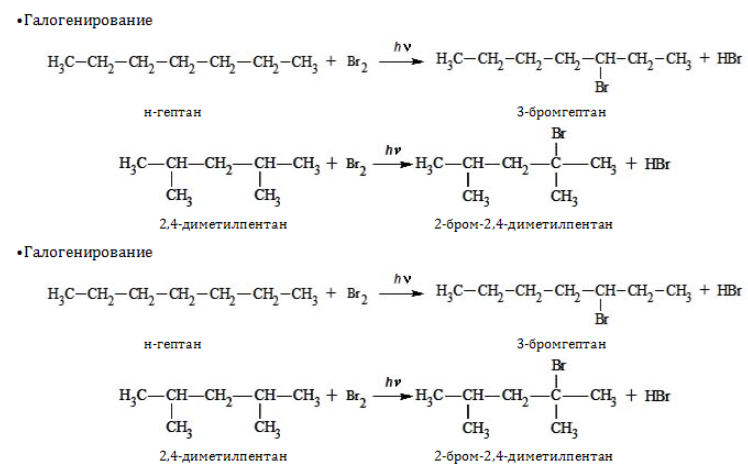
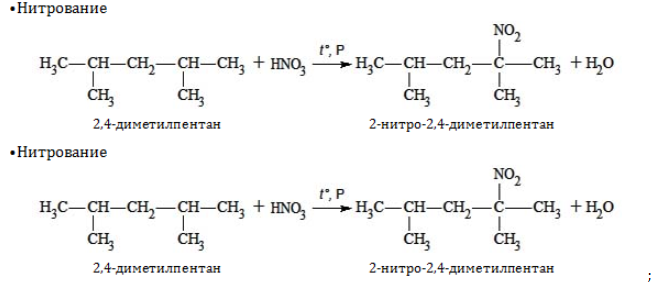
Химические свойства
Гептан и его изомеры – предельные углеводороды и проявляют все химические свойства, присущие данному классу органических соединений. Вследствие насыщенного характера всех связей они вступают только в реакции, протекающие с разрывом ковалентной связи. При этом, как правило, необходимо подвергнуть реагенты нагреванию и использовать катализаторы.
1. Замещение:
2. Окисление:
При недостатке кислорода продуктами неполного сгорания гептана являются угарный газ и сажа:
3. Разложение на низшие алканы и алкены при нагревании без доступа кислорода (крекинг):
4. Дегидрирование с образованием циклического углеводорода (дегидроциклизация):
5. Изомеризация с ветвлением углеродного скелета:
Получение гептана и его изомеров
Промышленное получение соединений с химическим составом С7H16 проводится при добыче и переработке природного газа и нефти либо методом синтеза Фишера–Тропша наряду с прочими углеводородами:
В лабораторной практике гептан и изомеры синтезируются следующими способами:
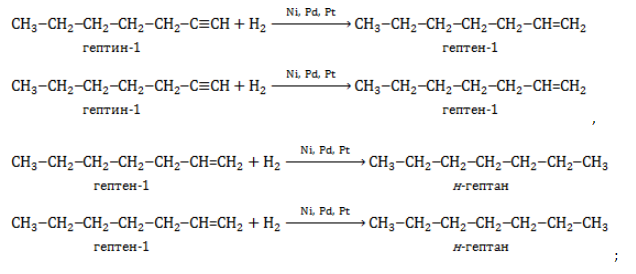
- гидрирование и дециклизация циклоалканов:
- гидрирование алкинов и алкенов:
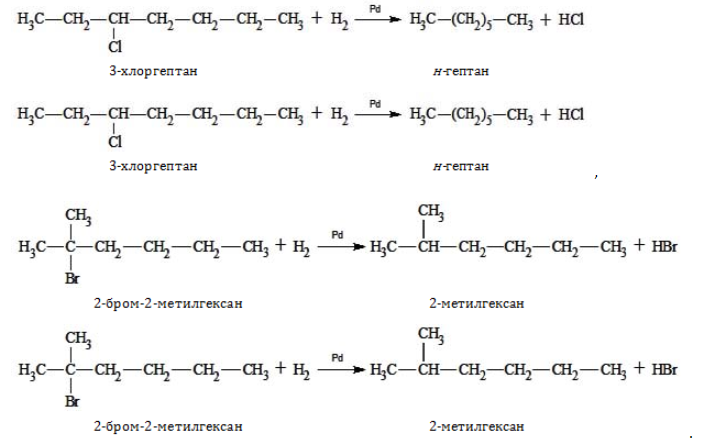
- восстановление галогенпроизводных предельных углеводородов:
Применение гептана и его изомеров
Углеводороды состава C7H16 используются в различных отраслях в зависимости от свойств.
1. В топливной промышленности находят применение:
- н-гептан – в качестве компонента эталонной смеси для определения антидетонационных качеств горючего;
- 2,2,3-триметилбутан (триптан) повышает устойчивость к детонации и добавляется в бензин как присадка.
2. В нефтепереработке и химической промышленности:
- н-гептан играет важную роль в процессах циклизации и ароматизации углеводородов, например, при получении толуола.
3. В качестве растворителя (чистый н-гептан либо в смеси с изомерами):
- для обработки склеиваемых поверхностей в производстве различных изделий из пластических масс;
- в технологиях экстрагирования растительных масел.
Это интересно:
Изомеры октана
Изомеры органических веществ
Заключение
В отношении пожаро- и взрывоопасности гептан входит в число опасных грузов III класса (легковоспламеняющиеся жидкости). Гептан оказывает раздражающее воздействие на центральную нервную систему и по шкале токсикологической опасности относится к веществам IV класса. При длительной работе с ним необходимо защищать кожные покровы и органы дыхания.
При использовании защитных средств, соблюдении герметичности тары и оборудования, вентиляции помещений работа с гептаном не представляет угрозы. Большим преимуществом гептана, как и прочих жидких углеводородов, является удобство хранения и транспортировки по сравнению с газообразными низшими алканами.
Cоставьте молекулярную, полную и сокращенную структурную формулу гептана, структурные формулы двух его изомеров и одного гомолога.
Помогите пожалуйста, отдам все 34 балла за один правильный, но верный ответ.
Можете ответить в виде фотографии(прикрепить её к ответу).
.
Вы перешли к вопросу Cоставьте молекулярную, полную и сокращенную структурную формулу гептана, структурные формулы двух его изомеров и одного гомолога?. Он относится к категории Химия,
для 10 — 11 классов. Здесь размещен ответ по заданным параметрам. Если этот
вариант ответа не полностью вас удовлетворяет, то с помощью автоматического
умного поиска можно найти другие вопросы по этой же теме, в категории
Химия. В случае если ответы на похожие вопросы не раскрывают в полном
объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части
сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете
ознакомиться с вариантами ответов пользователей.
Светило науки — 293 ответа — 889 раз оказано помощи
Класс: Алканы
Вещество: Гептан (C7H16)
Структурная формула (см. ниже):
H3C — CH2 — CH2 — CH2 — CH2 — CH2 — CH3
Гомологи (ближайшие) (см. ниже):
1) Гексан (C6H14)
2) Октан (C8H18)
Изомеры (см. ниже):
2-Метилгексан Н3С – СН (СН3) — СН2 — СН2 — СН2 — СН3
3-Метилгексан Н3С – СН2 — СН (СН3) — СН2 — СН2 — СН3
2,2-Диметилпентан (Н3С) 3 — С — СН2 — СН2 — СН3
2,3-Диметилпентан (Н3С) 2 — СН – СН (СН3) — СН2 — СН3
2,4-Диметилпентан (Н3С) 2- СН – СН2 – СН — (СН3)2
3,3-Диметилпентан Н3С – СН2 – С (СН3)2- СН2 — СН3
3-Этилпентан Н3С – СН2– СН (СН2СН3) — СН2 — СН3
2,2,3-Триметилбутан (Н3С) 3 — С — СН (СН3) — СН3
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.