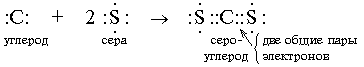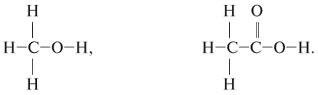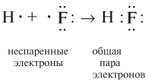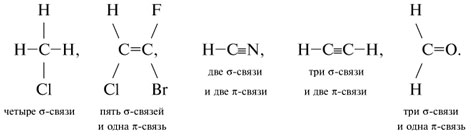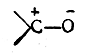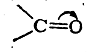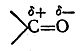From Wikipedia, the free encyclopedia
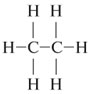
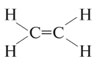
A carbon–carbon bond is a covalent bond between two carbon atoms.[1] The most common form is the single bond: a bond composed of two electrons, one from each of the two atoms. The carbon–carbon single bond is a sigma bond and is formed between one hybridized orbital from each of the carbon atoms. In ethane, the orbitals are sp3-hybridized orbitals, but single bonds formed between carbon atoms with other hybridizations do occur (e.g. sp2 to sp2). In fact, the carbon atoms in the single bond need not be of the same hybridization. Carbon atoms can also form double bonds in compounds called alkenes or triple bonds in compounds called alkynes. A double bond is formed with an sp2-hybridized orbital and a p-orbital that is not involved in the hybridization. A triple bond is formed with an sp-hybridized orbital and two p-orbitals from each atom. The use of the p-orbitals forms a pi bond.[2]
Chains and branching[edit]
Carbon is one of the few elements that can form long chains of its own atoms, a property called catenation. This coupled with the strength of the carbon–carbon bond gives rise to an enormous number of molecular forms, many of which are important structural elements of life, so carbon compounds have their own field of study: organic chemistry.
Branching is also common in C−C skeletons. Carbon atoms in a molecule are categorized by the number of carbon neighbors they have:
- A primary carbon has one carbon neighbor.
- A secondary carbon has two carbon neighbors.
- A tertiary carbon has three carbon neighbors.
- A quaternary carbon has four carbon neighbors.
In «structurally complex organic molecules», it is the three-dimensional orientation of the carbon–carbon bonds at quaternary loci which dictates the shape of the molecule.[3] Further, quaternary loci are found in many biologically active small molecules, such as cortisone and morphine.[3]
Synthesis[edit]
Carbon–carbon bond-forming reactions are organic reactions in which a new carbon–carbon bond is formed. They are important in the production of many man-made chemicals such as pharmaceuticals and plastics. The reverse reaction, where a carbon-carbon bond is broken, is known as carbon-carbon bond activation.
Some examples of reactions which form carbon–carbon bonds are the aldol reaction, Diels–Alder reaction, Grignard reaction, cross-coupling reactions, the Michael reaction and the Wittig reaction.
The directed synthesis of desired three-dimensional structures for tertiary carbons was largely solved during the late 20th century, but the same ability to direct quaternary carbon synthesis did not start to emerge until the first decade of the 21st century.[3]
Bond strengths and lengths[edit]
The carbon-carbon single bond is weaker than C-H, O-H, N-H, H-H, H-Cl, C-F, and many double or triple bonds, and comparable in strength to C-O, Si-O, P-O, and S-H bonds,[4] but is commonly considered as strong.
| C–C bond | Molecule | Bond dissociation energy (kcal/mol) |
|---|---|---|
| CH3−CH3 | ethane | 90 |
| C6H5−CH3 | toluene | 102 |
| C6H5−C6H5 | biphenyl | 114 |
| CH3C(O)−CH3 | acetone | 84 |
| CH3−CN | acetonitrile | 136 |
| CH3−CH2OH | ethanol | 88 |
The values given above represent C-C bond dissociation energies that are commonly encountered; occasionally, outliers may deviate drastically from this range.
| Molecule | Ethane | Ethylene | Acetylene |
|---|---|---|---|
| Formula | C2H6 | C2H4 | C2H2 |
| Class | alkane | alkene | alkyne |
| Structure | 
|

|

|
| Hybridisation of carbon | sp3 | sp2 | sp |
| C-C bond length | 153.5 pm | 133.9 pm | 120.3 pm |
| Proportion of C-C single bond | 100% | 87% | 78% |
| Structure determination method | microwave spectroscopy | microwave spectroscopy | infrared spectroscopy |
Extreme cases[edit]
Long, weak C-C single bonds[edit]
Various extreme cases have been identified where the C-C bond is elongated. In Gomberg’s dimer, one C-C bond is rather long at 159.7 picometers. It is this bond that reversibly and readily breaks at room temperature in solution:[6]
In the even more congested molecule hexakis(3,5-di-tert-butylphenyl)ethane, the bond dissociation energy to form the stabilized triarylmethyl radical is only 8 kcal/mol. Also a consequence of its severe steric congestion, hexakis(3,5-di-tert-butylphenyl)ethane has a greatly elongated central bond with a length of 167 pm.[7]
Twisted, weak C-C double bonds[edit]
The structure of tetrakis(dimethylamino)ethylene (TDAE) is highly distorted. The dihedral angle for the two N2C ends is 28º although the C=C distance is normal 135 pm. The nearly isostructural tetraisopropylethylene also has a C=C distance of 135 pm, but its C6 core is planar.[8]
Short, strong C-C triple bonds[edit]
On the opposite extreme, the central carbon–carbon single bond of diacetylene is very strong at 160 kcal/mol, as the single bond joins two carbons of sp hybridization.[9] Carbon–carbon multiple bonds are generally stronger; the double bond of ethylene and triple bond of acetylene have been determined to have bond dissociation energies of 174 and 230 kcal/mol, respectively.[10] A very short triple bond of 115 pm has been observed for the iodonium species [HC≡C–I+Ph][CF3SO3–], due to the strongly electron-withdrawing iodonium moiety.[11]
See also[edit]
- Carbon–hydrogen bond
- Carbon–oxygen bond
- Carbon–nitrogen bond
References[edit]
- ^ Dembicki, Harry (2016-10-06). Practical Petroleum Geochemistry for Exploration and Production. Elsevier. p. 7. ISBN 9780128033517.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ a b c Quasdorf, Kyle W.; Overman, Larry E. (2014). «Review: Catalytic enantioselective synthesis of quaternary carbon stereocentres». Nature (paper). 516 (7530): 181–191. Bibcode:2014Natur.516..181Q. doi:10.1038/nature14007. PMC 4697831. PMID 25503231.
- ^ Yu-Ran Luo and Jin-Pei Cheng «Bond Dissociation Energies» in CRC Handbook of Chemistry and Physics, 96th Edition.
- ^ CRC Handbook of Chemistry and Physics, 88th edition
- ^ Bochkarev, L. N.; Molosnova, N. E.; Zakharov, L. N.; Fukin, G. K.; Yanovsky, A. I.; Struchkov, Y. T. (1995). «1-Diphenylmethylene-4-(triphenylmethyl)cyclohexa-2,5-diene Benzene Solvate». Acta Crystallographica Section C Crystal Structure Communications. 51 (3): 489–491. doi:10.1107/S0108270194009005.
- ^ Rösel, Sören; Balestrieri, Ciro; Schreiner, Peter R. (2017). «Sizing the role of London dispersion in the dissociation of all-meta tert-butyl hexaphenylethane». Chemical Science. 8 (1): 405–410. doi:10.1039/c6sc02727j. ISSN 2041-6520. PMC 5365070. PMID 28451185.
- ^ Bock, Hans; Borrmann, Horst; Havlas, Zdenek; Oberhammer, Heinz; Ruppert, Klaus; Simon, Arndt (1991). «Tetrakis(dimethylamino)ethene: An Extremely Electron-Rich Molecule with Unusual Structure both in the Crystal and in the Gas Phase». Angewandte Chemie International Edition in English. 30 (12): 1678–1681. doi:10.1002/anie.199116781.
- ^ «NIST Webbook».
- ^ Blanksby, Stephen J.; Ellison, G. Barney (April 2003). «Bond Dissociation Energies of Organic Molecules». Accounts of Chemical Research. 36 (4): 255–263. CiteSeerX 10.1.1.616.3043. doi:10.1021/ar020230d. ISSN 0001-4842. PMID 12693923.
- ^ Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. (1992). Introduction to organic chemistry (4th ed.). Upper Saddle River, N.J.: Prentice Hall. p. 574. ISBN 978-0139738500. OCLC 52836313.
Углерод-углеродную связь представляет собой ковалентную связь между двумя углеродными атомами . Наиболее распространенной формой является одинарная связь : связь, состоящая из двух электронов , по одному от каждого из двух атомов. Одинарная связь углерод-углерод является сигма-связью и образуется между одной гибридизированной орбиталью каждого из атомов углерода. В этане орбитали являются sp 3 — гибридизированными орбиталями, но одинарные связи, образованные между атомами углерода с другими гибридизациями, действительно возникают (например, sp 2 к sp 2 ). Фактически, атомы углерода в одинарной связи не обязательно должны иметь одинаковую гибридизацию. Атомы углерода также могут образовывать двойные связи в соединениях, называемых алкенами, или тройные связи в соединениях, называемых алкинами . Двойная связь образуется с sp 2 -гибридизованной орбиталью и p-орбиталью, которая не участвует в гибридизации. Тройная связь образуется с sp-гибридизированной орбиталью и двумя p-орбиталями от каждого атома. Использование p-орбиталей образует пи-связь .
Цепи и разветвления
Углерод — один из немногих элементов, которые могут образовывать длинные цепочки из собственных атомов — свойство, называемое катенацией . В сочетании с прочностью углеродно-углеродной связи это дает начало огромному количеству молекулярных форм, многие из которых являются важными структурными элементами жизни, поэтому у углеродных соединений есть своя собственная область изучения: органическая химия .
Ветвление также характерно для скелетов C − C. Атомы углерода в молекуле классифицируются по количеству углеродных соседей, которые у них есть:
- Первичный углерод имеет один сосед углерода.
- Вторичный углерод имеет два углеродных соседей.
- У третичного углерода есть три атома углерода.
- Четвертичный углерод имеет четыре углеродных соседей.
В «структурно сложных органических молекулах» именно трехмерная ориентация углерод-углеродных связей в четвертичных локусах определяет форму молекулы. Кроме того, четвертичные локусы обнаруживаются во многих биологически активных малых молекулах, таких как кортизон и морфин .
Синтез
Реакции образования углерод-углеродной связи — это органические реакции, в которых образуется новая углерод-углеродная связь. Они важны при производстве многих искусственных химикатов, таких как фармацевтические препараты и пластмассы .
Некоторые примеры реакций , которые образуют углерод-углеродные связи являются альдольной реакции , Дильса-Альдера , добавление реагента Гриньяра к карбонильной группе , в реакции Хека , в реакции Михаэля и реакции Виттига .
Направленный синтез желаемых трехмерных структур третичных углеродов был в значительной степени решен в конце 20- го века, но та же способность управлять четвертичным углеродным синтезом не начала проявляться до первого десятилетия 21- го века.
Прочность и длина склеивания
Одинарная связь углерод-углерод слабее, чем CH, OH, NH, HH, H-Cl, CF и многие двойные или тройные связи, и сравнима по прочности со связями CO, Si-O, PO и SH, но обычно считается сильным.
| Связь C – C | Молекула | Энергия диссоциации связи (ккал / моль) |
|---|---|---|
| СН 3 -СН 3 | этан | 90 |
| С 6 Н 5 -СН 3 | толуол | 102 |
| С 6 Н 5 -С 6 Н 5 | бифенил | 114 |
| СН 3 С (О) -СН 3 | ацетон | 84 |
| CH 3 -CN | ацетонитрил | 136 |
| СН 3 -СН 2 ОН | спирт этиловый | 88 |
Приведенные выше значения представляют энергии диссоциации связи CC, которые обычно встречаются; иногда выбросы могут резко отклоняться от этого диапазона.
| Молекула | Этан | Этилен | Ацетилен |
|---|---|---|---|
| Формула | С 2 Н 6 | С 2 Н 4 | С 2 Н 2 |
| Класс | алкан | алкен | алкин |
| Состав |

|

|

|
| Гибридизация углерода | sp 3 | sp 2 | зр |
| Длина CC облигации | 1,535 Å | 1,339 Å | 1,203 Å |
| Доля одинарной облигации СС | 100% | 87% | 78% |
| Метод определения структуры | микроволновая спектроскопия | микроволновая спектроскопия | ИК-спектроскопия |
Крайние случаи
Длинные, слабые одинарные связи CC
Были выявлены различные крайние случаи, когда связь CC удлинена. В димере Гомберга одна CC-связь довольно длинная и составляет 159,7 пикометров . Именно эта связь обратимо и легко разрывается при комнатной температуре в растворе:
В еще более загруженной молекуле гексакис (3,5-ди- трет- бутилфенил) этана энергия диссоциации связи с образованием стабилизированного триарилметильного радикала составляет всего 8 ккал / моль. Гексакис (3,5-ди- трет- бутилфенил) этан также является следствием серьезной стерической перегрузки и имеет сильно вытянутую центральную связь длиной 167 мкм.
Скрученные, слабые двойные связи CC
Структура тетракис (диметиламино) этилена (ТДАЭ) сильно искажена. Двугранный угол для два Н 2 концов С 28º , хотя С = С расстоянием нормально 135 мкм. Почти изоструктурный тетраизопропилэтилен также имеет расстояние C = C 135 мкм, но его ядро C 6 является плоским.
Короткие, прочные тройные облигации СС
С другой стороны, центральная одинарная связь углерод-углерод диацетилена очень сильна при 160 ккал / моль, поскольку одинарная связь соединяет два атома углерода в результате sp-гибридизации. Множественные связи углерод-углерод обычно прочнее; двойная связь этилена и тройная связь ацетилена имеют энергии диссоциации связи 174 и 230 ккал / моль соответственно. Очень короткая тройная связь 115 пм наблюдалась для разновидностей иодония [HC≡C – I + Ph] [CF 3 SO 3 — ] из-за сильно электроноакцепторного иодониевого фрагмента.
Смотрите также
- Связь углерод – водород
использованная литература
Органическая химия – это химия углерода и его соединений с другими элементами.
В молекулах органических веществ могут присутствовать также атомы: водорода Н, кислорода О, азота N, серы S, фосфора P, галогенов, металлов и других элементов.
Количество известных органических соединений в настоящее время превышает 20 миллионов.
Углерод в органических веществах
Атомы углерода могут соединяться друг с другом с образованием цепей различного строения (разветвленные, неразветвленные, замкнутые) и длины (от двух до сотен тысяч атомов углерода).
В органических веществах углерод имеет валентность IV (образует 4 связи).
- Атом углерода может образовывать одинарные, двойные и тройные связи.
CH3-CH3 CH2=CH2 CH≡CH
В основе современной органической химии лежит теория строения органических соединений.
Основные положения теории строения органических соединений
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения).
- Свойства веществ зависят не только от вида и числа атомов в молекуле, но и от их взаимного расположения – т.е. от строения молекулы.
Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т. е. к появлению изомерии.
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
| Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилпропан) с разветвленным скелетом | |
|
н-Бутан CH3-CH2-CH2-CH3 |
Изобутан CH3-CH(CH3)-CH3 |
При этом температура кипения н-бутана -0,5оС, а изобутана -11,4оС.
- По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы – определить свойства.
- Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Это отражается на химических и физических свойствах вещества.
Формулы строения органических веществ
Состав органического вещества можно описать химическими формулами.
Химические формулы органических веществ бывают следующих типов:
Простейшая формула – может быть получена опытным путем через определение соотношения количества атомов химических элементов в веществе.
Например, простейшая формула метана CH4, а вот бензола – СН.
Истинная формула (брутто-формула) – показывает истинный состав молекулы, но не показывает ее структуру. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле.
Например, истинная формула бензола C6H6.
Полная (развернутая) структурная формула однозначно описывает порядок соединения атомов в молекуле.
Например, полная структурная формула бутана:
Сокращенная структурная формула – это структурная формула, в которой не указываются связи между углеродом и водородом.
Например, сокращенная структурная формула бутана:
CH3-CH2-CH2-CH3
Типы углеродных атомов в составе органических молекул
Типы углеродных атомов в составе органических молекул
|
Атомы углерода |
|||
| Первичные | Вторичные | Третичные | Четвертичные |
| Атомы углерода, которые в углеродной цепи соединены с одним атомом углерода | Атомы углерода, которые в углеродной цепи соединены с двумя атомами углерода | Атомы углерода, которые в углеродной цепи соединены с тремя атомами углерода | Атомы углерода, которые в углеродной цепи соединены с четырьмя атомами углерода |
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов.
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
Виды σ-связей
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь
С–С, С–Н, С–О |
Двойная связь
С=С, С=О |
Тройная связь
С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
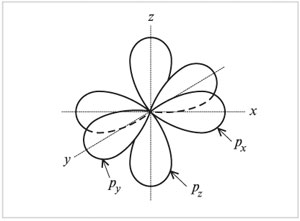
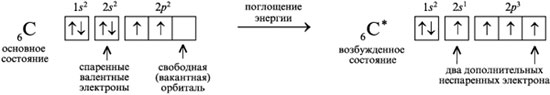
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s22s22p2
+6С 1s 2s
2p
В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С* 1s22s12p3
+6С* 1s2 2s1
2p3
Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы.
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp3, sp2 и sp-гибридизация.
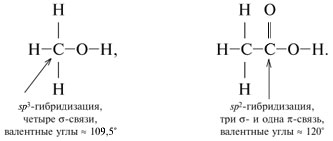
sp3-Гибридизация
В sp3-гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp3-гибридные орбитали:
Изображение с портала orgchem.ru
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в состоянии sp3-гибридизации направлены в пространстве под углом 109о 28’ друг к другу, что соответствует тетраэдрическому строению.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109о 28’
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Например, пространственное строение н-бутана
sp2-Гибридизация
В sp2-гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три sp2-гибридные орбитали атома углерода направлены в пространстве под углом 120о друг к другу, что соответствует плоскому строению (треугольник).
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp2— орбитали.
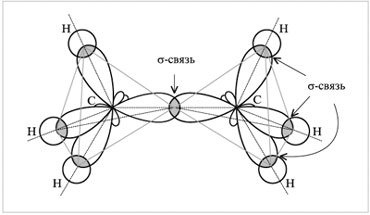
Изображение с портала orgchem.ru
Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp2-гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей.
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180о друг к другу, что соответствует линейному строению.
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
Например, молекула ацетилена имеет линейное строение.
Изомерия
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия)
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле.
Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ.
|
Классификация органических веществ по составу |
||
| Углеводороды | Кислородсодержащие вещества | Азотсодержащие вещества |
| Состоят из атомов углерода и водорода | Содержат также атомы кислорода | Содержат также атомы азота |
Углеводороды
Углеводороды– это вещества, состав которых отражается формулой СхНу, то есть в их составе только атомы углерода и водорода.
В зависимости от типа связей между атомами С, они делятся на предельные или насыщенные (все связи одинарные) и непредельные (ненасыщенные) — в молекуле присутствуют двойные и тройные связи.
Кроме того, углеводороды делятся на циклические (углеродная цепь образует кольцо) и ациклические или алифатические (углеродная цепь не замкнута в кольцо).
| Углеводороды | |||||
| Предельные (содержат только одинарные связи) | Непредельные (содержат двойные или тройные связи между атомами углерода) | ||||
| Алканы | Циклоалканы | Алкены | Алкадиены | Алкины | Ароматические углеводороды |
| Углеводороды с открытой (незамкнутой) углеродной цепью | Атомы углерода соединены в замкнутый цикл | Одна двойная связь | Две двойные связи | Одна тройная связь | Циклические углеводороды с тремя двойными связями (бензольное кольцо) |
| CnH2n+2 | CnH2n | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n-6 |
| Этан
CH3-CH3 |
Циклобутан
|
Этилен
CH2=CH2 |
Дивинил
CH2=CН-СН=СH2 |
Ацетилен
СН≡СН |
Бензол
|
| Ациклические углеводороды | |
| С неразветвленной цепью | С разветвленной углеродной цепью |
| н-Бутан
CH3-CH2-CH2-CH3 |
Изобутан
|
Кислородсодержащие органические вещества
Так как кислород имеет валентность II, он может образовать либо 2 одинарные связи, либо одну двойную. Соответственно, в органической молекуле он соединяется с водородом и углеродом.
- группа –О-Н (гидроксильная)
- группа >С=О (карбонильная)
- группа –СОО- (карбоксильная)
|
Кислородсодержащие органические вещества |
|||||
| Группа ОН | Группа С=О | Группа -СОО- | |||
| Гидроксил | Карбонил | Карбоксил | |||
| Спирт | Фенол | Альдегид | Кетон | Карбоновая кислота | Сложный эфир |
| R-OH |  |
 |
 |
 |
|
| Метанол
CH3-OH |
Фенол
|
Ацетальдегид
|
Пропанон
|
Уксусная кислота
|
Метилацетат
|
Азотсодержащие органические вещества
Азотсодержащие вещества можно также разделить на классы по наличию определенных функциональных групп.
- амины – содержат группы –NН2, –NH–, либо -N< ,
- нитрилы (группа –СºN),
- азотистые гетероциклы.
Некоторые органические вещества содержат и азот, и кислород.
К ним относятся:
- нитросоединения –NO2
- амиды –CONH2,
- аминокислоты – полифункциональные соединения, которые содержат и карбоксильную группу –COOH, и аминогруппу –NH2
| Азотсодержащие вещества | |||||
| Амины | Нитрилы | Нитросоединения | Амиды | Аминокислоты | Гетероциклы |
| -NH2
-NH- -N< |
-C≡N | R-NO2 | R-C(NH2)=O | -NH2, -COOH | |
| Метиламин
CH3-NH2 |
Нитрил уксусной кислоты
CH3-C≡N |
Нитрометан
CH3-NO2 |
Амид уксусной кислоты
CH3-C(NH2)=O |
Аминоуксусная кислота
CH2(NH2)-COOH |
Пиррол
|
Другие органические вещества
Органические соединения очень многочисленны и разнообразны.
К важным классам органических соединений также относятся галогенопроизводные органические вещества R–Hal ,которые содержат также атомы галогенов (хлора, фтора, брома и др.).
В состав органических соединений также могут входить несколько одинаковых или различных функциональных групп.
Гомологи. Гомологический ряд
Органические вещества разных классов тесно взаимосвязаны.
Соединения, содержащие одинаковые функциональные свойства, проявляют схожие химические и физические свойства.
Вещества, которые содержат одинаковые функциональные группы, имеют сходное строение, но отличаются друг от друга на одну или несколько групп –СH2–, образуют гомологический ряд.
Гомологи – это вещества, которые входят в один и тот же гомологический ряд.
Группу –СH2– называют гомологической разностью.
РАБОЧИЕ ТЕТРАДИ
Продолжение. Начало см. в № 15, 16/2004
Урок 5. Гибридизация
атомных орбиталей углерода
Ковалентная химическая связь образуется при
помощи общих связывающих электронных пар по
типу:
Образовывать химическую связь, т.е. создавать
общую электронную пару с «чужим» электроном от
другого атома, могут только неспаренные
электроны. Неспаренные электроны при записи
электронных формул находятся по одному в
клетке-орбитали.
Атомная орбиталь – это функция, которая
описывает плотность электронного облака в
каждой точке пространства вокруг ядра атома.
Электронное облако – это область пространства, в
которой с высокой вероятностью может быть
обнаружен электрон.
Для согласования электронного строения атома
углерода и валентности этого элемента
пользуются представлениями о возбуждении атома
углерода. В нормальном (невозбужденном)
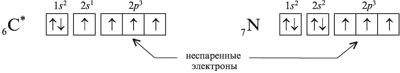
состоянии атом углерода имеет два неспаренных 2р2-электрона.
В возбужденном состоянии (при поглощении
энергии) один из 2s2-электронов может
переходить на свободную р-орбиталь. Тогда в
атоме углерода появляется четыре неспаренных
электрона:
Напомним, что в электронной формуле атома
(например, для углерода 6С – 1s22s22p2)
большие цифры перед буквами – 1, 2 – обозначают
номер энергетического уровня. Буквы s и р
указывают форму электронного облака (орбитали), а
цифры справа над буквами говорят о числе
электронов на данной орбитали. Все s-орбитали
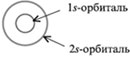
сферические:
На втором энергетическом уровне кроме 2s-орбитали
имеются три 2р-орбитали. Эти 2р-орбитали
имеют эллипсоидную форму, похожую на гантели, и
ориентированы в пространстве под углом 90° друг к
другу. 2р-Орбитали обозначают 2рх, 2рy
и 2рz в соответствии с осями, вдоль
которых эти орбитали расположены.
|
|
Форма и ориентация
|
При образовании химических связей
электронные орбитали приобретают одинаковую
форму. Так, в предельных углеводородах
смешиваются одна s-орбиталь и три р-орбитали
атома углерода с образованием четырех
одинаковых (гибридных) sр3-орбиталей:
Это – sр3-гибридизация.
Гибридизация – выравнивание
(смешивание) атомных орбиталей (s и р) с
образованием новых атомных орбиталей,
называемых гибридными орбиталями.
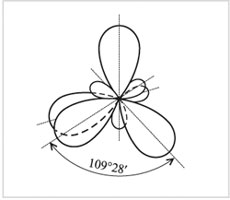 |
Четыре sp3-гибридные орбитали
|
Гибридные орбитали имеют
асимметричную форму, вытянутую в сторону
присоединяемого атома. Электронные облака
взаимно отталкиваются и располагаются в
пространстве максимально далеко друг от друга.
При этом оси четырех sр3-гибридных орбиталей
оказываются направленными к вершинам тетраэдра
(правильной треугольной пирамиды).
Соответственно углы между этими орбиталями –
тетраэдрические, равные 109°28′.
Вершины электронных орбиталей могут
перекрываться с орбиталями других атомов. Если
электронные облака перекрываются по линии,
соединяющий центры атомов, то такую ковалентную
связь называют сигма()-связью. Например, в молекуле этана
С2Н6 химическая связь образуется
между двумя атомами углерода перекрыванием двух
гибридных орбиталей. Это -связь. Кроме того, каждый из
атомов углерода своими тремя sр3-орбиталями
перекрывается с s-орбиталями трех атомов
водорода, образуя три -связи.
|
|
Схема перекрывания электронных
|
Всего для атома углерода возможны три
валентных состояния с различным типом
гибридизации. Кроме sр3-гибридизации
существует sр2— и sр-гибридизация.
sр2—Гибридизация – смешивание одной
s— и двух р-орбиталей. В результате
образуются три гибридные sр2-орбитали.
Эти sр2-орбитали расположены в одной
плоскости (с осями х, у) и направлены к
вершинам треугольника с углом между орбиталями
120°. Негибридизованная
р-орбиталь перпендикулярна к плоскости трех
гибридных sр2-орбиталей (ориентирована
вдоль оси z). Верхняя половина р-орбитали
находится над плоскостью, нижняя половина – под
плоскостью.
Тип sр2-гибридизации углерода бывает у
соединений с двойной связью: С=С, С=О, С=N. Причем
только одна из связей между двумя атомами
(например, С=С) может быть -связью. (Другие связывающие
орбитали атома направлены в противоположные
стороны.) Вторая связь образуется в результате
перекрывания негибридных р-орбиталей по обе
стороны от линии, соединяющей ядра атомов.
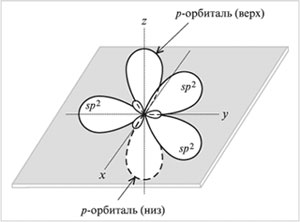 |
Орбитали (три sp2 и одна р)
|
Ковалентная связь, образующаяся путем
бокового перекрывания р-орбиталей соседних
углеродных атомов, называется пи()-связью.
|
|
Образование
|
Из-за меньшего перекрывании орбиталей -связь менее
прочная, чем -связь.
sр—Гибридизация – это смешивание
(выравнивание по форме и энергии) одной s- и
одной
р-орбиталей с образованием двух гибридных sр-орбиталей.
sр-Орбитали расположены на одной линии (под
углом 180°) и направлены в противоположные стороны
от ядра атома углерода. Две
р-орбитали остаются негибридизованными. Они
размещены взаимно перпендикулярно
направлениям -связей. На рисунке sр-орбитали
показаны вдоль оси y, а негибридизованные две
р-орбитали– вдоль осей х и z.
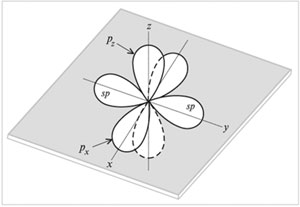 |
Атомные орбитали (две sp и две р)
|
Тройная углерод-углеродная связь СС состоит из
-связи, возникающей
при перекрывании
sp-гибридных орбиталей, и двух -связей.
Взаимосвязь таких параметров атома углерода, как
число присоединенных групп, тип гибридизации и
типы образуемых химических связей, показана в
таблице 4.
Таблица 4
Ковалентные связи углерода
| Число групп, связанных с углеродом |
Тип гибридизации |
Типы участвующих химических связей |
Примеры формул соединений |
|---|---|---|---|
| 4 | sp3 | Четыре |
|
| 3 | sp2 | Три одна |
|
| 2 | sp | Две и две |
H–C |
Упражнения.
1. Какие электроны атомов (например,
углерода или азота) называют неспаренными?
2. Что означает понятие «общие
электронные пары» в соединениях с ковалентной
связью (например, СН4 или Н2S)?
3. Какие электронные состояния атомов
(например, С или N) называют основными, а
какие возбужденными?
4. Что означают цифры и буквы в
электронной формуле атома (например, С или N)?
5. Что такое атомная орбиталь? Сколько
орбиталей на втором энергетическом уровне атома С
и чем они различаются?
6. В чем отличие гибридных орбиталей от
исходных орбиталей, из которых они образовались?
7. Какие типы гибридизации известны
для атома углерода и в чем они заключаются?
8. Нарисуйте картинку
пространственного расположения орбиталей для
одного из электронных состояний атома углерода.
9. Какие химические связи
называют
и какие ?
Укажите —
и —связи в
соединениях:
10. Для атомов углерода приведенных
ниже соединений укажите: а) тип гибридизации; б)
типы его химических связей; в) валентные углы.
Ответы на упражнения к теме 1
Урок 5
1. Электроны, которые находятся по
одному на орбитали, называют неспаренными
электронами. Например, в электронографической
формуле возбужденного атома углерода – четыре
неспаренных электрона, а у атома азота – три:
2. Два электрона, участвующие в
образовании одной химической связи, называют общей
электронной парой. Обычно до образования
химической связи один из электронов этой пары
принадлежал одному атому, а другой электрон –
другому атому:
3. Электронное состояние атома, в
котором соблюдается порядок заполнения
электронных орбиталей: 1s2, 2s2, 2p2,
3s2, 3p2, 4s2, 3d2,
4p2 и т.д., называют основным состоянием.
В возбужденном состоянии один из валентных
электронов атома занимает свободную орбиталь с
более высокой энергией, такой переход
сопровождается разъединением спаренных
электронов. Схематически это записывают так:
Тогда как в основном состоянии было только два
валентных неспаренных электрона, то в
возбужденном состоянии таких электронов
становится четыре.
5. Атомная орбиталь – это функция,
которая описывает плотность электронного облака
в каждой точке пространства вокруг ядра данного
атома. На втором энергетическом уровне атома
углерода четыре орбитали – 2s, 2рx, 2рy,
2рz. Эти орбитали различаются:
а) формой электронного облака (s – шар, р –
гантель);
б) р-орбитали имеют разную ориентацию в
пространстве – вдоль взаимно перпендикулярных
осей x, y и z, их обозначают рx, рy,
рz.
6. Гибридные орбитали отличаются от
исходных (негибридных) орбиталей формой и
энергией. Например, s-орбиталь – форма сферы, р
– симметричная восьмерка, sp-гибридная
орбиталь – асимметричная восьмерка.
Различия по энергии: E(s) < E(sр) < E(р).
Таким образом, sp-орбиталь – усредненная по
форме и энергии орбиталь, полученная смешиванием
исходных s— и p-орбиталей.
7. Для атома углерода известны три типа
гибридизации: sp3, sp2 и sp (см.
текст урока 5).
9. -связь
– ковалентная связь, образующаяся путем
лобового перекрывания орбиталей по линии,
соединяющей центры атомов.
-связь –
ковалентная связь, образующаяся путем бокового
перекрывания р-орбиталей по обе стороны от
линии, соединяющей центры атомов.
-Связи
показывают второй и третьей черточкой между
соединенными атомами.
10.
Электронные представления о простых и кратных углерод-углеродных связях
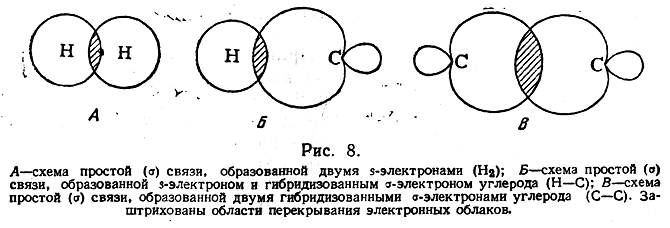
Согласно современным представлениям, необходимым условием для образования химической связи между двумя атомами является перекрывание облаков их электронов. Электрон образует связь в том направлении, в котором расположена наибольшая часть его облака, так что при этом осуществляется максимальное перекрывание облаков двух связующих электронов.
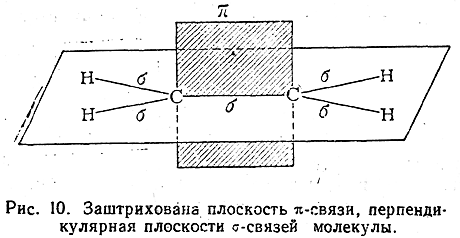
В случае простой связи (изображаемой одной валентной черточкой) максимальное перекрывание осуществляется по прямой, соединяющей два атома (рис. 8). Такая простая кова-лентная связь называется σ-связью, а электроны, ее образующие, — σ-электронами.
В молекуле этана, например, имеется семь σ-связей
расположенных друг относительно друга под углом 109°28′. Атомы углерода в таких соединениях, как говорят, находятся в первом валентном состоянии (sр3-гибридизация).
В молекуле этилена, как это установлено с помощью физических методов исследования, пять σ-связей расположены друг относительно друга под углом 120° и находятся в одной плоскости:
Однако при таком расположении связей в этилене у каждого атома углерода остается по одному неспаренному электрону. Они уже не могут образовать между атомами углерода вторую σ-связь, так как это сопровождалось бы нарушением принципа Паули. Поэтому такие неспаренные электроны атомов углерода образуют качественно иную связь. Перекрывание двух электронных облаков происходит так, что восьмерки этих облаков перпендикулярны плоскости, в которой расположены все шесть атомов молекулы этилена (рис. 9). Такая связь называется π-связью, а электроны, ее образующие, — π-электронами. Так как предполагается, что σ-связи в молекуле этилена образуются с участием гибридизованных электронов, а π-связь — с участием «чистых» р-электронов (т. е. из четырех электронов каждого углеродного атома гибридизованы один s-электрон и только два из трех р-электронов), то гибридизация электронов углеродного атома в молекуле этилена обозначается как sp2-гибридизация.
В молекуле ацетилена углерод находится в третьем валентном состоянии. В этой молекуле все четыре атома расположены на одной прямой и углы между σ-связями составляют 180° (sp-гибридизация). Электронные облака двух π-связей расположены вдоль пересекающихся взаимно-перпендикулярных плоскостей (рис. 11). Таким образом, согласно изложенным выше наглядным представлениям, две углерод-углеродные связи в молекуле этилена и три — в молекуле ацетилена по своему электронному строению не одинаковы. До сих пор, однако, не известно никаких химических или физических экспериментальных фактов, которые могли бы подтвердить это различие. Тот факт, что углеродные атомы, связанные двойными связями, способны легко присоединять только два атома водорода, галоида и т. п., так что одна из углерод-углеродных связей сохраняется, легко согласуется также и с предположением, что обе углерод-углеродные связи одинаковы. В самом деле, если по одной из таких одинаковых углерод-углеродных связей присоединяются, например, два атома водорода, то в результате этого характер второй оставшейся углерод-углеродной связи может измениться иона, отличаясь от двух имевшихся кратных связей в исходном соединении, может быть прочнее, чем каждая из них. На основе такого предположения можно объяснить, почему двойная связь легко присоединяет только два, а тройная — только четыре эквивалента.
Неравноценность связей могла бы быть установлена физическими методами исследования, из которых важное значение имеет, например, определение энергии связей С—С, С=С и С≡С Значения энергии этих связей составляют соответственно 79,3; 140,5; 196,7 ккал/моль (средние значения). Как видно, при образовании второй связи между углеродными атомами общая энергия связи между двумя атомами не становится вдвое большей, а возрастает лишь на 61,2 ккал/моль; отсюда делается вывод, что π-связь слабее σ-связи. Еще меньше увеличивается энергия связи между атомами углерода при возникновении третьей связи (на 56,2 ккал/моль).
Однако и из этих данных все же нельзя сделать однозначного вывода о неравноценности σ- и π-связей. Строго говоря, приведенный ход возрастания энергии связей между двумя атомами может свидетельствовать о различии σ- и π-связей только в том случае, если предварительно сделать допущение, что энергия простой связи С—С по крайней мере существенно не меняется, если рядом с ней возникает вторая связь (при переходе С—С ——> С=С), а затем и третья. Без такого предварительного допущения нельзя аргументировать различие σ- и π-связей приведенными величинами энергии их образования.
π-Связи широко распространены в органических соединениях, причем ими могут быть связаны друг с другом не только атомы углерода, но и атомы азота, сурьмы, мышьяка и т. п., а также атомы углерода с атомами кислорода, азота, серы и др.
В тех случаях, когда связь осуществляется между атомами, различающимися по электроотрицательности, она поляризована, т. е. электроны, ее образующие, смещены в сторону более электроотрицательного атома. При этом поляризация π-связи всегда больше поляризации σ-связи, связызающей те же атомы. Вместе с тем при такой поляризации электроны не переходят целиком из электронной оболочки одного атома в оболочку другого.
Поляризованная π-связь может быть рассмотрена на примере карбонильной группы >С= О. На основании экспериментальных исследований дипольных моментов большого числа альдегидов и кетонов известно, что дипольный момент карбонильной группы составляет примерно 2,7 D. Известно также, что дипольный момент σ-связи С—О (на основан.ии исследования простых эфиров) равен 1,2 D. Если бы поляризация π-связи была такого же порядка, то для карбонильной группы следовало бы ожидать дипольного момента, равного 1,2 + 1,2 = 2,4 D. Однако дипольный момент карбонильной группы в действительности превышает эту величину, а следовательно, π-связь поляризована в большей мере, чем σ-связь С—О. Если, с другой стороны, предположить, что π-связь поляризована до предела и, следовательно, в карбонильной группе имеется семиполярная связь
то в таком случае следовало бы ожидать дипольного момента порядка 5,7D (μ = 4,774 · 10-10 эл.-ст. ед. x 1,2·10-8 см=5,7288D). Следовательно, в карбонильной группе имеется лишь частичная поляризация π-связи. Обычно это изображают следующим образом:
Изогнутая стрелка указывает направление смещения я-элек-тронов, т. е. направление поляризации π-связи.
В результате такой поляризации (а также отчасти и поляризации σ-связи) атом углерода приобретает некоторый (неполный) положительный заряд, а атом кислорода — некоторый отрицательный заряд:
Наличие этих зарядов во многом определяет химическое поведение карбонильных соединений (течение реакций присоединения, замещения и др.).