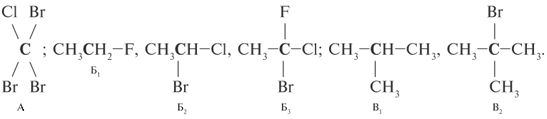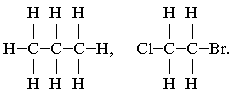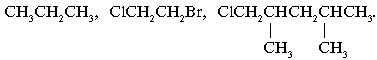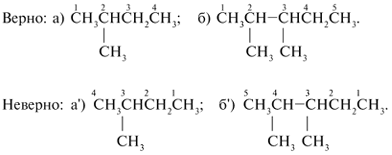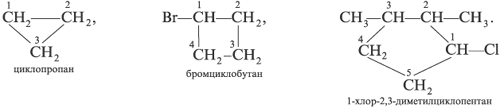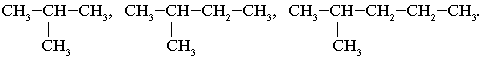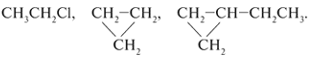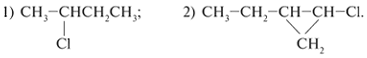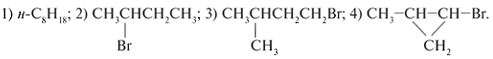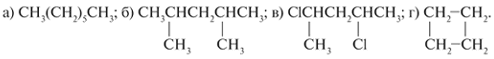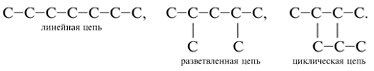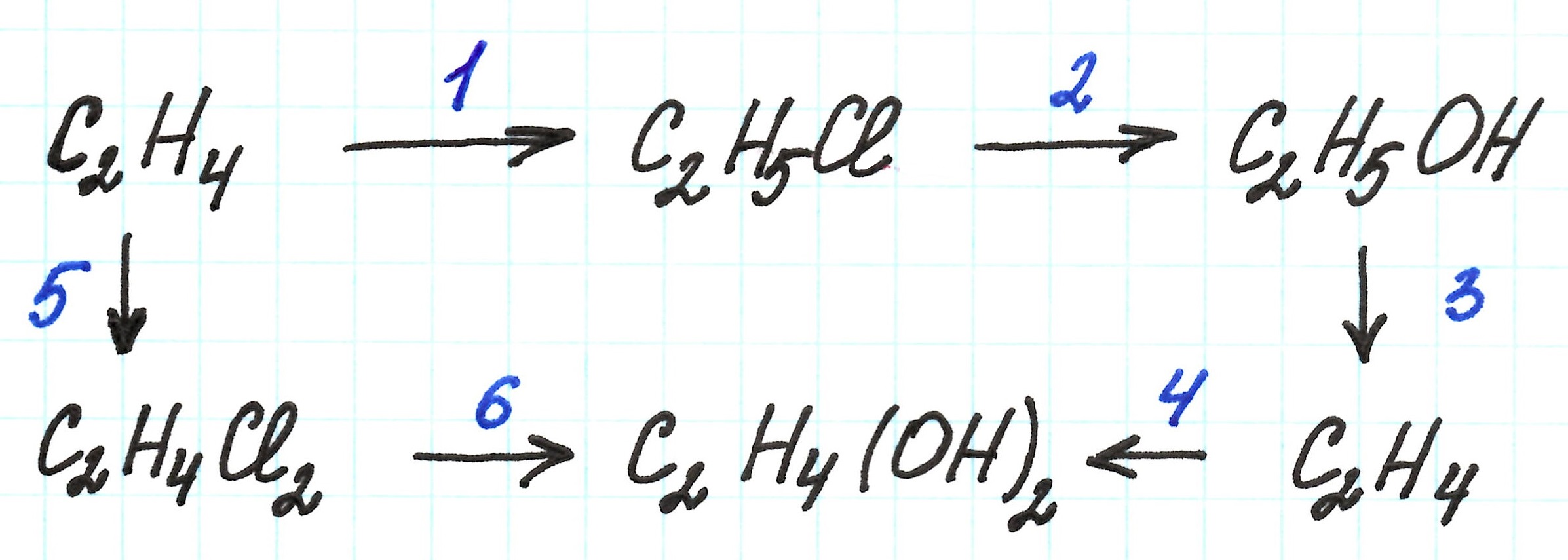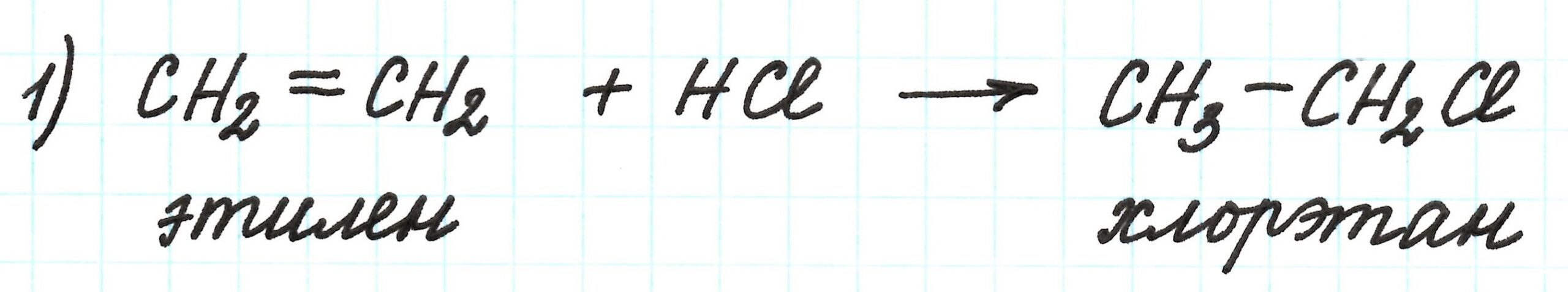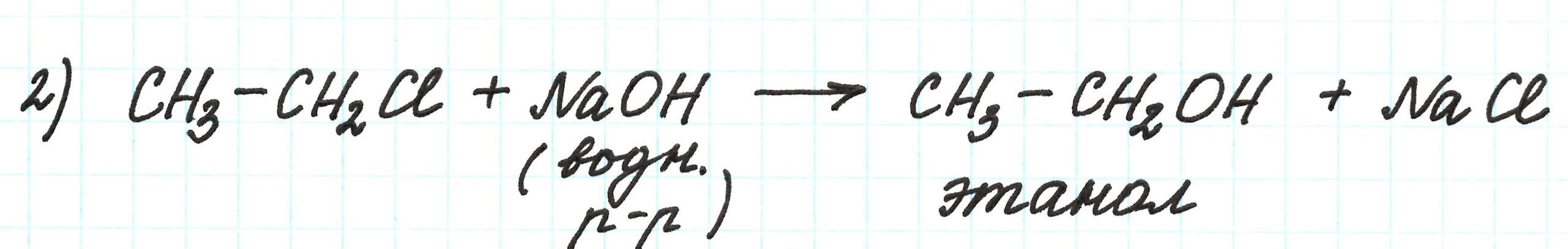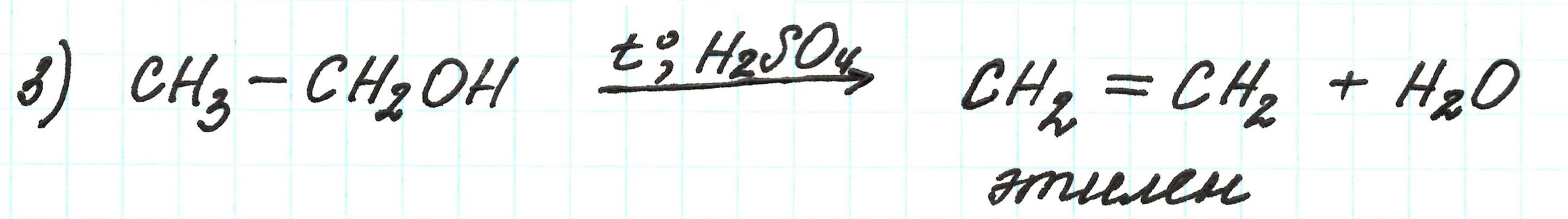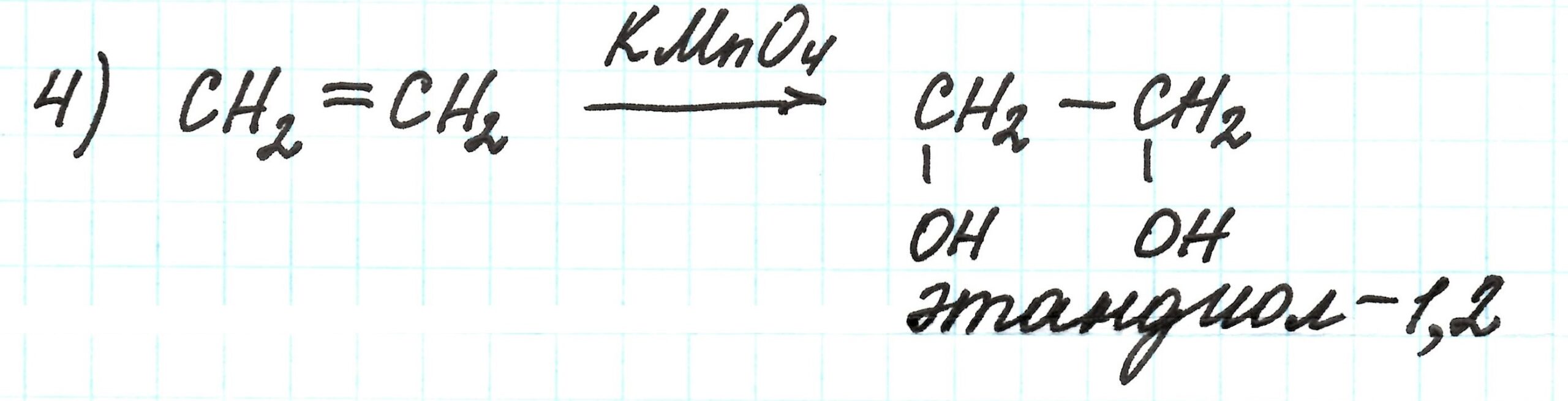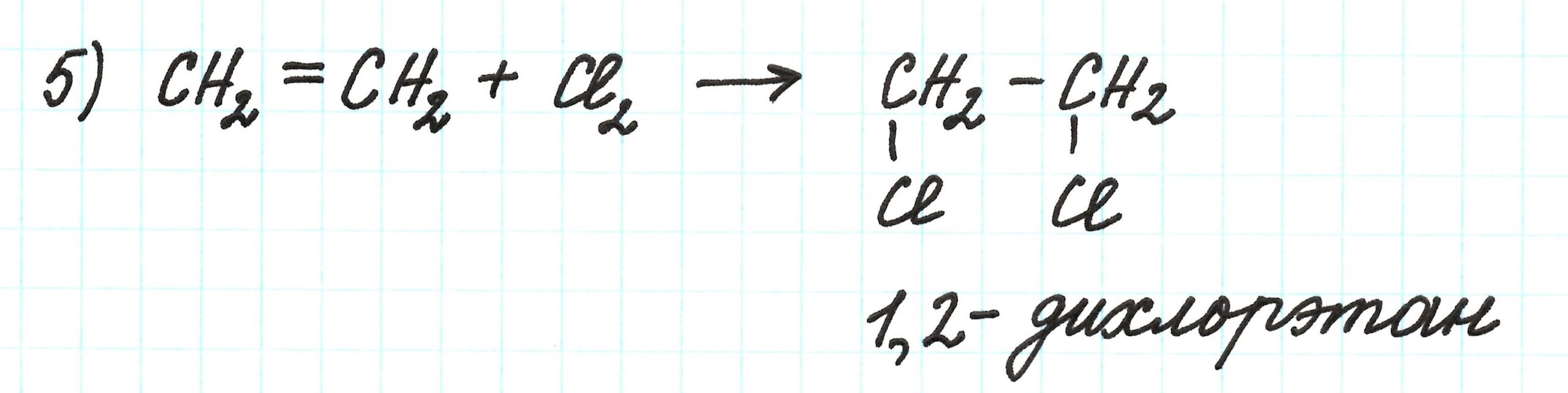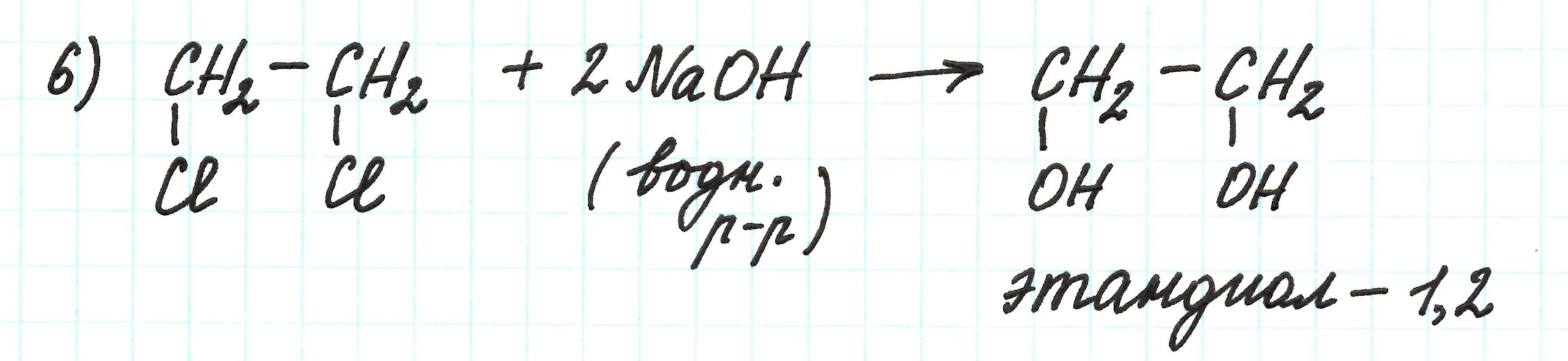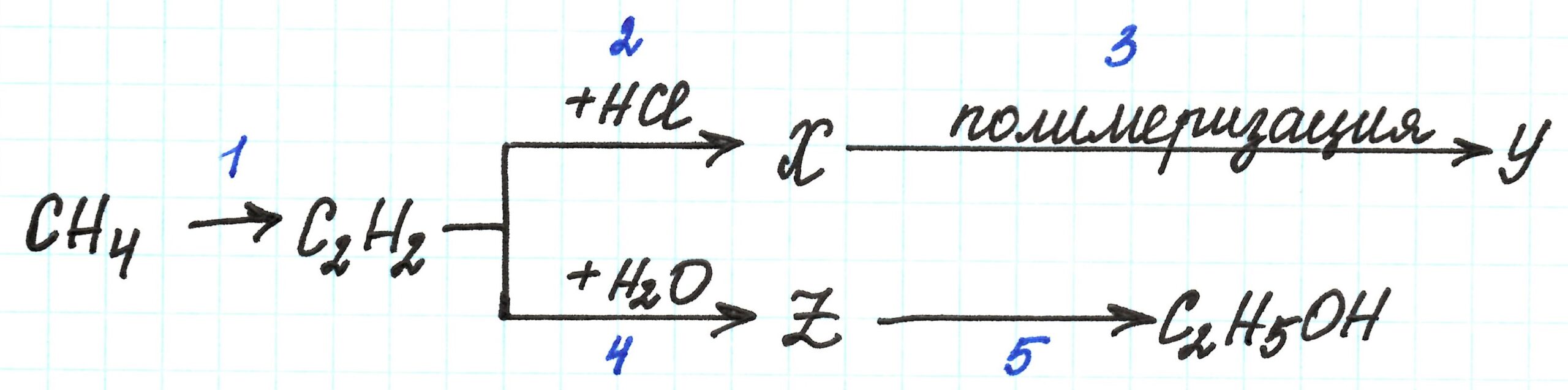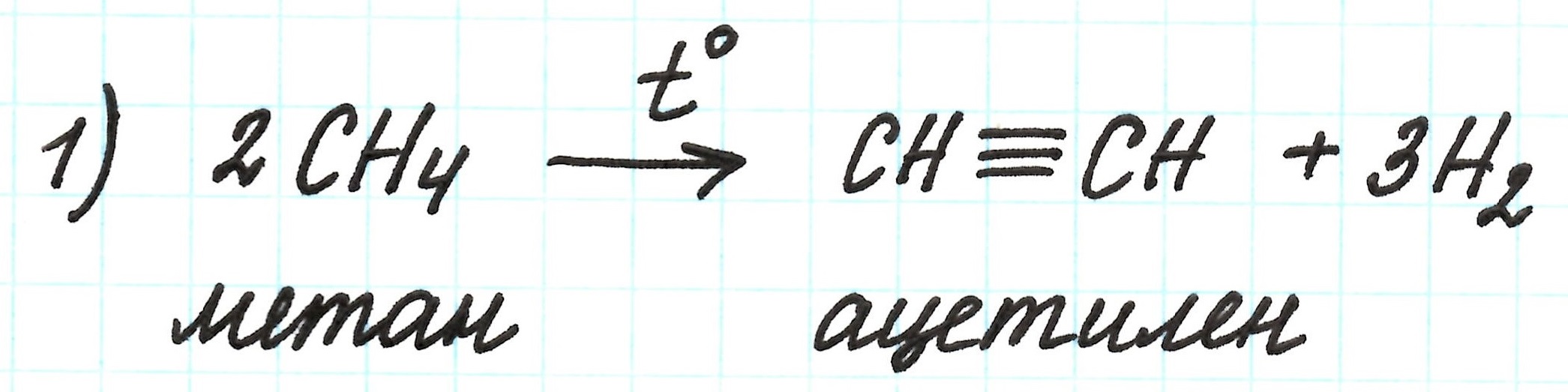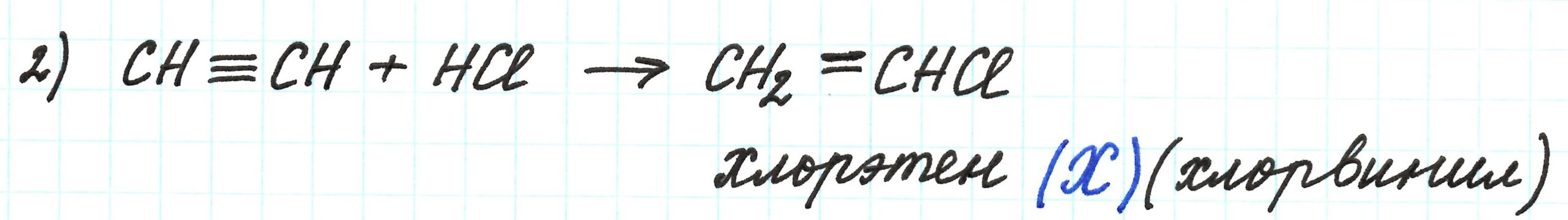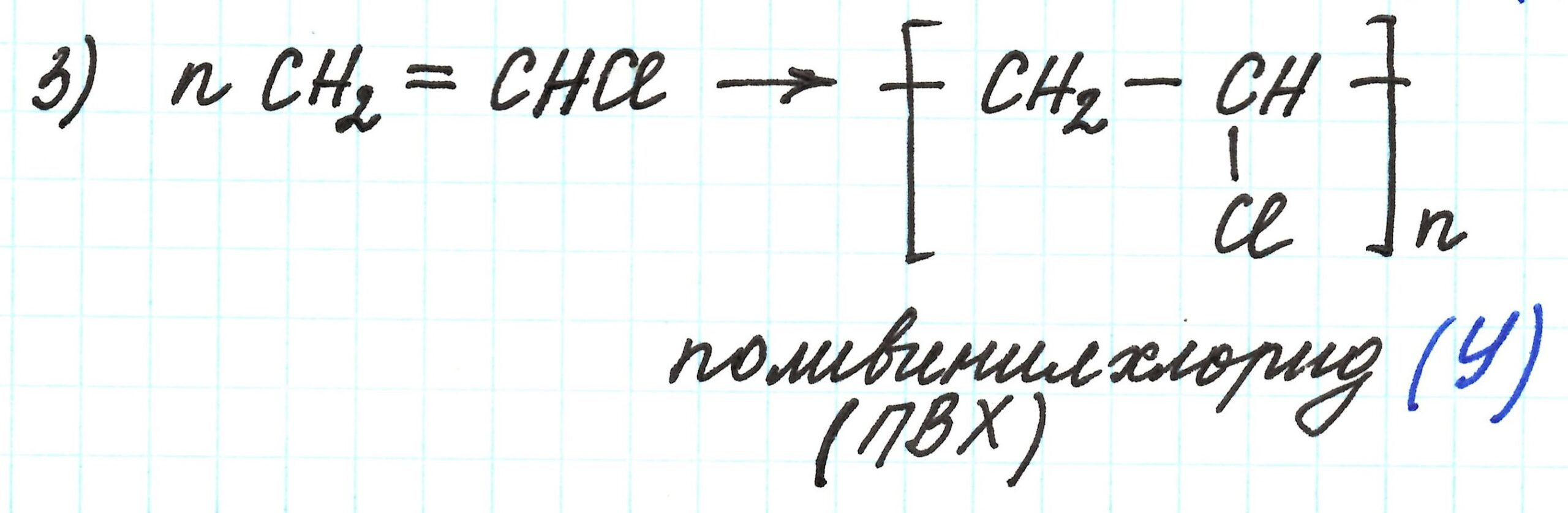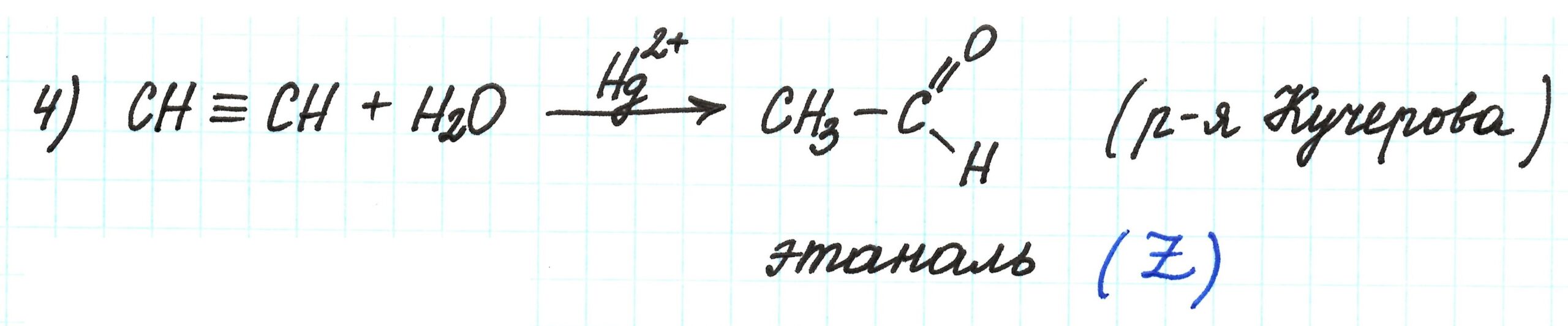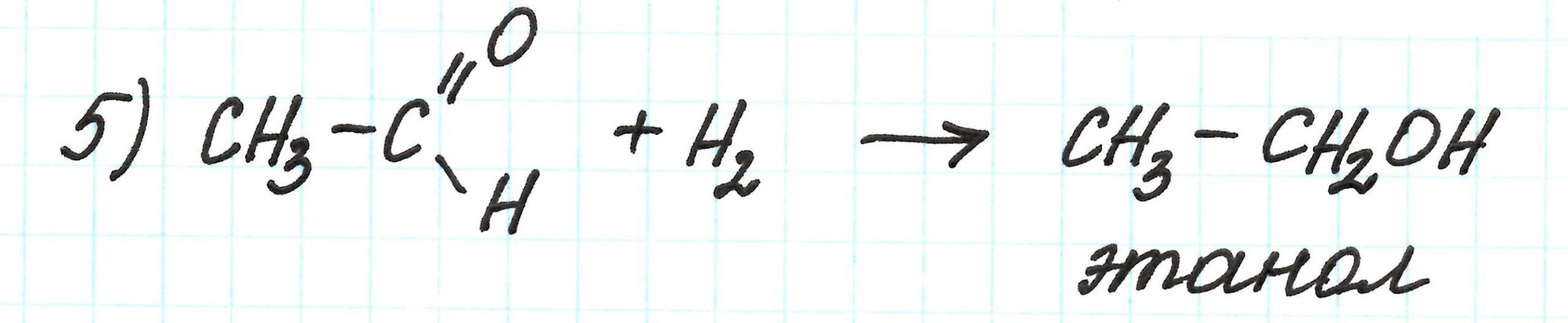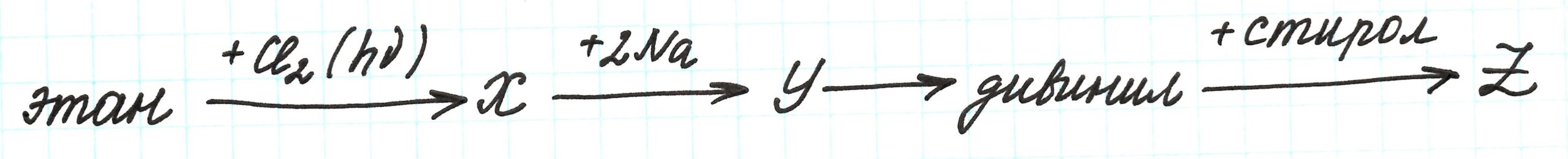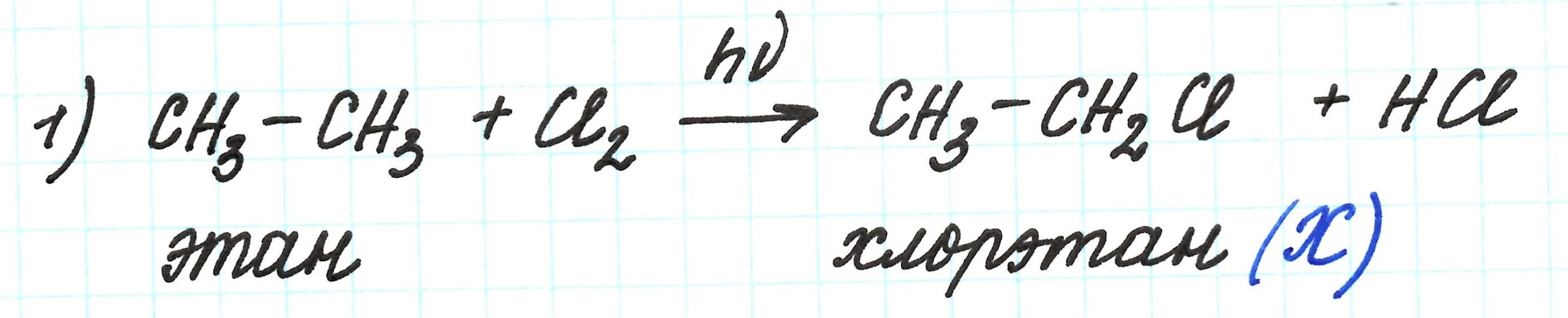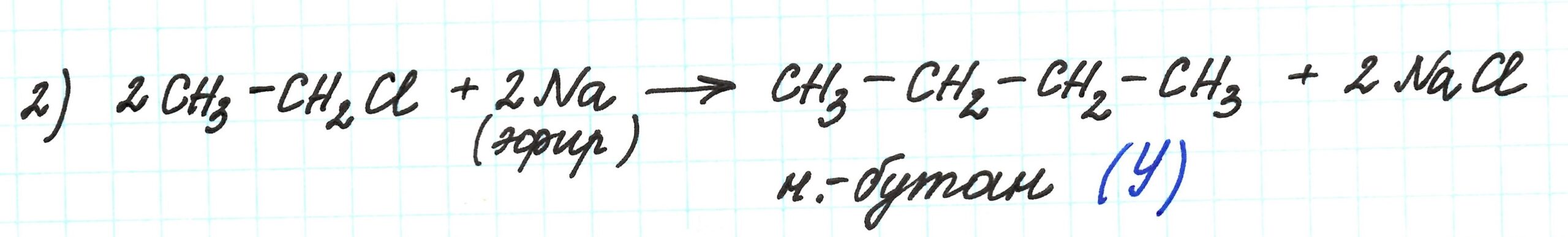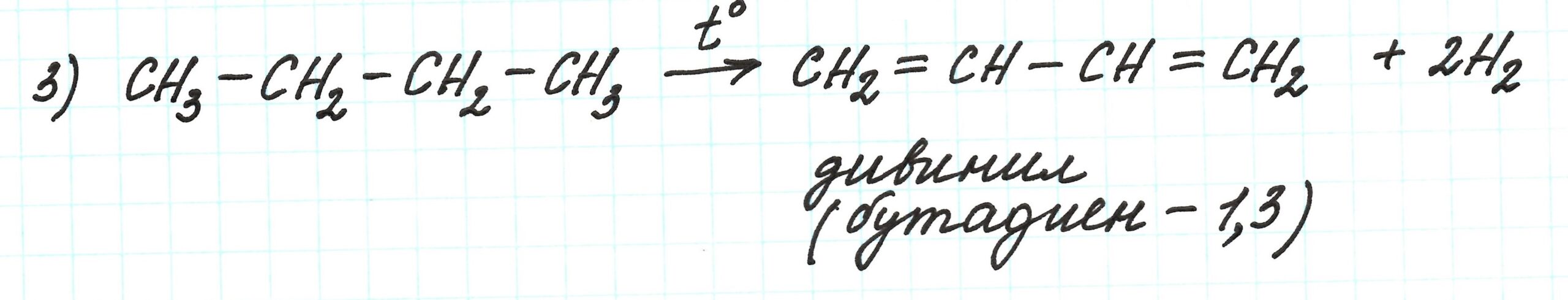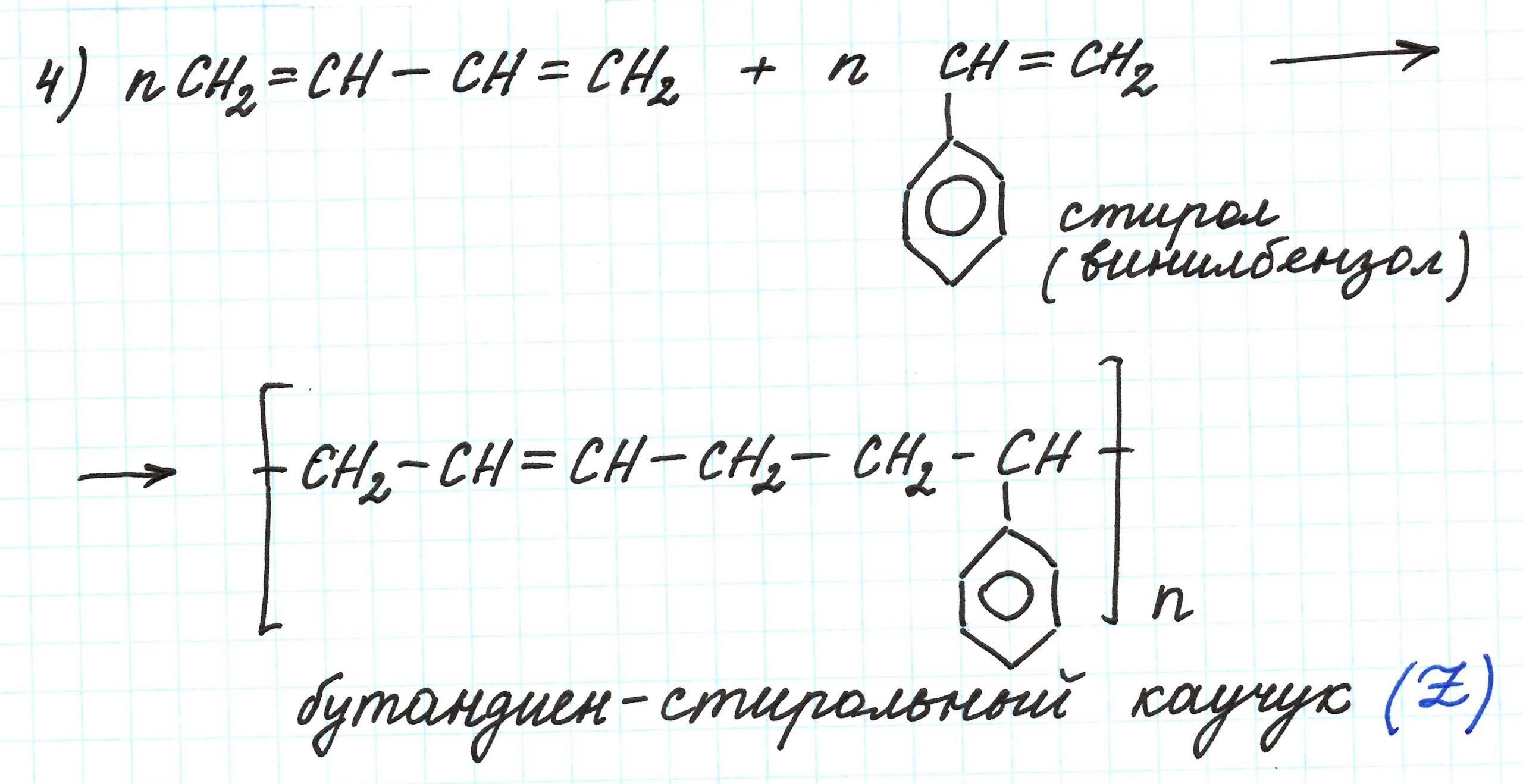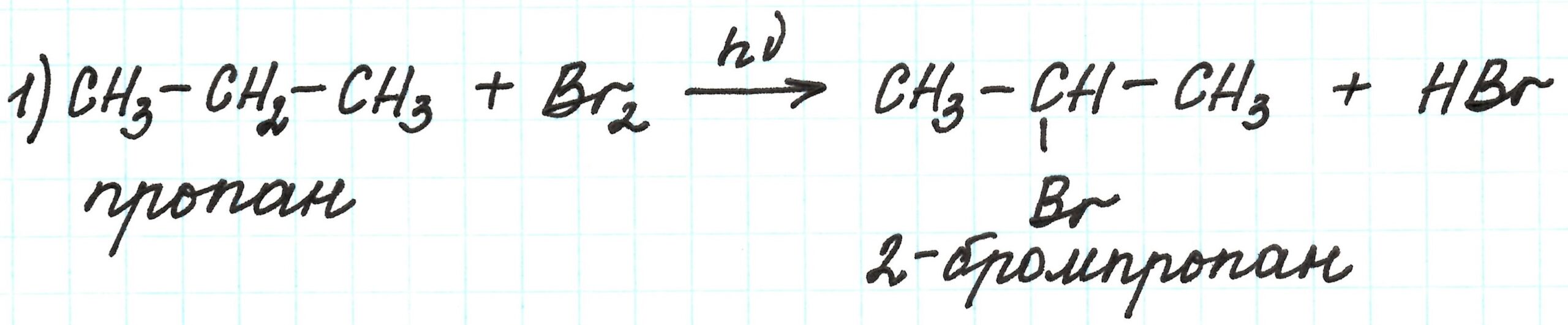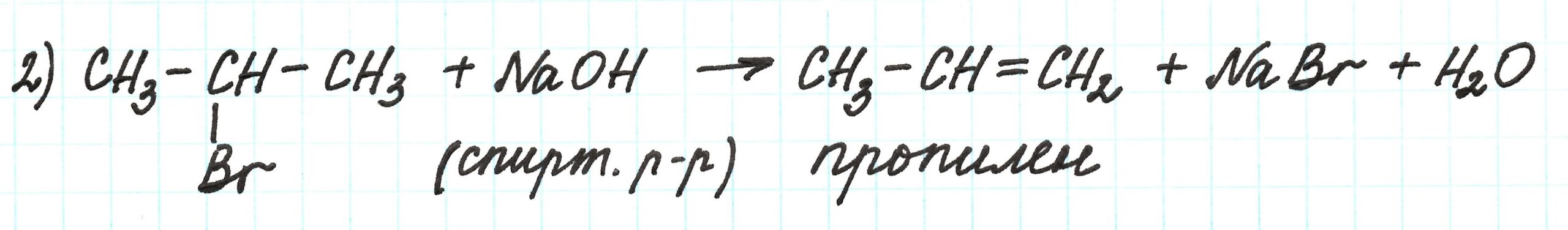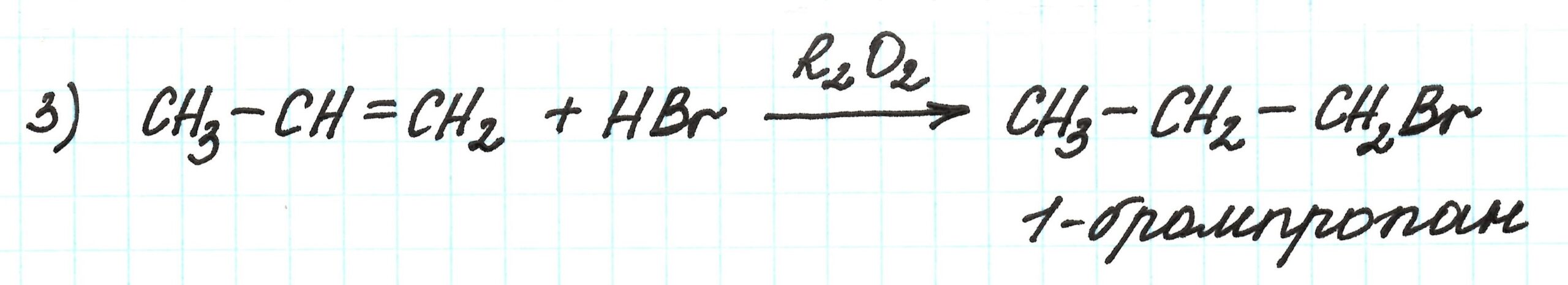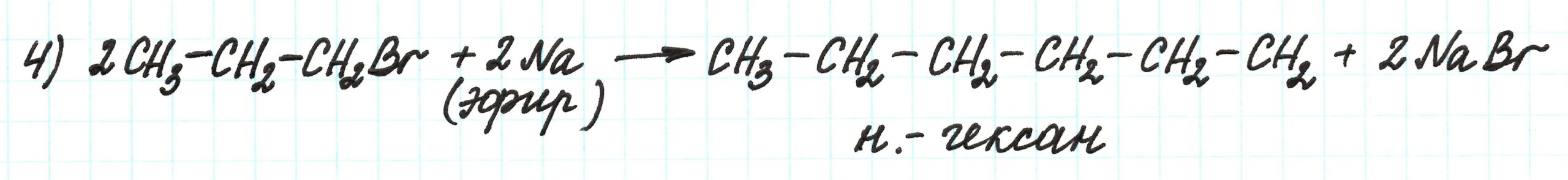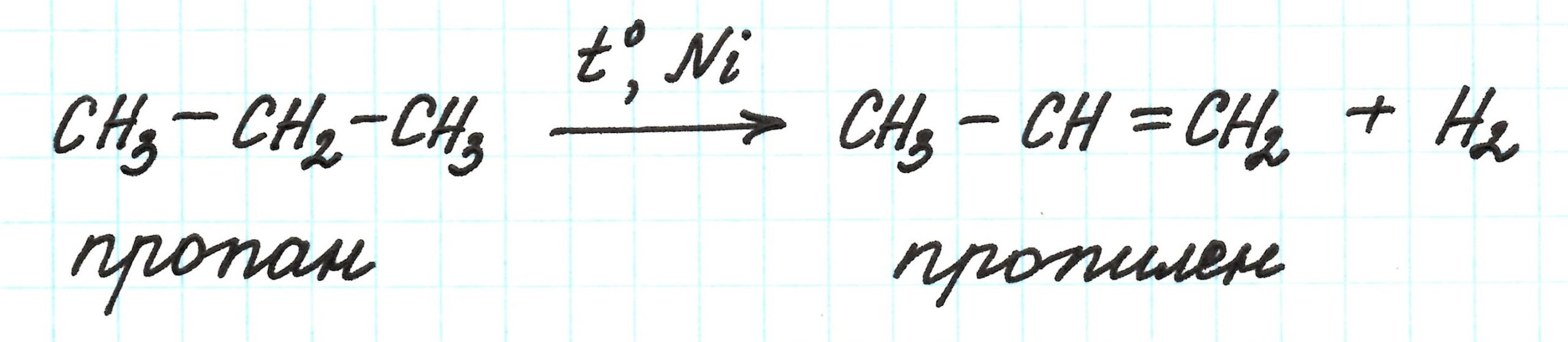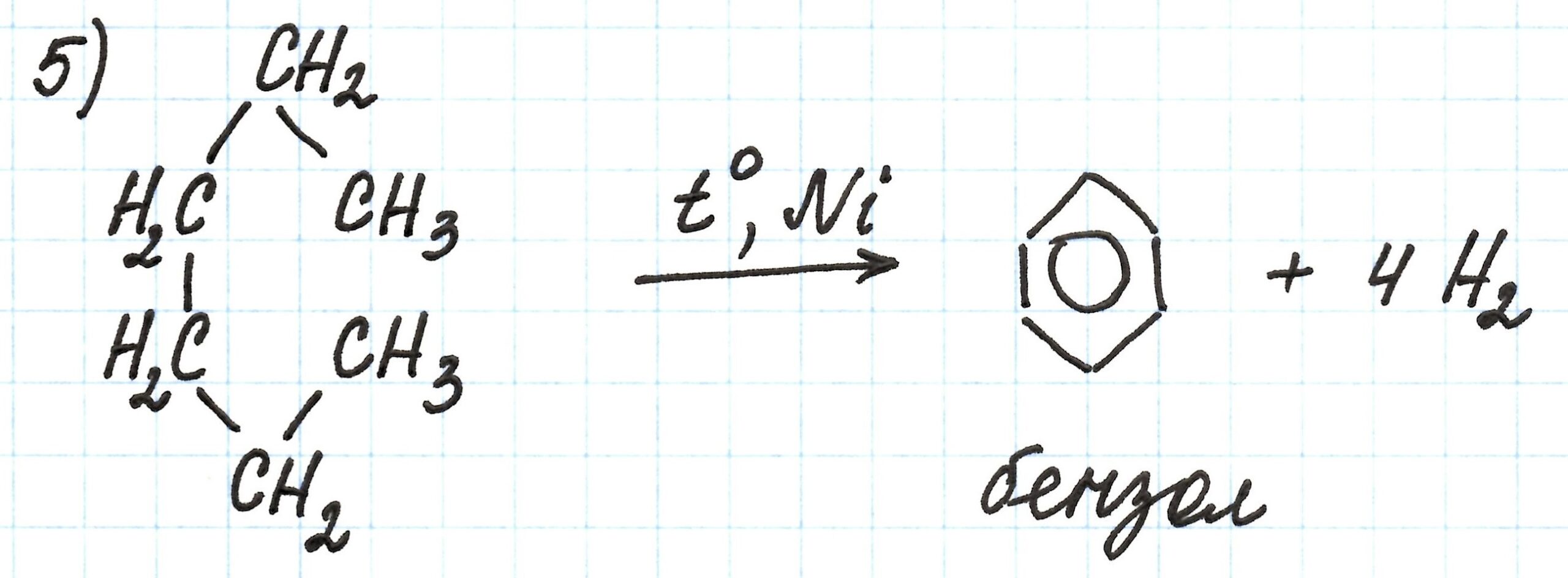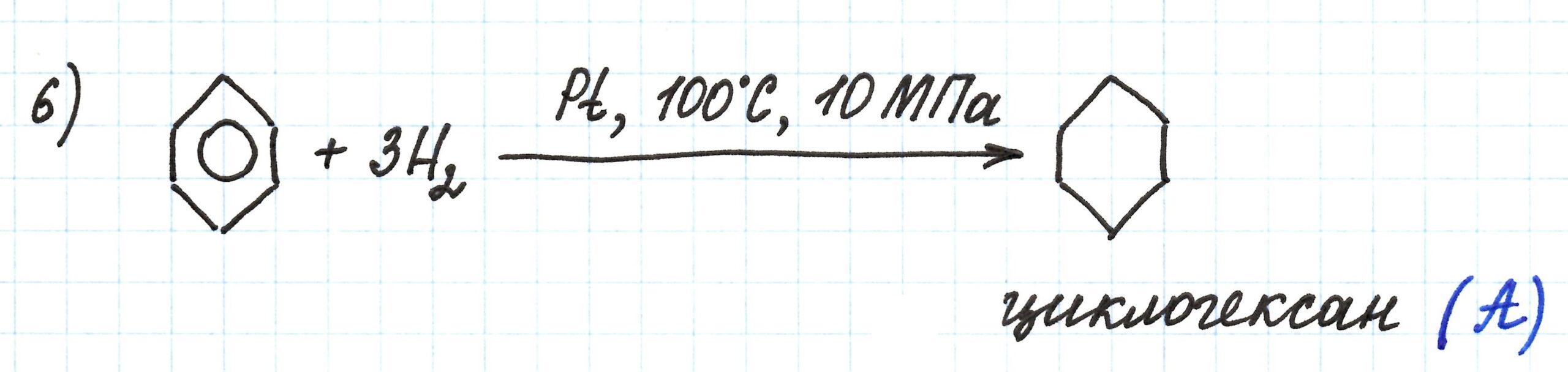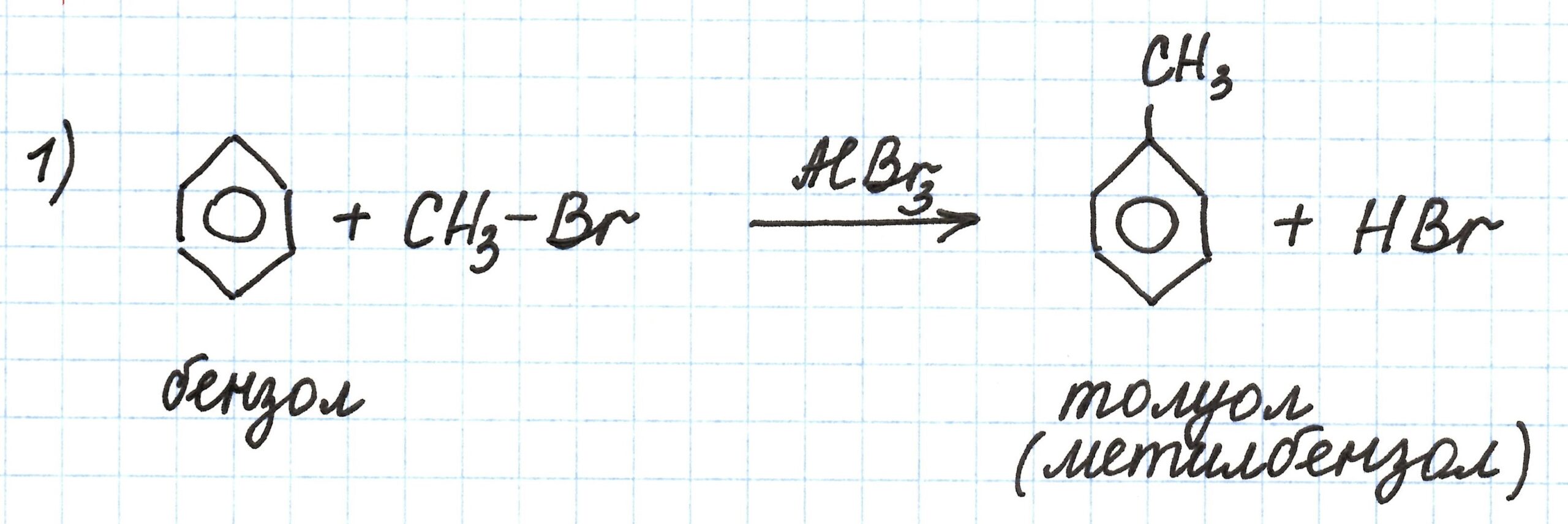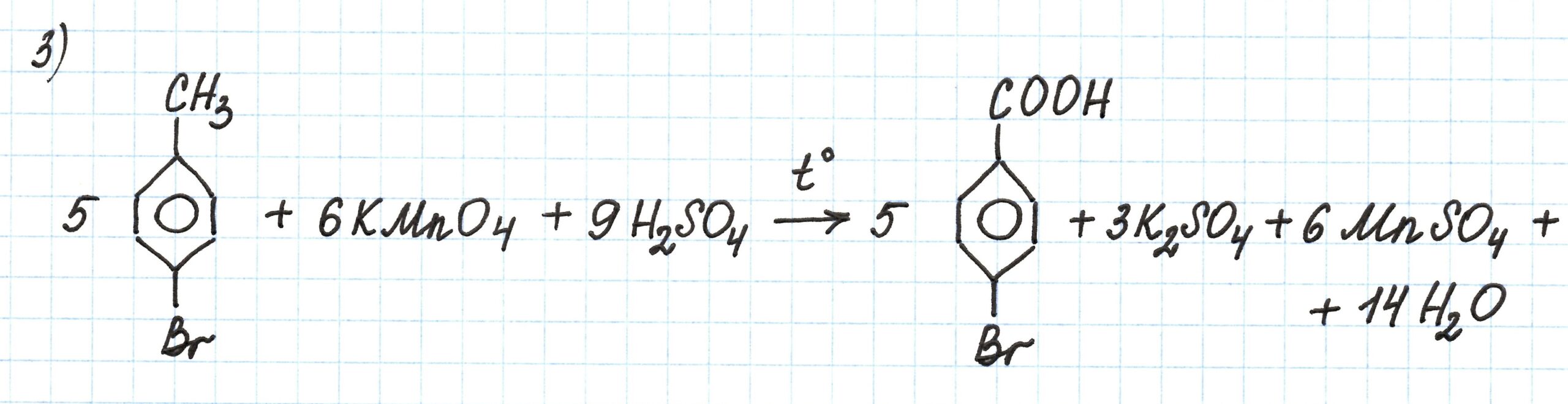Загрузить PDF
Загрузить PDF
Углеводороды, или соединения на основе цепочки из водорода и углерода, являются основой органической химии. Вам нужно научится наименовывать их согласно ИЮПАК, или Международному союзу теоритической и прикладной химии, который в настоящее время является признанным методом наименования углеводородных цепей.
Шаги
-
1
Узнайте, почему существуют правила. Правила ИЮПАК были созданы, чтобы поэтапно сократить старые названия (такие как толуол) и заменить их системой, которая будет последовательной, а также будет давать информацию о расположении заместителей (атомы или молекулы, присоединившиеся к углеводородной цепи).
-
2
Держите список префиксов под рукой. Эти префиксы помогут составить название вашему углеводороду. Они основаны на количестве углерода в главной цепи(а не все количество углерода в соединении). Например, CH3-CH3, называется этан. Возможно, ваш преподаватель не будет требовать от вас знания более 10 префиксов; но будьте готовы, если он или она все же потребуют больших знаний.
- 1: мет-
- 2: эт-
- 3: проп-
- 4: бут-
- 5: пент-
- 6: гекс-
- 7: гепт-
- 8: окт-
- 9: нон-
- 10: дек-
-
3
Практикуйтесь. Изучение системы ИЮПАК требует практики. Прочтите о следующих методах, чтобы рассмотреть несколько примеров, и затем найдите ссылки по практическим проблемам в разделе «Источники и ссылки» внизу страницы.
Реклама
-
1
Узнайте, что такое алканы. Алканы – это углеводородные цепи, которые не содержат двойной или тройной связи между молекулами. В названии алканов всегда должен быть суффикс -ан.
-
2
Нарисуйте молекулу. Вы можете нарисовать все символы молекулы или использовать структуру скелета. Выясните, каким способом требует рисовать ваш преподаватель, и придерживайтесь его.
-
3
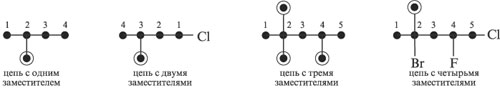
Посчитайте количество углерода в главной цепи. Главная цепь – это самая длинная непрерывная углеродная цепь в молекуле. Считайте углерод, начиная с ближайшего заместителя группы. Каждый заместитель должен быть записан по номеру его расположения в цепи.
-
4
Составьте название в алфавитном порядке. Заместители должны быть названы в алфавитном порядке (за исключением таких приставок, как «ди-», «три-» или «тетра-»), но не в числовом.
- Если в углеводородной цепи два одинаковых заместителя, используйте приставку «ди-» перед его названием. Даже если они присоединены к одному и тому же углероду, дважды напишите этот номер.
Реклама
-
1
Узнайте, что такое алкены. Алкены – это углеводородные цепи, которые содержат одну или более двойных связей между молекулами углерода, но не содержат тройную связь. В названии алкенов всегда должен быть суффикс -ен.
-
2
Нарисуйте молекулу.
-
3
Найдите главную цепь. Главная цепь алкенов должна содержать какую-либо двойную связь между углеродом. Кроме того, она должна быть пронумерована с ближайшей двойной связи углерод-углерод от конца.
-
4
Отметьте, где расположена двойная связь. Кроме того, что вы отметили расположение заместителей, вы также должны отметить, где находится двойная связь. Сделайте это таким образом, чтобы использовалось наименьшее число в нумерации двойных связей.
-
5
Измените суффикс на основе числа двойных связей в главной цепи. Если в главной цепи две двойные связи, название будет оканчиваться на «-диен», если три – то на «-триен» и так далее.
-
6
Назовите заместители в алфавитном порядке. Как и в случае с алканами, вы должны перечислить заместители в алфавитном порядке в окончательном названии. Исключением являются такие приставки, как «ди-», «три-» или «тетра-».
Реклама
-
1
Узнайте, что такое алкины. Алкины – это углеводородные цепи, которые содержат одну или более тройных связей. В названии всегда должен стоять суффикс -ин.
-
2
Нарисуйте молекулу.
-
3
Найдите главную цепь. Главная цепь алкинов должна содержать какой-либо атом углерода с тройной связью. Нумерацию стоит начать с самой ближайшей тройной связи в конце цепи.
- Если вы работаете с молекулой, которая имеет и двойную, и тройную связь, начните нумерацию с ближайшей множественной связи в конце цепи.
-
4
Отметьте расположение тройной связи. Кроме того, что вы отметили расположение заместителей, вы также должны отметить местонахождение тройной связи. Сделайте это таким образом, чтобы использовалось наименьшее число на тройной связи при нумерации.
- Если ваша молекула также содержит и двойные связи, вы должны их отметить.
-
5
Измените суффикс на основании количества тройных связей в главной цепи. Если в главной цепи две тройные связи, то название будет оканчиваться на «-диин», три связи – «триин» и так далее.
-
6
Назовите заместители в алфавитном порядке. Как и в случае с алканами и алкенами, вы должны перечислить заместители в алфавитном порядке в окончательном названии. Исключением являются такие приставки, как «ди-», «три-» или «дельта-».
- Если в молекуле также содержатся двойные связи, назовите их в первую очередь.
Реклама
-
1
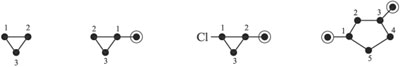
Выясните, какой вид циклических углеводородов вы рассматриваете. Процесс наименования циклических углеводородов работает, как и у нециклических – те, которые не содержат множественные связи, являются циклоалканами, с двойными связями – циклоалкенами, с тройными – циклоалкинами. К примеру, шести-углеродное кольцо без множественных связей называется циклогексаном.
-
2
Различайте названия циклических углеводородов. Есть несколько заметных различий между наименованием циклических и нециклических углеводородов:
- Так как все атомы углерода в кольце циклических углеводородов равны, вам не нужно нумеровать их, если в вашем циклической углеводороде только одна составляющая.
- Если в циклическом углеводороде содержится алкильная группа, большая и более сложная, чем само кольцо, то циклический углеводород может стать заместителем, а не главной цепью.
- Если на кольце два заместителя, пронумеруйте их в алфавитном порядке. Сперва (в алфавитном порядке) заместитель 1; затем нумерация происходит против часовой стрелки или по часовой стрелке –в зависимости от того, какой вариант даст меньшее число для второго заместителя.
- Если на кольце больше двух заместителей, то необходимо указать, что первый по алфавитному порядку присоединен к первому атому углерода. Другие нумеруются против или по часовой стрелке – в зависимости от того, какой вариант приведет к использованию меньшего количества чисел.
- Как и нециклические углеводороды, конечное название молекулы дается в алфавитном порядке, за исключением таких приставок, как «ди-», «три-» и «тетра-».
Реклама
-
1
Узнайте, что такое производные бензола. Производные бензола основаны на молекуле бензола, C6H6, в которой равномерно расположены три двойные связи.
-
2
Не нумеруйте углерод, если есть только один заместитель. Как и в случае с другими циклическими углеводородами, не требуется использование нумерации, если в кольце только один заместитель.
-
3
Узнайте о названиях бензола. Можно назвать вашу молекулу бензола как и любой другой циклический углеводород, начиная в алфавитном порядке с первого заместителя и присваивая номера по кругу. Однако есть некоторые специальные обозначения для расположения заместителей в молекуле бензола:
- Орто или о-: два заместителя расположены в 1 и 2.
- Мета или м-: два заместителя расположены в 1 и 3.
- Пара или п-: два заместителя расположены в 1 и 4.
-
4
Если в вашей молекуле бензола три заместителя, назовите ее как и обычный циклический углеводород.
Реклама
Советы
- Если есть два кандидата на длинную цепь, выберите ту, в которой больше разветвлений. Если же у вас две цепи с одинаковым количеством ответвлений, выберите ту, в которой ответвления ближе. Если же две цепи идентичны в отношении ответвлений, просто выберите одну из них.
- Если углеводород имеет ОН (гидроксильная группа) где-либо в связи, он является спиртом и в названии появляется суффикс «-ол» вместо «-ан».
- Продолжайте практиковаться! Когда вы столкнетесь с этими проблемами в тесте, знайте, что преподаватель, вероятно, составил вопросы так, что есть всего один верный ответ. Запомните правила и затем следуйте им шаг за шагом.
Реклама
Предупреждения
- Многие соединения называют распространенными названиями вместо использования системы ИЮПАК. Например, боковая цепь, которая будет называться по системе ИЮПАК 1-метилэтил, также известна как изопропиловая группа. Будьте осторожны, чтобы не смешать системы наименований.
Реклама
Об этой статье
Эту страницу просматривали 29 780 раз.
Была ли эта статья полезной?
Прежде чем анализировать, как составлять изомеры предельных углеводородов, выявим особенности данного класса органических веществ.
Насыщенные углеводороды
В органической химии выделяется множество классов CxHy. У каждого есть своя общая формула, гомологический ряд, качественные реакции, применение. Для насыщенных углеводородов класса алканов характерны одинарные (сигма) связи. Общая формула данного класса органических веществ CnH2n+2. Этим объясняются основные химические свойства: замещение, горение, окисление. Для парафинов не характерны присоединение, так как связи в молекулах этих углеводородов одинарные.
Изомерия
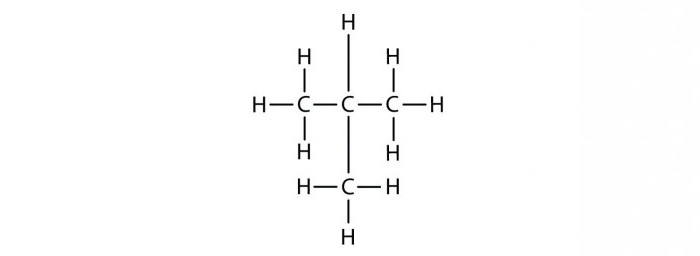
Такое явление, как изомерия объясняет многообразие органических веществ. Под изомерией принято понимать явление, при котором существует несколько органических соединений, имеющих одинаковый количественный состав (число атомов в молекуле), но различное расположение их в молекуле. Получаемые вещества называют изомерами. Они могут быть представителями нескольких классов углеводородов, а потому отличаются химическими свойствами. Разное соединение в молекуле алканов атомов С приводит к возникновению структурной изомерии. Как составлять изомеры алканов? Существует определенный алгоритм, согласно которому можно изобразить структурные изомеры данного класса органических веществ. Появляется подобная возможность только с четырех углеродных атомов, то есть, с молекулы бутана С4Н10.
Разновидности изомерии
Для того чтобы понять, как составлять формулы изомеров, важно иметь представление о ее видах. При наличии внутри молекулы одинаковых атомов в равном количестве, располагающихся в пространстве в разном порядке, идет речь о пространственной изомерии. Иначе ее называют стереоизомерией. В подобной ситуации применения одних только структурных формул будет явно недостаточно, потребуется использование специальных проекционных или пространственных формул. Предельные углеводороды, начиная с H3C–СН3 (этана), имеют различные пространственные конфигурации. Это обусловлено вращением внутри молекулы по связи С–С. Именно простая σ-связь создает конформационную (поворотную) изомерию.
Структурная изомерия парафинов
Поговорим о том, как составлять изомеры алканов. Класс имеет структурную изомерию, то есть, атом углерода образует разные цепи. Иначе возможность изменения положения в цепи атомов углерода называют изомерией углеродного скелета.
Изомеры гептана
Итак, как оставлять изомеры для вещества, имеющего состав C7H16? Для начала можно расположить все атомы углерода в одну длинную цепочку, добавить для каждого определенное число атомов С. Сколько? Учитывая, что валентность углерода равна четырем, у крайних атомов будет по три атома водорода, а у внутренних – по два. Полученная молекула имеет линейное строение, такой углеводород называют н – гептаном. Буква «н» подразумевает прямой углеродный скелет в данном углеводороде.
Теперь меняем расположение углеродных атомов, «укорачивая» при этом прямую углеродную цепочку в C7H16. Составить изомеры можно в развернутом либо сокращенном структурном виде. Рассмотрим второй вариант. Сначала один атом С расположим в виде радикала метил в разных положениях.
Данный изомер гептана имеет следующее химическое название: 2-метилгексан. Теперь «передвигаем» радикал к следующему углеродному атому. Полученный предельный углеводород называется: 3-метилгексан.
Если мы будем далее передвигать радикал, нумерация будет начинаться с правой стороны (ближе к началу располагается углеводородный радикал), то есть, мы получим такой изомер, который у нас уже есть. Поэтому думая над тем, как составлять формулы изомеров для исходного вещества, попробуем сделать скелет еще «короче».
Оставшиеся два углерода можно представить в виде двух свободных радикалов — метил.
Расположим сначала их у разных углеродов, входящих в главную цепь. Назовем полученный изомер -2,3 диметилпентан.
Теперь оставим один радикал на том же месте, а второй перенесем к следующему углеродному атому главной цепи. Данное вещество называется 2,4 диметилпентан.
Теперь расположим углеводородные радикалы у одного углеродного атома. Сначала у второго, получим 2,2 диметилпентан. Затем у третьего, получив 3,3 диметилпентан.
Теперь оставляем в основной цепи четыре атома углерода, оставшиеся три используем в качестве радикалов метил. Располагаем их следующим образом: два у второго атома С, один – у третьего углерода. Называем полученный изомер: 2,2, 3 триметилбутан.
На примере гептана мы разобрали, как правильно составлять изомеры для предельных углеводородов. На фото представлены примеры структурных изомеров для бутена6 его хлорпроизводных.
Алкены
Данный класс органических веществ имеет общую формулу CnH2n. Помимо насыщенных связей С-С в данном классе есть также двойная связь. Именно она определяет основные свойства данного ряда. Поговорим о том, как оставлять изомеры алкенов. Попробуем выявить их отличия от предельных углеводородов. Помимо изомерии главной цепи (структурные формулы) для представителей данного класса органических углеводородов также характерны еще три разновидности изомеров: геометрические (цис- и трансформы), положения кратной связи, а также межклассовая изомерия (с циклоалканами).
Изомеры C6H12
Попробуем выяснить, как составить изомеры c6h12, учитывая тот факт, что вещество с данной формулой может принадлежать сразу к двум классам органических веществ: алкенам, циклоалканам.
Для начала подумаем, как составлять изомеры алкенов, если есть двойная связь в молекуле. Ставим прямую углеродную цепочку, поставим кратную связь после первого углеродного атома. Попробуем не только составить изомеры с6н12, но и назвать вещества. Данное вещество — гексен – 1. Цифрой указывается положение в молекуле двойной связи. При ее передвижении по углеродной цепочке, получаем гексен -2, а также гексен — 3
Теперь порассуждаем, как составлять изомеры для данной формулы, меняя количество атомов в главной цепи.
Для начала укоротим углеродный скелет на один углеродный атом, его будет рассматривать в качестве радикала метил. Двойную связь оставим после первого атома С. Полученный изомер по систематической номенклатуре будет иметь следующее название: 2 метилпентен – 1. Теперь передвигаем углеводородный радикал по главной цепи, оставив положение двойной связи неизменным. Данный непредельный углеводород разветвленного строения называют 3 метилпентен -1.
Возможен без изменения основной цепи и положения двойной связи еще один изомер: 4 метилпентен -1.
Для состава C6H12 можно попробовать переместить двойную связь из первого во второе положение, не преобразуя саму главную цепочку. Радикал при этом будет передвигать по углеродному скелету, начиная со второго атома С. Данный изомер имеет название 2 метилпентен-2. Кроме того, можно поместить радикал CH3 третьего атома углерода получив при этом 3 метилпентен-2
Если поместить радикал у четвертого углерода атома в данной цепи, образуется еще одно новое вещество непредельный углеводород с извилистым углеродным скелетом – 4 метилпентен-2.
При дальнейшем сокращении числа С в главной цепи, можно получить еще один изомер.
Двойную связь оставим после первого углеродного атома, а два радикала поставим к третьему атому С основной цепи, получаем 3,3 диметилутен-1.
Теперь поставим радикалы у соседних углеродных атомов, не меняя положения двойной связи, получим 2,3 диметилбутен-1. Попробуем, не меняя размер главной цепи, передвинуть двойную связь во второе положение. Радикалы при этом мы может поставить только у 2 и 3 атомов С, получив 2,3 диметилбутен-2.
Других структурных изомеров для данного алкена нет, любые попытки их придумать приведут к нарушению теории строения органических веществ А. М. Бутлерова.
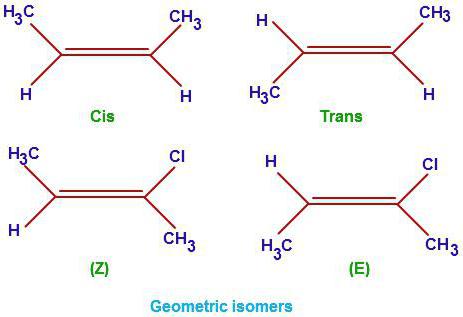
Пространственные изомеры C6H12
Теперь выясним, как составлять изомеры и гомологи с точки зрения пространственной изомерии. Важно понимать, что цис- и трансформы алкенов возможны только для положения двойной связи 2 и 3.
При нахождении в одной плоскости углеводородных радикалов, образуется цис – измер гексена -2, а при расположении радикалов в разных плоскостях, транс-форма гексена – 2.
Межклассовые изомеры C6H12
Рассуждая над тем, как составлять изомеры и гомологи, нельзя забывать и о таком варианте, как межклассовая изомерия. Для непредельных углеводородов ряда этилена, имеющих общую формулу CnH2n, такими изомерами являются циклоалканы. Особенностью данного класса углеводородов является наличие циклической (замкнутой) структуры при насыщенных одинарных связях между атомами углерода. Можно составить формулы циклогексана, метилциклопентана, диметилциклобутана, триметилциклопропана.
Заключение
Органическая химия многогранна, загадочна. Количество органических веществ превышает в сотни раз число неорганических соединений. Данный факт легко объясняется существованием такого уникального явления, как изомерия. Если в одном гомологическом ряду располагаются сходные по свойствам и строению вещества, то при изменении положения атомов углерода в цепи, появляются новые соединения, названные изомерами. Только после появления теории химического строения органических веществ удалось классифицировать все углеводороды, понять специфику каждого класса. Одно из положений данной теории, непосредственно касается явления изомерии. Великий русский химик сумел понять, объяснить, доказать, что именно от расположения углеродных атомов зависят химические свойства вещества, его реакционаня активность, практическое применение. Если сравнивать количество изомеров, образуемых предельными алканами и непредельными алкенами, лидируют, безусловно, алкены. Объясняется это тем, что в их молекулах есть двойная связь. Именно она позволяет этому классу органических веществ образовывать не только алкены разного вида и строения, но и вести речь о меклассовой изомерии с циклоалканами.
В этой статье мы разберем, как составлять молекулярные формулы основных классов органических соединений из информации об особенностях строения (наличие кратных связей, циклов, функциональных групп), и наоборот — как определять общую формулу гомологического ряда веществ с определенными функциональными группами, кратными связями или циклами.
Углеводороды
За основу берем формулу алканов — предельных нециклических углеводородов с одинарными связями между атомами углерода.
В молекуле линейных алканов на каждый атом углерода приходится по два атома водорода плюс по одному дополнительному атому водорода на концах углеродной цепи:
Таким образом, общая формула предельных нециклических углеводородов (алканов) — CnH2n+2.
В алкенах присутствует одна двойная связь. Двойная связь «отщипывает» от молекулы два атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна двойная связь (алкенов) CnH2n+2-2 — CnH2n.
Формулы алкенов отличаются от формул алканов с таким же количеством атомов углерода на 2 атома водорода:
C3H8 — C3H6 = 2H
Каждая пара атомов водорода определяет степень ненасыщенности молекулы. Степень ненасыщенности алкенов равна одному.
В алкинах присутствует одна тройная связь. Тройная связь «отщипывает» от молекулы уже четыре атома водорода:
| Ацетилен, этин | H-C≡C-H |
| Пропин | H-C≡C-СH3 |
| Бутин-1 | H-C≡C-СH2-СH3 |
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна тройная связь (алкинов): CnH2n+2-4 — CnH2n-2.
Формулы алкинов отличаются от формул алканов с таким же количеством атомов углерода на 4 водорода:
C3H8 — C3H4 = 4H
Степень ненасыщенности алкинов равна двум.
В алкадиенах присутствуют две двойные связи. Две двойные связи «отщипывают» от молекулы уже четыре атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть две двойные связи (алкадиенов): CnH2n+2-4 — CnH2n-2.
Степень ненасыщенности алкадиенов также равна двум.
В циклоалканах присутствуют только одинарные связи и атомы углерода образуют замкнутый цикл. Наличие цикла также уменьшает количество атомов водорода на два:
Таким образом, общая формула циклических углеводородов, в молекулах которых есть только одинарные связи (циклоалканов): CnH2n+2-2 — CnH2n.
В циклоалкенах присутствует одна одинарная связь и атомы углерода образуют замкнутый цикл. Наличие цикла и двойной связи уменьшает количество атомов водорода на четыре:
| Циклобутен |  |
Таким образом, общая формула циклических углеводородов, в молекулах которых есть одна двойная связь (циклоалкенов): CnH2n+2-4 — CnH2n-2.
Этот ряд можно продолжить и дальше:
Алкатриены — содержат три двойные связи, общая формула: CnH2n+2-6 = CnH2n-4
Алкенины — содержат одну двойную и одну тройную связь, общая формула:
CnH2n+2-6 = CnH2n-4
и так далее.
| Класс/группа | Тип связей и наличие цикла | Степень ненасыщенности | Общая формула |
| Алканы |
одинарные связи |
0 | CnH2n+2 |
| Алкены | двойная связь | 1 | CnH2n |
| Алкины | тройная связь | 2 | CnH2n-2 |
| Алкадиены | две двойные связи | 2 | CnH2n-2 |
| Циклоалканы | одинарные связи, цикл | 2 | CnH2n |
| Циклоалкены | двойная связь, цикл | 2 | CnH2n-2 |
| Циклоалкины | тройная связь, цикл | 6 | CnH2n-4 |
| Циклоалкадиены | две двойные связи, цикл | 6 | CnH2n-4 |
Определите молекулярную формулу и степень ненасыщенности гомологического ряда следующих классов органических веществ:
а) алкадиенины
б) циклоалкины
в) циклоалкатриены
г) алкендиины
а) CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
б) CnH2n-4, степень ненасыщенности 3, не хватает 6 атомов Н до алкана
в)CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
г) CnH2n-8, степень ненасыщенности 5, не хватает 10 атомов Н до алкана
Эта система работает и наоборот: знание молекулярной формулы можно определить возможный состав вещества.
Например, проанализируем формулу С3Н6.
До формулы алкана не хватает С3Н8 — С3Н6 = 2Н два атома водорода.
Степень непредельности равна одному. То есть в молекуле органического вещества есть либо цикл, либо двойная связь.
Определите возможную структуру (наличие кратных связей, циклов) молекул, которым соответствуют следующие формулы:
а) CnH2n-2
б) CnH2n-4
в) CnH2n-6
г) CnH2n-8
а) CnH2n-2, степень ненасыщенности 4, в молекуле либо две двойные связи, либо цикл и двойная связь, либо тройная связь
б) CnH2n-4, степень ненасыщенности 6, в молекуле либо три двойные связи; цикл и тройная связь; тройная связь и двойная связь и др.
в) CnH2n-6, степень ненасыщенности 8:
4 двойные связи; цикл и 3 двойные связи; две тройные связи; тройная связь и две двойные связи и др.
г) CnH2n-8, степень ненасыщенности 10:
5 двойных связей; цикл и 4 двойные связи и др.
РАБОЧИЕ ТЕТРАДИ
Предисловие
«Практическое пособие по химии. 10 класс»
предназначено для изучения химии в 10-м классе
средней школы по одному из современных
учебников, например, по книге Э.Е.Нифантьева и
Л.А.Цветкова «Химия 10–11». Настоящее пособие
представляет собой третью книгу практических
разработок по четырехгодичному курсу химии.
При несомненной связи с неорганической химией,
изучаемой в 8-м и 9-м классах, органическая химия
(10-й класс) по существу самостоятельный предмет. У
нее свой язык, специфическая терминология,
повторяющийся циклический характер подачи
материала о соединениях разных классов.
Например, порядок изучения алканов следующий:
состав соединений, их строение, изомерия,
названия, реакции получения и химических
превращений, применение и расчетные задачи.
Такой же порядок используется при рассмотрении
последующих классов органических соединений –
алкенов, спиртов и т. д.
По своей сути «Практическое пособие» является
лаконичным и доступным изложением курса
органической химии за 10-й класс по двум темам:
«Углеводороды» (14 уроков) и «Кислородсодержащие
соединения» (22 урока). После каждой темы следует
тестовая контрольная работа. Итоговая проверка
знаний по курсу органической химии базового
уровня образования также предложена в форме
тестов (31 вопрос).
Каждый урок этого пособия начинается кратким
изложением теоретических основ конкретного
вопроса. Рассмотрены типичные примеры,
иллюстрирующие материал, подходы к решению
задач. Урок заканчивается упражнениями (6–8
вопросов), контролирующими умения и навыки
учащихся. Ответы на многие задания, в том числе
решения расчетных и сложных задач, также
приведены в пособии. Первые уроки (№ 1–3, 7–12)
включают понятия органической химии, вводимые в
9-м классе. Эти уроки составлены в форме
химического диктанта. В диктанте названия
ключевых терминов обозначены только первыми
буквами и далее точками. Такие термины учащиеся
вписывают самостоятельно.
Пособие рассчитано на школьников с разным
уровнем подготовки. Одни сумеют воспроизвести
рассмотренные примеры, другие справятся с
предложенными заданиями и аналогичными
вопросами из других источников. В результате
такой формы работы учащиеся получают
необходимые теоретические и практические
сведения, которые позволяют им ориентироваться в
главных закономерностях органической химии.
Это «Практическое пособие» поможет учащимся в
изучении химии. Оно будет полезно учителям при
организации учебного процесса и абитуриентам
при подготовке к экзаменам в вуз.
СОДЕРЖАНИЕ
Тема 1. Углеводороды.
Урок 1. Строение органических соединений.
Урок 2. Структурные формулы и названия предельных
углеводородов.
Урок 3. Изомерия предельных углеводородов.
Урок 4. Ковалентные связи органических
соединений.
Урок 5. Гибридизация атомных орбиталей углерода.
Урок 6. Классификация реакций в органической
химии.
Урок 7. Химические свойства алканов.
Урок 8. Непредельные углеводороды.
Урок 9. Химические свойства алкенов.
Урок 10. Получение и применение алкенов.
Урок 11. Диены. Природный каучук.
Урок 12. Ацетилен и его гомологи.
Урок 13. Ароматические углеводороды (арены).
Урок 14. Получение, химические свойства и
применение бензола.
Урок 15. Контрольная работа № 1 (тесты) по теме 1
«Углеводороды».
Тема 2. Кислородсодержащие соединения.
Урок 16. Одноатомные предельные спирты.
Урок 17. Получение спиртов.
Урок 18. Химические свойства спиртов.
Урок 19. Применение спиртов. Цепочки химических
превращений с участием спиртов.
Урок 20. Многоатомные спирты.
Урок 21. Фенолы.
Урок 22. Задачи по теме «Спирты и фенолы».
Урок 23. Альдегиды.
Урок 24. Химические свойства и применение
альдегидов.
Урок 25. Кетоны.
Урок 26. Карбоновые кислоты.
Урок 27. Химические свойства карбоновых кислот.
Урок 28. Распознавание кислородсодержащих
веществ.
Урок 29. Сложные эфиры и другие производные
карбоновых кислот.
Урок 30. Происхождение и применение карбоновых
кислот и сложных эфиров.
Урок 31. Генетическая связь углеводородов, их
галогенопроизводных и кислородсодержащих
соединений.
Урок 32. Жиры.
Урок 33. Углеводы.
Урок 34. Циклические формы моносахаридов.
Урок 35. Дисахариды и олигосахариды.
Урок 36. Полисахариды.
Урок 37. Химические свойства углеводов.
Урок 38. Контрольная работа № 2 (тесты) по теме
«Кислородсодержащие соединения».
Урок 39. Итоговая работа «Вся органическая химия».
Словарь терминов
Нам не дано предугадать,
как слово наше в сердце отзовется.
Р.Казакова
Тема 1. Углеводороды
Урок 1. Строение органических
соединений
Органическая химия – это наука о соединениях
углерода. Мистер Углерод будет проводником по
этому пособию.
Углеводороды – органические соединения,
состоящие из атомов двух элементов – у……. и
в……. .
Многообразие органических соединений
обусловлено способностью атомов С образовывать
ц… , т.е. соединяться друг с другом. Углеродные
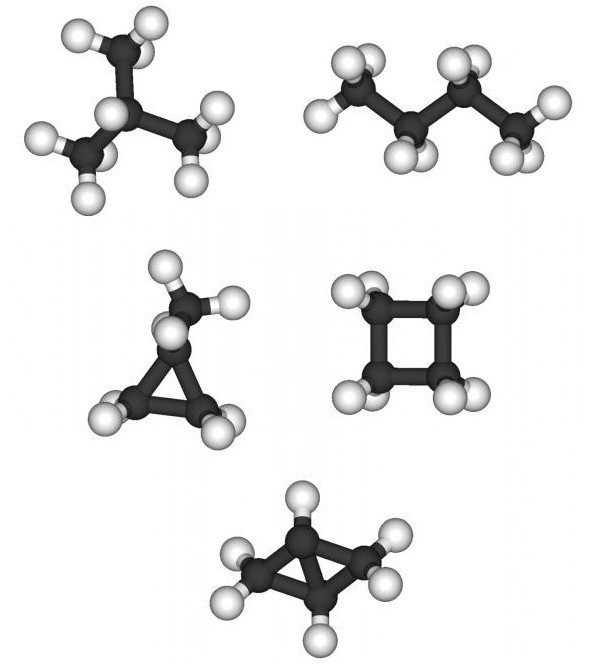
цепи бывают л……. , р………… и ц………. .
 |
Мистер Углерод |
Линейные цепи – такие, в которых
все атомы С располагаются на одной линии (прямой,
ломаной или закрученной). Если атомы С обозначать
точками, а химические связи между атомами
черточками, то линейные цепи выглядят так:
Разветвленные цепи – такие, в которых
некоторые атомы С не попадают на непрерывную
линию, соединяющую наибольшее число углеродных
атомов молекулы. Самую длинную цепь из атомов С
называют г…… у……… ц….. . Чтобы выделить главную
углеродную цепь, ее атомы С нумеруют. Атомы и
группы атомов, не входящие в главную цепь (в том
числе гетероатомы* для производных
углеводородов), связанные с главной цепью атомов
С, называют з………… .
В условной сокращенной записи разветвленных
цепей атомы углерода – заместители – будем
показывать точками в кружочке, а гетероатомы –
химическими символами.
Примеры разветвленных углеродных цепей:
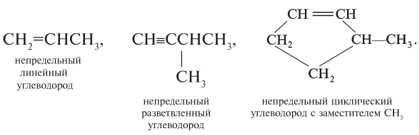
Циклические цепи (циклы) содержат 3, 4, 5, 6 и
большее число атомов С, замкнутых в кольцо.
Главной цепью в циклических соединениях служат
атомы углерода цикла, причем их счет начинают от
более сложного заместителя, входящего в цепь.
Примеры циклических цепей:
Группы звезд на небе тоже можно представить как
цепи разных видов:
 |
Небесные созвездия |
Задание 1. Запишите по
одному примеру углеродных цепей трех видов:
линейной, разветвленной, циклической, – каждая
из которых включала бы семь атомов С.
Задание 2. В ряду химических
символов подчеркните гетероатомы: Н, Li, С, N, O, F,
Cl.
Углеводороды линейного и разветвленного
строения, все связи между атомами углерода в
которых одинарные (насыщенные или предельные):
имеют название «а…..».
Общая формула алканов – СnH2n+2,
где n = 1, 2, 3, 4 и т. д. (любое целое число).
Например, если в молекуле предельного
углеводорода три атома углерода (n = 3), то
число атомов водорода будет восемь (2n + 2 = 2•3 +
2 = 8), молекулярная формула этого вещества – С3Н8.
Для алканов с пятью и пятьюдесятью атомами С
молекулярные формулы – С5Н… и С50Н…
.
Алканы, имеющие циклическое строение
(содержащие в составе молекулы цикл), называют
ц………… . Общая формула циклоалканов –
СnH2n. Так, для циклических
углеводородов, содержащих пять атомов С,
молекулярная формула будет С5Н10. Для
циклических цепей состава С5Н10, у
которых при атомах углерода (валентность С – IV)
указано необходимое число атомов H, формулы имеют
вид:
Известны непредельные углеводороды. В
них имеются углерод-углеродные связи двойные
(С=С) или тройные (СС) обычно
наряду с одинарными (С–С) связями:
Интересно, что при единичном углероде может
быть четыре гетероатомных заместителя
(структура А), при краевых атомах С углеродной
цепи – до трех гетероатомных заместителей
(структуры Б1–Б3), а при внутренних
атомах цепи – один или два заместителя
(структуры В1, В2):
* Гетероатомами в органической химии
называют все атомы, отличные от С и Н, например,
гетероатомы – F, Cl, Вr, N, О и т. д.
Урок 2. Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому
при записи структурных формул от углерода должно
отходить четыре черточки, изображающие
химические связи.
Форму записи состава органической молекулы, в
которой каждый атом C показан отдельно со
связями, называют с………. ф…….. . Химически
связанные атомы углерода представляют углеродный
скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы
углеводорода – это когда каждый атом молекулы
показан отдельно:
Такая запись громоздкая, занимает много места и
используется редко.
2. Форма записи, в которой указывают
общее число атомов водорода при каждом атоме С, а
между соседними углеродами ставят черточки,
означающие х……… с…. :
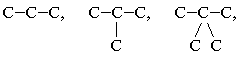
СН3–СН2–СН3, Сl–СН2–СН2–Br.
3. Структурная формула, в которой
черточки между атомами, расположенными в записи
на одной строке, не указывают, тогда как атомы,
выходящие на другие строки, соединяют черточками
с прямой цепью:
Иногда углеродные цепи изображают ломаными
линиями, геометрическими фигурами (треугольник,
квадрат, куб). При этом в каждом изломе цепи, а
также в начале и в конце цепи подразумевают атом
С. Например, изображениям
соответствуют структурные формулы
Ниже приведены некоторые свойства отдельных
предельных углеводородов и формы их записи (табл.
1).
Таблица 1
Названия предельных углеводородов
(алканов) линейного строения
| Название алкана |
Молекулярная формула |
Структурная формула |
Агрегатное состояние |
Температура кипения, °С |
|---|---|---|---|---|
| Метан | СН4 | СН4 | Газ | –161,6 |
| Этан | С2Н6 | СН3СН3 | Газ | –88,6 |
| Пропан | С3Н8 | СН3СН2СН3 | Газ | –42,1 |
| Бутан | С4Н10 | СН3СН2СН2СН3 | Газ | –0,5 |
| Пентан | С5Н12 | СН3(СН2)3СН3 | Жидкость | 36,1 |
| Гексан | С6Н14 | СН3(СН2)4СН3 | Жидкость | 68,7 |
| Гептан | С7Н16 | СН3(СН2)5СН3 | Жидкость | 98,5 |
| Октан | С8Н18 | СН3(СН2)6СН3 | Жидкость | 125,6 |
| Нонан | С9Н20 | СН3(СН2)7СН3 | Жидкость | 150,7 |
| Декан | С10Н22 | СН3(СН2)8СН3 | Жидкость | 174,0 |
Составление названий
разветвленных и замещенных алканов
1. Выбирают главную углеродную цепь и
нумеруют ее таким образом (слева или справа),
чтобы входящие заместители получили наименьшие
номера.
2. Название начинают с цифрового
локанта – номера углерода, при котором находится
заместитель. После цифры через черточку пишут
название заместителя. Разные заместители
указывают последовательно. Если одинаковые
заместители повторяются два раза, то в названии
после цифровых локантов, указывающих положение
этих заместителей, пишут приставку «ди».
Соответственно при трех одинаковых заместителях
приставка «три», при четырех – «тетра», при пяти
заместителях – «пента» и т. д.
Названия заместителей
| СН3– | С2Н5– | СН3СН2СН2– | Сl– | F– | Br– | –NO2 | |
| метил | этил | пропил | изопропил | хлор | фтор | бром | нитро |
Примеры:
3. Слитно с приставкой и заместителем
пишут название углеводорода, пронумерованного в
качестве главной углеродной цепи:
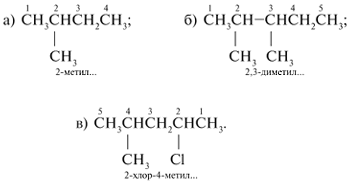
а) 2-метилбутан; б) 2,3-диметилпентан; в)
2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично,
только к названию углеводорода – по числу атомов
углерода в цикле – добавляют приставку «цикло»:
Вещества, сходные по строению, но различающиеся
на одну или несколько групп –СН2–,
известны как г……. .
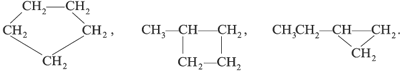
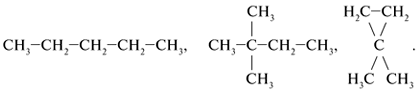
Примеры гомологов:
СН3–СН3, СН3–СН2–СН3,
СН3–СН2–СН2–СН3.
Элемент сходства – алканы с линейной цепью:
Cходство трех формул веществ последнего
примера – в каждом случае при втором атоме С
главной углеродной цепи находится одинаковый
заместитель – группа СН3.
Упражнения.
1. Укажите, к каким классам могут
принадлежать следующие соединения (алканы
подчеркните одной чертой, циклоалканы – двумя):
С5Н8, С4Н8, С4Н10,
С5Н12, С3Н4, С3Н8,
С4Н6, С6Н12, С7Н16,
С6Н6.
2. Составьте структурные формулы
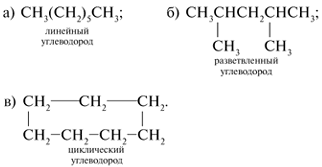
углеводородов, содержащих семь атомов С в
молекуле:
а) линейного строения; б) с разветвленной цепью; в)
с цепью, включающей цикл.
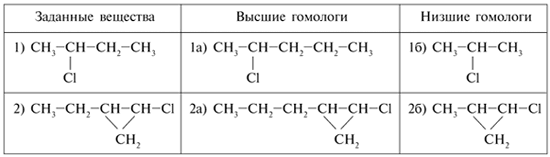
3. Выберите гомологи из следующих
веществ (выделите одинаковым образом). Поясните,
в чем их сходство и различие:
СН3Сl, СН3СН2СН3,
СН3СН2СН2СН3,
4. Составьте структурные формулы: а)
более высшего гомолога (+СН2); б) более
низшего гомолога – для следующих веществ:
5. Выберите главные цепи атомов
углерода, пронумеруйте их и соотнесите названия
(приведены ниже) со структурой следующих
соединений:
а) 1-Бром-2-метилциклопропан; б)
1-бром-3-метилбутан; в) н-октан; г) 2-бромбутан.
6. Назовите соединения по их структурным
формулам:
7. По химическим названиям составьте
структурные формулы веществ:
а) нормальный гептан; б) 2-метилгексан; в)
2,3-диметилпентан; г) 2-хлор-2,3-диметилбутан.
Ответы и решения
заданий и упражнений к теме 1
Урок 1
1.
Урок 2
1. Принадлежность соединений к классам
углеводородов определяем по их соответствию
общим формулам – алканы СnH2n+2,
циклоалканы :
2.
3. Гомологи:
а) СН3Сl и СН3СН2Сl; сходство
состоит в том, что оба вещества – хлорзамещенные
углеводороды, причем атом хлора находится у
крайнего атома С, т.е. на конце цепи, а различие
этих веществ в одном – на группу СН2 больше;
б) СН3СН2СН3 и СН3СН2СН2СН3;
сходство – это линейные углеводороды, они
различаются на группу СН2;
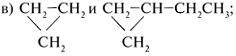
вещества содержат
трехуглеродное кольцо, а различаются на две
группы СН2.
4.
Цепочки превращений с углеводородами так же разнообразны, как велико разнообразие самих углеводородов. И это несмотря на то, что вещества состоят из атомов всего двух элементов: углерода и водорода.
Существует генетическая связь между классами углеводородов, а также между углеводородами и органическими веществами других классов (спиртами, альдегидами и т.д.). Такая взаимосвязь часто является основой цепочек превращений.
Условимся, что при решении цепочек по органической химии будем подписывать названия только органических веществ.
Пример 1.
Исходным веществом в этой цепочке является этилен – углеводород непредельного строения.
Первая реакция – присоединение галогеноводорода HCl по месту разрыва двойной связи. В результате образуется галогеналкан (хлорэтан):
Во второй реакции требуется получить спирт этанол. Реакция идет с участием раствора щелочи. Здесь очень важно указать, какой именно это раствор: водный или спиртовой.
В случае реакции галогеналкана с водным раствором щелочи получаем первичный спирт. В случае взаимодействия его со спиртовым раствором щелочи – алкен.
Третья реакция – внутримолекулярная дегидратация (то есть отщепление воды) спирта. В результате получаем алкен.
Продуктом четвертой реакции является двухатомный спирт этиленгликоль (этандиол — 1,2). Это результат окисления этилена раствором перманганата калия KMnO4:
Кстати! Данная реакция является качественной реакцией, позволяющей определить наличие в веществе двойной связи: происходит обесцвечивание раствора KMnO4.
Пятая реакция – присоединение галогена к алкену по месту разрыва двойной связи. Результат – образование дигалогеналкана:
Шестая реакция схожа со второй. Отличием является – образование не одноатомного, а двухатомного спирта. Условия реакции те же: взаимодействие с водным раствором щелочи:
Пример 2.
В этой цепочке превращений с углеводородами известны не все вещества. Они зашифрованы латинскими буквами X,Y и Z.
Реакция первая – межмолекулярное дегидрирование (отщепление H2 от двух молекул СН4) метана с получением ацетилена:
Реакция происходит в жестких условиях: t=1500℃. Нагревание нужно проводить очень быстро, так как в противном случае метан разлагается с образованием простых веществ H2 и С. Подробнее здесь.
Вторая реакция – присоединение к ацетилену галогеноводорода. По условию цепочки присоединяется одна молекула HCl. Реакция будет сопроводжаться разрывом только одной π-связи из двух. Результат реакции – образование непредельного соединения, содержащего галоген: хлорэтена, или хлорвинила.
Таким образом, хлорвинил – это вещество Х.
Третья реакция – реакция полимеризации хлорвинила, приводящая к образованию поливинилхлорида (ПВХ):
Подробнее об этой реакции здесь.
Поливинилхлорид – это вещество Y.
В четвертой реакции получаем ацетальдегид (этаналь) по реакции Кучерова: гидратацией (присоединением H2O) ацетилена:
Таким образом, этаналь – это вещество Z.
Пятая реакция – восстановление ацетальдегида (присоединением водорода) до спирта:
Подробнее о подобных реакциях здесь.
Пример 3.
Цепочка превращений с углеводородами в данном случае также содержит несколько зашифрованных веществ X,Y и Z.
Исходным веществом является алкан этан, который подвергается хлорированию на свету. Реакция имеет свободно-радикальный механизм.
По условию цепочки в реакции замещения участвует 1 моль хлора, поэтому получаем моногалогеналкан – хлорэтан – вещество Х.
Реакция превращения вещества X в вещество Y происходит при участии Na. Это реакция Вюрца, приводящая к удлинению углеродной цепи:
Таким образом, вещество Y – это н.-бутан.
В третьей реакции при дегидрировании (отщеплении водорода H2) н.-бутана образуется дивинил (или бутадиен – 1,3). Процесс протекает при высокой температуре и в присутствии катализаторов (Al2O3 и Cr2O3):
Взаимодействие полученного дивинила и стирола – реакция полимеризации, приводящая к образованию бутадиен-стирольного каучука (вещество Z):
Пример 4.
Это пример цепочки превращений с углеводородами, в которой даны не молекулярные формулы веществ, а их названия. Кроме того, два вещества зашифрованы: А и В.
Еще одна особенность данной цепочки: прямого способа получения гексана из пропана не существует. В связи с этим предположим промежуточные реакции. Вариантов может быть два:
Рассмотрим реакции 1 пути.
Первая реакция – галогенирование пропана. Это реакция замещения, идущая по свободно-радикальному механизму.
В молекуле пропана два атома углерода первичные и один (средний) вторичный. Благодаря взаимному влиянию атомов замещение водорода на атом брома будет идти по вторичному атому углерода. Получим не 1-бромпропан, а 2-бромпропан. Подробнее о подобных реакциях здесь.
Вторая реакция – получение пропилена путем взаимодействия 2-бромпропана и спиртового раствора щелочи.
Обратите внимание, что применение водного раствора щелочи приведет к получению одноатомного спирта.
Третья реакция также имеет свои особенности. Можно ожидать, что присоединение бромоводорода к пропилену пойдет с соблюдением правила Марковникова. Но тогда будет получен 2-бромпропан.
В нашем случае необходимо получить 1-бромпропан. В таком случае присоединение осуществляется против правила Марковникова в присутствии пероксидов .
Четвертая реакция – синтез Вюрца, идущий с удлинением углеродной цепи:
Реакции 2 пути отличаются только одним моментом: можно из пропана сразу получить пропилен, минуя 2-бромпропан:
Возвращаемся к основной цепочке.
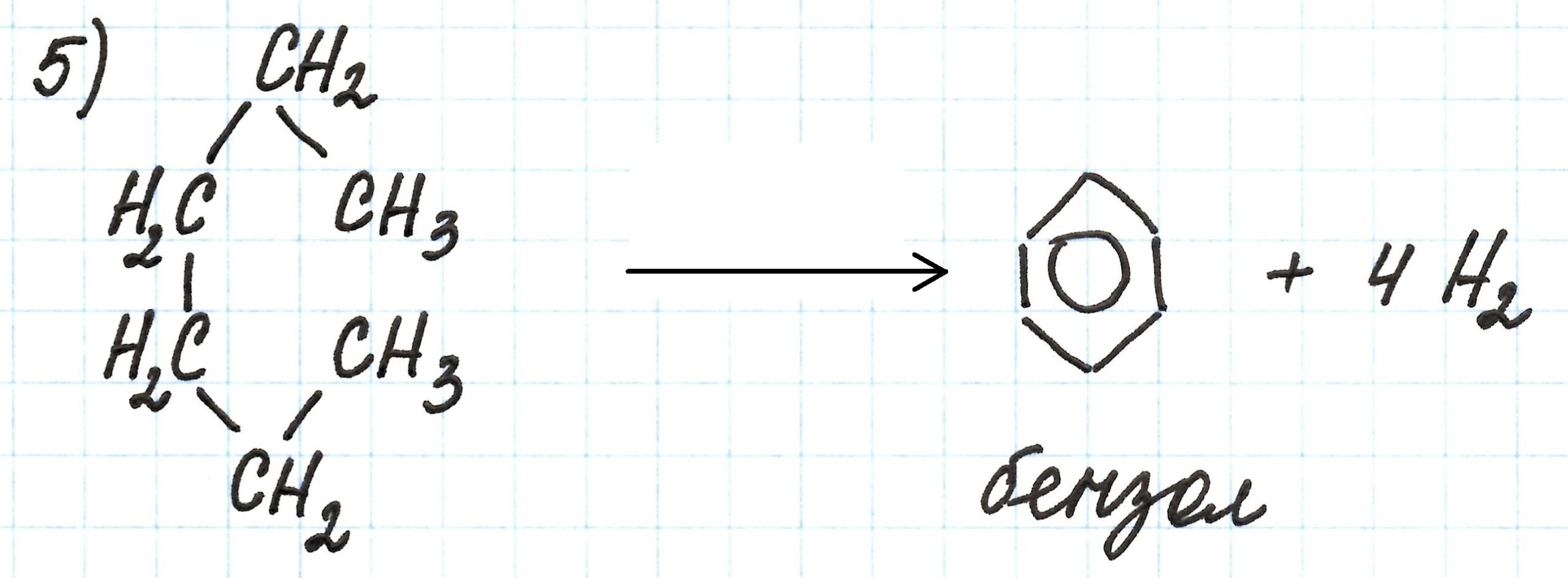
Пятая реакция – получение бензола из н.-гексана («ароматизация гексана»). Из-за того, что алканы химически мало активны, процесс идет в присутствии катализатора Cr2O3, при нагревании и под давлением:
В шестой реакции взаимодействие бензола с водородом Н2 приводит к получению вещества А, которым оказывается циклогексан.
Седьмая реакция – бромирование бензола.
Следует отметить, что бензол не реагирует с бромной водой (раствор Br2 в воде) и не обесцвечивает ее. То есть бромирование бензола не является реакцией присоединения, как это происходит у других непредельных соединений (алкенов, алкадиенов и др.). В данном случае – это реакция замещения. Осуществляется она при нагревании с собственно бромом и в присутствии бромида железа (III) FeBr3:
Таким образом, вещество В – это бромбензол.
Пример 5.
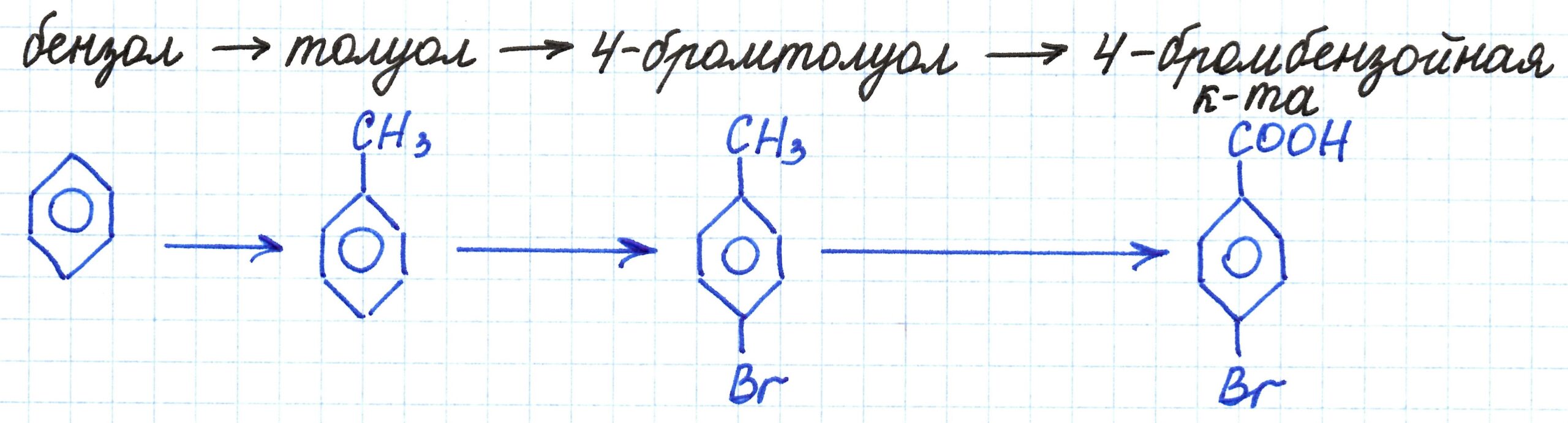
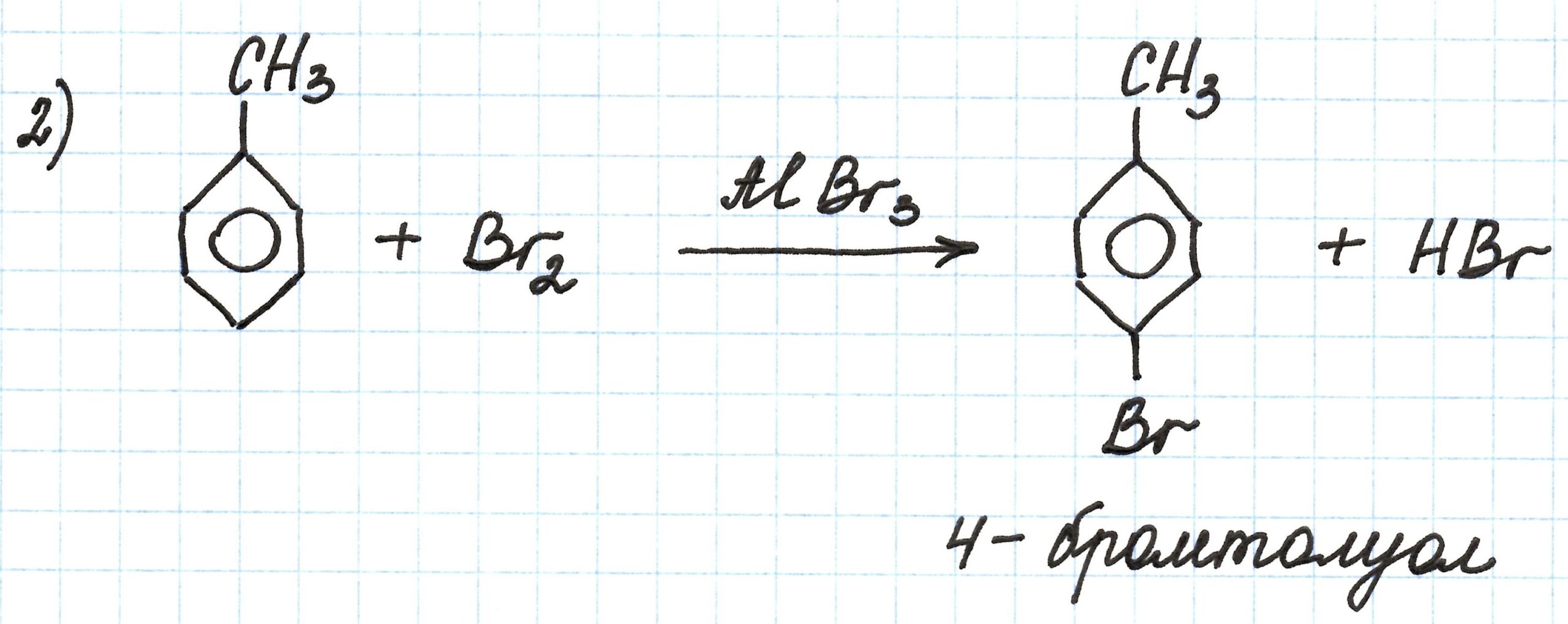
Цепочка превращений с углеводородами, имеющими ароматическое кольцо. Для лучшего восприятия под названиями веществ составим их структурные формулы.
В основе первого процесса реакция Фриделя-Крафтса — взаимодействие бензола с бромметаном в присутствии бромида алюминия. Получаем из бензола его гомолог – метилбензол (или толуол):
Вторая реакция – галогенирование гомолога бензола. Здесь важным является влияние метильной группы -СН3 на ход реакции замещения. Она оказывает воздействие на перераспределение электронной плотности в бензольном кольце. Это приводит к возможности замещения атомов водорода у строго определенных атомов углерода.
Подробнее о правилах ориентации при электрофильном замещении здесь.
В третей реакции происходит окисление 4-бромтолуола по боковой углеродной цепи (то есть по метильной группе). Процесс протекает при воздействии сильных окислителей (K2Cr2O7 или KMnO4) в кислой среде (H2SO4):
Начало было здесь.
Продолжение следует…
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.