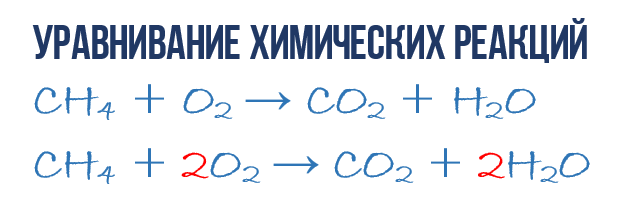Для того, чтобы составить уравнения реакции, нужно внимательно прочитать описание. Сначала просто записываем по описанию, а затем расставляем коэффициенты:
а)
Теперь расставляем коэффициенты. В левой части уравнения 2 атома железа, ставим справа перед железом коэффициент 2. Слева 3 атома кислорода, справа 1, ставим перед водой коэффициент 3. Получаем справа 3*2=6 атомов водорода. Нужно поставить слева перед водородом тоже коэффициент 3, тогда их там тоже станет 6. Вот что получится:
б)
Расставляем коэффициенты. Слева 2 атома хлора, справа 3, слева перед хлором ставим коэффициент 3, справа перед хлоридом алюминия 2, получаем по 6 атомов хлора в каждой части уравнения. Далее уравниваем алюминий. Перед алюминием слева тоже поставим 2. Получаем уравнение:
в)
Уравниваем. Слева два атома азота, справа один, ставим перед нитридом натрия коэффициент 2. Справа получается 6 атомов натрия. Перед натрием слева ставим коэффициент 6. Уравнение готово:
Рассмотрим порядок составления химической реакции на примере взаимодействия сложных веществ гидроксида натрия
NaOH
и серной кислоты
H2SO4
, протекающего с образованием сульфата натрия
Na2SO4
и воды
H2O
.
1. В левой части уравнения запишем формулы веществ, вступающих в реакцию (реагентов):
левая часть
реагенты
2. В правой части уравнения запишем формулы веществ, которые образуются в результате реакции (продуктов реакции):
правая часть
продукты реакции
3. Уравняем число атомов химических элементов с помощью коэффициентов:
Пример:
составь уравнение реакции горения магния в кислороде.
реагенты
продукт реакции
Составление уравнений химических реакций
Урок посвящен изучению алгоритма составления уравнения химической реакции. В ходе урока вы научитесь составлять схему и уравнение химической реакции, зная формулы исходных веществ и продуктов реакции.
I. Схема химической реакции
Сущность химической реакции с позиции атомно-молекулярной теории заключается в том, что продукты реакции образуются из тех же атомов, которые входили в состав исходных веществ.
Пример 1. При разложении воды образуются простые вещества – водород и кислород (Рис.1.).
Рис. 1. Разложение воды под действие электрического тока
Запишем формулу исходного вещества воды слева, а формулы продуктов реакции — водорода и кислорода – справа. Между ними поставим стрелку:
Н2О → Н2 + О2
Эта запись является схемой реакции.
Схема реакции показывает только состав исходных веществ и продуктов реакции, но не может полностью отражать сущность реакции. В состав молекулы воды входит один атом кислорода, а в состав простого вещества кислорода входят два атома. Это значит, что не выполняется закон сохранения массы веществ.
II. Химические уравнения реакций
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
Видео — эксперимент: “Нагревание смеси железа и серы”
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe + S = FeS
Рассмотрим еще один пример: 2Н2О = 2Н2 + О2
Чтобы не было противоречий с законом сохранения массы веществ, нужно уравнять число атомов каждого химического элемента слева и справа от стрелки.
Чтобы образовалась одна молекула кислорода, в реакцию должны вступить две молекулы воды. Поставив коэффициент «2» перед формулой воды. Теперь уравняем количество атомов водорода, поставив коэффициент «2» перед формулой Н2, вместо стрелки поставим знак равенства:
Эта запись является уравнением химической реакции. В отличие от схемы реакции, уравнение учитывает, что число атомов каждого химического элемента в реакции не меняется.
Цифры, стоящие перед формулой вещества, называются коэффициентами. Коэффициент показывает количество молекул вещества.
Прочитать записанное уравнение можно так: «Из двух молекул воды образуется две молекулы водорода и 1 молекула кислорода».
III. Алгоритм составления уравнения химической реакции
|
Составим уравнение химической реакции взаимодействия фосфора и кислорода |
|
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку: P + O2 → |
|
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов: P + O2 → P2O5 |
|
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
4P + 5O2 = 2P2O5 |
IV. Работа с тренажерами
V. Задания для закрепления
Задание №1
Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства:
Zn + O2 → ZnO
Fe + Cl2→ FeCl3
Mg + HCl → MgCl2 + H2
Al(OH)3 → Al2O3 + H2O
HNO3→ H2O+NO2+O2
CaO+H2O→ Ca(OH)2
H2+Cl2→ HCl
KClO3→ KClO4+KCl
Fe(OH)2+H2O+O2→ Fe(OH)3
KBr+Cl2→ KCl+Br2
Задание №2
Используя алгоритм составления уравнений химических реакций, составьте уравнения реакций взаимодействия между следующими парами веществ:
1) Na и O2
2) Na и Cl2
3) Al и S
Цель урока: помочь обучающимся сформировать знания о химическом
уравнении как об условной записи химической реакции с помощью химических формул.
Задачи:
Образовательные:
- систематизировать ранее изученный материал;
- обучать умению составлять уравнения химических реакций.
Воспитательные:
- воспитывать коммуникативные навыки (работа в паре, умение слушать и
слышать).
Развивающие:
- развивать учебно-организационные умения, направленные на выполнение
поставленной задачи; - развивать аналитические навыки мышления.
Тип урока: комбинированный.
Оборудование: компьютер, мультимедийный проектор, экран, оценочные
листы, карта рефлексии, “набор химических знаков”, тетрадь с печатной основой,
реактивы: гидроксид натрия, хлорид железа(III), спиртовка, держатель, спички,
лист ватмана, разноцветные химические знаки.
Презентация урока (приложение 3)
Структура урока.
І. Организационный момент.
ІІ. Актуализация знаний и умений.
ІІІ. Мотивация и целеполагание.
ІV. Изучение нового материала:
4.1 реакция горения алюминия в кислороде;
4.2 реакция разложения гидроксида железа (III);
4.3 алгоритм расстановки коэффициентов;
4.4 минута релаксации;
4.5 расставь коэффициенты;
V. Закрепление полученных знаний.
VІ. Подведение итогов урока и выставление оценок.
VІІ. Домашнее задание.
VІІІ. Заключительное слово учителя.
Ход урока
Химическая натура сложной частицы
определяется натурой элементарных
составных частей,
количеством их и
химическим строением.
Д.И.Менделеев
Учитель. Здравствуйте, ребята. Садитесь.
Обратите внимание: у вас на столе лежит тетрадь с печатной основой
(Приложение 2), в которой вы сегодня будете
работать, и оценочный лист, в нем вы будете фиксировать свои достижения,
подпишите его.
Оценочный лист. (Приложение 1.)
| Фамилия и имя обучающегося |
|
| Этапы работы | Количество баллов |
| Тест
“Физические и химические явления. |
|
| Задание “Расставь коэффициенты” | |
| Выходной контроль | |
| Общее количество баллов | |
| Оценка за урок |
Актуализация знаний и умений.
Учитель. Мы с вами познакомились с физическими и химическими
явлениями, химическими реакциями и признаками их протекания. Изучили закон
сохранения массы веществ.
Давайте проверим ваши знания. Я предлагаю вам открыть тетради с печатной основой
и выполнить задание 1. На выполнение задания вам дается 5 минут.
Тест по теме “Физические и химические явления. Закон сохранения массы
веществ”.
1. Чем химические реакции отличаются от
физических явлений?
- Изменение формы, агрегатного состояния вещества.
- Образование новых веществ.
- Изменение местоположения.
2. Каковы признаки химической реакции?
- Образование осадка, изменение цвета, выделение газа.
- Намагничивание, испарение, колебание.
- Рост и развитие, движение, размножение.
3. В соответствии с каким законом составляются уравнения химических
реакций?
- Закон постоянства состава вещества.
- Закон сохранения массы вещества.
- Периодический закон.
- Закон динамики.
- Закон всемирного тяготения.
4. Закон сохранения массы вещества открыл:
- Д.И. Менделеев.
- Ч. Дарвин.
- М.В. Ломоносов.
- И. Ньютон.
- А.И. Бутлеров.
5. Химическим уравнением называют:
- Условную запись химической реакции.
- Условную запись состава вещества.
- Запись условия химической задачи.
Учитель. Вы выполнили работу. Я предлагаю вам осуществить ее проверку.
Поменяйтесь тетрадями и осуществите взаимопроверку. Внимание на экран. За каждый
правильный ответ – 1 балл. Общее количество баллов занесите в оценочные листы.
Мотивация и целеполагание.
Учитель. Используя эти знания, мы сегодня будем составлять уравнения
химических реакций, раскрывая проблему “Является ли закон сохранения массы
веществ основой для составления уравнений химических реакций”
Изучение нового материала.
Учитель. Мы привыкли считать, что уравнение-это математический пример,
где есть неизвестное, и это неизвестное нужно вычислить. А вот в химических
уравнениях обычно ничего неизвестного не бывает: в них просто записывается все
формулами: какие вещества вступают в реакцию и какие получаются в ходе этой
реакции. Посмотрим опыт.
(Реакция соединения серы и железа.) Приложение 3
Учитель. С точки зрения массы веществ, уравнение реакции соединения
железа и серы понимается следующим образом
Железо + сера → сульфид железа (II ) (задание 2 тпо)
Но в химии слова отражаются химическими знаками. Запишите это уравнение
химическими символами.
Fe + S → FeS
(Один ученик пишет на доске, остальные в ТПО.)
Учитель. Теперь прочитайте.
Обучающиеся. Молекула железа взаимодействует с молекулой серы, получается
одна молекула сульфида железа (II).
Учитель. В данной реакции мы видим, что количество исходных веществ равно
количеству веществ в продукте реакции.
Всегда надо помнить, что при составлении уравнений реакций ни один атом не
должен потеряться или неожиданно появиться. Поэтому иногда, записав все формулы
в уравнении реакции, приходиться уравнивать число атомов в каждой части
уравнения – расставлять коэффициенты. Посмотрим еще один опыт
(Горение алюминия в кислороде.) Приложение 4
Учитель. Запишем уравнение химической реакции (задание 3 в ТПО)
Al + O2 → Al+3
O-2
Чтобы записать правильно формулу оксида, вспомним что
Обучающиеся. Кислород в оксидах имеет степень окисления -2, алюминий –
химический элемент с постоянной степенью окисления +3. НОК = 6
Al + O2 → Al2O3
Учитель. Мы видим, что в реакцию вступает 1 атом алюминия, образуется
два атома алюминия. Вступает два атома кислорода, образуется три атома
кислорода.
Просто и красиво, но неуважительно по отношению к закону сохранения массы
веществ – она разная до и после реакции.
Поэтому нам необходимо расставить коэффициенты в данном уравнении химической
реакции. Для этого найдем НОК для кислорода.
Обучающиеся. НОК = 6
Учитель. Перед формулами кислорода и оксида алюминия ставим
коэффициенты, чтобы число атомов кислорода слева и справа было равно 6.
Al + 3O2 →
2Al2O3
Учитель. Теперь получаем, что в результате реакции образуется четыре
атома алюминия. Следовательно, перед атомом алюминия в левой части ставим
коэффициент 4
4Al + 3O2 → 2Al2O3
Еще раз пересчитаем все атомы до реакции и после нее. Ставим равно.
4Al + 3O2 _= 2 Al2O3
Учитель. Рассмотрим еще один пример
(Учитель демонстрирует опыт по разложению гидроксида железа (III).)
Fe(OH)3 → Fe2O3 + H2O
Учитель. Расставим коэффициенты. В реакцию вступает 1 атом железа,
образуется два атома железа. Следовательно, перед формулой гидроксида железа (3)
ставим коэффициент 2.
2Fe(OH)3 → Fe2O3
+ H2O
Учитель. Получаем, что в реакцию вступает 6 атомов водорода (2х3),
образуется 2 атома водорода.
Обучающиеся. НОК =6. 6/2 = 3. Следовательно, у формулы воды ставим
коэффициент 3
2Fe(OH)3 → Fe2O3 +
3H2O
Учитель. Считаем кислород.
Обучающиеся. Слева – 2х3 =6; справа – 3+3 = 6
Обучающиеся. Количество атомов кислорода ,вступивших в реакцию, равно
количеству атомов кислорода, образовавшихся в ходе реакции. Можно ставить равно.
2Fe(OH)3 = Fe2O3
+3 H2O
Учитель. Теперь давайте обобщим все сказанное ранее и познакомимся с
алгоритмом расстановки коэффициентов в уравнениях химических реакций.
- Подсчитать количество атомов каждого элемента в правой и левой части
уравнения химической реакции. - Определить, у какого элемента количество атомов меняется, найти НОК.
- Разделить НОК на индексы – получить коэффициенты. Поставить их перед
формулами. - Пересчитать количество атомов, при необходимости действие повторить.
- Последним проверить количество атомов кислорода.
Учитель. Вы хорошо потрудились и , наверное, устали. Я предлагаю вам
расслабиться, закрыть глаза и вспомнить какие-либо приятные моменты жизни. У
каждого из вас они разные. Теперь откройте глаза и сделайте круговые движения
ими сначала по часовой стрелке, затем – против. Теперь интенсивно подвигайте
глазами по горизонтали: направо – налево, и вертикали: вверх – вниз.
А сейчас активизируем мыслительную деятельность и помассируем мочки ушей.
Учитель. Продолжаем работу.
В тетрадях с печатной основой выполним задание 5. Работать вы будете в парах.
Вам необходимо расставить коэффициенты в уравнених химических реакций. На
выполнение задания дается 10 минут.
- P + Cl2 →PCl5
- Na + S → Na2S
- HCl + Mg →MgCl2 + H2
- N2 + H2 →NH3
- H2O → H2 + O2
Учитель. Проверим выполнение задания (учитель опрашивает и выводит
на слайд правильные ответы). За каждый правильно поставленный коэффициент –
1 балл.
С заданием вы справились. Молодцы!
Учитель. Теперь давайте вернемся к нашей проблемы.
Ребята, как вы считаете, является ли закон сохранения массы веществ основой для
составления уравнений химических реакций.
Обучающиеся. Да, в ходе урока мы доказали, что закон сохранения массы
веществ – основа для составления уравнений химических реакций.
Закрепление знаний.
Учитель. Все основные вопросы мы изучили. Теперь выполним небольшой
тест, который позволит увидеть, как вы освоили тему. Вы должны на него отвечать
только “да” или “нет”. На работу дается 3 минуты.
Утверждения.
- В реакции Ca + Cl2→ CaCl2 коэффициенты не
нужны. (Да) - В реакции Zn + HCl → ZnCl2 + H2 коэффициент у
цинка 2. (Нет) - В реакции Ca + O2 → CaO коэффициент у оксида кальция 2.
(Да) - В реакции CH4 → C + H2 коэффициенты не нужны.
(Нет) - В реакции CuO + H2 → Cu + H2O коэффициент у
меди 2. (Нет) - В реакции C + O2 → CO коэффициент 2 надо поставить и у
оксида углерода (II) , и у углерода. (Да) - В реакции CuCl2 + Fe → Cu + FeCl2 коэффициенты
не нужны. (Да)
Учитель. Проверим выполнение работы. За каждый правильный ответ – 1
балл.
Итог урока.
Учитель. Вы справились хорошо с заданием. Сейчас подсчитайте общее
количество набранных баллов за урок и поставьте себе оценку согласно рейтингу,
который вы видите на экране. Сдайте мне оценочные листы для выставления вашей
оценки в журнал.
Домашнее задание.
Учитель. Наш урок подошел к концу, в ходе которого мы смогли доказать,
что закон сохранения массы веществ является основой для составления уравнений
реакций, и научились составлять уравнения химических реакций. И, как финальная
точка, запишите домашнее задание
§ 27, упр. 1 – для тех, кто получил оценку “3”
упр. 2– для тех, кто получил оценку “4”
упр. 3 – для тех, кто получил оценку “5”
Заключительное слово учителя.
Учитель. Я благодарю вас за урок. Но прежде чем вы покинете кабинет,
обратите внимание на таблицу (учитель показывает на лист ватмана с
изображением таблицы и разноцветными химическими знаками). Вы видите
химические знаки разного цвета. Каждый цвет символизирует ваше настроение.. Я
предлагаю вам составить свою таблицу химических элементов (она будет отличаться
от ПСХЭ Д.И.Менделеева) – таблицу настроения урока. Для этого вы должны подойти
к нотному листу, взять один химический элемент, согласно той характеристике,
которую вы видите на экране, и прикрепить в ячейку таблицы. Я сделаю это первой,
показав вам свою комфортность от работы с вами.
F Мне было на уроке комфортно, я получил ответ на все интересующие меня
вопросы.
F На уроке я достиг цели наполовину.
F Мне на уроке было скучно, я ничего не узнал
нового.
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Урок химии в 8-м классе по теме «Химические уравнения»
Разделы: Химия
Цель: научить учащихся составлять химические уравнения. Научить их уравнивать с помощью коэффициентов на основе знания закона сохранения массы вещества М.В. Ломоносова.
Задачи:
- Образовательные:
- продолжить изучение физических и химических явлений с введением понятия «химическая реакция»,
- ввести понятие «химическое уравнение»;
- научить учащихся составлять химические уравнения, уравнивать уравнения с помощью коэффициентов.
- Развивающие:
- продолжить развивать творческий потенциал личности учащихся через создание ситуации проблемного обучения, наблюдения, проведения опытов химических реакций.
- Воспитательная:
- воспитать умение работать в команде, группе.
Оборудование: табличный материал, справочники, алгоритмы, набор заданий.
Д/О: «Горение бенгальских огней»:, спички, сухое горючее, железный лист/ ТБ при работе с огнём.
I. Организационный момент
Определение цели урока.
II. Повторение
1) На доске набор физических и химических явлений: испарение воды; фильтрование; ржавление; горение дров; скисание молока; таяние льда; извержение вулкана; растворение сахара в воде.
Задание:
Дать пояснение каждому явлению, назвать практическое применение данного явления в жизни человека.
На доске нарисована капля воды. Создать полную схему превращения воды из одного агрегатного состояния в другое. Как называется данное явление в природе и каково его значение в жизни нашей планеты и всего живого?
III. Д/О «Горение бенгальских огней»
1. Что происходит с магнием, который составляет основу бенгальского огня ?
2. Что явилось основной причиной такого явления?
3. К какому типу относится данная химическая реакция?
4. Попробуйте схематично изобразить химическую реакцию, которую вы наблюдали в этом опыте.
– Предлагаю попробовать составить схему данной реакции:
– Как мы узнали, что получилось другое вещество? (По признакам химической реакции: изменение окраски, появление запаха.)
– Какой газ находится в воздухе, который поддерживает горение? (Кислород – О)
IV. Новый материал
Химическую реакцию можно записывать с помощью химического уравнения.
Можно вспомнить понятия «уравнение», которое дается в математике. В чем суть самого уравнения? Что-то уравнивают, какие-то части.
Попробуем дать определение «химического уравнения», можно смотреть на схему и попытаться дать определение:
Химическое уравнение – это условная запись химической реакции с помощь химических знаков, формул и коэффициентов.
Химические уравнения записываются на основе Закона сохранения массы вещества, открытого М.В.Ломоносовым в 1756 году, который гласит (учебник стр. 96): «Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате её».
– Надо научиться уравнивать химические уравнения с помощью коэффициентов.
– Для того чтобы хорошо научиться составлять химические уравнения, нам необходимо вспомнить:
– Что такое коэффициент?
– Что такое индекс?
Не забываем алгоритм «Составление химических формул».
Предлагаю пошаговый алгоритм составления химического уравнения:
V. Составления химического уравнения
1. Записываю в левой части уравнение вступающие в реакцию вещества: Al + O2
2. Ставлю знак «=» и записываю образующиеся вещества в правой части уравнения – продукты реакции: Al + O2 = Al2O3
3. Уравнивать начинаю с того химического элемента, которого больше или с кислорода, затем составляю конструкцию:
вступило кислорода «2», а получилось «3», их число не равно.
4. Ищу НОК (наименьшее общее кратное) двух цифр «2» и «3» – это «6»
5. Делю НОК «6» на число «2» и «3»и выставляю в качестве коэффициентов перед формулами.
6. Начинаю уравнивать следующие химические элементы – Al, рассуждаю так же. Вступило Al «1», а получилось «4», ищу НОК
Коэффициент «1» в уравнениях не пишется, но учитывается при составлении уравнения.
7. Читаю всю запись химического уравнения.
Такое долгое рассуждение позволяет быстро научиться уравнивать в химических уравнениях, учитывая, что правильное составление уравнений реакций для химии имеет большое значение: решение задач, написание химических реакций.
VI. Задание на закрепление
Фосфор + кислород = оксид фосфора (V)
Серная кислота + алюминий = сульфат алюминия + водород
Вода = водород + кислород
– Работает на доске один сильный ученик.
– Расставить коэффициенты в уравнениях химических реакций.
Химические уравнения отличаются по типам, но это мы рассмотрим на следующем уроке.
VII. Подведение итогов урока
Вывод. Выставление оценок.
VIII. Домашнее задание: § 27, упр. 2, с. 100.
Дополнительный материал: Р.т.с. 90-91, упражнение 2 – индивидуально.
Как составлять химические уравнения 8 класс поэтапно с объяснением
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Составление уравнений химических реакций
Урок посвящен изучению алгоритма составления уравнения химической реакции. В ходе урока вы научитесь составлять схему и уравнение химической реакции, зная формулы исходных веществ и продуктов реакции.
I. Схема химической реакции
Сущность химической реакции с позиции атомно-молекулярной теории заключается в том, что продукты реакции образуются из тех же атомов, которые входили в состав исходных веществ.
Пример 1. При разложении воды образуются простые вещества – водород и кислород (Рис.1.).
Рис. 1. Разложение воды под действие электрического тока
Запишем формулу исходного вещества воды слева, а формулы продуктов реакции — водорода и кислорода – справа. Между ними поставим стрелку:
Эта запись является схемой реакции.
Схема реакции показывает только состав исходных веществ и продуктов реакции, но не может полностью отражать сущность реакции. В состав молекулы воды входит один атом кислорода, а в состав простого вещества кислорода входят два атома. Это значит, что не выполняется закон сохранения массы веществ.
II. Химические уравнения реакций
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Запишем протекающую реакцию в виде уравнения химической реакции:
Рассмотрим еще один пример: 2Н2О = 2Н2 + О2
Чтобы не было противоречий с законом сохранения массы веществ, нужно уравнять число атомов каждого химического элемента слева и справа от стрелки.
Чтобы образовалась одна молекула кислорода, в реакцию должны вступить две молекулы воды. Поставив коэффициент «2» перед формулой воды. Теперь уравняем количество атомов водорода, поставив коэффициент «2» перед формулой Н2, вместо стрелки поставим знак равенства:
Эта запись является уравнением химической реакции. В отличие от схемы реакции, уравнение учитывает, что число атомов каждого химического элемента в реакции не меняется.
Цифры, стоящие перед формулой вещества, называются коэффициентами. Коэффициент показывает количество молекул вещества.
Прочитать записанное уравнение можно так: «Из двух молекул воды образуется две молекулы водорода и 1 молекула кислорода».
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
- Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
- В данном случае это атомы кислорода.
- Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:
http://urok.1sept.ru/articles/599246
http://kardaeva.ru/88-dlya-uchenika/8-klass/124-sostavlenie-uravnenij-khimicheskikh-reaktsij