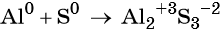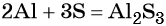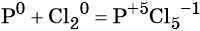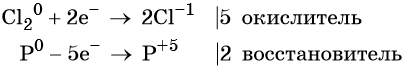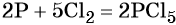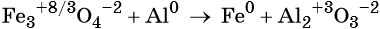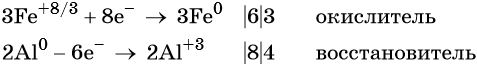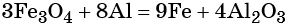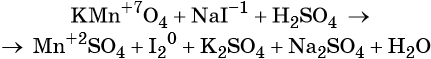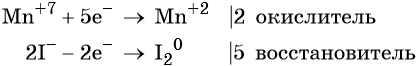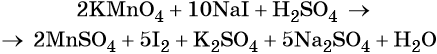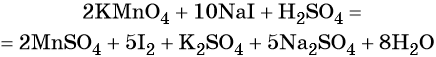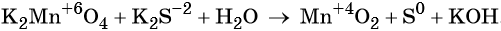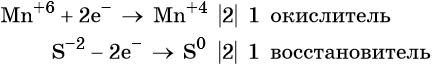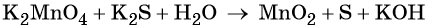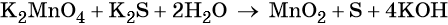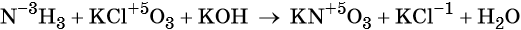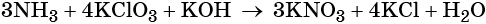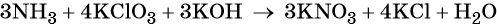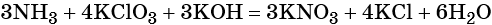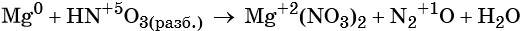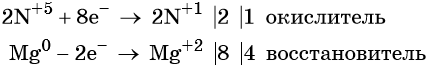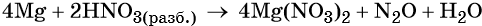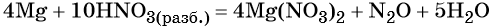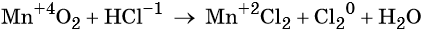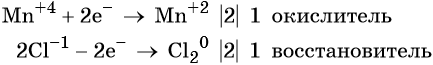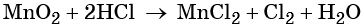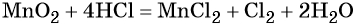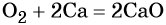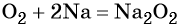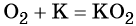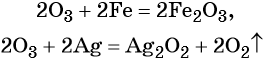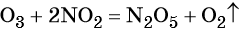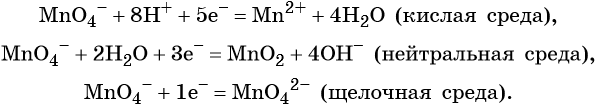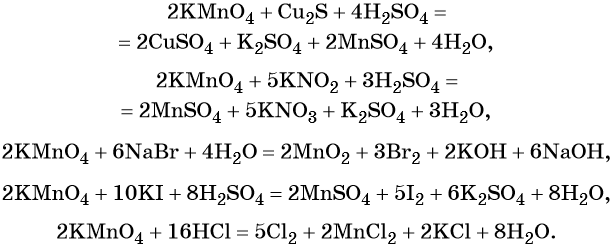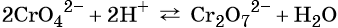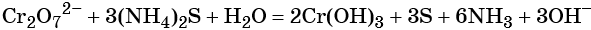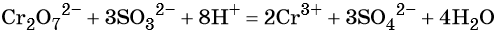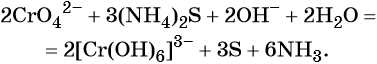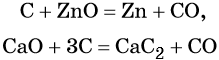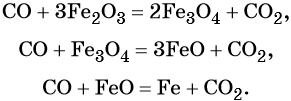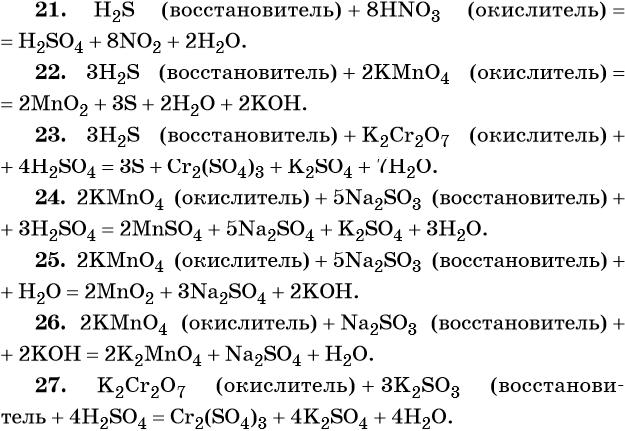1. Как определить окислительно-восстановительную реакцию?
Существуют различные классификации химических реакций. К одной из них относится такие, при которых вещества, вступающие во взаимодействие друг с другом (или само вещество) меняют степени окисления элементов.
В качестве примера рассмотрим две реакции:
Zn0 + 2Н+1С1-1 = Zn+2Cl2-1 + Н20 (1)
Н+1Cl-1 + К+1О-2Н+1 = К+1Cl-1 + H2+1O-2 (2)
В реакции (1) участвуют цинк и соляная кислота. Цинк и водород меняют свои степени окисления, хлор оставляет свою степень окисления неизменной:
Zn0 — 2е = Zn2+
2Н+1 + 2е = H20
2Сl-1 = 2 Сl-1
А в реакции (2), (реакция нейтрализации), хлор, водород, калий, и кислород не меняют свои степени окисления: Сl-1 = Cl-1, H+1 = H+1, К+1 = К+1, O-2 = O-2; Реакция (1) относится к окислительно-восстановительной, а реакция (2) принадлежит к другому типу.
Химические реакции, которые осуществляются с изменением степени окисления элементов, называются окислительно-восстановительными.
Для того чтобы определить окислительно-восстановительную реакцию необходимо установить степени окисления элементов в левой и в правой части уравнения. Для этого требуется знать, как определить степень окисления того или иного элемента.
В случае реакции (1) элементы Zn и Н меняют свои состояния, теряя или приобретая электроны. Цинк, отдавая 2 электрона, переходит в ионное состояние – становится катионом Zn2+. В данном случае происходит процесс восстановления и цинк окисляется. Водород приобретает 2 электрона, проявляет окислительные свойства, сам в процессе реакции восстанавливается.
2. Определение степени окисления элементов.
Степень окисления элементов в его соединениях определяется, исходя из положения, что общий суммарный заряд степеней окисления всех элементов данного соединения равен нулю. Например, в соединении Н3РО4 степени окисления у водорода +1, у фосфора +5, у кислорода -2; Составив математическое уравнение определим, что в сумме число частиц (атомов или ионов) составят заряд равный нулю: (+1)x3+(+5)+(-2)х4 = 0
Но в данном примере уже заданы степени окисления элементов. Каким же образом можно определить степень окисления cеры, например, в соединении тиосульфат натрия Na2S2O3, или марганца в соединении перманганат калия — КMnO4? Для этого необходимо знать постоянные степени окисления ряда элементов. Они имеют следующие значения:
1) Элементы I группы периодической системы (в том числе водород в соединении с неметаллами) +1;
2) Элементы II группы периодической системы +2;
3) Элементы III группы периодической системы +3;
4) Кислород (кроме в соединении со фтором или в перекисных соединениях) -2;
Исходя из этих постоянных значений степеней окисления (для натрия и кислорода) определим степень окисления серы в соединении Na2S2O3. Поскольку суммарный заряд всех степеней окисления элементов, состав которых отражает данная формула соединения, равен нулю, то обозначив неизвестный заряд у серы «2Х» (поскольку в формуле два атома серы), составим следующее математическое равенство:
(+1) х 2 + 2Х + (-2) х 3 = 0
Решая это уравнение относительно 2 х, получим
2Х= (-1) х 2 + (+2) х 3
или
Х = [(-2) + (+6)] : 2 = +2;
Следовательно, степень окисления серы в соединении Na2S2O3 равна (+2). Но неужели всегда будет необходимо пользоваться таким неудобным методом для определения степеней окисления тех или иных элементов в соединениях? Конечно же не всегда. К примеру, для бинарных соединений: оксидов, сульфидов, нитридов и т.д., можно пользоваться для определения степеней окисления так называемым методом «крест-на-крест». Допустим, дана формула соединения: оксид титана – Ti2O3. Используя простой математический анализ, исходя из того, что степень окисления кислорода нам известна и равна (-2): Ti2O3, нетрудно установить, что степень окисления у титана будет равна (+3). Или, к примеру, в соединении метан СН4 известно, что степень окисления водорода равна (+1), тогда не составляет труда определить степень окисления углерода. Она будет соответствовать в формуле этого соединения (-4). Так же, пользуясь методом «крест-на-крест», не сложно установить, что если дана следующая формула соединения Cr4Si3, то степень окисления хрома в неё равна (+3), а кремния (-4).
Для солей так же это не предоставляется затруднительным. Причём не имеет значения, дана или средняя соль или кислая соль. В данных случаях необходимо исходить из солеобразующей кислоты. К примеру, дана соль нитрат натрия (NaNO3). Известно, что она является производной азотной кислоты (НNO3), а в этом соединении степень окисления азота равна (+5), следовательно, и в её соли – нитрате натрия, степень окисления азота так же равна (+5). Гидрокарбонат натрия (NaHCO3) является кислой солью угольной кислоты (H2CO3). Так же, как и в кислоте, степень окисления углерода в этой соли будет равна (+4).
Следует отметить то обстоятельство, что степени окисления в соединениях: металлах и неметаллах (при составлении уравнения электронного баланса) равны нулю: К0, Са0, Аl0 , Н20, Cl20,N20В качестве примера приведём степени окисления наиболее типичных элементов:
Только окислителями являются вещества, имеющие максимальную, как правило положительную, степень окисления, например: КCl+7O4, H2S+6O4, K2Cr+6O4, HN+5O3, KMn+7O4. Это легко доказать. Если бы данные соединения могли быть восстановителями, то в данных состояниях они должны были бы отдавать электроны:
Cl+7– е = Cl+8
S+6 – е = S+7
Но элементы хлор и сера не могут существовать с такими степенями окисления. Аналогичным образом, только восстановителями являются вещества, имеющие минимальную, как правило, отрицательную степень окисления, например: H2S-2, HJ—, N-3H3. В процессе окислительно-восстановительных реакций такие соединения не могут быть окислителями, поскольку им пришлось бы присоединять электроны:
S-2 + е = S-3
J— + е = J-2
Но для серы и йода ионы с такими степенями окисления не характерны. Элементы с промежуточными степенями окисления, например N+1, N+4, S+4, Сl+3, С+2 могут проявлять как окислительные, так и восстановительные свойства.
3. Типы окислительно-восстановительных реакций.
Существует четыре типа окислительно-восстановительных реакций.
1) Межмолекулярные окислительно-восстановительные реакции.
Наиболее часто встречающийся тип реакций. При данных реакциях изменяются степени окисления элементов в разных молекулах, например:
2Bi+3Сl3 + 3Sn+2Cl2 = 2Bi0 + 3Sn+4Cl4
Bi+3 — 3е = Bi0
Sn+2 + 2е = Sn+4
2) Разновидностью межмолекулярных окислительно-восстановительных реакций является реакция конпропорционирования, в которой окислителем и восстановителем являются атомы одного и того же элемента: в данной реакции два атома одного элемента различными степенями окисления образуют один атом с иной степенью окисления:
SO2+4 + 2H2S-2 = 3S0 + 2Н2O
S-2 — 2е = S0
S+4 + 4е = S0
3) Реакции диспропорционирования осуществляются в случае, если окислителем и восстановителем являются атомы одного и того же элемента, или один атом элемента с одной степенью окисления образует соединение с двумя степенями окисления:
N+4O2 + NaOH = NaN+5O3+ NaN+3O2 + H2O
N+4 — е = N+5
N+4 + е = N+3
4) Внутримолекулярные окислительно-восстановительные реакции происходят в случаях, когда атом-окислитель и атом — восстановитель находятся в составе одного вещества, например:
N-3H4N+5O3 = N+12O + 2H2O
2N-3 — 8е =2N+1
2N+5 + 8е = 2N+1
4. Механизм окислительно-восстановительных реакций.
Окислительно-восстановительные реакции осуществляются за счет перехода электронов от атомов одного элемента к другому. Если атом или молекула теряет электроны, то такой процесс называется окислением, а данный атом является восстановителем, например:
Al0 — 3e = Al 3+
2Cl— — 2e = Cl20
Fe2+ — e = Fe3+
В данных примерах Al0, Cl—, Fe2+ являются восстановителями, а процессы их превращения в соединения Аl3+, Сl20, Fe3+ называются окислительными. Если атом или молекула приобретают электроны, то такой процесс называется восстановлением, а данный атом является окислителем, например:
Ca2++ 2e = Ca0
Cl20 + 2e = 2Cl—
Fe3+ + e = Fe2+
Окислителями, как правило, являются неметаллы (S, Cl2 ,F2, О2) или соединения металлов, имеющих максимальную степень окисления (Mn+7, Cr+6, Fe+3). Восстановителями являются металлы (К, Са, Аl) или соединения неметаллов, имеющих минимальную степень окисления (S-2, Сl-1 , N-3, P-3);
H2SO4 (конц.) + HJ → H2S + J2 + H2O
Прежде всего, установим, что степень окисления йода в йодистом водороде равна (-1), а серы в серной кислоте: (+6). В процессе реакции йод (-1) будет окисляться до молекулярного состояния, а сера (+6) восстанавливаться до степени окисления (-2) – сероводорода:
J—→ J02
S+6→ S-2
Чтобы составить уравнение электронного баланса необходимо учесть, что количество частиц атомов в левой и в правой частях полуреакций должно быть одинаковой
2J—→ J20
S+6 → S-2
Далее необходимо определить количество электронов, принявших участие в реакции:
2J— — 2e → J02
S+6 + 8e → S-2
Установив вертикальную черту, справа данной схемы полуреакции, определим коэффициенты реакции:
2J— — 2e → J02 |8
S+6 + 8e → S-2 |2
Сократив на «2», получим окончательные значения коэффициентов:
2J— — 2e → J02 |4
S+6 + 8e → S-2 |1
Подведем под данной схемой полуреакции горизонтальную черту и суммируем участвующее в реакции количество частиц атомов:
2J— — 2e → J02 |4
S+6 + 8e → S-2 |1
____________________
8J— + S+6 → 4 J02 + S-2
После этого необходимо расставить коэффициенты в уравнении реакции. Подставив полученные значения коэффициентов в молекулярное уравнение, приведем его к данному виду:
8HJ + H2SO4 = 4J2 + H2S + Н2O
Подсчитав количество атомов водорода в левой и правой частях уравнения, убедимся в необходимости коррекции коэффициента « 4 » перед водой, получим полное уравнение:
8HJ + H2SO4 = 4J2 + H2S + 4Н2O
Данное уравнение можно составить, используя метод электронно-ионного баланса. В этом случае отпадает необходимость в коррекции коэффициента перед молекулами воды. Уравнение составляется на основе диссоциации ионов соединений, участвующих в реакции: Например, диссоциация серной кислоты приводит к тому, что образуются два протона водорода и сульфат-анион:
H2SO4 ↔ 2H+ + SO42-
Аналогичным образом можно записать диссоциацию иодистого водорода и сероводорода:
HJ ↔ Н+ + J—
H2S ↔ 2Н+ + S2-
J2 не диссоциирует. Так же практически не диссоциирует Н2О. Составление уравнения методом полуреакции по йоду остается такой же:
2J— — 2e → J02
Полуреакция по атомам серы приобретет следующую форму:
SO4-2 → S-2
Поскольку в правой части полуреакции недостает четыре атома кислорода, то это количество необходимо сбалансировать за счет воды:
SO4-2 → S-2 + 4H2О
Тогда в левой части полуреакции необходимо компенсировать атомы водорода за счет протонов (т.к. реакция среды кислая):
SO42- + 8Н+ → S-2 + 4H2О
Подсчитав количество переходящих электронов, получим полную запись уравнения по методу полуреакций:
SO42- + 8Н+ + 8е → S-2 + 4H2О
Суммируя обе полуреакции, получим уравнение электронного баланса:
2J— — 2e → J02 |8 4
SO42- + 8Н+ + 8е → S-2 + 4H2О |2 1
_____________________________________
8J— + SO42- +8Н+ → 4J20 + S0 + 4H2O
Из данной записи следует, что метод электронно-ионного уравнения дает более полную картину окислительно-восстановительной реакции, чем метод электронного баланса.Количество электронов, участвующих в процессе, совпадает при обоих методах баланса, но в последнем случае как бы «автоматически» устанавливается количество протонов и молекул воды, участвующих в окислительно-восстановительном процессе.
Разберем несколько конкретных случаев окислительно-восстанови-тельных реакций, которые можно составить методом электронно-ионного баланса. Некоторые окислительно-восстановительные процессы осу-ществляются при участии щелочной среды, например:
KCrO2 + Br2 + KOH → KBr + K2CrO4 +H2O
В данной реакции восстановителем является хромит-ион (CrО2—), который окисляется до хромат-иона (CrO-24). Окислитель — бром (Br02) восстанавливается до бромид-иона (Br—):
СrO2— → CrO42-
Br02 → 2 Br—
Поскольку реакция происходит в щелочной среде, то первую полуреакцию необходимо составить с учетом гидроксид-ионов (OH—):
CrO2— + 4OH— — 3e = CrO2-4 + 2H2O
Вторую полуреакцию составляем уже известным способом:
CrO2— + 4OH— -3е = CrO42—+ 2H2O |2
Br02 + 2e = Br— |3
__________________________________________
2CrO2— + 3Br20 + 8OH— = 2CrO2-4 + 6Br— + 4H2O
После этого необходимо окончательно расставить коэффициенты в уравнении реакции и полностью молекулярное уравнение данного окислительно-восстановительного процесса примет вид:
2KCrO2 + 3Br2 + 8KOH = 2K2CrO4 + 6KBr + 4H2O.
В ряде случаев в окислительно-восстановительной реакции участвуют одновременно и недиссоциируемые вещества. Например:
AsH3 + HNO3 = H3AsO4 + NO2 + 4H2O
Тогда метод полуреакций составляется с учетом данного процесса:
AsH3 + 4H2O – 8e = AsO43- + 11H+ |1
NО3 + 2H+ + e = NO2 + H2O |8
________________________________________________
AsH3 + 8NО3 + 4H2O + 2H+ = AsO43- + 8NO2 + 11H+O
Молекулярное уравнение примет вид:
AsH3 + 8HNO3 = H3AsO4 + 8NO2 + 4H2O.
Окислительно-восстановительные реакции иногда сопровождаются одновременным процессом окисления-восстановления нескольких веществ. Например, в реакции с сульфидом меди взаимодействует концентрированная азотная кислота:
Cu2S + HNO3 = Cu(NO3)2 + H2SO4 + NO + H2O
D окислительно-восстановительном процессе участвуют атомы меди, серы и азота. При составлении уравнения методом полуреакций необходимо учитывать стадии данного процесса:
Cu+ → Cu2+
S2- → S+6
N5+ → N+2
В данной ситуации необходимо объединить в одну стадию окислительные и восстановительные процессы:
2Cu+ — 2e → 2Cu2+ |10e
S2- — 8e → S6+
_______________________
N5+ + 3e → N2+ |3e
При котором окислительно-восстановительная полуреакция примет вид:
2Cu+ — 2e → 2Cu2+
S2- — 8e → S6+ 3 (процессы восстановления)
_______________________
N5+ + 3e → N2+ 10 (процесс окисления)
_____________________________________
6Cu+ + 3S2- + 10N5+ → 6Cu2+ + 3S6+ + 10N2+
В итоге молекулярное уравнение реакции примет вид:
3Cu2S + 22HNO3 = 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O.
Особое внимание следует уделить окислительно-восстановительным реакциям с участием органических веществ. Например, при окислении глюкозы перманганатом калия в кислой среде происходит следующая реакция:
C6H12O6 +KMnO4 + H2SO4 > CO2 + MnSO4 + K2SO4 + H2O
При составлении баланса методом полуреакции превращения глюкозы учитывается отсутствие её диссоциации, но коррекцию количества атомов водорода осуществляется за счет протонов и молекул воды:
C6H12O6 + 6H2O — 24e = 6CO2 + 24H+
Полуреакция с участием перманганата калия примет вид:
MnO4—+ 8H+ + 5e = Mn2+ +4H2O
В итоге получим следующую схему окислительно-восствновительного процесса:
C6H12O6 + 6H2O — 24e = 6CO2 + 24H+ |5
MnО4— +8H+ + 5e = Mn+2 + 4H2O |24
___________________________________________________
5C6H12O6 + 30H2O + 24MnО4— + 192H+ = 30CO2 + 120H+ + 24Mn2+ + 96H2O
Сократив количества протонов и молекул воды в левой и правой части полуреакции, получим итоговое молекулярное уравнение:
5C6H12O6 + 24KMnO4 + 36H2SO4 = 30CO2 + 24MnSO4 + 12K2SO4 + 66H2O
5. Влияние среды на характер протекания окислительно-восстановительных реакций.
В зависимости от среды (избыток H+, нейтральной, избыток OH—) может изменяться характер протекания реакции между одними и теми же веществами. Для создания кислой среды обычно используется серная кислота (H2SO4), азотная кислота (HNO3), соляная кислота (HCl), в качестве среды OH— применяют гидроксид натрия (NaOH) или гидроксид калия (KOH). Например покажем, как среда влияет на переманганат калия (КMnO4). и продукты его реакции:
Для примера возьмём в качестве восстановителя Na2SO3, в качестве окислителя KMnO4
В кислой среде:
5Na2SO3 + 2KMnO4 + 3H2SO4 → 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
SO32- + H2O — 2e → SO42- + 2H+ |5
MnO4—+ 8H+ + 5e → Mn2+ + 4H2O |2
________________________________________________
5SO32- + 2MnO4— + 6H+ → 5SO42- + 2Mn2+ + 3H2O
В нейтральной (или слабощелочной):
3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
SO32- + H2O — 2e→ SO42- + 2H+ |3
MnO4— + 2H2O + 3e→ MnO2 + 4OН |2
_____________________________________
3SO32- + 2 MnO4— + H2O → 3SO42- + 2MnO2 + 2OН
В сильно щелочной среде:
Na2SO3 + 2KMnO4 + 2NaOH → Na2SO4 + K2MnO4 + Na2MnO + H2O
SO32- + 2 OН— — 2e → SO42- + H2O |1
MnO4— + e → MnO42 |2
____________________________________
SO32- + 2 MnO4— + 2OH → SO42- + 2MnO42- + H2O
Пероксид водорода (Н2О2) в зависимости от среды восстанавливается согласно схеме:
1) Кислая среда (H+) H2O2 + 2H+ + 2е → 2H2O
2) Нейтральная среда (Н2О) H2O2 + 2е → 2ОН
3) Щелочная среда (ОН—) H2O2 + 2е→ 2ОН
Пероксид водорода (Н2О2) выступает как окислитель:
2FeSO4 + H2O2 + H2SO4 → Fe2(SO4)3 + 2H2O
Fe2+ — е = Fe3+ |2
H2O2 + 2H+ + 2е = 2Н2О |1
________________________________
2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2 Н2О
Однако, встречаясь с очень сильными окислителями (KMnO4) Пероксид водорода (Н2О2) выступает как восстановитель:
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 8H2O
H2O2 – 2e → O2 + 2H+ |5
MnO4—+ 8H+ + 5e → Mn2+ + 4H2O |2
_________________________________
5H2O + 2 MnO4— + 6H+→ 5O2 + 2Mn2+ + 8H2O
6. Определение продуктов окислительно-восстановительных реакций.
В практической части данной темы рассматриваются окислительно-восстановительные процессы с указанием только исходных реагентов. Продукты реакций, как правило, необходимо определить. Например, в реакции участвуют хлорид железа (FeCl3) и иодид калия (KJ):
FeCl3 + KJ = A + B + C
требуется установить формулы соединений A, B, C, образующиеся в результате окислительно-восстановительного процесса.
Исходные степени окисления реагентов следующие: Fe3+, Cl—, K+, J—. Нетрудно предположить, что Fe3+, являясь окислителем (имеет максимальную степень окисления), может только снизить свою степень окисления до Fe2+:
Fe3+ + e = Fe2+
Хлорид-ион и ион калия в реакции не изменяют свою степень окисления, а иодид-ион может только повысить свою степень окисления, т.е. перейти в состояние J20:
2J— — 2e= J20
В результате реакции, помимо окислительно-восстановительного процесса, произойдет реакция обмена между FeCl3 и KJ, но с учетом изменения степеней окисления реакция определяется не по данной схеме:
FeCl3 + KJ = FeJ3 + KCl,
а примет вид
FeCl3 + KJ = FeJ2 + KCl,
где в качестве продукта C обозначается соединение J20:
FeCl3 + 6KJ = 2FeJ2 + 6KJ + J2
Fe3+ + e ═> Fe2+ |2
2J— — 2e ═> J20 |1
________________________________
2Fe+3 + 2J— = 2Fe2+ + J20
В дальнейшем, при определении продуктов окислительно-восстановительного процесса, можно применять так называемую «систему лифта». Принцип её заключается в том, что любую окислительно-восстановительную реакцию можно представить, как движение лифтов в многоэтажном строении в двух взаимно противоположных направлениях. Причём, «этажами» будут являться степени окисления соответствующих элементов. Поскольку любая из двух полуреакций в окислительно-восстановительном процессе сопровождается либо понижением, либо повышением степени окисления того или иного элемента, то простым рассуждением можно предположить о возможных их степенях окисления в образующихся продуктах реакции.
В качестве примера приведём реакцию, в которой сера реагирует с концентрированным раствором гидроксида натрия (NaOH):
S + NaOH(конц) = (А) + (В) + H2O
Поскольку в данной реакции изменения будут происходить только со степенями окисления серы, то для наглядности составим диаграмму её возможных состояний:
Соединениями (А) и (В) не могут быть одновременно состояния серы S+4 и S+6, поскольку в данном случае процесс происходил бы только с отдачей электронов, т.е. являлся бы восстановительным:
S0 — 4е=S+4
S0— 6е =S+6
Но это противоречило бы принципу окислительно-восстановительных процессов. Тогда следует полагать, что в одном случае процесс должен проходить с отдачей электронов, а в другом двигаться в противоположном направлении, т.е. быть окислительным:
S0 — 4е =S+4
S0+ 2е =S-2
С другой стороны, насколько вероятно, что процесс восстановления будет осуществляться до состояния S+4 или до S+6? Поскольку реакция протекает в щелочной, а не в кислой среде, то окислительная возможность её значительно ниже, поэтому образование соединения S+4 в этой реакции предпочтительнее, чем S+6. Следовательно, реакция в окончательном варианте примет вид:
4S + 6NaOH(конц) = Na2SO3 + 2Na2S + 3H2O
S0 +2e = S—2 | 4 | 2
S0 + 6OH— — 4e = SO32— + 3H2O | 2 | 1
3S0 + 6OH— = 2S—2 + SO32— + 3H2O
В качестве другого примера разберём следующую реакцию между фосфином и концентрированной азотной кислотой(HNO3):
PH3 + HNO3 = (А) + (В) + H2O
В данном случае имеем изменяющиеся степени окисления у фосфора и азота. Для наглядности приведём диаграммы состояния их степеней окисления.
Фосфор в состоянии степени окисления (-3) будет проявлять только восстановительные свойства, поэтому в реакции он будет повышать свою степень окисления. Азотная кислота сама по себе является сильным окислителем и создаёт кислую среду, поэтому фосфор от состояния (-3) достигнет своей максимальной степени окисления (+5).
В противоположность этому азот будет понижать свою степень окисления. В реакциях данного типа обычно до состояния (+4).
Далее нетрудно предположить, что фосфор в состоянии (+5), являясь продуктом (А), может быть только ортофосфорной кислотой H3PO4, поскольку среда реакции сильнокислая. Азот в таких случаях, обычно принимает степень окисления (+2) или (+4), чаще (+4). Поэтом продуктом (В) будет оксид азота NO2. Остаётся только решить это уравнение методом баланса:
P—3 – 8e = P+5 | 1
N+5 + e = N+4 | 8
P—3 + 8N+5 = P+5 + 8N+4
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
1. Окислители и восстановители
2. Классификация окислительно–восстановительных реакций
3. Основные правила составления ОВР
4. Общие закономерности протекания ОВР
5. Основные схемы ОВР
5.1. Схема восстановления перманганатов
5.2. Схема восстановления хроматов/бихроматов
5.3. Разложение нитратов
5.4. Окислительные свойства азотной кислоты
5.5. Взаимодействие металлов с серной кислотой
5.6. Пероксид водорода
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN+5O3, HCl+7O4), соли (KN+5O3, KMn+7O4), оксиды (S+6O3, Cr+6O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4+, Fe3+, Au3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2+, Fe2+, Cr2+), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S+4O3)2–, (НР+3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители:
-
перманганат калия (KMnO4);
-
дихромат калия (K2Cr2O7);
-
азотная кислота (HNO3);
-
концентрированная серная кислота (H2SO4);
-
пероксид водорода (H2O2);
-
оксиды марганца (IV) и свинца (IV) (MnO2, PbO2);
-
расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов .
К восстановителям, которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
2Al0 + Fe+32O3 → Al+32O3 + 2Fe0,
C0 + 4HN+5O3(конц) = C+4O2 ↑ + 4N+4O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых элемент-окислитель и элемент-восстановитель входят в состав одного вещества:
(N-3H4)2Cr+62O7 → N20 ↑+ Cr+32O3 + 4 H2O,
2 NaN+5O-23 → 2 NaN+3O2 + O02↑.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
2H2S-2 + S+4O2 = 3S + 2H2O
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается, а восстановитель окисляется.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Рассмотрим подробно метод электронного баланса.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
K+2S-2 + 2K+Mn+7O-24 = 2K+2Mn+6O-24 + S0
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
S-2 -2e = S0
Mn+7 + 1e = Mn+6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций.
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn+7 в кислой среде восстанавливается до Mn+2, а в щелочной — до Mn+6);
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N+5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N-3);
- либо окислитель практически не подвержен изменениям среды.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Если среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ. Например, при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстанавливается азот N+5.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества. Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn2+. Оксид марганца в степени окисления +2 проявляет основные свойства, поэтому в кислой среде образуется соль. Соли марганца +2 бесцветны. В нейтральном растворе марганец восстанавливается до степени окисления +4, с образованием амфотерного оксида MnO2 — коричневого осадка, нерастворимого в кислотах и щелочах. В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления +6. Соединения марганца +6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты. Манганаты придают раствору зеленую окраску.
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S0.
5 K2S + 2 KMnO4 + 8 H2SO4 = 5 S + 2 MnSO4 + 6 K2SO4 + 8 H2O,
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
K2S + 2 KMnO4 –(KOH)= 2 K2MnO4 + S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
- неметаллы с отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк — до +5;
- неметаллы с промежуточной степенью окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 + неМе (низшая с.о.) = неМе0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме0 = Ме (стабильная с.о.) + др. продукты
KMnO4 + P-3, As-3= P+5, As+5 + др. продукты
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде.
Восстанавливаются соединения хрома (VI) до соединений хрома (III). Соединения хрома Cr+3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3, и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K3[Cr(OH)6].
Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As+5 + другие продукты
Разложение нитратов
Соли-нитраты содержат азот в степени окисления +5 — сильный окислитель. Такой азот может окислять кислород (О-2). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярного кислорода O2.
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород.
Например:
2NaNO3 → 2NaNO2 + O2.
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь), то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
2Zn(NO3)2 → 2ZnО + 4NO2 + O2.
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов, расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N+5, участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород.
Например, разложение нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2.
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония:
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления +5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 оС образуется оксид азота (I) («веселящий газ») и вода:
NH4NO3 → N2O + 2H2O
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N+3 и восстановителя N-3
NH4NO2 → N2 + 2H2O
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Mn(NO3)2 = MnO2 + 2NO2
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
2Fe(NO3)2 → 2FeO + 4NO2 + O2 при 60°C
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 при >60°C
Нитрат никеля (II) разлагается до нитрита при нагревании до 150оС под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород, в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N+4); оксид азота (II) NO (N+2); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3. Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются.
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например, взаимодействие цинка с очень разбавленной азотной кислотой:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
- концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe. При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платиной Pt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами и металлами средней активности азотная кислота восстанавливается до оксида азота (IV) NO2;
Например, окисление меди концентрированной азотной кислотой:
Cu+ 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота (I) N2O;
Например, окисление натрия концентрированной азотной кислотой:
8Na+ 10HNO3 = 8NaNO3 + N2O + 5H2O
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
NO2; NO; N2O; N2; NH4NO3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например, взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H+, которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальной степени окисления.
Например:
Fe + H2SO4(разб) = FeSO4 + H2
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S+4O2, молекулярная сера S либо сероводород H2S-2, в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Например, медь окисляется концентрированной серной кислотой:
Cu0 + 2H2S+6O4(конц) = Cu+2SO4 + S+4O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S2- (в зависимости от температуры, степени измельчения и активности металла).
Например, взаимодействие концентрированной серной кислоты с цинком:
8Na0 + 5H2S+6O4(конц) → 4Na2+SO4 + H2S—2 + 4H2O
Пероксид водорода
Пероксид водорода H2O2 содержит кислород в степени окисления -1. Такой кислород может и повышать, и понижать степень окисления. Таким образом, пероксид водорода проявляет и окислительные, и восстановительные свойства.
При взаимодействии с восстановителями пероксид водорода проявляет свойства окислителя, и восстанавливается до степени окисления -2. Как правило, продуктом восстановления пероксида водорода является вода или гидроксид-ион, в зависимости от условий проведения реакции. Например:
S+4O2 + H2O2-1 → H2S+6O4-2
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например:
2KMn+7O4 + 5H2O2-1 + 3H2SO4 → 5O20 + 2Mn+2SO4 + K2SO4 + 8H2O
Окислительно-восстановительные реакции. Окислитель и восстановитель
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I20. Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S0. Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Основные коэффициенты в уравнении реакции равны единице:
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:
Проставляем найденные основные коэффициенты в уравнение реакции:
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl20, хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn2+, в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO42–. Данные переходы описываются следующими уравнениями
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr3+:
В щелочной — производные анионного комплекса [Cr(OH)6]3–:
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:
Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
2. KNO3 + Al → KAlO2 + Al2O3 + N2.
3. Na2O2 + H2SO4 + KMnO4 → O2↑ + MnSO4 + Na2SO4 + K2SO4 + H2O.
4. NaCl + H2SO4 + MnO2 → Cl2 + MnSO4 + Na2SO4 + H2O.
5. NaCl + H2SO4 + KMnO4 → Cl2 + MnSO4 + Na2SO4 + K2SO4 + H2O.
6. KNO2 + H2SO4 + MnO2 → MnSO4 + KNO + H2O.
7. KI + H2SO4 + KMnO4 → I2 + MnSO4 + K2SO4 + H2O.
8. KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O.
9. C + K2Cr2O7 + H2SO4 → CO2 + Cr2(SO4)3 + K2SO4 + H2O.
10. PbO2 + HNO3 + KI → Pb(NO3)2 + I2 + KNO3 + H2O.
11. PbO2 + HNO3 + Mn(NO3)2 → Pb(NO3)2 + HMnO4 + H2O.
12. NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + H2O.
13. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O.
14. KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O.
15. KNO2 + KI + H2SO4 → NO + I2 + K2SO4 + H2O.
16. KNO2 + FeSO4 + H2SO4 → NO + Fe2(SO4)3 + K2SO4 + H2O.
17. Ca3(PO4)2 + C + SiO2 → CaSiO3 + P + CO.
18. Sb + HNO3 → Sb2O5 + NO2 + H2O.
19. H2O2 + H2SO4 + KMnO4 → MnSO4 + O2 + H2O + K2SO4.
20. S + HNO3 → H2SO4 + NO2 + H2O.
21. H2S + HNO3 → H2SO4 + NO2 + H2O.
22. H2S + KMnO4 → MnO2 + S + H2O + KOH.
23. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
24. KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
25. KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH.
26. KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O.
27. K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
28. H2SO4 + C → SO2 + CO2 + H2O.
29. H2SO4 + Zn → ZnSO4 + H2S + H2O.
30. H2SO4 + KBr → SO2 + Br2 + KHSO4 + H2O.
31. H2SO4 + KI → H2S + I2 + K2SO4 + H2O.
32. PbO2 + HCl → PbCl2 + Cl2 + H2O.
33. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O.
34. KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O.
35. KClO3 + HCl → KCl + Cl2 + H2O.
36. HClO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + HCl + H2O.
37. NaBrO3 + NaBr + H2SO4 → Br2 + Na2SO4 + H2O.
38. HNO3 + I2 → HIO3 + NO2 + H2O.
39. HNO3 + I2 → HIO3 + NO + H2O.
40. H2SO4 + HI → I2 + H2S + S + H2O.
41. Fe2(SO4)3 + HI → FeSO4 + I2 + H2SO4.
42. HIO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + I2 + H2O.
43. NaIO3 + NaI + H2SO4 → I2 + Na2SO4 + H2O.
44. KMnO4 + Cu2O + H2SO4 → MnSO4 + CuSO4 + K2SO4 + H2O.
45. HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + NO2 + H2O.
46. H2SO4 + Cu2S → CuSO4 + SO2 + H2O.
47. Ag + HNO3 → AgNO3 + NO + H2O.
48. Zn + HNO3 → Zn(NO3)2 + N2O + H2O.
49. PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O.
50. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
51. H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
52. Ca3P2 + KMnO4 + H2SO4 → CaSO4 + H3PO4 + MnSO4 + K2SO4 + H2O.
Ответы
Для составления
уравнений окислительных – реакций
используется метод электронного баланса.
В основе его лежит следующее правило:
общее число
электронов, которое отдает восстановитель,
должно быть равно общему числу электронов,
которые присоединяет окислитель.
Рассмотрим
применение метода электронного баланса
на примере реакции, которая выражается
следующей схемой:
KMnO4
+ KBr + H2SO4
= MnSO4
+ Br2
+ K2SO4
+ H2O
а) Определяем
степени окисления всех элементов в
молекулах исходных веществ и продуктов
реакции:
+1
+7 -2 +1 -1 +1 +6 -2 +2 +6 -2 0
+1 +6 -2 +1 -2
KMnO4
+ KBr + H2SO4
= MnSO4
+ Br2
+ K2SO4
+ H2O
б) Находим элементы,
которые изменяют степени окисления,
это марганец и бром:
+7
-1 +2
0
KMnO4
+ KBr + H2SO4
= MnSO4
+ Br2
+ K2SO4
+ H2O
в) Составляем
уравнения процессов окисления и
восстановления:
Mn
+7
+ 5e
= Mn+2
восстановление окислителя
2Br-1
— 2e
= Br2
окисление восстановителя
г) Находим множители
для уравнений процессов окисления и
восстановления, при умножении на которые
количество отданных и принятых электронов
будут равны;
Mn +7
+ 5e = Mn+2
|2
2Br-1
— 2e = Br2
|
5
д) Найденные
множители запишем как коэффициенты
перед формулами веществ, которые содержат
элементы, участвующие процессах окисления
и восстановления:
2KMnO4
+ 10KBr + H2SO4
= 2MnSO4
+ 5Br2
+ K2SO4
+ H2O
е) Уравниваем число
атомов элементов, которые не изменяют
степени окисления. В данном случае это
атомы калия, серы, водорода и кислорода:
2KMnO4
+ 10KBr + 8H2SO4
= 2MnSO4
+ 5Br2
+ 6K2SO4
+ 8H2O
Проверяем
правильность уравнивания по равенству
числа атомов кислорода в левой (40 атомов)
и правой (40 атомов) частях уравнения.
Электролиз
Электролизом
называется окислительно – восстановительный
процесс, протекающий на электродах при
прохождении электрического тока через
расплав или раствор электролита.
Заряженные ионы
электролита под действием электрического
тока начинают двигаться к электродам:
катионы к катоду (отрицательно заряженному
электроду), анионы к аноду (положительно
заряженному электроду).На катоде катионы
принимают электроны и восстанавливаются,
на аноде анионы отдают электроны и
окисляются.
Электролиз расплавов
и растворов протекает по разному т.к. в
растворах дополнительно присутствуют
ионы Н+
и ОН— ,
которые также участвуют в процессе
электролиза.
Электролиз
расплава. В
теоретическом плане простейшим примером
электролиза является электролиз
расплава. Рассмотрим процесс электролиза
расплава NaCI
NaCI
= Na+
+ CI–
Под действием
электрического тока катионы движутся
катоду и принимают от него электроны:
Катод (—)
Na+
+ e
= Na0
– процесс восстановления.
Анионы CI–
движутся к аноду и отдают электроны:
Катод (—)
2 CI–
— 2е = CI2
— процесс
окисления.
Na+
+ e = Na0
2 CI–
—
2е
= CI2
Суммарное ионное
уравнение: 2Na+
+ 2 CI–
= 2Na0
+ CI2
электролиз
Суммарное
молекулярное уравнение: 2NaCI
= 2Na
+ CI2
На катоде выделяется
металлический натрий, на аноде –
газообразный хлор. Это реакция
окислительно — восстановительная, на
катоде всегда идет процесс восстановления,
на аноде всегда идет процесс окисления.
Электролиз
растворов.
Процесс на катоде.
1.Если катион
электролита находится в начале
электрохимического ряда (по AI
включительно), то на катоде идет процесс
восстановления воды (выделяется Н2).
Катионы металла не восстанавливаются,
остаются в растворе.
2.Если катион
электролита находится в ряду между
алюминием и водородом, то на катоде
восстанавливаются одновременно и ионы
металла и молекулы воды.
3.Если катион
электролита находится в ряду напряжения
после водорода, то на катоде идет
только процесс восстановления ионов
металла.
4.Если в растворе
находится смесь катионов разных металлов,
то первыми восстанавливаются катионы
менее активных металлов.
Катодные
процессы в водных растворах солей
|
Li, Na, |
Mn, Ni, |
H2 |
Cu, Pt, |
|
Men+ |
Men+ |
Men+ |
|
|
2Н2О |
2Н2О |
Процесс на аноде.
Продукты электролиза зависят от материала
анода и природы аниона.
-
Если анод растворимый
(железо, медь, серебро), то независимо
от природы аниона всегда идет окисление
металла анода. -
Если анод
нерастворимый (уголь, графит, платина,
золото), то анионы безкислородных кислот
(за исключением фторидов) окисляются
на аноде, а анионы оксокислот и фториды
не окисляются на аноде, а идет окисление
воды с выделением кислорода. При
электролизе щелочей идет окисление
гидроксид ионов.
Анодные процессы
в водных растворах
|
Анод |
Анионы безкислородные |
Анионы кислородсодержащие |
|
Нерастворимы |
Окисление аниона
Асm |
В щелочной среде
4ОН——
В кислой,
2Н2О |
|
Растворимый |
Окисление металла
Ме0 Анод раствор |
Окисление металла
Ме0 Анод раствор |
Массу вещества,
образовавшегося при электролизе найти
исходя из закона Фарадея:
,
где m
— масса вещества, М – малярная масса, n
— количество отданных или принятых
электронов, F
– число Фарадея (96500 Кл/моль) = А·ч/моль),
I
– сила тока (А), t
— продолжительность процесса.
Электролиз
используется для выделения и очистки
металлов, получения щелочей, хлора,
водорода. Алюминий, магний, натрий,
кадмий получают только электролизом.
Очистку меди, никеля, свинца проводят
целиком электрохимическим методом. Для
защиты от коррозии электрохимическим
методом на поверхность металлических
изделий наносится тонкий слой другого
металла (хрома, серебра, меди, никеля,
золота), устойчивого к коррозии.
ХИМИЧЕСКИЕ ИСТОЧНИКИ
ЭЛЕКТРИЧЕСКОЙ ЭНЕРГИИ
Устройства, которые
применяют для непосредственного
преобразования энергии химических
реакций в электрическую энергию, называют
гальваническими элементами или
химическими источниками электрической
энергии. Действие любого гальванического
элемента основано на протекании в нем
окислительно – восстановительной
реакции.
Классический пример гальванического
элемента – элемент Даниэля – Якоби, он
состоит из цинковой пластины (1),
погруженной в раствор сульфата цинка
и медной пластины (2), погруженной в
раствор сульфата меди. Растворы разделены
пористой перегородкой (4) (или
электролитическим мостиком).
При замкнутой
цепи цинк окисляется, ионы цинка переходят
в раствор, электроны движутся по внешней
цепи к медному электроду.
На медном электроде
происходит восстановление ионов меди
из раствора, медь выделяется на пластинке.
Цинковый электрод является анодом,
медный катодом, цинк растворяется, медь
выделяется из раствора, сульфат анионы
движутся через пористую перегородку
от медного к цинковому электроду.
Процесс на аноде
Zn
= Zn+2
+ 2e
Процесс на катоде
Cu+2
+ 2e
= Cu
Суммарное уравнение:
Zn
+ Cu+2
= Zn+2
+ Cu
Молекулярное
уравнение: Zn
+ CuSO4
= Zn
SO4
+ Cu
Кратко строение
элемента Даниэля – Якоби можно записать
следующей схемой:
Zn|ZnSO4(р)
||
CuSO4(р)|Cu
Таким образом, при
работе гальванического элемента
электроны от восстановителя переходят
к окислителю по внешней цепи, на электродах
идут электрохимические процессы, в
растворе наблюдается направленное
движение ионов. В настоящее время
используются различные гальванические
элементы: железо – никелевые, кадмиево
– никелевые, серебряно – цинковые,
свинцовые, и др. их называют аккумуляторами.
В свинцовом аккумуляторе одни пластины
заполнены дооксидом свинца, другие
губчатым свинцом. Металлический свинец
при работе аккумулятора является анодом
и окисляется:
Pb
+ SO4-2
= PbSO4
+2e
Диоксид свинца
является катодом, он восстанавливается:
PbO2
+ SO4-2
+ 4H+
+
2e = PbSO4
+2H2O
Суммарный процесс:
Pb
+ PbO2
+ 2H2SO4
= 2PbSO4
+ 2H2O
При зарядке, через
аккумулятор пропускают электрический
ток и в результате этого электрохимические
процессы на электродах протекают в
обратном направлении.
Свинцовый электрод
становится катодом, на нем протекает
процесс восстановления:
PbSO4
+2e
= Pb
+ SO4-2
На электроде из
PbO2
происходит процесс окисления:
PbSO4
+ 2H2O
= PbO2
+ SO4-2
+ 4H+
+
2e
ЭЛЕКТРОДНЫЕ
ПОТЕНЦИАЛЫ
Электродвижущая
сила гальванического элемента равна
алгебраической сумме электродных
потенциалов электродов.
Скачок потенциала,
возникающий на границе раздела металл
– раствор его соли, называется электродным
или окислительно – восстановительным
потенциалом ().
Зависимость
электродного потенциала от природы
металла, концентрации его ионов в
растворе и температуры количественно
выражается уравнением В. Нернста.
,
где F — число Фарадея
равно 96500Кл/моль,
z – заряд иона, R – газовая постоянная
8,31Дж/моль·К,
Т температура по Кельвину,
— стандартный электродный потенциал
металла. Подставляя в формулу число
Фарадея, температуру 298К, газовую
постоянную и десятичный логарифм,
получаем:
Стандартным
электродным потенциалом металла
называется скачок потенциала на границе
раздела металл — раствор его соли с
концентрацией 1 моль/л.
Для измерения
электродных потенциалов собирают
гальваническую цепь, состоящую из
исследуемого электрода и стандартного
водородного электрода. Водородный
электрод представляет собой платиновую
пластинку, насыщенную газообразным
водородом, которая опущена в водный
раствор кислоты. Потенциал стандартного
водородного электрода принят равным
нулю. Например: для цинкового электрода:
Zn|ZnSO4||
H2SO4
|H2,Pt
Потенциал цинкового
электрода будет равен ЭДС такого
гальванического элемента с обратным
знаком, если берется медный электрод,
то его потенциал будет равен ЭДС
гальванического элемента.
Последовательность
металлов, расположенных в порядке
убывания (возрастания) значений их
электродных потенциалов, называется
рядом напряжения или рядом активности
металлов. В гальванических элементах
более активный металл является анодом
(он растворяется при работе гальванического
элемента) , а менее активный катодом.
Для расчета ЭДС гальванического элемента
из потенциала менее активного металла
отнимается потенциал более активного
металла.
Например: стандартный
потенциал цинкового электрода равен
-0,76 В, медного 0,35В. ЭДС = 0,35 – (-0,76) = 1,11В.
ЭЛЕКТРОХИМИЧЕСКАЯ
КОРРОЗИЯ МЕТАЛЛОВ
К электрохимической
коррозии относятся все случаи коррозии
в водных растворах или во влажной
атмосфере. Для предупреждения от
электрохимической коррозии применяются
различные методы. Например, защитные
металлические покрытия. Железные изделия
могут покрываться тонкой пленкой хрома,
никеля, цинка, кадмия, алюминия, олова,
серебра, золота и др. При нарушении
целостности металлического покрытия
в влажной среде, возникает гальванический
элемент, что приводит к растворению
более активного металла. Металл, который
в ряду напряжения стоит левее, становится
анодом и разрушается, при этом менее
активный металл не изменяется.
Для защиты металлов
от коррозии используют как анодное, так
и катодное покрытие металлов. При анодном
покрытии берется более активный металл
(например, покрытие цинком железного
изделия), он и растворяется при коррозии,
а основной металл не разрушается.
Катодное покрытие (например, серебрение
железного изделия), защищает металл до
тех пор пока пленка не нарушена. При
нарушении защитной пленки основной
металл становится анодом, а покрытие
катодом, соответственно разрушается
защищаемый металл, а покрытие не
разрушается.
Соседние файлы в папке Методические указания для студентов
- #
10.03.20161.09 Mб151Занятие 12.doc
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Содержание:
- Окислительно-восстановительные реакции
- Электролиз
- Теория окислительно-восстановительных реакций
- Важнейшие восстановители и окислители
- Составление уравнении окислительно-восстановительных реакции
- Метод электронного баланса
- Метод полуреакций, или ионно-электронный метод
- Влияние среды на характер протекания реакций
- Классификация окислительно-восстановительных реакций
- Сущность электролиза
- Электролиз водных растворов электролитов
- Катодные и анодные процессы
- Применение электролиза
- Окислительно- востановительные реакции кратко и подробно
- Степень окисления
- ОВР и химия
- Окисленность элементов
- Окислительно-восстановительные реакции и их определения
- Составление уравнений окислительно-восстановительных реакций
- Важнейшие окислители и восстановители
- Окислительно-восстановительная двойственность
- Химические источники электрической энергии
- Электродные потенциалы
- Ряд напряжений металлов
- Электролиз
- Законы электролиза
- Электролиз в промышленности
- Электрохимическая поляризация. Перенапряжение
Окислительно—восстановительные реакции (ОВР) – это реакции, при протекании которых происходит изменение степени окисления химических элементов, входящих в состав реагентов. Степень окисления – условный (формальный) заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Электролиз
Электролиз – это физико-химический окислительно-восстановительный процесс, протекающий в растворах или расплавах электролитов под действием электрического тока, заключающийся в выделении на электродах составных частей растворённых веществ или других веществ — продуктов вторичных реакций на электродах
Теория окислительно-восстановительных реакций
Все химические реакции можно разделить на два типа. К первому из них относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ. Например:
Как видно, степень окисления каждого из атомов до и после реакции осталась без изменения.
Ко второму типу относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ. Например:
Здесь в первой реакции атомы хлора и кислорода, а во второй — атомы брома и хлора изменяют степень окисления.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Изменение степени окисления связано с оттягиванием или перемещением электронов.
Окислительно-восстановительные реакции — самые распространенные и играют большую роль в природе и технике. Они являются основой жизнедеятельности. С ними связаны дыхание и обмен веществ в живых организмах, гниение и брожение, фотосинтез в зеленых частях растений. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов и при электролизе. Они лежат в основе металлургических процессов и круговорота элементов в природе. С их помощью получают аммиак, щелочи, азотную, соляную и серную кислоты и многие другие ценные продукты. Благодаря окислительно-восстановительным реакциям происходит превращение химической энергии в электрическую — в гальванических элементах и аккумуляторах. Они же лежат в основе мероприятий по охране природы. Поэтому эти реакции преобладают и в школьном курсе неорганической химии.
Рассмотрим основные положения теории окислительно-восстановительных реакций.
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом. Например:
При окислении степень окисления повышается.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Например:
При восстановлении степень окисления понижается.
3. Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются. Так как атомы, молекулы и ионы входят в состав определенных веществ, то и эти вещества соответственно называются восстановителями или окислителями.
4. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями:
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
При этом, независимо от того, переходят ли электроны с одного атома на другой полностью или же лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединении электронов.
Процессы окисления и восстановления можно физически отделить друг от друга и осуществить перенос электронов по внешней электрической цепи. Пусть в стакан 2 налит раствор йодида калия KI (рис. 7.1), а в стакан 4 — раствор хлорида железа (III) FeCl3. Растворы соединены между собой так называемым «электролитическим ключом» 3 — U-образной трубкой, заполненной раствором хлорида калия KCI, обеспечивающим ионную проводимость. В растворы опущены платиновые электроды 1 и 5. Если замкнуть цепь, включив в нее чувствительный амперметр, то по отклонению стрелки можно будет наблюдать прохождение электрического тока и его направление. Электроны перемещаются от электрода с раствором йодида калия к электроду с раствором хлорида железа (III), т. е. от восстановителя — ионов I— — к окислителю — ионам Fe3+. При этом ионы I— окисляются до молекул йода I2, а ионы Fe3+ восстанавливаются до ионов железа (II) Fе2+. Через некоторое время продукты реакций можно обнаружить характерными реакциями: йод — раствором крахмала, а ионы Fe2+ — раствором гексациано-(II) феррата калия (красной кровяной соли) K3[Fe(CN)6].
Рис. 7.1. Схема гальванического элемента, построенного на основе окислительно-восстановительной реакции
Приведенная на рис. 7.1 схема представляет собой гальванический элемент, построенный на основе окислительно-восстановительной реакции. Он состоит из двух полуэлементов, в первом протекает процесс окисления восстановителя:
а во втором — процесс восстановления окислителя;
Поскольку эти процессы протекают одновременно, то, умножив последнее уравнение на коэффициент 2 (для уравнивания числа отданных и присоединенных электронов) и суммируя почленно приведенные уравнения, получим уравнение реакции:
или
Всякая окислительно-восстановительная реакция может служить источником электрического тока, если она протекает в гальваническом элементе.
Важнейшие восстановители и окислители
Восстановители и окислители могут быть как простыми веществами, т. е. состоящими из одного элемента, так и сложными.
В соответствии с их местом в периодической системе элементов атомы большинства металлов содержат на внешнем энергетическом уровне 1—2 электрона. Поэтому в химических реакциях они отдают валентные электроны, т. е. окисляются. Металлы обладают восстановительными свойствами.
В периодах с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Так, например, в III периоде натрий — самый активный в периоде восстановитель, а хлор—самый активный в периоде окислитель.
У элементов главных подгрупп с повышением порядкового номера усиливаются восстановительные свойства и ослабевают окислительные. Лучшие восстановители — щелочные металлы, а наиболее активные из них Fr и Cs. Лучшие окислители — галогены. Элементы главных подгрупп IV—VII групп (неметаллы) могут как отдавать, так и принимать электроны и проявлять восстановительные и окислительные свойства. Исключение составляет фтор. Он проявляет только окислительные свойства, так как обладает наибольшей относительной электроотрицательностью (см. табл. 2.2).
Элементы побочных подгрупп (четных рядов больших периодов) имеют металлический характер, так как на внешнем уровне их атомов содержится 1—2 электрона. Поэтому их простые вещества являются восстановителями. Таким образом, в отличие от простых веществ металлов, выступающих в роли восстановителей, простые вещества — неметаллы проявляют себя и как окислители, и как восстановители.
Окислительные или восстановительные свойства сложных веществ зависят от степени окисления атома данного элемента. Например, 
Сложные анионы, содержащие атомы с высокой степенью окисления, также являются окислителями. Например, 


Важнейшие восстановители и окислители приведены в табл. 7.1.
Таблица 7.1. Важнейшие восстановители и окислители
Составление уравнении окислительно-восстановительных реакции
Применяются два метода составления уравнений окислительно-восстановительных реакций — метод электронного баланса и метод полуреакций.
Метод электронного баланса
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах.
Пример 1. Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:
Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь — восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) — окислитель. Эти изменения можно выразить электронными уравнениями
из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
И после сокращения одинаковых ионов получим
Пример 2. Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор). Запишем формулы исходных и конечных веществ реакции:
Покажем изменение степеней окисления атомов до и после реакции:
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. HCl — восстановитель, МnO2 — окислитель. Составляем электронные уравнения:
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления — 1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль НСl приходится 1 моль МnО2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2+2=4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме. Перепишем составленное уравнение в ионной форме:
и после сокращения одинаковых ионов в обеих частях уравнения (они подчеркнуты) получим
Пример 3. Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия. Напишем схему реакции — формулы исходных и полученных веществ:
Затем покажем изменение степеней окисления атомов до и после реакции:
Изменяются степени окисления у атомов серы и марганца (H2S — восстановитель, КMnO4 — окислитель). Составляем электронные уравнения, т. е. изображаем процессы отдачи и присоединения электронов:
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль H2S и 2 моль КMnO4, тогда получим 5 моль атомов S и 2 моль КMnO4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль K2SO4 и 8 моль воды.
Окончательное уравнение реакции будет иметь вид
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2 


Переписываем уравнение в ионной форме:
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
Метод полуреакций, или ионно-электронный метод
Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса (см. пример 3). При пропускании сероводорода H2S через подкисленный раствор перманганата калия КMnO4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементарной серы, т. е. протекания процесса:
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Это первая полуреакция — процесс окисления восстановителя H2S.
Обесцвечивание раствора связано с переходом иона 
В кислом растворе кислород, входящий в состав ионов МnO4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные —два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так:
И сократив на 10H+, окончательно получим
Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов; в левой части (2-)+(6+)=4+, в правой 2(2+)=4+. Уравнение составлено правильно, так как атомы и заряды уравнены.
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части конного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ноны объединяем в молекулы:
Таким образом, составление уравнений окислительно-восстановительных реакций с помощью метода полуреакций приводит к тому же результату, что и метод электронного баланса.
Сопоставим оба метода. Достоинство метода полуреакций по сравнению с методом электронного баланса в том, что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионов 

Влияние среды на характер протекания реакций
Реакции окисления — восстановления могут протекать в различных средах: в кислой (избыток Н+-ионов), нейтральной (Н2O) и щелочной (избыток гидроксид-конов ОН—). В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов. Так, например, ион 



Обычно для создания в растворе кислой среды используют серную кислоту. Азотную и соляную кислоту применяют редко: первая сама является окислителем, вторая способна окисляться. Для создания щелочной среды применяются растворы гидроксидов калия или натрия.
Руководствуясь приведенной схемой, составим методом полуреакций уравнения реакции взаимодействия сульфита натрия Na2SO3 (восстановитель) с перманганатом калия КМnO4 (окислитель) в различных средах (примеры 1—3).
Пример 1. В кислой среде:
или
Пример 2. В нейтральной или слабощелочной среде:
или
Пример 3. В сильнощелочной среде:
или
Пероксид водорода в зависимости от среды восстанавливается согласно схеме:
Здесь Н2O2 выступает как окислитель. Например:
Однако, встречаясь с очень сильным окислителем, таким, как КMnO4, пероксид водорода выступает как восстановитель. Например:
Классификация окислительно-восстановительных реакций
Обычно различают три типа окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные и реакции диспропорционирования.
К межмолекулярным относятся реакции, в которых окислитель и восстанови!ель находятся в разных веществах. Рассмотренные в § 7.3 и § 7.4 реакции относятся к этому типу. Сюда же следует отнести и реакции между разными веществами, в которых атомы одного и того же элемента имеют различные степени окисления:
К внутримолекулярным относятся такие реакции, в которых окислитель и восстановитель находятся в одном и том же веществе. В этом случае атом с более положительной степенью окисления окисляет атом с меньшей степенью окисления. Такими реакциями являются реакции термического разложения. Например:
Сюда же следует отнести и разложение веществ, в которых атомы одного и того же элемента имеют разные степени окисления:
Протекание реакций диспропорционирования сопровождается одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента. При этом исходное вещество образует соединения, одно из которых содержит атомы с более высокой, а другое с более низкой степенями окисления. Очевидно, эти реакции возможны для веществ, содержащих атомы с промежуточной степенью окисления. Примером может служить превращение манганата калия 

К реакциям диспропорционирования относятся и такие часто встречающиеся реакции, как
Раньше реакции диспропорционирования называли реакциями самоокисления — самовосстановления, сейчас это название почти не употребляется.
Сущность электролиза
В растворах и расплавах электролитов имеются разноименные по знаку ионы (катионы и анионы), которые, подобно всем частицам жидкости, находятся в хаотическом движении. Если в такой раствор или расплав электролита, например в расплав хлорида натрия (NaCl плавится при 801°С), погрузить инертные (угольные) электроды и пропустить постоянный электрический ток, то ионы будут двигаться к электродам: катионы Na+ — к катоду, анионы Cl— — к аноду (рис. 7.2). Ионы натрия Na+, достигнув катода, принимают от него электроны и восстанавливаются:
а хлорид-ионы Сl— отдав электроны аноду, окисляются:
В итоге на катоде выделяется металлический натрий, а на аноде хлор.
Если теперь почленно сложить уравнения этих двух электродных реакций (предварительно умножив первое на 2), то получим общее, пли суммарное, уравнение электролиза хлорида натрия:
или
Рис. 7.2. Схема электролиза расплава NaCl
Эта реакция является окислительно-восстановительной: на аноде протекает процесс окисления, на катоде — процесс восстановления.
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Сущность электролиза состоит в осуществлении за счет электрической энергии химических реакций — восстановления на катоде и окисления на аноде. При этом катод отдает электроны катионам, а анод принимает электроны от анионов.
Восстановительное и окислительное действие электрического тока во много раз сильнее действия химических восстановителей и окислителей. Так, ни один химический окислитель не может отнять у фторид-иона F— его электрон. Поэтому долгое время фтор не могли по лучить в свободном состоянии, хотя его соединения широко распространены в природе. Отнять электрон у фторид-иона удалось лишь при электролизе раствора фторида калия во фтороводородной кислоте. В этом случае на аноде выделяется фтор 
Сущность электролиза удобно изображать с помощью схемы, которая показывает диссоциацию электролита, направление движения ионов, процессы на электродах и выделяющиеся вещества. Схема электролиза расплава хлорида натрия выглядит так:
Для проведения электролиза электроды погружают в расплав или раствор электролита и соединяют их с источником постоянного тока. Прибор, в котором проводят электролиз, называют электролизером или электролитической ванной (рис. 7.2),
Электролиз водных растворов электролитов
Надо различать электролиз расплавленных электролитов и их растворов. В последнем случае в процессах могут участвовать молекулы воды.
В качестве примера рассмотрим электролиз концентрированного водного раствора хлорида натрия (электроды угольные). В этом случае в растворе находятся гидратированные ионы Na+ и Сl—, а также молекулы воды. При прохождении тока через раствор катионы Na+ движутся к катоду, а хлорид-ионы Сl— — к аноду. Однако реакции, протекающие на электродах, существенно отличаются от реакций, идущих в расплаве соли. Так, на катоде вместо ионов натрия восстанавливаются молекулы воды;
а на аноде окисляются хлорид-ионы:
В итоге на катоде выделяется водород, на аноде — хлор, а в растворе (вблизи катода) накапливается гидроксид натрия NaOH (отрицательные заряды ионов ОН— компенсируются положительными зарядами ионов Na+). Общее уравнение электролиза водного раствора NaCl в ионной форме имеет вид
или в молекулярной форме:
Катодные и анодные процессы
Как же протекает восстановительный процесс на катоде в водных растворах?
Ответ можно получить с помощью ряда стандартных электродных потенциалов (см. табл. 12.1). Здесь возможны три случая:
1) катионы металлов, имеющих больший стандартный электродный потенциал, чем у водорода (от Сu2+ до Аl3+), при электролизе практически полностью восстанавливаются на катоде;
2) катионы металлов, имеющих малый стандартный электродный потенциал (от Li+ до Аl3+ включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды;
3) катионы металлов, имеющих стандартный электродный потенциал, меньший, чем у водорода, но больший, чем у алюминия (от Аl3+ до Н+), при электролизе на катоде восстанавливаются одновременно о молекулами воды.
Если же водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения алгебраической величины стандартного электродного потенциала соответствующего металла. Так, из смеси катионов Ag+, Cu2+, Fe2+ сначала будут восстанавливаться катионы серебра 

Характер реакций, протекающий на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Обычно аноды подразделяют на нерастворимые и растворимые. Первые изготавливаются из угля, графита, платины, иридия; вторые — из меди, серебра, цинка, кадмия, никеля и других металлов.
На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом анионы бескислородных кислот (например, S2-, I—, Вг—, Сl—)при их достаточной концентрации легко окисляются. Если же раствор содержит анионы кислородных кислот (например, 
Растворимый анод при электролизе сам подвергается окислению, т. е. посылает электроны во внешнюю цепь. При отдаче электронов смещается равновесие между электродом и раствором;
и анод растворяется.
Примеры электролиза водных растворов электролитов приведены в § 7.9.
Применение электролиза
Электролиз находит весьма широкое применение. Для защиты металлических изделий от коррозии на их поверхность наносится тончайший слой другого металла — хрома, серебра, золота, меди, никеля и т. д. Иногда применяют многослойное покрытие. Например, внешние детали автомобиля сначала покрывают тонким слоем меди, на медь наносят тончайший слой никеля, а на него — слой хрома.
Нанесенные на металлы электролизом покрытия получаются ровными по толщине, прочными, служат долго, и, кроме того, таким способом можно покрывать изделия любой формы. Эту отрасль прикладной электрохимии называют гальваностегией. Кроме защиты от коррозии, гальванические покрытия иногда придают красивый декоративный вид предметам.
Другая отрасль электрохимии, близкая по принципу к гальваностегии, названа гальванопластикой. Это получение точных металлических копий о различных предметов. Предмет, с которого хотят изготовить копию, покрывают воском, дают воску застыть и получают восковую матрицу, на которой все углубления копируемого предмета будут выпуклостями. Внутреннюю поверхность матрицы покрывают тонким слоем графита, проводящим электрический ток. Этот графитовый катод опускают в ванну с раствором сульфата меди; анодом служит медь. При электролизе модный анод растворяется, а на катоде осаждается медь. Таким образом получается точная медная копия предмета. С помощью гальванопластики изготовляют клише для печати, грампластинки, металлизируют различные предметы. Гальванопластика открыта русским ученым Б. С. Якоби (1838).
Электролиз используется для получения многих металлов — щелочных, щелочноземельных, алюминия, лантаноидов и др., а также для очистки некоторых металлов от примесей.
В дальнейшем при изучении химии вы встретитесь с другими важными применениями электролиза в технике, в искусстве и быту.
Окислительно- востановительные реакции кратко и подробно
ОВР – реакции, протекающие с изменением степеней окисления элементов, образующих молекулы реагирующих веществ.
- Процесс окисления – процесс отдачи электронов
- Процесс восстановления – процесс принятия электронов
- Окислитель – принимает электроны, восстанавливается и понижает степень окисления
- Восстановитель – отдаёт электроны, окисляется и повышает степень окисления
Степень окисления
Степень окисления атома относится к основным понятиям химии. Она введена для характеристики состояния атома в соединениях.
Степень окисления — условный заряд атома в соединении, вычисленный исходя
из предположения, что он состоит только из ионов.
Если атом отдает электроны, то он получает положительную степень окисления; если атом принимает электроны, то он получает отрицательный заряд. У простых веществ степень окисления равна 0 (нуль).
Положительную степень окисления в соединениях всегда имеют металлы 

Если при написании требуется показать заряд несвязанного иона (например, находящегося в растворе), то знак 

Если необходимо составить формулу бинарного соединения по степени окисления, то поступают следующим образом:
1) пишут химические знаки элементов в том порядке, в котором элементы следуют друг за другом в ряду электроотрицательности (на первом месте знак элемента, отдающего электроны), например,
2) исходя из строения атомов, записывают над знаками степени окисления: 
3) проставляют индексы так, чтобы число положительного заряда
было равно числу отрицательного заряда:
В случае, если следует определить степень окисления элементов в предложенной формуле, поступают следующим образом:
1. Как правило, на первом месте записывают элементы с положительными степенями окисления, а на втором — элемент с отрицательной степенью окисления.
Устанавливают, какой из двух элементов получил электроны. Например, в соединении 
2. Определяют, сколько электронов получил кислород. Так как кислород находится в 
Поскольку атомов у кислорода пять, то общий заряд кислорода
3. На атоме фосфора, следовательно, общий положительный заряд (+10), а на один атом приходится (+5).
Итак, результат:
4. Предлагаемое соединение прочитывается слева направо, а название вещества, наоборот, — справа налево.
К первому слогу латинского названия кислорода — оксигениум — добавляют суффикс «ид’: оксид фосфора
В случае более сложных соединений, например 
1) проставляют степень окисления кислороду (-2) и водороду (+1).
2) подсчитывают заряд серы так:
3) если формула содержит скобки, то действуют похожим образом, например:
Существуют формулы и более сложного состава, но учиться считать их степень окисления вы будете позднее. Изменение степени окисления элементов в Периодической системе можно проследить по таблице 13.
Пользуясь алгоритмом, выведем формулы кислородных и водородных соединений рассмотренных элементов (табл. 14, 15), имея в виду, что у кислорода в них степень окисления (-2), а водорода (+1). Мы получим:
1) два ряда кислородных соединений (табл. 14):
2) ряд водородных соединений (табл. 15):
Степень окисления любого элемента в простом веществе равна 0.
Сумма степеней окисление всех атомов в составе нейтральной молекулы равна 0.
Если соединение обрадовано двумя элементами, то у элемента с большей электроотрицательностью степень окисления меньше нуля, а у элемента с меньшей электроотрицательностью — больше нуля.
Максимальная положительная степень окисления любого элемента главной пол группы равна номеру группы в Периодической системе элементов, а минимальная степень окисления для металлов равна 0, а для неметаллов равна N-8, где N — номер группы.
Степень окисления фтора в соединениях равна -1.
Степень окисления водорода в соединениях равна +1 исключение — гидриды металлов 
Степень окисления кислорода равна -2 (исключения — пероксиды: 
ОВР и химия
Кроме известных вам типов химических реакций: соединения, разложения, замещения, обмена — существуют и другие классификации химических реакций. Рассмотрим реакции, расставим в них степень окисления элементов:
В уравнении (1) ни один из элементов не меняет степень окисления.
В уравнении (2) степень окисления меняется у цинка и водорода.
Реакции, идущие без изменения степени окисления элементов» называются неокислительно-восстановительными. Такими всегда бывают реакции обмена.
Реакции, идущие с изменением степени окисления элементов, называются окислительно-восстановительными. Такими реакциями всегда являются реакции замещения. Реакции соединения и разложения могут быть двух типов.
Рассмотрим основные положения теории окислительно-восстановительных реакций:
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом. Например:
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Например:
При окислении степень окисления элемента повышается, а при восстановлении степень окисления понижается (рис. 25).
3. Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакций они окисляются.
4. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакций они восстанавливаются.
Так как атомы, молекулы, ионы входят в состав определенных веществ, то эти вещества соответственно называются восстановителями или окислителями.
5. Окисление всегда сопровождается восстановлением, и наоборот.
6. Число электронов, отданных восстановителем, равно числу электронов, присоединенных окислителем.
Рассмотрим механизм окислительно-восстановительной реакции подробнее. Например, взаимодействие кальция и фосфора. Кальций как металл отдает свои внешние электроны, а фосфор принимает недостающие электроны:
Затем найденное число электронов вынесем за черту, после этого находим общее кратное между числами отданных и принятых электронов:
Найденные числа последнего столбца называются основными коэффициентами, их расставляют к элементам с нулевой степенью окисления или наименьшей, если нулевой нет:
Такой подбор коэффициентов называется методом электронного баланса.
Рассмотрим данный метод подбора коэффициентов на более сложном примере. Такая реакция происходит при зажигании спичек:
Этапы подбора коэффициентов:
1) расставляем степень окисления у каждого элемента:
2) определяем, какие элементы изменили степень окисления. Это фосфор и хлор;
3) составляем две полуреакции для фосфора и хлора:
4) записываем найденные числа электронов за черту, находим общее кратное:
5) выставляются полученные основные коэффициенты: 

Для простых веществ: 
Если затрудняетесь определить, отдает или принимает элемент электроны, используйте схему 4:
Например, для полуреакции:
и наоборот:
Окислительно-воссталовительные реакции — это самые распространенные реакции (рис. 26). Они играют важную роль в природе и технике, являются основой жизнедеятельности. С ними связаны дыхание, обмен веществ в живых организмах, гниение, брожение, фотосинтез. Их можно наблюдать при горении топлива, получении чугуна и стали и т. д. Они лежат в основе круговорота элементов в природе, с их помощью получают многие ценные продукты.
Реакции, идущие о изменением степени окисления элементов, называются окислительно — восстановительными.
Окисление — процесс отдачи электронов, который сопровождается повышением степени окисление элемента. Вещество, отдающее электроны, называется восстановителем. Восстановление — процесс присоединения электронов, который сопровождается понижением степени окисления элемента. Вещество, принимающее электроны, является окислителем.
Окисление всегда сопровождается восстановлением, и наоборот. Число отданных электронов восстановителем равно числу электронов, присоединенных окислителем.
Окисленность элементов
Когда элемент находится в свободном состоянии — образует простое вещество, тогда движение электронов около всех атомов этого вещества происходит одинаково. Это справедливо для всех простых веществ, независимо от их структуры. Например, в молекуле водорода электроны в равной мере движутся около обоих атомов: молекула 
Иначе обстоит дело в сложных веществах. Химические связи между атомами различных элементов несимметричны; в молекулах сложных веществ осуществляются, как правило, полярные ко-валентные связи. В ионных соединениях эта неравномерность распределения электронов максимальна — при образовании веществ с ионной связью валентные электроны практически полностью переходят от атома одного элемента к атому другого.
Неравномерность распределения электронов между атомами в соединениях получила название окисленности. При этом элемент, электроны которого смещаются к атомам другого элемента (полностью в случае ионной связи или частично в случае полярной), проявляет положительную окисленность. Элемент, к атомам которого смещаются электроны атома другого элемента, проявляет отрицательную окисленность.
Число электронов, смешенных от одного атома данного элемента (при положительной окисленности) или к одному атому данного элемента (при отрицательной окисленности), называется степенью окисленности элемента*.
* Эту величину называют также степенью окисления или окислительным числом элемента.
В простых веществах степень окисленности элемента всегда равна нулю. В соединениях некоторые элементы проявляют всегда одну и ту же степень окисленности, но для большинства элементов она в различных соединениях различна.
Постоянную степень окисленности имеют щелочные металлы 









Определим в качестве примера степень окисленности углерода в 


Для установления степени окисленности элементов в соединениях можно пользоваться таблицей электроотрицательностей элементов (табл. 6). При этом следует иметь в виду, что при образовании химической связи электроны смещаются к атому более электроотрицательного элемента. Так, относительная электроотрицательность фосфора равна 2,2, а иода 2,6. Поэтому в соединении 





Окислительно-восстановительные реакции и их определения
Все химические реакции можно разбить на две группы. В реакциях первой группы окисленность всех элементов, входящих в состав реагирующих веществ, остается неизменной, а в реакциях второй группы окисленность одного или нескольких элементов изменяется.
В качестве примера реакций первой группы можно привести реакцию нейтрализации:
Примером реакции второй группы может служить взаимодействие металла с кислотой:
Если при реакции нейтрализации ни один элемент не изменяет степень своей окисленности, то во втором примере степень окисленности цинка изменяется от 0 до +2, а водорода—от +1 до 0.
Реакции, в результате которых изменяются степени окисленности элементов, называются окислительно восстановительными,
Окислительно-восстановительные реакции имеют очень большое значение в биологических системах. Фотосинтез, дыхание, пищеварение —все это цепи окислительно-восстановительных ре-акций. В технике значение окислительно-восстановительных реакций также очень велико. Так, вся металлургическая промышленность основана на окислительно-восстановительных процессах в ходе которых металлы выделяются из природных соединений.’
Простым примером окислительно-восстановительной реакции может служить реакция образования ионного соединения из простых веществ, например, взаимодействие натрия с хлором:
Эта реакция, как всякая гетерогенная реакция, протекает в несколько стадий. В ходе одной из них атомы натрия превращаются в положительно заряженные ионы; степень окисленности натрия изменяется от 0 до +1:
Такой процесс — отдача электронов, сопровождающаяся повышением степени окисленности элемента,— называется окислением.
Электроны, отдаваемые натрием, принимаются атомами хлора, которые превращаются при этом в отрицательно заряженные ионы; степень окисленности хлора изменяется от 0 до —1:
Присоединение электронов, сопровождающееся понижением степени окисленности элемента, называется восстановлением.
Таким образом, в рассматриваемой реакции натрий окисляется, а хлор восстанавливается.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем, а вещество, содержащее восстанавливающийся элемент, окислителем. Следовательно, в данном примере натрий — восстановитель, а хлор — окислитель.
Из уравнений процессов восстановления и окисления видно, что одна молекула хлора, восстанавливаясь, присоединяет два электрона, а окисление одного атома натрия сопровождается отдачей одного электрона. Общее число электронов в системе при химических реакциях не изменяется: число электронов, отдаваемых молекулами (атомами, ионами) восстановителя, равно числу электронов, присоединяемых молекулами (атомами, ионами) окислителя. Поэтому одна молекула хлора может окислить два атома натрия.
Составление уравнений окислительно-восстановительных реакций
Мы рассмотрели простейший пример окислительно-восстановительной реакции — образование соединения из двух простых веществ. Обычно уравнения окислительно-восстановительных реакций носят более сложный характер и расстановка коэффициентов в них часто представляет довольно трудную задачу; приведем несколько примеров.
Пример 1. Взаимодействие между иодоводородом и концентрированной серной кислотой. Эта реакция протекает согласно схеме:
Если мы подсчитаем степень окисленности каждого элемента в исходных веществах и в продуктах реакции, то увидим, что она изменяется у иода и у серы. У иода в 


Уравнение процесса окисления иода имеет простой вид:
Уравнение восстановления серы более сложно, так как и исходное вещество 



Четыре атома кислорода, высвобождающиеся при этом процессе, должны связаться в четыре молекулы воды. Для этого понадобятся восемь ионов водорода. Кроме того, два иона водорода необходимы для образования молекулы 

Суммарный заряд ионов, находящихся в левой части этой схемы, равен восьми элементарным положительным зарядам, а в правой ее части имеются лишь незаряженные частицы. Поскольку суммарный заряд в ходе процесса не изменяется, то, следовательно, в процессе восстановления принимают участие также восемь электронов:
В рассматриваемом примере отношение числа электронов, принимаемых в процессе восстановления, к числу электронов, высвобождающихся- при окислении, равно 4: 1. Для получения суммарного уравнения реакции надо, складывая уравнения процессов восстановления и окисления, учесть это соотношение — умножить уравнение восстановления на 4. При этом в записи обычно справа от вертикальной черты проставляются необходимые множители;
Полученное уравнение реакции может быть представлено и в молекулярной форме:
Пример 2. Взаимодействие алюминия с нитратом калия в щелочной среде. Схема реакции:
Здесь степень окисленности изменяется у азота и алюминия. Металлический алюминий (степень окисленности равна 0) превращается в ион 
В щелочной среде источником кислорода, необходимого для протекания этого процесса, служат ионы 

В левой части схемы имеются четыре отрицательных заряда, а в правой — один. Следовательно, в ходе процесса отдаются три электрона:
Для получения уравнения восстановления будем исходить из схемы:
Здесь в ходе процесса атомы азота лишаются атомов кислорода и связываются с атомами водорода. В щелочной среде это возможно при участии молекул воды. Три молекулы воды понадобятся для связывания трех атомов кислорода и еще три молекулы воды — для образования молекулы 
Суммарный заряд правой части схемы равен девяти отрицательным зарядам, а левой — одному. Следовательно, в процессе принимают участие восемь электронов:
Отношение числа электронов, высвобождающихся в процессе окисления, к числу электронов, принимаемых при восстановлении, в данном примере равно 3:8. Следовательно, для получения суммарного уравнения реакции необходимо сложить уравнения процессов окисления и восстановления, умножив первое из них на 8, а второе на 3
или в молекулярной форме:
Пример 3. Каталитическое окисление аммиака. Этой реакцией пользуются в производстве азотной кислоты (см. 

При 
Согласно схеме реакции, степень окисленности изменяется у азота и у кислорода. У азота она возрастает от —3 до +2, а у кислорода уменьшается от 0 до —2. Запишем эти изменения в виде схем, отмечая степени окисленности элементов над их символами. Во избежание путаницы с зарядом иона, будем при этом пользоваться римскими цифрами:
Отношение числа электронов, принимаемых при восстановлении, к числу электронов, высвобождающихся при окислении, равно 4:5. Следовательно, пять молекул кислорода могут окислить четыре молекулы аммиака:
Составление уравнений реакций в трех рассмотренных примеpax проведено в определенном порядке. Его можно придерживаться и в других случаях при составлении уравнений окислительно-восстановительных реакций. Последовательность действий при этом следующая:
1. Составить схему реакции с указанием исходных и образующихся веществ.
2. Определить степень окисленности элементов в веществах правой и левой части схемы; отметить элементы, степень окисленности которых изменяется.
3. Составить уравнения процессов восстановления и окисления; найти отношение числа электронов, принимаемых при восстановлении и отдаваемых при окислении.
4. Сложить уравнения окисления и восстановления с учетом найденного отношения числа электронов (п. 3).
Важнейшие окислители и восстановители
Какие вещества могут проявлять свойства окислителей, а какие — восстановителей? Как уже говорилось, окислитель содержит в своем составе элемент, понижающий степень своей окисленности, а восстановитель содержит элемент, степень окисленности которого повышается в ходе реакции. Следовательно, окислителями могут быть прежде всего соединения высших, а восстановителями — низших степенен окисленности, присущих данному элементу.
Металлы проявляют в своих соединениях только положительную окисленность, и низшая их степень окисленности равна нулю. Иначе говоря, низшей степенью окисленности они обладают только в свободном состоянии. Действительно, все свободные металлы способны, хотя и в различной степени, проявлять только восстановительные свойства. На практике в качестве восстановителей применяют алюминий, магний, натрий, калий, цинк и некоторые другие металлы. Если металлу присущи несколько степеней окисленности, то те его соединения, в которых он проявляет низшую из них, также обычно являются восстановителями, например, соединения железа(II), олова(II), хрома(II), меди(I).
Окислителями могут быть те соединения металлов, в которых степень окисленности металла велика — равна номеру группы, в которой находится металл, или близка к нему. На практике применяют, в частности: аммиачный раствор оксида серебра, аммиачный раствор сульфата меди(II), хлорид ртути(II), диоксид свинца 




Неметаллы проявляют как положительную, так и отрицательную окисленность. Естественно, что соединения, содержащие неметаллы в высших положительных степенях окисленности, могут быть окислителями, а соединения, в которых неметалл проявляет отрицательную окисленность, — восстановителями.
К широко применяемым в промышленности восстановителям относятся водород, углерод (в виде угля или кокса) и монооксид углерода 
К сильным окислителям принадлежат неметаллы верхней части VI и VII групп периодической системы. Сильные окислительные свойства этих веществ объясняются большой электроотрицательностью их атомов. Сильнее всего окислительные свойства выражены у фтора, но в практике чаще пользуются в качестве окислителей кислородом, хлором и бромом.
К соединениям, применяемым в качестве окислителей, относятся также кислоты. Наибольшее практическое значение имеют соляная, серная и азотная кислоты. При этом элементом окислителем в соляной кислоте является водород, в азотной — азот, в разбавленной серной — водород, в концентрированной — сера. Поэтому уравнение процесса восстановления соляной и разбавленной серной кислот имеет вид:
Азотная кислота, в зависимости от ее концентрации, температуры и природы восстановителя, может восстанавливаться до различных степеней окисленности азота (см. 

При восстановлении концентрированной серной кислоты также могут образовываться различные продукты (см. 
Из других соединений неметаллов, применяемых в качестве окислителей, можно указать на пероксид водорода, соли кислот, в которых кислотообразующий элемент проявляет высокую степень окисленности — хлораты 

Окислительно-восстановительная двойственность
Внутримолекулярное окисление-восстановление. Соединения высшей степени окисленности, присущей данному элементу, могут в окислительно-восстановительных реакциях выступать только в качестве окислителей, степень окисленности элемента может в этом случае только понижаться. Соединения низшей степени окисленности могут быть, наоборот, только восстановителями; здесь степень окисленности элемента может только повышаться. Если же элемент находится в промежуточной степени окисленности, то его атомы могут, в зависимости от условий, как принимать, так и отдавать электроны. В первом случае степень окисленности элемента будет понижаться, во втором — повышаться. Поэтому соединения, содержащие элементы в промежуточных степенях окисленности, обладают окислительно-восстановительной двойственностью — способностью вступать в реакции как с окислителями, так и с восстановителями. ‘
Так, азот образует соединения, в которых степень его окисленности изменяется от —3 (аммиак и соли аммония) до +5 (азотная кислота и ее соли). Азот, входящий в состав аммиака, может выступать только в качестве восстановителя, азот азотной кислоты— только в качестве окислителя. Азотистая же кислота 


В качестве примеров окислительно-восстановительной двойственности азотистой кислоты можно привести реакции:
Кроме азотистой кислоты окислительно-восстановительной двойственностью обладают сера, иод, пероксид водорода и ряд других веществ.
Вещества, содержащие элемент в промежуточной степени окисленности, обладают в ряде случаев еще одним характерным свойством. Оно состоит в том, что в определенных условиях такое вещество претерпевает процесс, в ходе которого часть элемента окисляется, а часть — восстанавливается. Этот процесс называется самоокислением — самовосстановлением. Так, при взаимодействии хлора с водой получается смесь соляной и хлорноватистой 
Здесь и окисление, и восстановление претерпевает хлор;
Самоокисление-самовосстановление называют также диспропорционированием.
Некоторые сложные вещества в определенных условиях (обычно при нагревании) претерпевают внутримолекулярное окисление-восстановление. При этом процессе одна составная часть вещества служит окислителем, а другая — восстановителем. Примерами внутримолекулярного окисления-восстановления могут служить многие процессы термической диссоциации. Так, в ходе термической диссоциации водяного пара
кислород окисляется (его степень окисленности возрастает от —2 до 0), а водород восстанавливается (его степень окисленности уменьшается от +1 до 0).
Другим примером может служить реакция разложения нитрита аммония, применяемая в лабораторной практике для получения чистого азота:
Здесь ион 
Химические источники электрической энергии
Мы уже знаем, что при любой окислительно-восстановительной реакции происходит переход электронов от восстановителя к окислителю.
Так, при опускании цинковой пластинки в раствор сульфата меди происходит реакция
Здесь восстановитель — цинк — отдает электроны. Эта полуреакция выражается уравнением:
Окислитель — ион меди — принимает электроны. Уравнение этой полуреакции имеет вид:
В рассматриваемом примере обе полуреакции протекают в месте соприкосновения цинка с раствором, так что электроны непосредственно переходят от атомов цинка к ионам меди. Можно, однако, осуществить эту реакцию таким способом, что окислительная и восстановительная полуреакции окажутся пространственно разделенными, а электроны будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока — по внешней цепи. Этот направленный поток электронов представляет собою электрический ток. При таком осуществлении окислительно-восстановительной реакции ее энергия будет превращена в электрическую энергию, которую можно использовать, включив во внешнюю цепь устройство, потребляющее электрическую энергию (например, электронагревательный прибор, электрическую лампу и т. п.).
Устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами. Их называют также химическими источниками электрической энергии (сокращенно ХИЭЭ) или химическими источниками тока.
В технике гальваническими элементами принято называть только ХИЭЭ, в которых протекают практически необратимые реакции. Такие ХИЭЭ обычно нельзя перезаряжать: они предназначены для однократного использования (в одни или несколько приемов). ХИЭЭ, в которых протекают практически обратимые реакции, называют аккумуляторами: их можно перезаряжать и использовать многократно.
Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух пластин или стержней, изготовленных из различных металлов и погруженных в раствор электролита. Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление — на другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи.
Рассмотрим в качестве примера медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфатом меди (рис. 82). Этот элемент (элемент Якоби —Даниэля) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала.
При работе элемента, т. е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. Вся совокупность этих процессов схематически изображается уравнением полуреакции, или электрохимическим уравнением:
На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися нонами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид:
Суммарное уравнение реакции, протекающей в элементе, получится при сложении уравнений обеих полуреакций. Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
Направление движения ионов в растворе обусловлено протекающими у электродов электрохимическими процессами. Как уже сказано, у цинкового электрода катионы выходят в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор, наоборот, все время обедняется катионами, так что здесь раствор заряжается отрицательно. В результате этого создается электрическое поле, в котором катионы, находящиеся в растворе 

Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом. В медно-цинковом элементе цинковый электрод является анодом, а медный — катодом.
Рис. 82. Схема медно-цинкогово гальванического элемента.
Рис. 83. Схема движения ионов и электронов при работе медно-цинкового гальванического элемента.
Протекающая в гальваническом элементе окислительно-восстановительная реакция представляет собой сложный процесс. Она включает собственно электрохимические стадии (превращения атомов, ионов или молекул на электродах), перенос электронов, перенос ионов. Все эти стадии сопряжены между собой и протекают с одной и той же скоростью; число электронов, которые за единицу времени отдает цинк, равно числу электронов, принимаемых за это же время ионами меди. Поэтому скорость реакции, протекающей в гальваническом элементе, пропорциональна количеству электричества, перенесенного по цепи в единицу времени, т. е. силе тока в цепи.
Электрический ток, протекающий по внешней цепи гальванического элемента, может производить полезную работу. Но работа, которую можно выполнить за счет энергии химической реакции, зависит от ее скорости: она максимальна при бесконечно медленном— обратимом — проведении реакции (см. § 67). Следовательно, работа, которую можно произвести за счет реакции, протекающей в гальваническом элементе, зависит от величины отбираемого от него тока. Если, увеличивая сопротивление внешней цепи, уменьшать ток до бесконечно малого значения, то и скорость реакции в элементе тоже будет бесконечно малой, а работа — максимальной. Теплота, выделяемая во внутренней цепи элемента, будет при этом, наоборот, минимальна.
Работа электрического тока выражается произведением количества прошедшего по цепи электричества на напряжение. В медно-цинковом элементе при окислении одного эквивалента цинка и Одновременном восстановлении одного эквивалента ионов меди по цепи пройдет количество электричества, численно равное одному фарадею 

где 
Но поскольку эта работа зависит от силы тока, то и напряжение между полюсами элемента тоже зависит от силы тока (
Для этого предельного случая полезная работа, производимая электрическим током в медно-цинковом элементе при взаимодействии одного эквивалента цинка с одним эквивалентом ионов меди, выразится уравнением
где 
Ясно, что при взаимодействии одного моля атомов цинка с одним молем ионов меди уравнение примет вид:
В общем случае при растворении (или выделении) одного моля вещества, ионы которого имеют заряд, равный 
При постоянных температуре и давлении максимальная полезная работа реакции равна взятому с обратным знаком изменению энергии Гиббса
Если концентрации (точнее говоря, активности) веществ, участвующих в реакции, равны единице, т. е. если соблюдаются стандартные условия, то э.д.с. элемента называется его стандартной электродвижущей силой и обозначается 
Учитывая, что стандартное изменение энергии Гиббса реакции связано с ее константой равновесия (см. § 68) соотношением
получим уравнение, связывающее стандартную э. д. с. с константой равновесия реакции, протекающей в гальваническом элементе:
Измерения электродвижущих сил можно производить с высокой точностью. Эти измерения представляют собой один из наиболее точных методов определения стандартных энергии Гиббса, а следовательно, и констант равновесия окислительно-восстановительных реакций в растворах.
Окислительно-восстановительная реакция протекает в гальваническом элементе несмотря на то, что окислитель и восстановитель непосредственно друг с другом не соприкасаются. Для того .чтобы понять, как это происходит, как возникает электродвижущая сила при пространственном разделении процессов окисления и восстановления, рассмотрим более детально явления, происходящие на границах раздела фаз в гальваническом элементе.
Прямые опыты с применением радиоактивных индикаторов Показывают, что если привести металл 

При этом металлический электрод оказывается заряженным отрицательно, а раствор — положительно. Если при установлении контакта металл — раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном направлении, то между электродом и раствором также устанавливается равновесие; но в этом случае электрод заряжается положительно, а раствор — отрицательно.
В .элементе Якоби—Даниэля соответствующие равновесия устанавливаются между цинковым электродом и раствором сульфата цинка
а также между медным электродом и раствором сульфата меди;
В этом элементе имеются еще две границы раздела фаз: между растворами сульфатов цинка и меди, а также медью и цинком (см. рис. 82). Граница между растворами не оказывает существенного влияния ни на величину э. д. е., ни на протекание реакции при работе элемента. Что же касается границы между металлами, то через нее могут проходить не ионы, как в случае границы металл— раствор, а электроны*. И здесь вследствие неодинакового энергетического состояния электронов в меди и в цинке первоначальные скорости перехода электронов из одного металла в другой и в обратном направлении различны. Однако и в этом случае быстро устанавливается равновесие, при котором металлы также приобретают заряды противоположного знака:
* Диффузия атомов и ионов из металла в металл происходит много медленнее и практически не влияет на установление равновесия на границе между металлами.
Таким образом, при разомкнутой цепи на трех имеющихся в элементе Якоби— Даниэля границах раздела фаз устанавливаются равновесия, причем фазы заряжаются. В результате энергетическое состояние электронов на концах разомкнутой цеп» оказывается неодинаковым: на том медном проводнике, который соприкасается с цинковым электродом, энергия Гиббса электронов выше, а на том, который соединен с медным электродом, — ниже. Разность энергий Гиббса электронов на концах цепи и определяет; э.д. с. данного элемента.
При замыкании внешней цепи электроны перемешаются от цинкового электрода к медному. Поэтому равновесия на фазовых границах нарушаются; происходит направленный переход ионов цинка из металла в раствор, ионов меди — из раствора в металл, электронов— от цинка к меди: протекает окислительно-восстановительная реакция.
В принципе электрическую энергию может дать любая окислительно-восстановительная реакция. Однако число реакций, практически используемых в химических источниках электрической энергии, невелико. Это связано с тем, что не всякая окислительно-восстановительная реакция позволяет создать гальванический элемент, обладающий технически ценными свойствами (высокая и практически постоянная э.д.е., возможность отбирания больших токов, длительная сохранность и др.). Кроме того, многие окислительно-восстановительные реакции требуют расхода дорогостоящих веществ.
В отличие от медно-цинкового элемента, во всех современных гальванических элементах и аккумуляторах используют не два, а один электролит; такие источники тока значительно удобнее в эксплуатации. Например, в свинцовых аккумуляторах (см. § 189) электролитом служит раствор серной кислоты.
Почти во всех выпускаемых в настоящее время гальванических элементах анод изготовляется из цинка, а в качестве вещества для катода обычно применяются оксиды менее активных металлов. Описание важнейших гальванических элементов см. § 214, аккумуляторов—§§ 189, 201, 244.
Химические источники электрической энергии применяются в различных отраслях техники. В средствах связи (радио, телефон, телеграф) и в электроизмерительной аппаратуре они служат источниками электропитания, на автомобилях, самолетах, тракторах применяются для приведения в действие стартеров и других устройств, на транспорте, в переносных фонарях с их помощью производится освещение.
Все обычные ХИЭЭ не свободны от двух недостатков. Во-первых, стоимость веществ, необходимых для их работы (например, свинца, кадмия), высока. Во-вторых, отношение количества энергии, которую может отдать элемент, к его массе мало. На протяжении последних десятилетий ведутся исследования, направленные на создание элементов, при работе которых расходовались бы дешевые вещества с малой плотностью, подобные жидкому или газообразному топливу (природный газ, керосин, водород и др.). Такие гальванические элементы называются топливными. Проблеме топливного элемента уделяется в настоящее время большое внимание и можно полагать, что в ближайшем будущем топливные элементы найдут широкое применение.
Электродные потенциалы
Каждая окислительно-восстановительная реакция слагается из полуреакций окисления и восстановления. Когда реакция протекает в гальваническом элементе или осуществляется путем электролиза, то каждая полуреакция протекает на соответствующем электроде; поэтому полуреакции называют также электродными процессами.
В § 98 было показано, что протекающей в гальваническом элементе окислительно-восстановительной реакции соответствует е.д. с. этого элемента 

В соответствии с разделением окислительно-восстановительной реакции на две полуреакции, электродвижущие силы также принято представлять в виде разности двух величии, каждая из которых отвечает данной полуреакции. Эти величины называются электродными потенциалами.
Для медно-цинкового элемента реакция, протекающая при его работе
разбивается на полуреакции;
Соответственно э.д. с. этого элемента 



При этом изменение энергии Гиббса 
а изменение энергии Гиббса 
В общем случае любому электродному процессу
соответствует электродный потенциал 

Здесь 

В дальнейшем, говоря об электродных процессах, мы будем записывать их уравнения в сторону восстановления (за исключением, конечно, тех случаев, когда речь будет идти именно об окислении).
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих трех факторов: 1) от природы веществ — участников электродного процесса, 2) от соотношения между концентрациями* этих веществ и 3) от температуры системы. Эта зависимость выражается уравнением:
* Строго говоря, величина электродного потенциала зависит от соотношения не концентраций, а активностей (см. § 86) веществ; во всех рассматриваемых далее уравнениях вместо концентрации должна стоять активность. Но при невысоких концентрациях растворов погрешность, вносимая заменой активности на концентрацию, невелика.
Здесь 








Физический смысл величины 

Концентрации (активности) , равные единице, называются стандартными концентрациями (активностями). Поэтому и потенциал, отвечающий этому случаю, называется стандартным потенциалом. Итак, стандартный электродный потенциал — это потенциал данного электродного процесса при концентрациях (точнее говоря, активностях) всех участвующих в нем веществ, равных единице.
Таким образом, в уравнении электродного потенциала первое слагаемое 

Для обычной при электрохимических измерениях стандартной температуры 

Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного процесса принять равным нулю. В качестве эталона для создания такой шкалы принят электродный процесс
Изменение энергии Гиббса, связанное с протеканием этой полуреакции при стандартных условиях, принимается равным нулю. В соответствии с этим и стандартный потенциал данного электродного процесса принят равным нулю. Все электродные потенциалы, приводимые в настоящей книге, а также в большинстве других современных изданий, выражены по этой, так называемой водородной шкале.
Рис. 84. водородный электрод.
Рис. 85. Цепь для измерения электродного потенциала: слева — электрод, потенциал которого нужно измерить; справа — каломельный электрод; в середине — соединительный сосуд.
Приведенный выше электродный процесс осуществляется на водородном электроде. Последний представляет собой платиновую пластинку, электролитически покрытую губчатой платиной и погруженную в раствор кислоты, через который пропускается водород (рис. 84). Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются на атомы (пластина катализирует этот распад). На поверхности соприкосновения платины с раствором кислоты может протекать, окисление атомов или восстановление ионов водорода. Платина при этом практически не принимает участия в электродных реакциях и играет как бы роль губки, пропитанной атомарным водородом.
Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов.
Установим, какой вид принимает общее уравнение электродного потенциала для водородного электрода. В соответствии с уравнением электродного процесса (см. стр. 271) 

где 

Обычно парциальное давление водорода 

Поскольку стандартный потенциал рассматриваемого процесса принят равным нулю, то
или, учитывая, что 
Для определения потенциала того или иного электродного процесса нужно составить гальванический элемент из испытуемого и стандартного водородного электродов и измерить его э. д. с. Поскольку потенциал стандартного водородного электрода равен нулю, то измеренная э. д. с будет представлять собою потенциал данного электродного процесса.
Практически при измерениях потенциалов в качестве электрода сравнения пользуются не стандартным водородным, а другими электродами, более удобными в обращении, потенциалы которых но отношению к стандартному водородному электроду известны. При этом необходимо рассчитать э. д. с. элемента согласно уравнению:
Здесь 


Решая уравнение относительно 
В качестве электродов сравнения чаще всего применяют хлор-серебряный и каломельный электроды. Хлорсеребряный электрод— это серебряная проволочка, покрытая слоем 
Каломельный электрод представляет собой ртуть, покрытую взвесью каломели 

Для того чтобы найти значение электродного потенциала, необходимо измерить не напряжение работающего элемента, а именно его э. д. с. При измерениях э. д. с. сопротивление внешней цепи (т. е. измерительного устройства) очень велико. Реакция в элементе при этом практически не протекает. Таким образом, электродные потенциалы отвечают обратимому протеканию процессов или, что то же самое, состоянию электрохимического равновесия на электродах. Поэтому электродные потенциалы часто называют равновесными электродными потенциалами или просто равновесными потенциалами.
Рассмотрим теперь, какой вид принимает общее уравнение электродного потенциала в важнейших случаях.
1. Электродный процесс выражается уравнением
где 


К этому случаю относятся оба электрода медно-цинкового элемента и вообще любой металлический электрод в растворе соли этого же металла. Здесь окисленной формой металла являются его ионы, а восстановленной — атомы. Следовательно, 


Например, для процесса
а для процесса
2. Электродный процесс выражается уравнением:
В этом случае и окисленная 

Например, для процесса 
В этом и в рассматриваемых ниже случаях электрод, на котором протекает электродный процесс, изготовляется из инертного материала. Чаще всего в качестве такого материала применяют платину.
Мы рассмотрели примеры, когда в электродных процессах принимали участие только ионы, состоящие из одного элемента. Однако часто окисляющееся или восстанавливающееся вещество состоит не из одного, а из двух или большего числа элементов. Чаще всего в составе окислителя содержится кислород; при этом в электродном процессе обычно принимают участие также вода и продукты ее диссоциации — ионы водорода (в кислой среде) или гидроксид-ионы (в щелочной среде). Рассмотрим, как будут выглядеть в таких случаях уравнения потенциалов электродных процессов.
3. Электродный процесс выражается уравнением:
Эта полуреакция (при протекании ее в сторону восстановления) играет очень большую роль при коррозии металлов (см. § 196). Кислород — самый распространенный окислитель, вызывающий коррозию металлов в водных средах.
В рассматриваемом электродном процессе в результате восстановления кислорода, протекающего с участием ионов водорода, образуется вода. Следовательно, 



Для рассматриваемого процесса 
При парциальном давлении кислорода, равном нормальному атмосферному давлению (которое условно принимается равным единице), 
4. Для электродных процессов, записываемых более сложными уравнениями, в выражениях для потенциалов содержится большее число переменных концентраций. Рассмотрим, например, электродный процесс:
Эта полуреакция протекает (в сторону восстановления) при взаимодействии перманганата калия с большинством восстановителей в кислой среде.
Концентрации всех веществ, участвующих в рассматриваемом электродном процессе, кроме воды, — величины переменные. Для этого процесса 
Примеры 3 и 4 показывают, что в случае электрохимических процессов, протекающих с участием воды, концентрация ионов водорода входит в числитель логарифмического члена уравнения потенциала. Поэтому электродные потенциалы таких процессов зависят от 
Таблица 18. Электродные потенциалы в водных растворах при 25 °С н при парциальном давлении газов, равном нормальному атмосферному давлению
Продолжение табл. 18
Как уже сказано, зависимость электродного потенциала от природы веществ — участников электродного процесса учитывается величиной 

Положение той или иной электрохимической системы в этом ряду характеризует ее окислительно-восстановительную способность. Под электрохимической системой здесь подразумевается совокупность всех веществ — участников данного электродного процесса.
Окислительно-восстановительная способность представляет собою понятие, характеризующее именно электрохимическую систему, но часто говорят и об окислительно-восстановительной способности того или иного вещества (или иона). При этом следует, однако, иметь в виду, что многие вещества могут окисляться или восстанавливаться до различных продуктов. Например, перманганат калия 




Соответствующие электродные процессы выражаются уравнениями:
Поскольку стандартные потенциалы этих трех электродных процессов различны (см. табл. 18), то различно и положение этих трех систем в ряду 

Элементы, проявляющие в своих соединениях только одну степень окисленности, имеют простые окислительно-восстановительные характеристики и занимают в ряду стандартных потенцпалоз мало мест. К их числу относятся в основном металлы главных подгрупп I-III групп периодической системы. Много же мест в ряду занимают те элементы, которые образуют соединения различных степеней окисленности — неметаллы и многие металлы побочных подгрупп периодической системы.
Ряд стандартных электродных потенциалов позволяет решать вопрос о направлении самопроизвольного протекания окислительно-восстановительных реакций. Как и в общем случае любой химической реакции, определяющим фактором служит здесь знак изменения энергии Гиббса реакции. Если из двух электрохимических систем составить гальванический элемент, то при его работе электроны будут самопроизвольно переходить от отрицательного полюса элемента к положительному, т. е. от электрохимической системы с более низким значением электродного потенциала к системе с более высоким его значением. Но это означает, что первая из этих систем будет выступать в качестве восстановителя, а вторая—в качестве окислителя. Следовательно, в гальваническом элементе окислительно-восстановительная реакция может самопроизвольно протекать в таком направлении, при котором электрохимическая система с более высоким значением электродного потенциала выступает в качестве окислителя, т. е. восстанавливается. При непосредственном взаимодействии веществ возможное направление реакции будет, конечно, таким же, как и при ее осуществлении в гальваническом элементе.
Если окислитель и восстановитель расположены далеко друг от друга в ряду 


может самопроизвольно идти как слева направо, так и справа налево. Направление ее протекания определяется концентрациями ионов железа и ртути. В этой реакции участвуют две электрохимические системы:
Соответствующим электродным процессам отвечают потенциалы:
Подсчитаем величины 



Таким образом, при взятом соотношении концентраций 
Теперь подсчитаем 


Следовательно, при этих концентрациях 
Если окислительно-восстановительная реакция протекает с участием воды и ионов водорода или гидроксид-ионов, то необходимо учитывать также величину 
В табл. 18 включено 39 полуреакций; комбинируя их друг с другом, можно решить вопрос о направлении самопроизвольного протекания 
Пример. Установить, направление возможного протекания реакции:
Запишем уравнение реакции в иоино-молекулярной форме: 2Вг~ + РЬ02 + 4Н+ = РЬ2+ + Вг2 + 2НгО
В табл. 18 находим стандартные электродные потенциалы электрохимических систем, участвующих в реакции:
Окислителем всегда служит электрохимическая система с более высоким значением электродного потенциала. Поскольку здесь 

Чем дальше находится та или иная система в ряду стандартных потенциалов, т. е. чем больше ее стандартный потенциал, тем более сильным окислителем является ее окисленная форма. И, наоборот, чем раньше расположена система в ряду, т. е. чем меньше значение 

При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакции — возрастают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция заканчивается— наступает состояние химического равновесия.
Ряд напряжений металлов
Если из всего ряда стандартных электродных потенциалов выделить только те электродные процессы, которые отвечают общему уравнению
то получим ряд напряжений металлов. В этот ряд всегда помешают, кроме металлов, также водород, что позволяет видеть, какие металлы способны вытеснять водород из водных растворов кислот. Ряд напряжений для важнейших металлов приведен в табл. 19. Положение того или иного металла в ряду напряжений характеризует его способность к окислительно-восстановительным взаимодействиям в водных растворах при стандартных условиях. Ионы металлов являются окислителями, а металлы в виде простых веществ — восстановителями. При этом, чем дальше расположен металл в ряду напряжений, тем более сильным окислителем в водном растворе являются его ионы, и наоборот, чем ближе металл к началу ряда, тем более сильные восстановительные свойства проявляет простое вещество — металл.
Таблица 19. Ряд напряжений металлов
Потенциал электродного процесса
в нейтральной среде 


* Потенциалы металлов в воде, конечно, отличны от их потенциалов в стандартных условиях; в большинстве случаев они имеют более отрицательное значение. Но, как правило, это не сказывается на правильности выводов о способности металлов вытеснять водород из воды.
Металлы, расположенные между магнием и водородом, вытесняют водород из растворов кислот. При этом на поверхности некоторых металлов также образуются защитные пленки, тормозящие реакцию. Так, оксидная пленка на алюминии делает этот металл стойким не только в воде, но и в растворах некоторых кислот. Свинец не растворяется в серной кислоте при ее концентрации ниже 80%, так как образующаяся при взаимодействии свинца с серной кислотой соль 
Металлы способны вытеснять друг друга из растворов солей. Направление реакции определяется при этом их взаимным положением в ряду напряжений. Рассматривая конкретные случаи таких реакций, следует помнить, что активные металлы вытесняют водород не только из воды, но и из любого водного раствора. Поэтому взаимное вытеснение металлов из растворов их солей практически происходит лишь в случае металлов, расположенных в ряду после магния.
Вытеснение металлов из их соединений другими металлами г.лервые подробно изучал Бекетов *. В результате своих работ он расположил металлы по их химической активности в «вытеснитель-ный ряд», являющийся прототипом ряда напряжений металлов.
* Николай Николаевич Бекетов (1826—1911) — крупный русский ученый — физико-химик. Выдающимся трудом Бекетова являются его «Исследования над явлениями вытеснения одних элементов другими», опубликованные в 1865 г. Ои открыл свойство алюминия вытеснять при высокой температуре металлы из их оксидов. Это открытие впоследствии легло в основу металлотермии (см. § 192), получившей широкое применение в металлургии. Бекетов осуществил многочисленные термохимические измерения. Ои впервые (с 1865 г.) ввел преподавание физической химии как учебной дисциплины.
Взаимное положение некоторых металлов в ряду напряжений н в периодической системе на первый взгляд не соответствует друг другу. Например, согласно положению в периодической системе химическая активность калия должна быть больше, чем натрия, а натрия — больше, чем лития. В ряду же напряжений наиболее активным оказывается литий, а калий занимает среднее положение между литием и натрием. Цинк и медь по их положению в периодической системе должны иметь приблизительно равную химическую активность, но в ряду напряжений цинк расположен значительно раньше меди. Причина такого рода несоответствий состоит в следующем.
При сравнении металлов, занимающих то или иное положение в периодической системе, за меру их химической активности — восстановительной способности — принимается величина энергии ионизации свободных атомов. Действительно, при переходе, например, сверху вниз по главной подгруппе I группы периодической системы энергия ионизации атомов уменьшается, что связано с увеличением их радиусов (т. е. с большим удалением внешних электронов от ядра) и с возрастающим экранированием положительного заряда ядра промежуточными электронными слоями (см. § 31). Поэтому атомы калия проявляют большую химическую активность — обладают более сильными восстановительными свойствами,—чем атомы натрия, а атомы натрия — большую активность, чем атомы лития.
При сравнении же металлов в ряду напряжений за меру химической активности принимается работа превращения металла, находящегося в твердом состоянии, в гидратированные ионы в водном растворе. Эту работу можно представить как сумму трех слагаемых: энергии атомизации — превращения кристалла металла в изолированные атомы, энергии ионизации свободных атомов металла и энергии гидратации образующихся ионов. Энергия атомизации характеризует прочность кристаллической решетки данного металла. Энергия ионизации атомов — отрыва от них валентных электронов — непосредственно определяется положением металла в периодической системе. Энергия, выделяющаяся при гидратации, зависит от электронной структуры иона, его заряда и радиуса. Ионы лития и калия, имеющие одинаковый заряд, но различные радиусы, будут создавать около себя неодинаковые электрические поля. Поле, возникающее вблизи маленьких ионов лития, будет более сильным, чем поле около больших ионов калия. Отсюда ясно, что ионы лития будут гидратироваться с выделением большей энергии, чем ионы калия.
Таким образом, в ходе рассматриваемого превращения затрачивается энергия на атомизацию и ионизацию и выделяется энергия при гидратации. Чем меньше будет суммарная затрата энергии, тем легче будет осуществляться весь процесс и тем ближе к началу ряда напряжений будет располагаться данный металл. Но из трех слагаемых общего баланса энергии только одно — энергия ионизации—непосредственно определяется положением металла в периодической системе. Следовательно, нет оснований ожидать, что взаимное положение тех или иных металлов в ряду напряжений всегда будет соответствовать их положению в периодической системе. Так, для лития суммарная затрата энергии оказывается меньшей, чем для калия, в соответствии с чем литий стоит в ряду напряжений раньше калия.
Для меди и цинка затрата энергии на ионизацию свободных атомов и выигрыш ее при гидратации ионов близки. Но металлическая медь образует более прочную кристаллическую решетку, чем цинк, что видно из сопоставления температур плавления этих металлов: цинк плавится при 

При переходе от воды к неводным растворителям взаимное положение металлов в ряду напряжений может изменяться. Причина этого лежит в том, что энергия сольватации ионов различных металлов по-разному изменяется при переходе от одного растворителя к другому.
В частности, ион меди весьма энергично сольватируется в некоторых органических растворителях; это приводит к тому, что в таких растворителях медь располагается в ряду напряжений до водорода и вытесняет его из растворов кислот.
Таким образом, в отличие от периодической системы элементов, ряд напряжений металлов не является отражением общей Закономерности, на основе которой можно давать разностороннюю Характеристику химических свойств металлов. Ряд напряжений характеризует лишь окислительно-восстановительную способность электрохимической системы «металл — ион металла» в строго определенных условиях: приведенные в нем величины относятся К водному раствору, температуре 
Электролиз
Электролизом называется совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита.
Примером электролиза может служить электролиз расплава хлорида магния. При прохождении тока через расплав 
Анионы хлора перемещаются к положительному электроду и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия — окисление ионов хлора
а вторичным — связывание образующихся атомов хлора в молекулы:
Складывая уравнения процессов, протекающих у электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава 
Эта реакция не может протекать самопроизвольно; энергия, необходимая для ее осуществления, поступает от внешнего источника тока.
Как и в случае химического источника электрической энергии, электрод, на котором происходит восстановление, называется катодом; электрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод— положительно, т. е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. Причина этого заключается в том, что процессы, протекающие при электролизе, в принципе обратны процессам, идущим при работе гальванического элемента. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию.
При рассмотрении электролиза водных растворов нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются еще ионы, являющиеся продуктами диссоциации воды — 


Какие именно электрохимические процессы будут протекать у электродов при электролизе, прежде всего будет зависеть от относительных значений электродных потенциалов соответствующих электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. На протекание некоторых электрохимических процессов оказывает тормозящее действие материал электрода; такие случаи оговорены ниже.
Рассматривая катодные процессы, протекающие при электролизе водных растворов, ограничимся важнейшим случаем— катодным восстановлением, приводящим к выделению элементов в свободном состоянии. Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода (см. стр. 273) и в случае нейтральных растворов 





* К важнейшим условиям электролиза относятся плотность тока, температура, состав раствора. Плотностью тока называется отношение силы тока к рабочей площади электрода.
Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды:
Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряженнй. В ряде случаев большое значение имеют 
При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще всего применяют графит, уголь, платину.
На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фторо-водорода и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от 
а в кислой или нейтральной:
В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона
равен 



При электролизе водных растворов бескислородных кислот и их солей (кроме 


и
в ряду стандартных электродных потенциалов. Эта аномалия связана со значительным перенапряжением (см. § 104) второго и этих двух электродных процессов — материал анода оказывает тормозящее действие на процесс выделения кислорода.
В случае активного анода число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды с выделением кислорода, разряд аниона (т. е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла).Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
Рассмотрим несколько типичных случаев электролиза водных растворов.
Электролиз раствора 

Схема электролиза* раствора хлорида меди(II):
* На этой и на последующих схемах в рамки заключены формулы веществ, являющихся конечными продуктами электролиза.
Электролиз раствора 




Схема электролиза раствора сульфата калия:
Рис. 86. Схема установки, закон Фарадея.
Электролиз раствора 





Схема электролиза раствора сульфата никеля:
Этот процесс применяется для электрической очистки никеля (так называемое электролитическое рафинирование, см. § 103).
Законы электролиза
С количественной стороны процесс электролиза впервые был изучен в 30-х годах XIX века выдающимся английским физиком Фарадеем *, который в результате своих исследований установил следующие законы электролиза:
* Майкл Фарадей (1791—1867)—один из крупнейших английских физиков и химиков. Большая часть его работ относится к области электричества. Он установил законы электролиза, открыл явление электромагнитной индукции. Впервые получил в жидком виде ряд газов (хлор, аммиак и др.), Открыл бензол и изобутилен.
1. Масса образующегося при электролизе вещества пропорциональна количеству прошедшего через раствор электричества.
Этот закон вытекает из сущности электролиза. Как уже говорилось, в месте соприкосновения металла с раствором происходит электрохимический процесс — взаимодействие ионов или молекул электролита с электронами металла, так что электролитическое образование вещества является результатом этого процесса. Ясно, что количество вещества, получающегося у электрода, всегда будет пропорционально числу прошедших по цепи электронов, т. е. количеству электричества.
2. При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств веществ.
Пусть, например, электрический ток последовательно проходит через растворы соляной кислоты, нитрата серебра, хлорида меди(II) и хлорида олова(IV) (рис. 86). Через некоторое время определяют количества выделившихся продуктов электролиза. Оказывается, что за время, в течение которого из раствора соляной кислоты выделяется 1 г водорода, т. е. 1 моль атомов, из остальных растворов выделяются указанные ниже массы металлов:
Сопоставляя выделившиеся массы металлов с атомными массами тех же металлов, находим, что выделяется 1 моль атомов серебра, 

Рассматривая второй закон электролиза с точки зрения электронной теории, нетрудно понять, почему при электролизе вещества выделяются в химически эквивалентных количествах. Обратимся, например, к электролизу хлорида меди(II). При выделении меди из раствора каждый ион меди получает от катода два электрона, и в то же время два хлорид-иона отдают электроны аноду, превращаясь в атомы хлора. Следовательно, число выделившихся атомов меди всегда будет вдвое меньше числа выделившихся атомов хлора, т. е, массы меди и хлора будут относиться друг к другу, как их эквивалентные массы.
Измерениями установлено, что количество электричества, обусловливающее электрохимическое превращение одного эквивалента вещества, равно 96485 (округленно 96 500) кулонам. Величина 

Второй закон электролиза дает прямой метод определения эквивалентов различных элементов. На этом же законе основаны расчеты, связанные с электрохимическими производствами.
Законы электролиза относятся к электролизу растворов, расплавов и твердых электролитов с чисто ионной проводимостью.
Электролиз в промышленности
Важнейшее применение электролиз находит в металлургической и химической промышленности и в гальванотехнике.
В металлургической промышленности электролизом расплавленных соединений и водных растворов получают металлы, а также производят электролитическое рафинирование — очистку металлов от вредных примесей и извлечение ценных компонентов.
Электролизом расплавов получают металлы, имеющие сильно отрицательные электродные потенциалы, и некоторые их сплавы.
При высокой температуре электролит и продукты электролиза могут вступать во взаимодействие друг с другом, с воздухом, а также с материалами электродов и электролизера. В результате этого простая, в принципе, схема электролиза (например, электролиз 
Электролитом обычно служат не индивидуальные расплавленные соединения, а их смеси. Важнейшим преимуществом смесей является их относительная легкоплавкость, позволяющая проводить электролиз при более низкой температуре.
В настоящее время электролизом расплавов получают алюминий, магний, натрий, литий, бериллий и кальций. Для получения калия, бария, рубидия и цезия электролиз расплавов практически не применяется из-за высокой химической активности этих металлов и большой их растворимости в расплавленных солях. В последние годы электролизом расплавленных сред получают некоторые тугоплавкие металлы.
Электролитическое выделение металла из раствора называется электроэкстракцией. Руда или обогащенная руда—концентрат (см. § 192)—подвергается обработке определенными реагентами, в результате которой металл переходит в раствор. После очистки от примесей раствор направляют на электролиз. Металл выделяется на катоде и в большинстве случаев характеризуется высокой чистотой. Этим методом получают главным образом цинк, медь и кадмий.
Электролитическому рафинированию металлы подвергают для удаления из них примесей и для перевода содержащихся в них компонентов в удобные для переработки продукты. Из металла, подлежащего очистке, отливают пластины и помещают их в качестве анодов в электролизер. При прохождении тока металл подвергается анодному растворению — переходит в виде катионов в раствор. Далее катионы металла разряжаются на катоде, образуя компактный осадок чистого металла. Содержащиеся в аноде примеси либо остаются нерастворенными, выпадая в виде анодного шлама, либо переходят в электролит, откуда периодически или непрерывно удаляются..
Рассмотрим в качестве примера электрорафинирование меди, основным компонентом раствора служит сульфат меди — наиболее распространенная и дешевая соль этого металла. Но раствор 
Металлические примеси, содержащиеся в неочищенной («черновой») меди, можно разделить на две группы:
1) 
2) 

Электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
К гальванотехнике относятся гальваностегия и гальванопластика. Процессы гальваностегии представляют собой нанесение путем электролиза на поверхность металлических изделий слоев других металлов для предохранения этих изделий от коррозии, для придания их поверхности твердости, а также в декоративных целях. Из многочисленных применяемых в технике гальванотехнических процессов важнейшими являются хромирование, цинкование и никелирование.
Сущность гальванического нанесения покрытий состоит в следующем. Хорошо очищенную и обезжиренную деталь, подлежащую защите, погружают в раствор, содержащий соль того металла, которым ее необходимо покрыть, и присоединяют в качестве катода к цепи постоянного тока; при пропускании тока на детали осаждается слой защищающего металла. Наилучшая защита обеспечивается мелкокристаллическими плотными осадками. Такие осадки обладают, кроме того, лучшими механическими свойствами.
Гальванопластикой называются процессы получения точных металлических копий с рельефных предметов электроосажденнем металла. Путем гальванопластики изготовляют матрицы для прессования различных изделий (граммофонных пластинок, пуговиц и др.), матрицы для тиснения кожи и бумаги, печатные радиотехнические схемы, типографские клише. Гальванопластику открыл русский академик Б. С. Якоби (1801—1874) в тридцатых годах XIX века.
К гальванотехнике относятся также другие виды электрохимической обработки поверхности металлов: электрополирование стали, оксидирование алюминия, магния. Последнее представляет собой анодную обработку металла, в ходе которой определенным образом изменяется структура оксидной пленки на его поверхности. Это приводит к повышению коррозионной стойкости металла. Кроме того, металл приобретает при этом красивый внешний вид.
В химической промышленности методом электролиза получают различные продукты; к числу их относятся фтор, хлор, едкий натр, водород высокой степени чистоты, многие окислители, в частности пероксид водорода.
Электрохимическая поляризация. Перенапряжение
Когда электрод находится при потенциале, равном равновесному, на нем устанавливается электрохимическое равновесие:
Прн смещении потенциала электрода в положительную или в отрицательную сторону на нем начинают протекать процессы окисления или восстановления. Отклонение потенциала электрода от его равновесного значения называется электрохимической поляризацией или просто поляризацией.
Поляризацию можно осуществить включением электрода в цепь постоянного тока. Для этого необходимо составить электролитическую ячейку из электролита и двух электродов—изучаемого и вспомогательного. Включая ее в цепь постоянного тока, можно сделать изучаемый электрод катодом или (при обратном включении ячейки) анодом. Такой способ поляризации называется поляризацией от внешнего источника электрической энергии.
Рассмотрим простой пример поляризации. Пусть медный электрод находится в 0,1 

а на границе металла с раствором установится электрохимическое равновесие:
Подключим электрод к отрицательному полюсу источника тока — сделаем его катодом. Избыток электронов, который появится теперь на электроде, сдвинет потенциал электрода в отрицательную сторону и одновременно нарушит равновесие. Электроны будут притягивать катионы меди из раствора — пойдет процесс восстановления;
Если подключить электрод не к отрицательному, а к положительному полюсу источника тока — сделать его анодом, то вследствие удаления части электронов потенциал электрода сместится в положительную сторону и равновесие также нарушится. Но теперь на электроде будет протекать процесс окисления, так кай в ходе этого процесса высвобождаются электроны:
Таким образом, поляризация электрода в отрицательную сторону связана с протеканием процесса восстановления, а поляризация в положительную сторону — с протеканием процесса окисления. Процесс восстановления иначе называют катодным процессом, а процесс окисления — анодным. В связи с этим поляризация в отрицательную сторону называется катодной поляризацией, а в положительную — анодной.
Другой способ поляризации электрода—это контакт его с электрохимической системой, электродный потенциал которой имеет более положительное или более отрицательное значение, чем потенциал рассматриваемого электрода.
Рассмотрим работу медно-цинкового гальванического элемента. При разомкнутой цепи как на медном, так и на цинковом электродах устанавливаются электрохимические равновесия. Но электродные потенциалы, отвечающие этим равновесиям, различны. В случае 0,1 
При замыкании цепи оба электрода оказывают друг на друга поляризующее действие: потенциал медного электрода под влиянием контакта с цинком сдвигается в отрицательную сторону, а потенциал цинкового электрода под влиянием контакта с медью — в положительную. Иначе говоря, медный электрод поляризуется катодно, а цинковый — анодно. Одновременно на обоих электродах нарушаются электрохимические равновесия и начинают протекать электрохимические процессы: катодный процесс на медном электроде и анодный — на цинковом:
Поляризация электрода — необходимое условие протекания электродного процесса. Кроме того, от ее величины зависит скорость электродного процесса; чем сильнее поляризован электрод, тем с большей скоростью протекает на нем соответствующая полуреакция.
Кроме величины поляризации на скорость электродных процессов влияют некоторые другие факторы. Рассмотрим катодное восстановление ионов водорода. Если катод изготовлен из платины, то для выделения водорода с заданной скоростью необходима определенная величина катодной поляризации. При замене платинового электрода на серебряный (при неизменных прочих условиях) для получения водорода с прежней скоростью понадобится большая поляризация. При замене катода на свинцовый поляризация потребуется еще большая. Следовательно, различные металлы обладают различной каталитической активностью по отношению к процессу восстановления ионов водорода. Величина поляризации, необходимая для протекания данного электродного процесса с определенной скоростью, называется перенапряжением данного электродного процесса. Таким образом, перенапряжение выделения водорода на различных металлах различно.
В табл. 20 приведены для 1 н. растворов величины катодной поляризации, которую необходимо осуществить на электроде для выделения на нем водорода со скоростью 0,1 мл в минуту с 
Таблица 20. Перенапряжение выделения водорода на различных металлах
Выяснение связи между величиной поляризации и скоростью электродного процесса является важнейшим методом изучения электрохимических процессов. При этом результаты измерений обычно представляют в виде поляризационных кривых — кривых зависимости плотности тока на электроде от величины поляризации. Вид поляризационной кривой того или иного электродного процесса отражает особенности его протекания. Методом поляризационных кривых изучают кинетику и механизм окислительно-восстановительных реакций, работу гальванических элементов, явления коррозии и пассивности металлов, различные случаи электролиза.
Большой вклад в развитие кинетики электродных процессов и теории перенапряжения внес советский ученый А. Н Фрумкин*.
* Александр Наумович Фрумкин (!895—1976) — крупнейший советский электрохимик, академик, лауреат Ленинской и Государственной премий. Разработал количественную теорию влияния электрического поля на адсорбцию молекул, развил учение о строении границы металл — раствор, внес значительный вклад в теорию э. д. с. гальванического элемента.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований