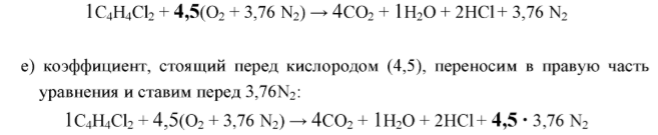Горение простых и сложных веществ. Тепловой эффект химической реакции.(8 класс)
Горение простых и сложных веществ.
Тепловой эффект химической реакции.(8 класс)
ГУ « Аулиекольская школа-гимназия имени Султана Баймагамбетова
отдела образования акимата Аулиекольского района»
Здравствуйте. Я учитель химии Аулиекольской школы-гимназии
. Моё педагогическое кредо: «Учитель — всегда ученик».
Тема моего урока: «Горение простых и сложных веществ. Тепловой эффект химической реакции»(8 класс)
сформировать знания о реакциях горения, условиях их протекания и прекращения, знания о тепловом эффекте химической реакции, экзо — и эндотермических реакциях,
развивать внимание, логическое мышление, продолжить формирование умений сравнивать, делать выводы; воспитывать интерес к предмету химии.
Знать: понятия «реакция горения», «тепловой эффект химической реакции», « экзо и эндотермической реакции»
Уметь: определять тип реакции по тепловому эффекту.
Владеть терминологией, изученной во время урока;
С целью активизации познавательного интереса учащихся я использую на уроке различные инструменты Асtivstudio Activinspire: ссылка на музыку, ссылки на видео, тел. лента. ресурсы библиотеки студий, а также ресурсы Интернета.
Премечание: на уроке используется флипчарт, который переведён в программу Power Point, при этом, к сожалению, некоторые свойства флипчарта потеряны.
Горение простых и сложных веществ. Тепловой эффект химической реакции(8класс)
Образовательные: сформировать знания о реакциях горения, условиях их протекания и прекращения, знания о тепловом эффекте химической реакции, экзо — и эндотермических реакциях, термохимических уравнениях, закрепить навыки составления химических уравнений реакций горения;
Развивающие: развивать внимание, память, логическое мышление, продолжить формирование умений сравнивать, делать выводы;
Воспитательные: воспитывать интерес к предмету химии, коллективизм, стремление самому добывать знания. Содействовать развитию внимательности, инициативности, трудолюбия, творческих способностей.
Тип урока: Изучение нового материала.
Оборудование: таблица ПСХЭ ДИ Менделеева, интерактивная доска, Xplorer GLX, датчик температуры, flt «Горение эфф»
Реактивы: лабораторные стаканы, раствор лимонной кислоты, сода, натрий, вода
Знать: понятия «реакция горения», «тепловой эффект химической реакции2, « экзо и эндотермической реакции
Уметь: составлять термохимические уравнения, определять тип реакции по тепловому эффекту.
Владеть терминологией, изученной во время урока;
1. Организационно-мотивационный этап (слайд 2,3 flt «Горение эфф», стихи о горении и звучит музыка –ссылка на стр.2 )
Учитель: Горение – это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем. Пламя, огонь, как одно из проявлений реакции горения, имеет и свое монументальное отражение. Яркий пример – мемориал славы в с. Аулиеколь(стр. флипчарта 4)
Об огне сложены сказки, легенды. В старину люди думали, что в огне живут маленькие ящерицы – духи огня. А были и такие, которые считали огонь божеством и строили в его честь храмы. Сотни лет горели в этих храмах, не угасая, светильники, посвященные богу огня. Поклонение огню было следствием незнания людьми процесса горения.
Олимпийский огонь. Раз в четыре года в мире происходит событие, сопровождающееся переносом «живого» огня. В знак уважения к основателям олимпиад огонь доставляют из Греции. По традиции один из выдающихся спортсменов доставляет этот факел на главную арену олимпиады. говорил: «Изучение природы огня и без химии предпринимать отнюдь невозможно».
Сегодня на уроке мы поговорим о реакциях горения веществ, роли реакций горения и о энергии химических реакций
2. Организационно-мотивационный этап (Повторение пройденного материала)
1 Что называется реакцией горения?
2. Какие продукты образуются при горении?
Задание 1. Составьте уравнения реакций горения. Назовите продукты реакций (2 ученика у интерактивной доски — слайд 5)


Задание3 Горение простых и сложных веществ. Выберите из вазы со свечой продукты этих реакций(слайд6)


Вопрос А какие продукты образуются при горении сложных веществ? (оксиды) Составьте уравнения реакции горения метана СН4, если образуются оксиды. СН4+О2(слайд 6)
Изучение нового материала
Учитель Горение — реакция окисления, протекающая с достаточно большой скоростью, сопровождающаяся выделением тепла и света.
Схематически этот процесс окисления можно выразить следующим образом:
Горение – это первая химическая реакция,
с которой познакомился человек.
Ребята, помогите оппонентам в следующем споре о роли огня
Спор 2 учеников о роли огня
1 ученик ( показ слайдов «сварка металлов, горение топлива в печи и горении реактивного топлива при полёте самолёта»-стр.11-15)
Без огня человек не сварит пищу, сталь,
без него невозможно движение транспорта.
Огонь стал нашим другом и союзником, символом славных дел,
добрых свершений, памятью о минувшем.
2 ученик (показ слайда «пожар», стр15)
Позвольте возразить! При горении идет интенсивное окисление, в процессе горения появляется огонь, следовательно, такое окисление протекает очень быстро. Если скорость реакции окажется достаточно большой? Может произойти взрыв. Так взрываются смеси горючих веществ с воздухом или кислородом. К сожалению, известны случаи взрывов смесей воздуха с метаном, водородом, парами бензина, эфира, мучной и сахарной пылью и т. п., приводящие к разрушениям и даже человеческим жертвам.
Учитель: Сделайте вывод о роли огня
Вывод: Чтобы не допустить взрывов и пожаров, нужно знать условия возникновения и прекращения горения
Для возникновения горения необходимы:
-
горючее вещество окислитель (кислород) нагревание горючего вещества до температуры воспламенения (демонстрация слайдов — стр. 9)
Температура воспламенения у каждого вещества различна.
В то время как эфир может воспламениться от горячей проволоки, для того чтобы поджечь дрова, нужно нагреть их до нескольких сот градусов. Температура воспламенения веществ различна. Сера и дерево воспламеняются при температуре около 270 °С, уголь – около 350 °С, а белый фосфор – около 40 °С.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже — в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного моль реагента или (реже) для моля продукта реакции. Количество теплоты, выделяющееся или поглощающееся при химической реакции, называется тепловым эффектом реакции (Q). Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений:
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
2 H2(г) + O2(г) = 2 H2О(ж) + Q
Это уравнение реакции называется термохимическим уравнением. Здесь символ «+Q« означает, что при сжигании водорода выделяется теплота. Эта теплота называется тепловым эффектом реакции. В термохимических уравнениях часто указывают агрегатные состояния веществ.Реакции протекающие с выделением энергии называются ЭКЗОТЕРМИЧЕСКИМИ (от латинского «экзо» – наружу). Например, горение метана:
CH4 + 2O2 = CO2 + 2H2O + Q
Реакции протекающие с поглощением энергии называются ЭНДОТЕРМИЧЕСКИМИ (от латинского «эндо» — внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании.
C + H2O = CO + H2 – Q
Тепловые эффекты химических реакций нужны для многих технических расчетов.( демонстрация слайдов с уравнениями реакций и определениями понятий стр7, глоссарий на стр.8)
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы.
Учитель: Теплота есть в любой химической реакции. Как экспериментально определить тип реакции по тепловому эффекту?
Взаимодействие 1.5 М раствора лимонной кислоты с содой
1. Определение начальной температуры 30 мл 1.5 М раствора лимонной кислоты с помощью датчика температуры PS -2153
2. Добавили 10г гидрокарбоната натрия
3. Через 20 сек реакции измерили температуру
4. отобразили на экране график зависимости температуры от времени
5. по графику определили тип реакции(разность температур меньше нуля)
Вывод: реакция эндотермическая
Опыт 2 Реакция оксида кальция с водой
1. Провести реакцию оксида кальция с водой
2. измерить начальную температуру с помощью датчика температуры PS -2153
3. измерить температуру через 20 сек
4. отобразили на экране график зависимости температуры от времени
5. по графику определили тип реакции (разность температур больше нуля)
Вывод: реакция экзотермическая
(учащиеся заполняют таблицу на стр16)
Учитель: От чего зависит тепловой эффект реакции?(природа реагирующих веществ, агрегатное состояние веществ, степени измельчения веществ )
3. Диагностика ( учащиеся выполняют тест по теме урока, flt эффект)
Запишите ваши ассоциации к слову «горение»(стр19)
5 Домашнее задание ( телеграфная лента-стр20)
Правила составления уравнения реакции горения
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ИВАНОВСКИЙ ИНСТИТУТ ГОСУДАРСТВЕННОЙ ПРОТИВОПОЖАРНОЙ СЛУЖБЫ МИНИСТЕРСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ ПО ДЕЛАМ ГРАЖДАНСКОЙ ОБОРОНЫ, ЧРЕЗВЫЧАЙНЫМ СИТУАЦИЯМ И ЛИКВИДАЦИИ ПОСЛЕДСТВИЙ СТИХИЙНЫХ БЕДСТВИЙ»
Кафедра химии, теории горения и взрыва
Т.А Мочалова, Д.В. Батов, А.В. Петров
Теория горения и взрыва
Задания и методические указания по выполнению
Расчетно-графической работы
Иваново
Мочалова Т.А, Батов Д.В., Петров А.В. Теория горения и взрыва. Задания и методические рекомендации по выполнению расчетно-графической работы. Учебное пособие. Иваново: ООНИ ИвИ ГПС МЧС России, 2012.- 38 с.
Учебное пособие предназначено для обучающихся по специальности 280705 Пожарная безопасность и направлению подготовки 280700 Техносферная безопасность. Учебное пособие охватывает основные темы дисциплины «Теория горения и взрыва» и рассчитано на более глубокое ее усвоение. Пособие содержит варианты контрольных заданий и методические рекомендации по выполнению расчетно-графической работы по дисциплине «Теория горения и взрыва».
Печатается по решению Редакционно-издательского совета института
Рассмотрено и рекомендовано к публикации кафедрой химии, теории горения и взрыва, протокол № 7 от 22 декабря 2011 года.
Ведущий научный сотрудник ФГБУН
Институт химии растворов им. Г.А.Крестова РАН
доктор химических наук П.Р.Смирнов
кафедры физики и теплотехники
Ивановского института ГПС МЧС России
кандидат химических наук О.Е.Сторонкина
© Ивановский институт ГПС МЧС России, 2012
| Стр. |
| Список используемых сокращений |
| ВВЕДЕНИЕ |
| Общие указания по выполнению расчетно-графической работы |
| Правила составления уравнения реакции горения |
| Пример решения задач |
| Задачи для самостоятельного решения |
| Список рекомендуемой литературы |
| Приложения |
Список используемых сокращений
КПР – концентрационные пределы распространения пламени
НКПР – нижний концентрационный предел распространения пламени
ВКПР — верхний концентрационный предел распространения пламени
ТПР – температурные пределы распространения пламени
ПГ – продукты горения
ГВ – горючее вещество

Введение
В результате изучения дисциплины «Теория горения и взрыва» у обучающихся формируется теоретический фундамент для глубокого осмысления всей системы показателей пожарной опасности веществ и материалов как совокупности предельных условий и параметров возникновения и прекращения горения.
Овладение методами расчета показателей пожарной опасности веществ необходимо, прежде всего, для будущей практической деятельности: для решения вопросов обеспечения безопасности технологических процессов, зданий и сооружений, а также обеспечения пожарной безопасности людей во время пожаров.
Использование знаний о механизмах протекания горения дает возможность управлять горением на пожаре, организовывать профилактические меры против возникновения самовоспламенения, самовозгорания, воспламенения, меры по снижению интенсивности горения на пожаре, его локализации и тушению.
1. Общие указания по выполнению расчетно-графической работы
В соответствие с учебным планом обучающиеся по дисциплине «Теория горения и взрыва» обязаны выполнить расчетно-графическую работу. Расчетно-графическая работа выполняется по индивидуальному заданию.
Вариант задания выбирается по двум последним цифрам номера зачётной книжки (Приложение 1).
При необходимости преподаватель имеет право изменить вариант расчетно-графической работы обучающегося.
Расчетно-графические работы могут быть оформлены как в ученических тетрадях в объеме не более 18 листов рукописного текста, так и на листах формата А-4, в объеме не более 15 листов, компьютерным набором, ориентация книжная.
При выполнении расчетно-графической работы в ученической тетради с полями, содержащей не менее 18 листов, на титульном листе тетради должны быть указаны звание, фамилия, имя, отчество, номер зачётной книжки и номер учебной группы обучающегося. Работа выполняется аккуратно, разборчивым почерком через строчку, графики вычерчиваются при помощи линейки и карандаша. В задании должны быть представлены номер и полный текст задачи.
При выполнении расчетно-графической работы на компьютере необходимо учитывать следующие требования:
— ориентация страниц – книжная;
— на титульном листе указывается министерство, название кафедры, фамилия, инициалы обучающегося, номер учебной группы, номер варианта, должность, фамилия, инициалы преподавателя (приложение 3);
— поля: верхнее – 1 см, левое – 2 см, нижнее – 1 см, правое – 1 см;
— интервал между строками- одинарный;
— красная строка 1,5 см от левой границы текста;
— нумерация по центру листа внизу;
— шрифт Times New Roman, размер шрифта 14;
— работа скрепляется в папку-скоросшиватель.
Задание должно быть оформлено в соответствии со следующей схемой: формулировка задачи, дано, найти, решение, ответ.
При решении задач даются ссылки на использованные справочные данные и соответствующий литературный источник. Литература, используемая в процессе выполнения задания, приводится в конце работы. Список литературы составляется с учетом правил оформления библиографии (Приложение 1).
Выполненная и правильно оформленная расчетно-графическая работа сдается преподавателю. Работа, выполненная не по своему варианту, к зачету не принимается. Такая работа должна быть выполнена повторно.
Правила составления уравнения реакции горения
При решении практически всех задач по дисциплине «Теория горения и взрыва» необходимо составить уравнение реакции горения. Поэтому очень важно научиться делать это правильно. Изучите изложенные ниже правила составления уравнений реакции горения, разберите примеры.
Правило № 1. В левой части уравнения записываем горючее вещество и окислитель [воздух в виде(O2 + 3,76N2)].
Правило № 2.В правой части уравнения записываем продукты реакции горения, учитывая, что:
углерод (С), содержащийся в горючем веществе, превращается в CO2,
сера (S), содержащаяся в горючем веществе, превращается в SO2,
фосфор (Р), содержащийся в горючем веществе, превращается в P2O5,
водород (Н), содержащийся в горючем веществе, превращается в H2O,
хлор (Cl), содержащийся в горючем веществе, превращается в HCl,
фтор (F), содержащийся в горючем веществе, превращается в HF,
бром (Br), содержащийся в горючем веществе, превращается в HBr,
йод (I), содержащийся в горючем веществе, превращается в HI,
кислород (О), содержащийся в горючем веществе, входит в состав образующихся оксидов (CO2, SO2, H2O) как и кислород воздуха.
азот (N), при температуре горения ниже 2000 о С не вступает в реакцию. Поскольку, в условиях реального пожара температура не превышает значения 1500 – 1600 о С, то принимают, что азот выделяется в свободном виде (N2). Следовательно, 3,76 молей N2 из воздуха переходят в неизменном виде в продукты горения.
Если горючее вещество содержит другие элементы, то они переходят в высшие оксиды.
Правило № 3. Атомы кислорода, входящие в состав молекул горючего вещества (например, C2H6OS — 2-тиолэтанол), участвуют в реакции горения в качестве окислителя, как кислород воздуха.
Правило № 4.Расставляем коэффициенты в схеме реакции горения для того, чтобы в исходных веществах (левая часть уравнения) и получившихся из них продуктах реакции (правая часть уравнения) содержалось одинаковое количество атомов данного вида. При подсчете количества атомов данного вида стехиометрические коэффициенты и индексы, указывающие количество атомов в молекуле, перемножаются.
Рекомендуется придерживаться следующей последовательности действий.
Перед формулой горючего вещества всегда ставится коэффициент 1, так как все расчеты ведут на 1 моль горючего вещества.
Перед формулой углекислого газа ставится коэффициент равный количеству атомов углерода в молекуле горючего вещества.
Уравниваем число атомов элементов, входящих в состав молекул горючего вещества, за исключением Н, О и N.
Уравниваем число атомов водорода, учитывая их содержание в молекулах галогеноуглеводородов и воды.
Уравниваем число атомов кислорода, рассчитав их количество в правой части уравнения и учитывая атомы кислорода, содержащиеся в молекуле горючего вещества.
Коэффициент, поставленный перед молекулой кислорода, переносим в правую часть уравнения и ставим перед 3,76N2. Уравниваем число атомов азота, содержащиеся в молекуле горючего вещества.
Рассмотрим несколько примеров составления реакций горения веществ в воздухе, в которых использованы описанные выше правила.
Пример 1. Составить уравнение реакции горения С6Н4N2О4 в воздухе.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, кислород вошел в состав воды и углекислого газа, азот выделился в свободном виде — N2. Азот, содержащийся в воздухе, также не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 6, равный количеству атомов углерода в молекуле горючего вещества:
в) Уравниваем число атомов элементов, входящих в состав молекулы горючего вещества, за исключением Н и О. В данном случае уравниваем число атомов азота. В состав горючего вещества входят два атома азота. В составе выделившейся молекулы азота тоже два атома, поэтому перед молекулой азота в продуктах реакции ставим коэффициент 1:
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества четыре атома водорода. В состав молекулы воды входит только два атома. Следовательно, перед формулой воды ставим коэффициент 2:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе шести молекул углекислого газа: 6 ∙ 2 = 12;
в составе двух молекул воды: 2 ∙ 1 = 2;
итого: 12 + 2 = 14 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества имеется 4 атома кислорода. Вычитаем это число из количества атомов кислорода в правой части уравнения (14 – 4 = 10). Затем делим полученное число на 2 (количество атомов водорода в Н2О) (10/2 = 5) и ставим полученный коэффициент перед воздухом:
е) коэффициент 5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Чтобы убедиться в правильности составленного уравнения реакции горения, рассчитаем количество атомов одних и тех же элементов в его правой и левой частях:
С – слева 6, справа 6 ∙ 1 = 6;
Н – слева 4, справа 2 ∙ 2 = 4;
N – слева: в горючем веществе 2, в воздухе 5∙ 3,76 = 18,8, итого 20,8;
справа 2 + 5∙ 3,76 = 20,8;
О — слева: в горючем веществе 4, в воздухе 5 ∙ 2 = 10, итого 14;
справа: в углекислом газе 6 ∙ 2 = 12, в воде 2 ∙ 1 = 2, итого 14.
Вывод: уравнение реакции горения составлено верно.
Пример 2. Составить уравнение реакции горения п-дихлорбензола (С4Н4Сl2) в воздухе.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, хлор превратился в хлороводород. Азот, содержащийся в воздухе, не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 4, равный количеству атомов углерода в молекуле горючего вещества:
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О, N. В данном случае уравниваем число атомов хлора. В состав горючего вещества входят два атома хлора. В составе выделившейся молекулы хлороводорода один атом Cl, поэтому перед молекулой хлороводорода в продуктах реакции ставим коэффициент 2:
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества четыре атома водорода. Из них два атома водорода уже вошли в состав двух молекул хлороводорода. Оставшиеся два атома водорода перейдут в состав молекулы Н2О. Следовательно, перед молекулой воды ставим коэффициент 1:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе четырех молекул углекислого газа: 4 ∙ 2 = 8;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 8 + 1 = 9 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества нет атомов кислорода. Следовательно, делим количество атомов кислорода в правой части уравнения на 2 (9 /2 = 4,5) и ставим полученный коэффициент перед воздухом:
е) коэффициент 4,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Пример 3. Составить уравнение реакции горения ацетилена (С2Н2) в воздухе.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду. Азот, содержащийся в воздухе, не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 2, равный количеству атомов углерода в молекуле ацетилена:
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О и N. В данном случае таких элементов нет.
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества — два атома водорода. В состав молекулы воды входит также два атома водорода. Следовательно, перед молекулой воды ставим коэффициент 1:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе двух молекул углекислого газа: 2 ∙ 2 = 4;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 4 + 1 = 5 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества нет атомов кислорода, следовательно, делим количество атомов кислорода в правой части уравнения на 2 (5/2 = 2,5) и ставим данный коэффициент перед воздухом:
е) коэффициент 2,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Пример 4. Составить уравнение реакции горения C6Н8SО3 в воздухе.
1.В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, кислород вошел в состав воды и углекислого газа, сера образовала оксид SO2. Азот воздуха не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 6, равный количеству атомов углерода в молекуле горючего вещества:
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О и N. В данном случае уравниваем число атомов серы. В состав молекулы горючего вещества входит один атом серы. В составе выделившейся молекулы SO2 тоже один атом, поэтому перед молекулой SO2 в продуктах реакции ставим коэффициент 1:
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества восемь атомов водорода, а в состав молекулы воды входит только два атома. Следовательно, перед молекулой воды ставим коэффициент 4:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе шести молекул углекислого газа: 6 ∙ 2 = 12;
в составе четырех молекул воды: 4 ∙ 1 = 4;
в составе одной молекулы оксида серы: 1∙ 2 = 2
итого: 12 + 4 + 2 = 18 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества имеется 3 атома кислорода. Вычитаем это число из количества атомов кислорода в правой части уравнения (18 – 3 = 15). Делим полученное число на 2 (15 /2 = 7,5) и ставим данный коэффициент перед воздухом:
е) коэффициент 7,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Многообразие реакций горения не исчерпывается рассмотренными в данном разделе примерами. Однако, используя описанные правила, можно самостоятельно составить реакцию горения многих других горючих веществ. Написание уравнений реакций горения является важной составной частью при решении многих задач в курсе «Теория горения и взрыва».
Пример решения задач
Задача. Используя данные таблицы, определить показатели пожарной опасности толуола: группу горючести, температуру вспышки; концентрационные пределы распространения пламени (в % и г/м 3 ) при t = 25, 45 и 65 o C, построить график зависимости КПР от температуры; температурные пределы распространения пламени, низшую теплоту сгорания по следствию из закона Гесса; максимальное давление взрыва, тротиловый эквивалент возможного аварийного взрыва при взрыве в технологическом оборудовании. Рассчитать объем воздуха, объем и процентный состав компонентов продуктов горения.
| Начальное давление, Па | Начальная температура, 0 С | Температура взрыва, 0 С. | Масса вещества, кг | Коэффициент избытка воздуха |
| 101 300 | 1,3 |
1. Составляем уравнение реакции горения толуола в воздухе (см. правила составления уравнения реакции горения) и определяем стехиометрический коэффициент β (коэффициент перед кислородом):
2. Рассчитываем объём, занимаемый 1 кмоль воздуха при заданных условиях.
3. Рассчитываем молярную массу толуола.
М (C7H8) = 12 × 7 + 1 × 8 = 92 (кг/кмоль)
4. Рассчитываем объём воздуха, необходимого для полного сгорания заданной массы толуола.
5. Определяем избыточное количество вещества кислорода и азота.
= b(a — 1), кмоль; = 9(1,3 — 1) = 2,7 (кмоль)
=3,76 × b(a — 1), кмоль; =3,76 × 9(1,3 — 1) = 10,2 (кмоль)
6. Рассчитываем общее количество вещества продуктов горения.
ånпг = , кмоль;
ånпг = 7 + 4 + 33,84 + 2,7 + 10,2 = 57,74 (кмоль)
7. Определяем общий объём образующихся продуктов горения.
, м 3 ;
8. Определяем мольный процентный состав компонентов продуктов горения. Принимаем общее количество вещества продуктов горения за 100%, а количество вещества конкретного продукта реакции за %:
Для СО2 получаем следующую пропорцию.
ånпг = 57,74 кмоль – 100%
= 7 кмоль – %,
отсюда
Аналогично находим процентное содержание оставшихся продуктов горения:
При расчете процентного содержания азота суммируем его количество перешедшее в продукты горения в результате реакции и из избытка воздуха.
9. Определяем группу горючести толуола. Для этого рассчитываем его коэффициент горючести по формуле:
где: nC, nS, nH, nN, nO, nCl, nF, nBr— соответственно число атомов углерода, серы, водорода, азота, кислорода, хлора, фтора, брома в молекуле вещества.
Если расчётное значение К £ 0 – вещество негорючее, 0 2 – вещество является горючим.
Записываем количество атомов составляющих толуол (С7Н8): nC= 7; nH= 8;
Рассчитываем коэффициент горючести:
Вывод: К > 2, следовательно, толуол – горючее вещество.
10. Определяем температуру вспышки. Для этого по справочнику [4] находим температуру кипения толуола:
Определяем температуру вспышки по формуле Элея:
.
Справочное значение 7 0 С [4].
11. Рассчитываем нижний и верхний концентрационный пределы распространения пламени толуола при стандартных условиях по формуле:
, об. %
— нижний (верхний) концентрационные пределы распространения пламени, % об.;
b — число молекул кислорода, необходимое для полного окисления молекулы горючего;
a и b — константы определяемые по табл. 2 приложения 2.
Концентрационные пределы распространения пламени при заданных условиях рассчитываются по формулам:
и — концентрационные пределы распространения пламени при стандартных условиях (Р = 101325 Па, Т = 298 К);
и — концентрационные пределы распространения пламени при заданной температуре Т;
1550 К и 1110 К — температура горения соответственно на нижнем и верхнем концентрационных пределах распространения пламени.
Рассчитываем КПР при температуре 298 К.
Для расчета выбираем из табл. 2 Приложения 2: a = 8.64, b = 4.679.
Для расчета при b > 7.5 a = 0.768, b = 6.554.
Рассчитываем КПР при температуре Т = 273,15 + 45 = 318,15 К.
Рассчитываем КПР при температуре Т = 273,15 + 65 = 338,15 К.
Строим графики зависимостей КПР от температуры.
Из графика делаем вывод, что с увеличением температуры НКПР толуола незначительно уменьшается, ВКПР – сильно возрастает. Изменение ВКПР приблизительно в 10 раз превышает изменение НКПР. Таким образом, с ростом температуры область воспламенения паров толуола расширяется.
12. Рассчитываем концентрационные пределы распространения пламени толуола в граммах на кубометр (j / н или j / в):
, г/м 3
Vt – объем занимаемый 1 кмоль газа при заданной температуре и давлении, м 3 /кмоль;
М – молярная масса, кг/кмоль.
Определяем мольный объем паров толуола при заданных температурах:
При Т = 298.15 К
При Т = 318.15 К
При Т = 338.15 К
Рассчитываем КПР паров толуола при заданных температурах:
При Т = 298.15 К г/м 3 ; (г/м 3 )
При Т = 318.15 К г/м 3 ; (г/м 3 )
При Т = 338.15 К г/м 3 ; (г/м 3 )
13. Определяем температурные пределы распространения пламени по уравнению Антуана:
,
tН(В) – нижний (верхний) температурные пределы распространения пламени;
— давление насыщенного пара на нижнем (верхнем) температурном пределе распространения пламени, мм.рт.ст.;
А, В, С – константы, определяемые по таблице 10 Приложения 2.
Определяем давление насыщенного пара на нижнем и верхнем температурных пределах распространения пламени по формуле:
Из табл. 10 приложения 2 находим значения констант А, В и С для толуола:
А = 6,95508, В = 1345,087, С = 219,516
Подставляем значения в уравнение Антуана и определяем температурные пределы распространения пламени:
Справочные значения tн = 6 о С, tв = 37 о С [4].
14. Рассчитываем низшую теплоту сгорания толуола, используя следствие из закона Гесса.
Qн = [S(ni× )ПГ — S(nj× )ГВ], кДж/моль.
Здесь ni×и — число молей и стандартные энтальпии образования компонентов продуктов горения (ПГ), nj и — число молей и стандартные энтальпии образования компонентов горючей смеси (ГВ).
По уравнению реакции находим, что при сгорании 1 моль толуола выделяется 7 моль углекислого газа и 4 моль воды:
, ,
Определяем по табл. 3 приложения 2 значения стандартных теплот образования горючего вещества и продуктов горения, учитывая при этом, что теплоты образования простых веществ (О2, N2) равны нулю.
Df = 50,02 кДж/моль;
Df = -393,65 кДж/моль;
Df = -241,91 кДж/моль
Следует иметь в виду, что существует две шкалы тепловых эффектов. В термодинамической шкале экзотермическому процессу соответствует знак минус, эндотермическому – знак плюс. В термохимической шкале знаки изменяются на противоположные. В справочной литературе используется в основном термодинамическая шкала. Однако для расчетов в курсе «Теории горения и взрыва» применяют термохимическую шкалу. Поэтому значения стандартных энтальпий образования веществ нужно подставлять в уравнение с обратным знаком.
Qн = = 7×393,65 + 4×241,91 – 1∙(-50,02) = 3773,21 (кДж/моль)
15. Рассчитываем максимальное давление взрыва паров толуола при заданных условиях по формуле:
Рн – давление паровоздушной смеси до взрыва, Па;
ТВЗР – температура взрыва, К;
Тн — температура паровоздушной смеси до взрыва, К;
Snпг — число моль продуктов горения, моль;
Sncм — число моль исходной газовоздушной смеси, моль.
По уравнению реакции горения определяем число моль газов в горючей смеси до взрыва и число моль продуктов горения.
Sncм = = 1 + 9 + 9∙3,76 = 43,84 моль
ånп.г= =7 + 4 + 33,84 + 2,7 + 10,2=57,74 (моль)
Переводим начальную температуру и температуру взрыва из шкалы Цельсия в шкалу Кельвина:
Тн = 273 + 23 = 296 К
ТВЗР = 273 + 2678 = 2951 К
Рассчитываем давление взрыва паров толуола при заданных условиях.
16. Рассчитываем тротиловый эквивалент возможного аварийного взрыва паров толуола при взрыве в технологическом оборудовании по формуле:
QН — низшая теплота сгорания взрывчатого вещества, Дж/кг;
mВВ – масса горючего вещества в смеси, кг;
4520×10 3 – низшая теплота сгорания тринитротолуола (ТНТ, тротил), Дж/кг.
Согласно расчету, проведенному в п.14, низшая теплота сгорания толуола равна Qн = 3773,21 кДж/моль. Переводим ее в кДж/кг, разделив на молярную массу (92∙10 -3 кг/моль):
Рассчитываем тротиловый эквивалент возможного аварийного взрыва при взрыве в технологическом оборудовании:
(кг тротила)
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
http://megaobuchalka.ru/7/36497.html
При решении практически всех задач по
дисциплине «Теория горения и взрыва»
необходимо составить уравнение реакции
горения. Поэтому очень важно научиться
делать это правильно. Изучите изложенные
ниже правила составления уравнений
реакции горения, разберите примеры.
Правило № 1. В левой части уравнения
записываем горючее вещество и окислитель
[воздух в виде (O2 + 3,76N2)].
Правило № 2. В правой части уравнения
записываем продукты реакции горения,
учитывая, что:
углерод (С), содержащийся в горючем
веществе, превращается в CO2,
сера (S), содержащаяся
в горючем веществе, превращается в SO2,
фосфор (Р), содержащийся в горючем
веществе, превращается в P2O5,
водород (Н), содержащийся в горючем
веществе, превращается в H2O,
хлор (Cl), содержащийся
в горючем веществе, превращается в HCl,
фтор (F), содержащийся
в горючем веществе, превращается в HF,
бром (Br), содержащийся
в горючем веществе, превращается в HBr,
йод (I), содержащийся
в горючем веществе, превращается в HI,
кислород (О), содержащийся в горючем
веществе, входит в состав образующихся
оксидов (CO2,
SO2,
H2O)
как и кислород воздуха.
азот (N), при температуре
горения ниже 2000 оС не вступает в
реакцию. Поскольку, в условиях реального
пожара температура не превышает значения
1500 – 1600 оС, то принимают, что азот
выделяется в свободном виде (N2).
Следовательно 3,76 молей N2
из воздуха переходят в неизменном виде
в продукты горения.
Если горючее вещество содержит другие
элементы, то они переходят в высшие
оксиды, как указанные выше углерод,
водород и фосфор.
Правило
№ 3. Атомы
кислорода, входящие в состав молекул
горючего вещества (например, C2H6OS
— 2-тиолэтанол), участвуют в реакции
горения в качестве окислителя, как
кислород воздуха.
Правило № 4. Уравниваем реакцию
горения для того, чтобы в исходных
веществах (левая часть уравнения) и
получившихся из них продуктах реакции
(правая часть уравнения) содержалось
одинаковое количество атомов данного
вида. При подсчете количества атомов
данного вида стехиометрические
коэффициенты и индексы, указывающие
количество атомов в молекуле, перемножаются.
Рекомендуется придерживаться следующей
последовательности действий.
Перед формулой горючего вещества всегда
ставится коэффициент 1, так как все
расчеты ведут на 1 моль горючего вещества;
Перед формулой углекислого газа ставится
коэффициент равный количеству атомов
углерода в молекуле горючего вещества.
Уравниваются атомы элементов, входящих
в состав молекул горючего вещества, за
исключением Н, О и N.
Уравниваются атомы водорода, учитывая
их содержание в молекулах галогеноуглеводородов
и воды.
Уравниваются атомы кислорода, рассчитав
их количество в правой части уравнения
и учитывая атомы кислорода, содержащиеся
в молекуле горючего вещества.
Коэффициент, поставленный перед молекулой
кислорода, переносим в правую часть
уравнения и ставим перед 3,76N2.
Уравниваем атомы азота, содержащиеся
в молекуле горючего вещества.
Рассмотрим несколько примеров составления
реакций горения веществ в воздухе, в
которых использованы описанные выше
правила.
Пример
1. Составить
уравнение реакции горения С6Н4N2О4
в воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
С6Н4N2О4
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
С6Н4N2О4
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ N2
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду, кислород
вошел в состав воды и углекислого газа,
азот выделился в свободном виде — N2.
Азот, содержащийся в воздухе, также не
участвует в реакции горения и выделяется
в неизменном виде – 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ N2
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 6, равный количеству
атомов углерода в молекуле горючего
вещества:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ N2
+ 3,76 N2
в) Уравниваем элементы, входящие в состав
молекулы горючего вещества, за исключением
Н и О. В данном случае уравниваем атомы
азота. В состав горючего вещества входят
два атома азота. В составе выделившейся
молекулы азота тоже два атома, поэтому
перед молекулой азота в продуктах
реакции ставим коэффициент 1:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ 1N2
+ 3,76 N2
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества четыре атома
водорода. В состав молекулы воды входит
только два атома. Следовательно, перед
формулой воды ставим коэффициент 2:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ 6СО2
+ 2Н2О
+ 1N2
+ 3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе шести молекул углекислого
газа: 6 ∙ 2 = 12;
в составе двух молекул воды: 2 ∙ 1 = 2;
итого: 12 + 2 = 14 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества имеется 4 атома
кислорода. Вычитаем это число из
количества атомов кислорода в правой
части уравнения (14 – 4 = 10). Затем делим
полученное число на 2 (количество атомов
водорода в Н2О) (10/2 = 5) и ставим
полученный коэффициент перед воздухом:
1С6Н4N2О4
+ 5(О2
+ 3,76 N2)
→ 6СО2
+ 2Н2О
+ 1N2
+ 3,76 N2
е) коэффициент 5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1С6Н4N2О4
+ 5(О2
+ 3,76 N2)
→ 6СО2
+ 2Н2О
+ 1N2
+ 5
∙ 3,76
N2
Чтобы
убедиться в правильности составленного
уравнения реакции горения, рассчитаем
количество одинаковых атомов в его
правой и левой частях:
С
– слева 6, справа 6 ∙
1 = 6;
Н
– слева 4, справа 2 ∙ 2 = 4;
N
– слева: в горючем веществе 2, в воздухе
5∙ 3,76 = 18,8, итого 20,8;
справа
2 + 5∙ 3,76 = 20,8;
О
— слева: в горючем веществе 4, в воздухе
5 ∙ 2 = 10, итого 14;
справа:
в углекислом газе 6 ∙ 2 = 12, в воде 2 ∙ 1 =
2, итого 14.
Вывод:
уравнение реакции горения составлено
верно.
Пример
2. Составить
уравнение реакции горения пара-дихлорбензола
С4Н4Сl2
в воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
С4Н4Сl2
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
С4Н4Сl2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ HCl
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду, хлор
превратился в хлороводород. Азот,
содержащийся в воздухе, не участвует в
реакции горения и выделяется в неизменном
виде – 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1
С4Н4Сl2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ HCl
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 4, равный количеству
атомов углерода в молекуле горючего
вещества:
1С4Н4Сl2
+ (О2
+ 3,76 N2)
→ 4СО2
+ Н2О
+ HCl
+ 3,76 N2
в) Уравниваем элементы, входящие в состав
горючего вещества, за исключением Н и
О. В данном случае уравниваем атомы
хлора. В состав горючего вещества входят
два атома хлора. В составе выделившейся
молекулы хлороводорода один атом Cl,
поэтому перед молекулой хлороводорода
в продуктах реакции ставим коэффициент
2:
1С4Н4Сl2
+ (О2
+ 3,76 N2)
→ 4СО2
+ Н2О
+ 2HCl
+ 3,76 N2
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества четыре атома
водорода. Из них два атома водорода уже
вошли в состав двух молекул хлороводорода.
Оставшиеся два атома Н перейдут в состав
молекулы Н2О. Следовательно, перед
молекулой воды ставим коэффициент 1:
1С4Н4Сl2
+ (О2
+ 3,76 N2)
→ 4СО2
+ 1Н2О
+ 2HCl
+ 3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе четыре молекул углекислого
газа: 4 ∙ 2 = 8;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 8 + 1 = 9 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества нет атомов кислорода.
Следовательно, делим количество атомов
кислорода в правой части уравнения на
2 (9 /2 = 4,5) и ставим полученный коэффициент
перед воздухом:
1С4Н4Сl2
+ 4,5(О2
+ 3,76 N2)
→ 4СО2
+ 1Н2О
+ 2HCl
+ 3,76 N2
е) коэффициент 4,5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1С4Н4Сl2
+ 4,5(О2
+ 3,76 N2)
→ 4СО2
+ 1Н2О
+ 2HCl
+ 4,5
∙ 3,76 N2
Пример
3. Составить
уравнение реакции горения ацетилена
С2Н2
в
воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
С2Н2
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
С2Н2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду. Азот,
содержащийся в воздухе, не участвует в
реакции горения и выделяется в неизменном
виде – 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1
С2Н2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 2, равный количеству
атомов углерода в молекуле ацетилена:
1
С2Н2
+ (О2
+ 3,76 N2)
→ 2СО2
+ Н2О
+ 3,76 N2
в)
Уравниваем элементы, входящие в состав
горючего вещества, за исключением Н и
О. В данном случае таких элементов нет.
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества — два атома
водорода. В состав молекулы воды входит
также два атома водорода. Следовательно,
перед молекулой воды ставим коэффициент
1:
1
С2Н2
+ (О2
+ 3,76 N2)
→ 2СО2
+ 1Н2О
+
3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе двух молекул углекислого
газа: 2 ∙ 2 = 4;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 4 + 1 = 5 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества нет атомов кислорода,
следовательно, делим количество атомов
кислорода в правой части уравнения на
2 (5/2 = 2,5) и ставим данный коэффициент
перед воздухом:
1
С2Н2
+ 2,5(О2
+ 3,76 N2)
→ 2СО2
+ 1Н2О
+ 3,76 N2
е) коэффициент 2,5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1
С2Н2
+ 2,5(О2
+ 3,76 N2)
→ 2СО2
+ 1Н2О
+ 2,5
∙ 3,76 N2
Пример
4. Составить
уравнение реакции горения C6Н8SО3
в воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
C6Н8SО3
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
C6Н8SО3
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ SO2
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду, кислород
вошел в состав воды и углекислого газа,
сера образовала оксид SO2.
Азот воздуха не участвует в реакции
горения и выделяется в неизменном виде
– 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ SO2
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 6, равный количеству
атомов углерода в молекуле горючего
вещества:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ SO2
+ 3,76 N2
в)
Уравниваем элементы, входящие в состав
горючего вещества, за исключением Н и
О. В данном случае уравниваем атомы
серы. В состав молекулы горючего вещества
входит один атом серы. В составе
выделившейся молекулы SO2
тоже один
атом, поэтому перед молекулой SO2
в продуктах реакции ставим коэффициент
1:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ 1SO2
+ 3,76 N2
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества восемь
атомов водорода, а в состав молекулы
воды входит только два атома. Следовательно,
перед молекулой воды ставим коэффициент
4:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ 6СО2
+ 4Н2О
+ 1SO2
+ 3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе шести молекул углекислого
газа: 6 ∙ 2 = 12;
в составе четырех молекул воды: 4 ∙ 1 =
4;
в составе одной молекулы оксида серы:
1∙ 2 = 2
итого: 12 + 4 + 2 = 18 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества имеется 3 атома
кислорода. Вычитаем это число из
количества атомов кислорода в правой
части уравнения (18 – 3 = 15). Делим полученное
число на 2 (15 /2 = 7,5) и ставим данный
коэффициент перед воздухом:
1
C6Н8SО3
+ 7,5(О2
+ 3,76 N2)
→ 6СО2
+ 4Н2О
+ 1SO2
+ 3,76 N2
е) коэффициент 7,5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1
C6Н8SО3
+ 7,5(О2
+ 3,76 N2)
→ 6СО2
+ 4Н2О
+ 1SO2
+7,5
∙ 3,76 N2.
Многообразие реакций горения не
исчерпывается рассмотренными в данном
разделе примерами. Однако, используя
описанные правила, можно самостоятельно
составить реакцию горения многих других
горючих веществ. Написание уравнений
реакций горения является важной составной
частью при решении многих задач в курсе
«Теория горения и взрыва».
Правило № 1.
В левой части уравнения записываем горючее вещество и воздух в виде:
Правило № 2.
В правой части уравнения записываем продукты реакции горения, учитывая, что:
Правило № 3.
Уравниваем реакцию горения для того, чтобы в исходных веществах и получившихся из них продуктах реакции содержалось одинаковое количество одинаковых атомов. При этом коэффициенты и индексы перемножаются:
Правило № 4.
Кислород, входящий в состав горючего вещества, например,
участвует в реакции горения, как и кислород воздуха, в качестве окислителя.
- Учебники
- 8 класс
- Химия 👍
- Габриелян
- №4
авторы: Габриелян, Сладков, Остроумов.
издательство: «Просвещение»
Раздел:
- ГЛАВА 1. Первоначальные химические понятия
- ГЛАВА 2. Важнейшие представители неорганических веществ. Количественные отношения в химии
- §13. Кислород
- Часть II
Запишите уравнения реакций горения сложных веществв:
а) сероводорода $H_{2}S$
б) серокглерода $CS_{2}$
в) этана $C_{2}H_{6}$
г) ацетилена $C_{2}H_{2}$
reshalka.com
ГДЗ Химия 8 класс рабочая тетрадь Габриелян. §13. Часть II. Номер №4
Решение а
$2H_{2}S + 2O_{2} = SO_{2} + 2H_{2}O$
Решение б
$CS_{2} + 3O_{2} = 2SO_{2} + CO_{2}$
Решение в
$2C_{2}H_{6} + 7O_{2} = 4CO_{2} + 6H_{2}O$
Решение г
$2C_{2}H_{2} + 5O_{2} = 4CO_{2} + 2H_{2}O$
- Предыдущее
- Следующее
Нашли ошибку?
Если Вы нашли ошибку, неточность или просто не согласны с ответом, пожалуйста сообщите нам об этом
Описание презентации по отдельным слайдам:
-
-
2 слайд
Мемориал славы в г.Братске.
-
3 слайд
Олимпийский огонь
-
-
5 слайд
Горение — реакция окисления, протекающая с достаточно большой скоростью, сопровождающаяся выделением тепла и света.
-
6 слайд
Взаимодействие простых и сложных веществ с кислородом относится к реакциям окисления.
-
-
-
-
10 слайд
Оксиды – это вещества, состоящие из двух элементов, одним из которых является кислород.
-
11 слайд
Медленное окисление
-
12 слайд
сера + кислород → оксид серы
S + O2 = SO2фосфор + кислород→оксид фосфора
4Р + 5O2 = 2Р2O5 -
13 слайд
2NaNO3 = 2NaNO2 + O2↑
С + О2 = СО2
-
14 слайд
t
2KMnO4 = K2MnO4 + MnO2 + O2↑
S + O2 = SO2 -
-
16 слайд
Условия возникновения
горения:
1. Горючее вещество
2. Кислород (окислитель)
3.Нагревание горючего вещества до температуры воспламенения -
-
18 слайд
Реакции горения сложных веществ
Cu2S + 2O2 = 2CuO + SO2
СН4 + 2O2 = СO2+ 2Н2O -
19 слайд
Горение парафина
-
20 слайд
Стадии горения:
Испарение,
газификация вещества.
2. Разложение вещества.
3. Окисление вещества.