Межмолекулярные взаимодействия
Рассмотрим взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не образуются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
- фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота),
- вода H2O (пар, лед, жидкая вода):
- раствор аммиака и органических аминов — между молекулами аммиака и воды;
- органические соединения, в которых есть связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью.
Особым видом химической связи является водородная связь.
Водородная связь — это взаимодействие, возникающее между положительно заряженным атомом водорода и намного более электроотрицательным атомом, чаще всего кислорода, азота или фтора.
Это взаимодействие в несколько раз сильнее межмолекулярных сил, но в десять — пятнадцать раз слабее ковалентной связи.
Водородная связь образуется за счёт электростатического притяжения заряженных атомов, а также некоторый вклад в её возникновение вносит донорно-акцепторное взаимодействие. Из-за поляризации у атома водорода частично освобождается электронная орбиталь, а в атомах фтора, кислорода и азота есть пары электронов. Атом водорода выступает акцептором электронов, атом другого неметалла — их донором.
Водородная связь бывает межмолекулярной (в воде, аммиаке, фтороводороде, спиртах, карбоновых кислотах), а также внутримолекулярной (в многоатомных спиртах, белках, нуклеиновых кислотах).
Рис. (1). Примеры образования межмолекулярных водородных связей
Водородная связь значительно повышает температуры кипения и плавления веществ, а также их взаимную растворимость.
Рассмотрим влияние водородной связи на температуры кипения водородных соединений неметаллов (IV)–(VII) групп.
Рис. (2). Температуры кипения водородных соединений
Температуры кипения зависят от молекулярных масс веществ и должны возрастать в каждом ряду. Но для воды, аммиака и фтороводорода эти значения температур не подчиняются общей закономерности. Причина такого явления — возникновение водородной связи.
Водородная связь образуется не только между одинаковыми молекулами, но и между разными. Например, такая связь возникает между молекулами спиртов и воды, что обуславливает их способность смешиваться друг с другом. Так, метанол, этанол, пропанол, этиленгликоль, глицерин растворяются в воде неограниченно благодаря образованию водородных связей.
Рис. (3). Водородная связь между метанолом и водой
Значение водородных связей
Водородные связи широко встречаются в природе и оказывают значительное влияние на свойства веществ. Они значительно повышают температуры плавления и кипения веществ, влияют на их растворимость в воде.
Благодаря образованию водородных связей вода, метанол, этанол, уксусная кислота и многие другие вещества при обычных условиях находятся в жидком состоянии.
Водородные связи обуславливают вторичную (спиралевидную) структуру белков, а также соединяют две комплементарные цепи ДНК в единое целое.
Рис. (4). Водородные связи в молекуле ДНК
Источники:
Рис. 1. Примеры образования межмолекулярных водородных связей, https://www.shutterstock.com/ru/image-vector/chemistry-hydrogen-bond-fluorine-oxygen-nitrogen-1446160808, дата обращения: 24.08.2022.
Рис. 2. Температуры кипения водородных соединений, https://www.shutterstock.com/image-vector/effect-hidrogen-bonding-on-boiling-point-2090523175, дата обращения: 24.08.2022.
Рис. 3. Водородная связь между метанолом и водой, примеры образования водородной связи, https://www.shutterstock.com/ru/image-vector/chemistry-hydrogen-bond-fluorine-oxygen-nitrogen-1446160808, дата обращения: 24.08.2022.
Рис. 4. Водородные связи в молекуле ДНК. © ЯКласс.
Водородная химическая связь

4.5
Средняя оценка: 4.5
Всего получено оценок: 1334.
4.5
Средняя оценка: 4.5
Всего получено оценок: 1334.
Между атомами водорода и атомом элемента, обладающим высокой электроотрицательностью, возникает особый тип связи – водородная химическая связь. Она может образовываться не только внутри молекулы, но и между соседними молекулами.
Общее описание
Электроотрицательность – способность атома удерживать валентные электроны на внешнем энергетическом уровне или количественная характеристика, показывающая, с какой силой притягиваются электроны к ядру атома. Наиболее электроотрицательными элементами являются фтор, азот и кислород.
Сильное электростатическое взаимодействие между атомом водорода и электроотрицательными атомами обуславливается небольшими размерами атома водорода и силой притяжения атомов элементов. В результате возникает частный случай ковалентной полярной связи. Примерами водородной химической связи являются:
- плавиковая кислота (HF);
- вода (H2O);
- аммиак (NH3);
- соляная кислота (HCl);
- сероводород (H2S).
Наличие водородной связи обуславливает физические и химические свойства вещества. В частности определяет температуру плавления, кипения, растворимость, кислотность.
Особенностью связи является её невысокая прочность и распространённость, особенно в органических веществах.
Типы
Водородная связь бывают двух типов:
- межмолекулярная, возникающая между несколькими однотипными молекулами;
- внутримолекулярная, возникающая внутри одной молекулы.
Способ образования связи в обоих типах одинаковый. Разница только в том, что с помощью межмолекулярной водородной связи образуются цепочка молекул, а при внутримолекулярной связи водород «сцепляется» с атомами внутри молекулы.
Например, молекула воды образована одним атомом кислорода и двумя атомами водорода. За счёт высокой электроотрицательности кислород, на внешнем энергетическом уровне которого шесть электронов, притягивает единственные электроны двух атомов водорода. Две пары электронов кислорода остаются свободными. При этом у водорода освобождается орбиталь. Другая аналогичная молекула может присоединиться в месте свободных электронных пар атома кислорода, заполнив освободившуюся орбиталь водорода. Возникает межмолекулярная водородная связь.
Аналогичным образом соединяются молекулы плавиковой кислоты и аммиака. Однако связь между азотом и водородом будет слабее, чем между водородом и кислородом. Также молекулы плавиковой кислоты сильнее притягиваются друг к другу, чем молекулы воды. Это объясняется величиной электроотрицательности.
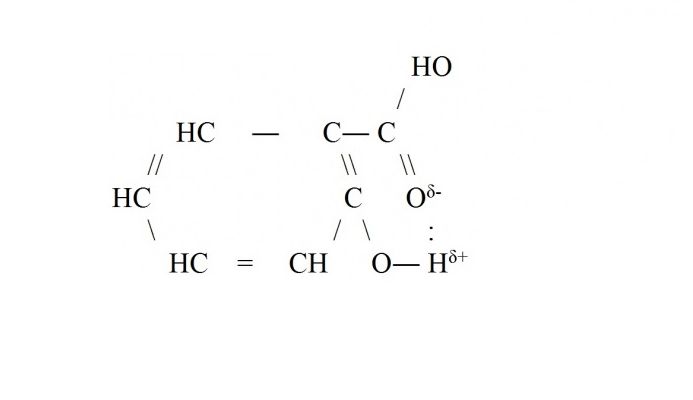
Внутримолекулярная водородная связь чаще всего возникает внутри сложных молекул органических веществ – белков, ДНК, аренов. Например, водородная связь образуется в молекуле салициловой кислоты между атомом водорода гидроксильной группы и кислорода, входящего в функциональную группу -СООН.
Водородные связи графически изображаются точками.
Что мы узнали?
Между атомами водорода и атомами неметаллов возникает водородная связь, основанная на электростатическом взаимодействии атомов. Это частный случай ковалентной полярной связи, характеризующийся взаимодействием водорода и атомов с высокой электроотрицательностью. Связь бывает двух типов: межмолекулярная, возникающая между молекулами вещества, и внутримолекулярная, возникающая между водородом и атомом другого элемента в одной молекуле. Водородная связь присуща неорганическим и органическим веществам.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Ирина Гребнева
5/5
-
Ирина Волкова
5/5
-
Ольга Борзенко
5/5
-
Самир Сулхаев
5/5
-
Елена Сорокина
5/5
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 1334.
А какая ваша оценка?
…
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее.
Образование водородной связи
При возникновении подходящих условий водородная связь возникает самопроизвольно.
Какие же условия приводят к возникновению водородной связи?
Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия.
На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
Так, для гидридов элементов 6 группы наблюдается последовательное увеличение температур кипения и плавления с увеличением молекулярной массы (номера периода), но из этой закономерности выпадает вода.
В 5 группе аномально высокие температуры кипения и плавления наблюдаются у аммиака NH3, а в 7 группе – у HF, по сравнению с гидридами элементов соответствующих групп.
Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения и плавления?
Это связано с присутствием в воде, аммиаке и фтороводороде водородных связей.
Водородная связь — это внутри- или межмолекулярная связь, которая образуется с соединениях между атомами водорода и атомами, имеющими большую электроотрицательность (N, O, F).
Механизм образования водородной связи, вследствие электростатического притяжения атомов — электростатический. Но частично он также носит донорно–акцепторный характер.
Образуемые соединения имеют большую полярность, возникает диполь. Атом водорода находится на положительном конце диполя. Этот диполь может взаимодействовать с неподеленной электронной парой кислорода (и азота, и фтора), который принадлежит другой или этой же молекуле. Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Графически, на рисунках, водородная связь обозначается тремя точками:
Виды водородной связи
- Межмолекулярная водородная связь образуется между различными молекулами веществ. Обязательным условием образования такого вида водородной связи — это наличие водорода в одной молекуле и одного из элементов с высокой электроотрицательностью в другой молекуле (например, F, O, N, Cl, S). Связь может возникать как между одинаковыми молекулами, так и между разными. Например, это могут быть молекулы аммиака, воды, фтороводорода, спиртов (например, метанол, этанол), карбоновых кислот (например, муравьиная, уксусная кислоты), аминокислот в молекуле белка:
- Внутримолекулярная водородная связь образуется внутри одной молекулы. Условие образования внутримолекулярной водородной связи — это наличие в одной молекуле и атомов водорода и атомы с высокой электроотрицательностью. Такая связь может возникнуть, например, у многоатомных спиртов (этиленгликоль, глицерин), белков, углеводов, оксикислот (салициловая кислота) и других органических соединений:
Характеристика водородной связи
Водородная связь характеризуется
- Направленностью в пространстве и насыщаемостью.
- Водородная связь оказывает большое влияние на свойства многих веществ, особенно в биологических системах. Например, водородная связь определяет довольно некомпактную упаковку молекул воды во льду, поэтому плотность льда меньше плотности жидкой воды. Наличие водородной связи в веществах способствует аномальному росту их температур кипения и плавления.
- Водородная связь — слабая связь. Величина энергии водородной связи обычно лежит в пределах от 4 до 25 кДж/моль, это всего несколько процентов от величины энергии обычной химической связи. Теперь предположим, что водородная связь возникает в результате электростатического взаимодействия между диполем связи X-H и неподеленной электронной порой на атоме Y. Тогда прочность водородной связи увеличивается в ряду:
N-H···Y ˂ O-H···Y ˂ F-H···Y
Т.е., связь тем прочнее, чем меньше размер атома с неподеленными парами — N, O, F и больше его электроотрицательность. Среди них более прочную водородную связь образует тот, неподеленная электронная пара которого менее сильно притягивается к своему ядру.
Водородная связь
– особый тип
межмолекулярного взаимодействия. Атомы
водорода, которые ковалентно связаны
с атомом элемента, имеющего высокое
значение электроотрицательности (чаще
всего F,
O, N, а также Cl, S
и C),
несут на себе относительно высокий
эффективный заряд. Вследствие этого
такие атомы водорода могут электростатически
взаимодействовать с атомами указанных
элементов. Так, атом Н+
одной молекулы воды ориентируется и
соответственно взамодействует (что
показано тремя точками) с атомом О—
другой молекулы воды:
В твердой воде (лед)
каждый атом О тетраэдрически окружен
четырьмя атомами Н (два их них связаны
ковалентно, два других – электростатически);
получается соответствующая кристаллическая
решетка льда. В жидкой воде практически
отсутствуют свободные молекулы Н2О,
которые за счет электростатического
взаимодействия указанного типа
объединяются в агрегаты.
Связи, образуемые
атомом Н, находящимся между двумя атомами
электроотрицательных элементов,
называются водородными:
-
+
-
А
—
Н
В
Энергия
водородной связи значительно меньше
энергии обычной ковалентной связи (150
– 400 кДж/моль). Для соединений фтора она
достигает порядка 40 кДж/моль. Однако
этой энергии достаточно, чтобы вызвать
ассоциацию молекул соответствующих
соединений в жидком состоянии, например,
в жидком фтороводороде НF
(рис. 26).
Рис.
26.
Агрегация молекул НF
за счет водородных связей
Длина
водородной связи также меньше длины
ковалентной связи. Так в полимере (HF)n
длина связи
F — H = 0,092 нм, а связи F∙∙∙H = 0,14 нм. У воды
длина связи O — H = 0,096 нм, а связи O ∙∙∙
H = 0,177нм.
Образование
межмолекулярных водородных связей
приводит к существенному изменению
свойств веществ: повышению вязкости,
диэлектрической постоянной, температур
кипения и плавления.
2.7. Поляризация связи и дипольный момент
Электронная
плотность в молекулах распределяется
в зависимости от электроотрицательности
(ЭО) атомов, образующих молекулу.
Симметричное расположение зоны повышенной
электронной плотности можно объяснить
тем, что одинаковые атомы в молекуле,
обладающие одной и той же
электроотрицательностью, в равной
степени действуют на электронную
плотность и она располагается симметрично
относительно ядер двух атомов. Атомы,
имеющие разные значения электроотрицательности,
различно влияют на электронную плотность,
и
при этом она смещается из симметричного
положения ближе к тому атому, у которого
ЭО больше.
Смещение
электронной плотности к атому с большей
ЭО получило название поляризации.
Молекулы,
образованные атомами, имеющими одинаковую
ЭО, являются электросимметричными, т.е.
у них “центры тяжестей” положительных
и отрицательных зарядов совпадают.
Такие молекулы получили название
ковалентных неполярных (например,
H2,
Cl2)
,
а
связь в
них
называется
ковалентной неполярной связью.
Молекулы,
в которых имеет место поляризация,
характеризуются электрической
асимметрией, у таких молекул “центры
тяжести” положительных и отрицательных
зарядов не совпадают.
По
этой причине распределение электронной
плотности вдоль связи асимметрично, а
следовательно, атом более электроотрицательного
элемента приобретает отрицательный
эффективный заряд
(обозначение
),
а атом-партнер –положительный
эффективный заряд (обозначение
).
Ковалентные
связи между атомами, несущими некоторый
эффективный заряд, называются полярными
ковалентными связями,
а молекулы — ковалентно-полярными.
Пример.
В молекуле HCl
распределение электронной плотности
вдоль связи H – Cl таково, что электрический
“центр
тяжести”
отрицательного заряда смещен к атому
Cl, а “центр
тяжести”
положительного заряда – к атому Н. В
результате на атомах хлора и водорода
возникают эффективные заряды Н—
Cl.
Полярные
молекулы
являются
диполями, т.е.
системами,
состоящими из двух равных по величине
и противоположных по знаку зарядов,
находящихся на некотором расстоянии
один от другого.
Полярной
является молекула воды Н2О.
Расстояние
между центрами положительного и
отрицательного зарядов называется
длиной
диполя
.Полярность
молекулы характерзуется величиной ее
дипольного
момента
,
который
равен векторной сумме дипольных моментов
связей, имеющихся в молекуле.
Дипольный момент связи равен
произведение длины диполя
на величину электрического заряда
:
.
Длина диполя имеет значение порядка
диаметра атома, т.е. 10—8см, а величина заряда электрона 1,6 •
10-19Кл. Дипольный момент выражают
в дебаях и обозначают буквой
D. В системе единиц
СИ дипольный момент измеряется в кулон
— метрах (Кл∙м):
1D
= 3,3∙10-30
Кл·м.
Например, в ряду галогеноводородов с
уменьшением разности ЭО атомов, образующих
молекулу, дипольный момент убывает:
-
HCl
HBr
HI
=
1,04=0,79
=0,39
Дипольный момент двухатомных молекул
равен дипольному моменту связи. Если
связь неполярная, то и молекула неполярна.
В многоатомных молекулах дипольный
момент молекулы равен векторной сумме
дипольных моментов отдельных связей.
Например, молекула СО2(О—= С+=
О—) —
неполярна, хотя связи С = О полярны, так
как О ← С → О и суммарный дипольный
момент молекулы равен нулю.
Молекула SO2
полярна,дипольный момент=
1,61D.
Полярность молекулы зависит
не только от наличия в ней полярных
связей, но и от геометрической формы
молекулы. В рассмотренных примерах
молекула СО2
имеет линейное строение, а молекула SO2
– угловое строение.