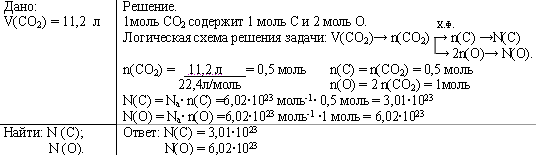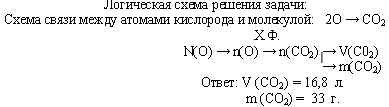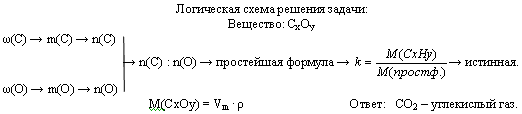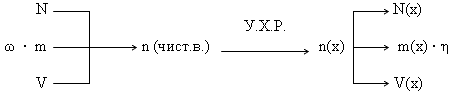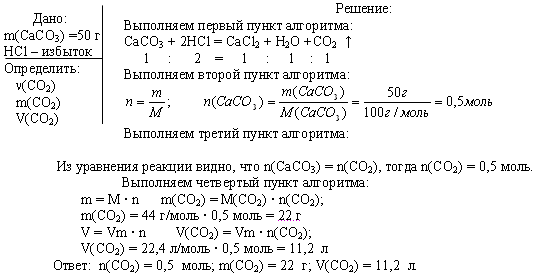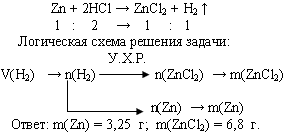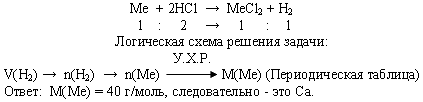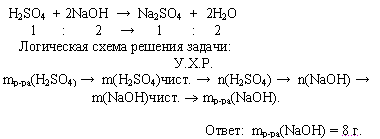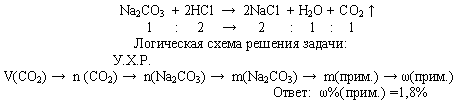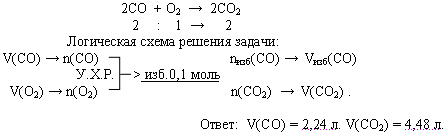ВНИМАНИЕ!!!
УЧАЩИЕСЯ 9 КЛАССОВ!!!
Для успешной сдачи экзамена по химии в некоторых билетах
вам необходимо будет решить задачу. Предлагаем вам рассмотреть, разобрать и
закрепить в памяти решение типовых задач по химии.
Задача на вычисление массовой доли вещества, находящегося в
растворе.
В 150 г воды растворили 50г фосфорной кислоты. Найдите
массовую долю кислоты в полученном растворе.
Записываем известные величины в условие задачи.
Дано: m(H2O) = 150г, m(H3PO4) =
50г
А так же записываем, что нам необходимо найти в результате
решения задачи.
Найти : w (H3PO4) — ?
Приступаем к решению задачи.
Решение: 1). Находим массу
получившегося раствора. Для этого просто сложим массу воды и массу прилитой к
ней фосфорной кислоты.
m(раствора) = 150г + 50 г = 200 г
2). Для решения нам необходимо знать формулу массовой доли.
Записываем формулу массовой доли вещества в растворе.
w (вещества) = * 100%
Подставляем в формулу массу фосфорной кислоты из условия
задачи и рассчитанную массу раствора. и производим математические подсчеты.
w (H3PO4) = * 100%= 25%
Записываем ответ.
Ответ: w (H3PO4) =25%
Задача на вычисление количества вещества одного из
продуктов реакции, если известна масса исходного вещества.
Вычислите количество вещества железа, которое получится в
результате взаимодействия водорода с 480г оксида железа(III).
Записываем известные величины в условие задачи.
Дано: m(Fe2O3) = 4
Так же записываем, что необходимо найти в результате
решения задачи.
Найти : n (Fe) — ?
Приступаем к решению задачи.
Решение: 1). Для решения
подобных задач сперва нужно записать уравнение реакции, описанной в условии
задачи.
Fe2O3 + 3 H2 2Fe + 3H2О
2). Затем запишем формулу количества вещества.
n = , где n- количество
вещества, m — масса этого вещества, а M — молярная масса вещества.
По условию задачи нам не известна масса получившегося железа,
т. е. в формуле количества вещества нам неизвестны две величины. Поэтому мы
будем искать количество вещества по количеству вещества оксида железа (III).
Количества вещества железа и оксида железа(III) следующим отношением.
=
;где 2-
стехиометрический коэффициент из уравнения реакции, стоящий перед железом, а 1
– коэффициент, стоящий перед оксидом железа(III).
отсюда n (Fe)= 2 n (Fe2O3)
3). Находим количество вещества оксида железа(III).
n (Fe2O3) = = 3 моль, где 480г –
масса оксида железа (III), 160 – молярная масса
оксида железа (III), которую мы вычисляем на основании относительных атомных
масс железа и кислорода, а также учитывая количество этих атомов в оксиде
железа (III): М(Fe2O3)= 2х 56 + 3х 16=112 + 48 = 160
4). Находим количество вещества железа, получившегося в ходе
реакции.
n (Fe) = 2 : 3 моль = 6 моль
Запишем ответ.
Ответ: n (Fe) = 6 моль
Задача на вычисление объема полученного газа, если известна
масса исходного вещества.
Какой объем водорода образуется при взаимодействии соляной
кислоты с 54 г алюминия?
Записываем условие задачи.
Дано: m(Al) = 54г
А так же записываем, что нам необходимо найти в результате
решения задачи.
Найти : V (H2) — ?
Приступаем к решению задачи.
Решение: 1) записываем уравнение
реакции по условию задачи.
2 Al + 6 HCl 2 AlCl3 +3 H2
2). Запишем формулу объема вещества.
V = Vm *n, где V – объем вещества, Vm — молярный объем газа
при нормальных условиях (н. у.) величина постоянная и равная 22, 4 *n — количество
вещества данного газа.
V (Н2) = Vm * n (Н2)
3). Но в этой формуле нам неизвестно количество вещества
водорода.
4). Найдем количество вещества водорода по количеству вещества
алюминия по следующему соотношению.
=
; отсюда n (H2) = 3 n
(Al): 2 , где 3 и 2 – стехиометрические коэффициенты, стоящие соответственно
перед водородом и алюминием.
5). Найдем количество вещества алюминия по формуле количества
вещества n =
n (Al) =
n (Al) = = 2 моль
6). А теперь высчитаем получившееся в ходе реакции количество
вещества водорода по формуле n (H2) = 3 n (Al).
n (H2) = 3 х 2= 6 моль
7). Найдем полученный объем водорода по формуле V (Н2) = Vm *
n (Н2)
V (Н2) =22, 4 * 6 моль= 134 ,4 л
Запишем ответ.
Ответ: V (Н2) =134 ,4 л
Задача на вычисление количества вещества (или объема) газа,
необходимого для реакции с определенным количеством вещества (или объемом)
другого газа.
Какое количество вещества кислорода потребуется для
взаимодействия с 8 моль водорода при нормальных условиях?
Запишем условия задачи.
Дано: n (H2) = 8моль
А так же запишем, что необходимо найти в результате решения
задачи.
Найти : n(O2) — ?
Приступаем к решению задачи.
Решение: 1). Запишем уравнение
реакции, следуя условию задачи.
2 H2 + О2 2 H2О
2). Количество вещества водорода и количество вещества
кислорода связывает следующее соотношение :
=
; где 2 и 1 –
стехиометрические коэффициенты, стоящие перед водородом и кислородом
соответственно в уравнении реакции.
3). Отсюда 2 n (O2)= n (H2)
А количество вещества кислорода равно : n (O2)= n (H2):2
4). Нам остается подставить в полученную формулу данные из
условия задачи.
n (О2) = 8моль :2 = 4 моль
5). Запишем ответ.
Ответ: n (О2) = 4 моль
Решение задач на расчёт по уравнению реакции.
Для выполнения расчётов по уравнениям химических реакций необходимо учитывать коэффициенты, стоящие перед формулами реагентов и продуктов реакции, т.к. они связаны с количествами реагирующих веществ: отношение количества вещества к коэффициенту перед его формулой в уравнении химической реакции одинаково для всех участников реакции.
Объём любого газа пропорционален количеству вещества, т.е. коэффициенты в уравнении реакции показывают соотношения объёмов реагирующих и образовавшихся газообразных веществ.
Количество вещества n можно выразить через массу вещества, объём газообразного вещества или число частиц вещества:
n = m/M, где m — масса вещества, М — молярная масса (численно равна относительной молекулярной массе);
n = V/Vm, где V — объём газообразного вещества, Vm — молярный объём (Vm =
22,4 л/моль);
n = N/Na, где N — число частиц вещества (молекул или атомов), Na -постоянная Авогадро.
Единицы измерения основных величин:
количество вещества n — моль
масса m — г
объём V — л.
Иногда в задачах вместо массы вещества указаны массы раствора и массовая доля растворённого вещества. Следовательно, необходимо найти массу растворённого вещества прежде, чем находить его количество:
m (в-ва) = m (р-ра) * w (в-ва).
Если в задаче вместо массы раствора известен его объём и плотность, то для нахождения массы раствора необходимо воспользоваться формулой:
m (р-ра) = V (р-ра) * p (р-ра).
Нахождение искомых величин:
m = n*M
V = n*Vm
N = n* Na
m (р-ра) = m (в-ва)/w(в-ва)
w (в-ва) = m (в-ва)/ m (р-ра).
Алгоритм решения расчётных задач:
1. Внимательно прочитайте условие задачи. Выпишите числовые данные с указанием соответствующих величин (масса, объём, количество вещества и т.п.).
2. Сформулируйте вопрос задачи (какую величину требуется найти).
3. Составьте уравнение реакции.
4. Выразите количество вещества, для которого имеются числовые данные в задаче, используя необходимые формулы, связывающие количество вещества n с массой, объёмом или числом частиц вещества.
5. Используя стехиометрические коэффициенты уравнения реакции, выразите количество искомого вещества через количество известного вещества.
6. Найдите искомую величину, используя полученное количество вещества.
7. Запишите полученный ответ.
Пример: Какая масса осадка образуется при взаимодействии избытка хлорида цинка с 160г раствора гидроксида натрия с массовой долей растворённого вещества 15%?
Дано:
m (р-ра NaOH)=160г
w (NaOH)= 15% или 0,15
Найти: m (Zn(OH)2)
Решение:
2NaOH + ZnCl2 = Zn(OH)2 + 2NaCl
1) m(NaOH)= m(р-ра NaOH)*w(NaOH) = 160г * 0,15 = 24г.
2) n(NaOH)= m(NaOH)/M(NaOH) = 24г/40г/моль = 0,6 моль.
3) n(Zn(OH)2) = 1/2*n(NaOH) = 0,6 моль*1/2 = 0,3 моль.
4) m(Zn(OH)2) = n(Zn(OH)2) * M(Zn(OH)2) = 0,3 моль * 99г/моль = 29,7г.
Ответ: m(Zn(OH)2)= 29,7г.
Последнее изменение: Воскресенье, 12 апреля 2015, 22:08
Алгоритм 1. Вычисление массу определённого количества вещества
Задание: Определить массу 5 моль воды (Н2О).
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Рассчитать молярную массу вещества, используя периодическую таблицу Д. И. Менделеева. Массы всех атомов округлять до единиц, хлора — до 35,5 |
M(H2O)=2⋅1+16=18 г/моль |
|
2. |
Найти массу воды по формуле: m=ν⋅M |
m(H2O) = 5 моль⋅18 г/моль=90 г |
|
3. |
Записать ответ |
Ответ: масса 5 моль воды равна 90 г |
|
Расчеты количества вещества |
Расчеты доли |
Расчеты выхода продукта реакции |
|
ν=m/M, ν=V/VM, ν=N/NA, ν=Q/F, ν=PV/RT |
ω=mч/mоб, ϕ=Vч/Vоб, χ=νч/νоб |
η = mпр./mтеор., η = Vпр./Vтеор., η = νпр./νтеор. |
|
ν-количество вещества (моль); νч— количество вещества частное (моль); νоб— количество вещества общее (моль); m- масса (г); mч — масса частная (г); mоб— масса общая (г); V — объём (л); VМ — объем 1 моль (л); Vч — объём частный (л); Vоб — объем общий (л); N — количество частиц (атомов, молекул, ионов); NA — число Авогадро (количество частиц в 1 моль вещества) NA =6,02⋅1023; Q — количество электричества (Кл); F — постоянная Фарадея (F ≈ 96500 Кл); Р — давление (Па) (1атм ≈105 Па); R — универсальная газовая постоянная R ≈ 8,31 Дж/(моль⋅К); Т — абсолютная температура (К); ω — массовая доля; ϕ — объёмная доля; χ — мольная доля; η — выход продукта реакции; mпр Vпр νпр — масса, объём, количество вещества практические; mтеор ,Vтеор., νтеор. — масса, объем, количество вещества теоретические. |
Алгоритм 2. Вычисление массовой доли растворенного вещества
Задание: Вычислить массовую долю соли (NaCl) в растворе, полученном при растворении в 475 г воды 25 г соли.
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Записать формулу для нахождения массовой доли. |
ω(%)=(mч/mоб)⋅100% |
|
2. |
Найти массу раствора. |
mр-ра= m(H2O) + m(NaCl) = 475 + 25 = 500 г |
|
3. |
Вычислить массовую долю, подставив значения в формулу. |
ω(NaCl) = (25/500)⋅100%=5% |
|
4. |
Записать ответ. |
Ответ: массовая доля NaCl составляет 5% |
Алгоритм 3. Расчет массы вещества в растворе по его массовой доле
Задание: Сколько граммов сахара и воды необходимо взять для получения 200 г 5 % раствора?
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Записать формулу для определения массовой доли растворённого вещества. |
ω=mч/mоб ⇒ mч=mоб⋅ω |
|
2. |
Вычислить массу соли. |
mсоли= 200⋅0,05=10 г |
|
3. |
Определить массу воды. |
m(H2O) = m(р-ра) — m(соли) = 200 — 10 = 190 г |
|
4. |
Записать ответ. |
Ответ: необходимо взять 10 г сахара и 190 г воды |
Алгоритм 4. Определение выхода продукта реакции в % от теоретически возможного
Задание: Вычислить выход нитрата аммония (NH4NO3) в % от теоретически возможного, если при пропускании 85 г аммиака (NH3) в раствор азотной кислоты (HNO3), было получено 380 г удобрения.
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Записать уравнение химической реакции и расставить коэффициенты |
NH3 + HNO3 = NH4NO3 |
|
2. |
Данные из условия задачи записать над уравнением реакции. |
m=85 г mпр. =380 г NH3 + HNO3 = NH4NO3 |
|
3. |
Под формулами веществ написать количество вещества согласно коэффициентам; произведение количества вещества на молярную массу вещества |
m=85 г m=380 г NH3 + HNO3 = NH4NO3 1моль 1 моль 1⋅17 г 1⋅80 г |
|
4. |
Практически полученная масса нитрата аммония известна (380 г). С целью определения теоретической массы нитрата аммония составить пропорцию |
85/17=х/380 |
|
5. |
Решить уравнение, определить х. |
х=400 г теоретическая масса нитрата аммония |
|
6. |
Определить выход продукта реакции (%), отнеся практическую массу к теоретической и умножить на 100% |
η=mпр./mтеор.=(380/400)⋅100%=95% |
|
7. |
Записать ответ. |
Ответ: выход нитрата аммония составил 95%. |
Алгоритм 5. Расчет массы продукта по известной массе реагента, содержащего определённую долю примесей
Задание: Вычислить массу оксида кальция (СаО), получившегося при обжиге 300 г известняка (СаСО3), содержащего 10 % примесей.
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Записать уравнение химической реакции, поставить коэффициенты. |
СаСО3 = СаО + СО2 |
|
2. |
Рассчитать массу чистого СаСО3, содержащегося в известняке. |
ω(чист.) = 100% — 10% = 90% или 0,9; m(CaCO3) = 300⋅0,9=270 г |
|
3. |
Полученную массу СаСО3 записать над формулой СаСО3 в уравнении реакции. Искомую массу СаО обозначить через х. |
270 г х г СаСО3 = СаО + СО2 |
|
4. |
Под формулами веществ в уравнении записать количество вещества (согласно коэффициентам); произведения количеств веществ на их молярную массу. |
270 г х г СаСО3 = СаО + СО2 1 моль 1 моль 1⋅100 г 1⋅56 г |
|
5. |
Составить пропорцию. |
270/100=х/56 |
|
6. |
Решить уравнение. |
х = 151,2 г |
|
7. |
Записать ответ. |
Ответ: масса оксида кальция составит 151, 2 г |
Алгоритм 6. Расчет массы продукта реакции, если известен выход продукта реакции
Задание: Сколько г аммиачной селитры (NH4NO3) можно получить при взаимодействии 44,8 л аммиака (н. у.) с азотной кислотой, если известно, что практический выход составляет 80 % от теоретически возможного?
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Запишите уравнение химической реакции, расставьте коэффициенты. |
NH3 + HNO3 = NH4NO3 |
|
2. |
Данные условия задачи напишите над уравнением реакции. Массу аммиачной селитры обозначьте через х. |
44,8 л х г NH3 + HNO3 = NH4NO3 |
|
3. |
Под уравнением реакции напишите: а) количество веществ согласно коэффициентам; б) произведение молярного объёма аммиака на количество вещества; произведение молярной массы NH4NO3 на количество вещества. |
44,8 л х г NH3 + HNO3 = NH4NO3 1 моль 1 моль 1⋅22,4 л 1⋅80 г |
|
4. |
Составьте пропорцию. |
44,4/22,4=х/80 |
|
5. |
Решите уравнение, найдя х (теоретическую массу аммиачной селитры) |
х= 160 г. |
|
6. |
Найдите практическую массу NH4NO3, помножив теоретическую массу на практический выход (в долях от единицы) |
m(NH4NO3) = 160⋅0,8=128 г |
|
7. |
Запишите ответ. |
Ответ: масса аммиачной селитры составит 128 г. |
Алгоритм 7. Определение массы продукта, если один из реагентов взят в избытке
Задание: 14 г оксида кальция (СаО) обработали раствором, содержащем 37,8 г азотной кислоты (HNO3). Вычислите массу продукта реакции.
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Запишите уравнение реакции, расставьте коэффициенты |
CaO + 2HNO3 = Сa(NO3)2 + H2O |
|
2. |
Определите количества реагентов по формуле: ν=m/M |
ν(CaO) = 14/56=0,25 моль; ν(HNO3) = 37,8/63=0,6 моль |
|
3. |
Над уравнением реакции напишите рассчитанные количества вещества. Под уравнением — количества вещества согласно стехиометрическим коэффициентам. |
0,25 моль 0,6 моль CaO + 2HNO3 = Сa(NO3)2 + H2O 1 моль 2 моль |
|
4. |
Определите вещество, взятое в недостатке, сравнив отношения взятых количеств веществ к стехиометрическим коэффициентам. |
0,25/1<0,6/2 . Следовательно, в недостатке взята азотная кислота. По ней и будем определять массу продукта. |
|
5. |
Под формулой нитрата кальция (Ca(NO3)2) в уравнении проставьте: а) количество вещества, согласно стехиометрического коэффициента; б) произведение молярной массы на количество вещества. Над формулой (Са(NO3)2) — х г. |
0,25 моль 0,6 моль х г CaO + 2HNO3 = Сa(NO3)2 + H2O 1 моль 2 моль 1 моль 1⋅164 г |
|
6. |
Составьте пропорцию |
0,25/1=х/164 |
|
7. |
Определите х |
х = 41 г |
|
8. |
Запишите ответ. |
Ответ: масса соли (Ca(NO3)2) составит 41 г. |
Алгоритм 8. Расчёты по термохимическим уравнениям реакций
Задание: Сколько теплоты выделится при растворении 200 г оксида меди (II) (СuO) в соляной кислоте (водный раствор HCl), если термохимическое уравнение реакции: CuO + 2HCl = CuCl2 + H2O + 63,6 кДж
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Данные из условия задачи написать над уравнением реакции |
200 г CuO + 2HCl = CuCl2 + H2O + 63,6 кДж |
|
2. |
Под формулой оксида меди написать его количество (согласно коэффициенту); произведение молярной массы на количество вещества. Над количеством теплоты в уравнении реакции поставить х. |
200 г х CuO + 2HCl = CuCl2 + H2O + 63,6 кДж 1 моль 1⋅80 г |
|
3. |
Составить пропорцию. |
200/80=х/63,6 |
|
4. |
Вычислить х. |
х=159 кДж |
|
5. |
Записать ответ. |
Ответ: при растворении 200 г CuO в соляной кислоте выделится 159 кДж теплоты. |
Алгоритм 9. Составление термохимического уравнения
Задание: При сжигании 6 г магния выделяется 152 кДж тепла. Составить термохимическое уравнение образования оксида магния.
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Записать уравнение химической реакции, показав выделение тепла. Расставить коэффициенты. |
2Mg + O2 = 2MgO + Q |
|
2. |
Данные из условия задачи написать над уравнением реакции. |
6 г 152 2Mg + O2 = 2MgO + Q |
|
3. |
Под формулами веществ написать: а) количество вещества (согласно коэффициентам); б) произведение молярной массы на количество вещества. Под тепловым эффектом реакции поставить х. |
6 г 152 2Mg + O2 = 2MgO + Q 2 моль х 2⋅24 |
|
4. |
Составить пропорцию. |
6/(2⋅24)=152/х |
|
5. |
Вычислить х (количество теплоты, согласно уравнению) |
х=1216 кдж |
|
6. |
Записать в ответе термохимическое уравнение. |
Ответ: 2Mg + O2 = 2MgO + 1216 кДж |
Алгоритм 10. Расчет объёмов газов по химическим уравнениям
Задание: При окислении аммиака (NH3) кислородом в присутствии катализатора образуется оксид азота (II) и вода. Какой объём кислорода вступит в реакцию с 20 л аммиака?
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Записать уравнение реакции и расставить коэффициенты. |
4NH3 + 5O2 = 4NO + 6H2O |
|
2. |
Данные из условия задачи написать над уравнением реакции. |
20 л х 4NH3 + 5O2 = 4NO + 6H2O |
|
3. |
Под уравнением реакции записать количества веществ согласно коэффициентам. |
20 л х 4NH3 + 5O2 = 4NO + 6H2O 4 моль 5 моль |
|
4. |
Составить пропорцию. |
20/4=х/5 |
|
5. |
Найти х. |
х= 25 л |
|
6. |
Записать ответ. |
Ответ: 25 л кислорода. |
Алгоритм 11. Определение объема газообразного продукта по известной массе реагента, содержащего примеси
Задание: Какой объём (н.у) углекислого газа (СО2) выделится при растворении 50 г мрамора (СаСО3), содержащего 10 % примесей в соляной кислоте?
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Записать уравнение химической реакции, расставить коэффициенты. |
CaCO3 + 2HCl = CaCl2 + H2O + CO2 |
|
2. |
Рассчитать количество чистого СаСО3, содержащегося в 50 г мрамора. |
ω(СаСО3)=100% — 10% =90% Для перевода в доли от единицы поделить на 100%. ω(СаСО3)= 90%/100%=0,9 m(CaCO3)=m(мрамора)⋅ω(СаСО3)= 50⋅0,9=45 г |
|
3. |
Полученное значение написать над карбонатом кальция в уравнении реакции. Над СО2 поставить х л. |
45 г х л CaCO3 + 2HCl = CaCl2 + H2O + CO2 |
|
4. |
Под формулами веществ записать: а) количество вещества, согласно коэффициентам; б) произведение молярной массы на кол-во вещества , если говорится о массе вещества, и произведение молярного объёма на количество вещества, если говорится об объёме вещества. |
45 г х л CaCO3 + 2HCl = CaCl2 + H2O + CO2 1 моль 1 моль 1⋅100 г 1⋅22,4 л |
|
5. |
Составить пропорцию. |
45/100=х/22,4 |
|
6. |
Найти х |
х = 10,08 л |
|
7. |
Записать ответ. |
Ответ: получится 10.08 литра (н. у.) углекислого газа. |
Алгоритм 12. Расчет состава смеси по уравнению химической реакции
Задание: На полное сгорание смеси метана и оксида углерода (II) потребовался такой же объём кислорода. Определите состав газовой смеси в объёмных долях.
|
№ п/п |
Последовательность действий |
Выполнение действий |
|
1. |
Записать уравнения реакций, расставить коэффициенты. |
СО + 1/2О2 = СО2 СН4 + 2О2 = СО2 + 2Н2О |
|
2. |
Обозначить количество вещества угарного газа (СО) — х, а количество метана за у. |
х СО + 1/2О2 = СО2 у СН4 + 2О2 = СО2 + 2Н2О |
|
3. |
Определить количество кислорода, которое будет израсходовано на сжигание х моль СО и у моль СН4. |
х 0,5 х СО + 1/2О2 = СО2 у 2у СН4 + 2О2 = СО2 + 2Н2О |
|
4 |
Сделать вывод о соотношении количества вещества кислорода и газовой смеси. |
Равенство объёмов газов свидетельствует о равенстве количеств вещества. |
|
5. |
Составить уравнение. |
х + у = 0,5х + 2у |
|
6. |
Упростить уравнение. |
0,5 х = у |
|
7. |
Принять количество СО за 1 моль и определить требуемое количество СН4. |
Если х=1, то у=0,5 |
|
8. |
Найти общее количество вещества. |
х + у = 1 + 0,5 = 1,5 |
|
9. |
Определить объёмную долю оксида монооксида углерода (СО) и метана в смеси. |
ϕ(СО) = 1/1,5 = 2/3 ϕ(СН4) = 0,5/1,5 = 1/3 |
|
10. |
Записать ответ. |
Ответ: объёмная доля СО равна 2/3, а СН4 — 1/3. |
Расчеты по уравнениям химических реакций
- Какой объем кислорода необходим для получения 14г оксида кальция (н.у.)?
- Найдите массу оксида железа(III), полученного при взаимодействия 2,8г железа с кислородом.
- Найти массу хлорида натрия, полученного при взаимодействии 6,9 г натрия с 6,72 л хлора (н.у.).
- Найти массу серебра, полученного при разложении 14,5 г оксида серебра, содержащего 20% примесей.
- При взаимодействии 33,6 л водорода (н.у.) с кислородом образовалось 21,6 г воды. Найти массовую долю выхода воды в процентах от теоретического.
- Найти массу йода, которая потребуется для получения йода алюминия массой 61,2 г.
- Найти массу кальция, которая необходима для получения 4,48 г оксида кальция, если массовая доля выхода оксида кальция равна 80%.
- При взаимодействии образца технического алюминия, содержащего 10% примесей, с серой образовалось 33,75 г сульфида алюминия, что составляет 75% от теоретического. Найти массу технического образца.
- Сожгли смесь цинка и магния массой 11,3 г. Каковы массовые доли цинка и магния в смеси, если известно, что на сжигание цинка пошло 1,6 г кислорода?
- Для хлорирования 6 г двухвалентного металла израсходовано 5,6 л хлора (н.у.). Какой это был металл?
- Какой объем кислорода (н.у.) необходим для полного сжигания 30 л водорода?
- Сколько граммов водорода выделится при взаимодействии 69 г натрия с 18 г воды?
- Сколько граммов водорода выделится при взаимодействии 195 г цинка с 49 г серной кислоты?
- Сколько граммов соли образуется при взаимодействии 80г оксида магния и 9,8 г фосфорной кислоты?
- Сколько граммов воды образуется при взаимодействии 160 г оксида меди и 20г водорода?
- Сколько граммов водорода выделится при взаимодействии 12 г магния и 9,8 г фосфорной кислоты?
- Сколько граммов соли образуется при взаимодействии 6г магния и 98 г серной кислоты?
- Сколько граммов оксида магния образуется при сгорании 240 г магния в 3,2 кислорода?
- Сколько граммов соли образуется при взаимодействии 9,8 г серной кислоты и 130 г цинка.
- Сколько граммов воды образуется при взрыве смеси, состоящей из 4 г водорода и 40 г кислорода?
- Сколько граммов меди образуется при восстановлении 160 г оксида меди и 2 водорода?
- Сколько граммов оксида серы (IV) образуется при сгорании 8 г серы в 32 г кислорода?
- Сколько граммов воды образуется при взрыве смеси 20г водорода и 64 г кислорода?
- Сколько граммов соли образуется при взаимодействии 10г гидроксида натрия и 36,5 г соляной кислоты?
- Сколько граммов водорода выделится при взаимодействии 78г калия с 9 г воды?
- Определите, какая масса нитрата магния получится при реакции 20г оксида магния с раствором, содержащим 94,5 г азотной кислоты.
- Сколько граммов оксида фосфора (V) образуется при сгорании 31 г фосфора в 8г кислорода?
- Сколько граммов воды образуется при взаимодействии 112г оксида кальция с 9,8 г серной кислоты?
- Какой объем углекислого газа выделится при действии раствора, содержащего 30г соляной кислоты, на 25 г карбоната кальция?
- В раствор, содержащий 40г сульфата меди (II), поместили 10г железных опилок. Какие вещества образуются в результате реакции и какова их масса?
- Сколько граммов оксида магния образуется при сгорании 10г магния в 16 г кислорода?
- Сколько граммов воды образуется при взаимодействии 20г гидроксида натрия и 980 г серной кислоты?
- Сколько граммов водорода выделится при взаимодействии 112 г железа (II) с 9,8 г серной кислоты?
- Сколько граммов воды образуется при взаимодействии 112 г гидроксида калия с 146 г соляной кислоты?
- Сколько граммов водорода выделится при взаимодействии 78г калия с 9 г воды?
- При разложении 4,34г оксида ртути выделилось 0,32 г кислорода. Сколько ртути при этом получилось? Дайте обоснованный ответ.
- Сколько соли получится, если взять 505 г нитрата калия и 196 г серной кислоты?
- Сколько соли получится, если взять 120г оксида магния и 147 г фосфорной кислоты?
- Сколько соли получится, если взять 28г оксида кальция и 18,9г азотной кислоты?
- Сколько граммов углекислого газа образуется при сгорании 24 г углерода в 8 г кислорода?
Расчётные задачи по химии учащиеся решают с начала VIII класса и до конца обучения в школе. Решение задач позволяет:
- расширять кругозор учащихся;
- развивать умение логически мыслить;
- воспитывать самостоятельность, внимательность, умение анализировать, делать правильные выводы;
- устанавливать связь химии с другими науками: физикой, математикой, биологией, экологией и др.;
- способствует политехнической подготовке учащихся, готовиться к успешной аттестации по предмету (в том числе и в форме ЕГЭ).
Решая задачи, учащиеся более глубоко усваивают учебный материал, учатся применять приобретённые теоретические знания на практике.
Традиционная методика обучения решения химических задач (чаще всего – это решение задач методом составления пропорций) имеет ряд недостатков. В результате лишь немногие учащиеся сознательно и творчески овладевают общим подходом к решению, умеют оценивать свои действия в процессе решения, самостоятельно составлять условия задач, умеют выбирать рациональные способы решения и др.
Представленная методика обучения решения задач от общих приёмов к частным позволяет решить недостатки традиционных способов обучения. В данной работе показываются приёмы решения задач с использованием основных физических величин. Среди них величина n (или ν) — количество вещества — позволяет связать все основные физические величины друг с другом. Это даёт возможность составлять логические схемы решения задач с использованием этих физических величин.
Задача учителя состоит в том, чтобы научить учащихся понимать смысл этих физических величин и применять физические формулы при решении расчётных задач различных типов, научить анализировать условия задач, через составление логической схемы решения конкретной задачи на основе знания общего подхода к решению. Составление логической схемы задачи предотвращает многие ошибки, которые допускают учащиеся.
Ниже приведены основные формулы физических величин и их взаимосвязи, которые учащиеся должны знать в обязательном порядке и использовать их при решении.
В данной работе показываются примеры решения некоторых основных типов задач, по которым можно понять методический подход при обучении учащихся.
Исходные формулы, отображающие взаимосвязь физических величин.
1. Относительная атомная масса (Ar):
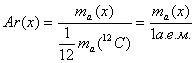
2. Относительная молекулярная масса (Mr): 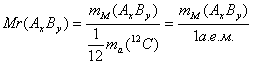
.
3. Плотность вещества (ρ) позволяет связать собой массу (m) и объем (V) вещества: .
4. Масса, объем, число частиц (N), количество теплоты (Q) связаны между собой универсальной физической величиной – количеством вещества – n(или ν):
5. Относительная плотность (D):
6. Массовая доля ω:
элемента в веществе: ;
;
примеси в веществе: ;
растворенного вещества в растворе: ; mр-ра = mр.в.+ mр-ля
mр-ра=Vр-ра· ρр-ра.
7. Объемная доля вещества в смеси (φ) (для газов): .
8. Молярная концентрация (Сm или С): .
9. Уравнение Клапейрона — Менделеева: .
Методика решения задач различных типов.
Расчеты по химическим формулам.
Решение данного типа задач начинается с осмысления понятия записи химической формулы, с осмыслением того, что учащиеся могут узнать по записи химической формулы. Рассмотрим примеры решения задач с использованием веществ только молекулярного строения. Молекулярная (истинная) формула показывает действительное число атомов каждого элемента в молекуле. В таблице №1 показано, какие сведения о веществе можно узнать по записи формулы вещества.
Таблица № 1.
Алгоритм решения базовой задачи.
- Заданный по условиям параметр переводим в количество вещества (n или ν).
- По индексам определяем количество вещества искомого химического элемента (n(х) или ν(х)).
- По формулам, отображающим взаимосвязь величин, рассчитываем неизвестный параметр.
Графическая схема решения базовой задачи.

Примеры задач
Задача 1. Рассчитайте число атомов углерода и кислорода в 11,2 л. (н.у.) углекислого газа.
Задача 2. В каком объеме углекислого газа содержится 9,03·1023 атомов кислорода?
Какова его масса?
Задача 3. Газ, плотность которого равна 1,96 г/л (н.у.), состоит из углерода и кислорода, причем ω(C) = 0,27. Определите формулу данного вещества.
Логическая схема решения задачи:
Расчёты по химическим уравнениям.
Химическими уравнениями называют условную запись химической реакции посредством химических знаков, формул и коэффициентов.
Уравнение химической реакции показывает, какие вещества вступают в реакцию и какие образуются, а также соотношение количеств этих веществ. Иными словами, химическое уравнение – это способ выражения (передачи) качественной и количественной информации о химическом явлении.
Запишем уравнение реакции в общем виде: aA + bB ® cC +dD, где А и В – исходные вещества, С и D – продукты реакции, a, b, c, d – стехиометрические коэффициенты.
Стехиометрические коэффициенты подбирают на основе того, что число атомов каждого элемента до и после реакции остается неизменным. Это можно рассматривать как следствие закона сохранения массы.
Рассмотрим информацию, содержащуюся в стехиометрических коэффициентах.
Отношение стехиометрических коэффициентов равно:
отношению числа частиц, вступивших в реакцию и образовавшихся в результате реакции
a : b : c : d = N(A) : N(B) : N(C) : N(D)
отношению молярных количеств веществ, вступивших в реакцию и образовавшихся в результате реакции a : b : c : d = n(A) : n(B) : n(C) : n(D)
отношению объемов, вступивших в реакцию и образовавшихся в результате реакции газообразных веществ a : b : c : d = V(A) : V(B) : V(C) : V(D).
Последнее отношение выполняется, если:
- это газообразные вещества, близкие по свойствам к идеальному газу,
- объемы этих газов измерены при одинаковом давлении и температуре.
Несмотря на большое разнообразие задач данного типа, принцип решения их одинаков: по известному параметру (N, m, V) одного вещества рассчитывается неизвестный параметр X (Nx, mx, Vx) другого вещества. Такая задача является простейшей (базовой).
Алгоритм решения базовой задачи (последовательность действий).
- Составляем уравнение химической реакции и выписываем мольные соотношения прореагировавших и получившихся веществ.
- По формулам, отображающим взаимосвязь физических величин, переводим заданную по условию величину в количество (n или ν) исходного вещества.
- По мольным отношениям рассчитываем n определяемого вещества (Х).
- По формулам, отображающим взаимосвязь физических величин, рассчитываем неизвестный параметр X.
Графическая схема решения базовой задачи.
В качестве базовых рассмотрим решение следующих задач:
Задача 1. Вычислите n, m, V углекислого газа, полученного при действии на 50 г карбоната кальция избытком раствора соляной кислоты.
Задача 2. При взаимодействии цинка с избытком раствора соляной кислоты выделилось 1,12 л водорода (н.у.). Вычислите массы растворившегося цинка и образовавшейся соли.
Задача 3. При взаимодействии с избытком соляной кислоты металла (валентность, которого во всех соединениях равна II) массой 12 г образовался водород объемом 6,72 л (н.у.).
Определите, какой это металл.
Усложнение базовой задачи.
Расчет массы реагирующих или образующихся химических соединений на практике осложнен. Это обусловлено несколькими причинами:
- Исходные вещества или продукты реакции задаются в условиях отличных от нормальных.
- Исходные вещества вводятся в виде растворов.
- Во многих случаях реагенты содержат примеси, которые в данной конкретной реакции либо не участвуют вообще, либо образуют отличные от целевого продукта вещества.
- Выход продуктов не соответствует теоретическому, т.к. очистка целевого вещества приводит не только к освобождению от многочисленных примесей, но и к частичной потери основного вещества.
Таким образом, перед использованием исходных данных для решения задачи и подстановки их в основную цепь расчетов необходимо провести те или иные дополнительные преобразования. Для перевода условий, отличных от нормальных (для газообразных веществ) используется исходная формула 9 — расчеты физико-химических величин по управлению Клапейрона — Менделеева.
1. Исходные вещества вводятся в виде раствора.
Задача. Сколько граммов 10%-ного раствора гидроксида натрия требуется для нейтрализации
20 г 4,9%-нго раствора серной кислоты?
2. Расчет количественных параметров продуктов реакции, если исходные вещества содержат примеси, расчет массовой доли примеси.
Абсолютно чистого вещества в природе не бывает, поэтому в химических производствах вынуждены использовать исходные вещества, содержащие примеси. Эти примеси обычно имеют отличные от основного вещества свойства и, поэтому не образуют в процессе производства нужные продукты.
В связи с этим, чтобы определить количественные параметры получаемого продукта, необходимо вначале рассчитать количественные параметры вступающего в реакцию чистого вещества, которое содержится в исходном объекте. После этого решается базовая задача.
Обратные задачи заключаются в оценке чистоты исходных веществ по количеству продуктов реакции.
Содержание примеси обычно выражают в частях от единицы (или выражают в %). Эта величина показывает массовую долю чистого вещества (примеси) в исходном образе (формула 1).
Для вычисления массы чистого вещества (или примесей), содержащегося в смеси, используют формулу 2.
(1)
m(смеси) = m(осн.в.) + m(прим.) (2)
Задача. При взаимодействии 10,8 г кальцинированной соды (безводный карбонат натрия)
с избытком раствора соляной кислоты получили 2,24 л (н.у.) оксида углерода (IV).
Вычислите содержание примеси в соде.
3. Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
Как быть, если одновременно заданы параметры нескольких реагирующих веществ? По какому из них вести расчет? Это определяют, сравнения отношения стехиометрических коэффициентов и отношение количеств вещества, взятых для данной реакции.
Если один из реагентов присутствует в количестве больше, чем стехиометрическое, то часть его остается неиспользованной после окончания реакции (избыток вещества). Очевидно, что расчеты нужно вести по веществу, которое в данной реакции расходуется полностью (т.е. находится в недостатке).
Задача. В реакционном сосуде смешали 6,72 л оксида углерода (II) и 2,24 л кислорода и смесь подожгли. Определите объемный состав полученной смеси.
Используемая литература:
- Кузнецова Н.Е., Лёвкин А.Н. Задачники по химии для учащихся 8 и 9 классов общеобразовательных учреждений. М.: Вентана-Граф, 2008.
- Лидин Р.А., Аликберова Л.Ю. Химия: Справочник для старшеклассников и поступающих в вузы – М.: АСТ-ПРЕСС ШКОЛА, 2002.
- Лидин Р.А., Аликберова Л.Ю. Задачи, вопросы и упражнения по химии: 8-11 кл.: Пособие для учащихся общеобразовательных учреждений. – М.: Просвещение, 2002.
Ключевые слова: решение 25 типовых задач по химии, определение массы, доли, числа,
1
Определение относительной молекулярной массы Мг
Задача
Какова относительная молекулярная масса Мг нитробензола С6Н5NO2? Какова молекулярная масса этого вещества в а.е.м.?
2
Определение массовой доли элемента в соединении
Задача
Какова масса в граммах 1 атома 131I ?
3
Определение числа молекул в порции вещества
Задача
Сколько молекул воды содержится в 1 капле воды массой 0,03 г?
4
Определение массы атома в граммах
Задача
Какова массовая доля фосфора в фосфате кальция Са3(РO4)2 ?
Ответ: ω = 0.2 или 20%
5
Определение молярной массы
Задача
Какова молярная масса вещества, если масса 2.5 моль этого вещества равна 250 г?
6
Определение массового отношения элементов в соединении
Задача
Каково массовое отношение углерода, водорода и кислорода в глюкозе С6Н1206 ?
7
Определение объема, который занимает порция газа при н.у.
Задача
Какой объем (н.у.) занимают 66 г С02?
8
Определение теплового эффекта реакции
Задача
Молярная теплота сгорания угля на воздухе 393.5 кДж/моль. Сколько теплоты выделится при полном сгорании 1 кг угля?
9
Определение максимального выхода продукта реакции
Задача
Сколько максимально литров (н.у.) водорода можно получить, используя 45.5 г цинка и избыток соляной кислоты?
10
Определение реального выхода продукта реакции
Задача
При прокаливании 15,8 г перманганата калия КМnО4 получено 0,896 л (н.у.) кислорода. Каков выход кислорода в данном случае?
11
Определение выхода продукта по стехиометрическим соотношениям
Задача
Сколько граммов азотной кислоты HNO3 максимально можно получить из 44.8 л (н.у.) азота?
12
Определение содержания основного компонента (или содержания примеси) в исходном веществе
Задача
Каково содержание (в процентах) СаСО3 в образце известняка, при длительном прокаливании 400 г которого получено 78,4 л С02 (н.у.)?
13
Определение выхода реакции, когда одно из исходных веществ взято в избытке
Задача
Сколько граммов поваренной соли NaCI можно получить, если смешать два раствора, один из которых содержит 29,2 г HCI, а другой 44 г NaOH?
14
Определение состава газовой смеси (в объемных процентах)
Задача
20 л (н.у.) аммиака пропустили через нагретую до 350°С трубку с железным катализатором. Объем полученной газовой смеси (н.у.) равен 25 л. Каков состав полученной газовой смеси (в объемных процентах) ?
15
Определение объема газа, расходуемого на проведение реакции с другими газами
Задача
Какой минимальный объем кислорода, содержащего 10 объемн. % озона, необходим для полного сжигания 4 л пропана С3Н8 ?
16
Определение молекулярной формулы вещества по относительной плотности его паров
Задача
Относительная плотность паров углеводорода по воздуху 2,69. Массовая доля водорода в соединении 7,69%. Какова молекулярная формула углеводорода?
17
Определение состава газовой смеси
Задача
Относительная плотность 30 л смеси метана СН4 и азота N2 по гелию равна 5. Сколько литров метана и азота взято для приготовления смеси?
18
Определение состава солей в растворе
Задача
В растворе смешали 9,8 г H2S04 и 6,5 г NaOH. Какие соли и в каких количествах образовались?
19
Приготовление раствора с заданной массовой долей растворенного вещества
Задача
Сколько граммов сахарозы надо растворить в 250 г воды, чтобы получить раствор с массовой долей сахарозы 0,3 (30%)?
20
Приготовление раствора с заданной массовой долей растворенного вещества
Задача
: Сколько граммов медного купороса CuS04 • 5Н20 надо добавить к 300 г 2%-го раствора сульфата меди, чтобы получить 5%-ный раствор ?
21
Приготовление раствора с заданной массовой долей растворенного вещества
Задача
Сколько миллилитров воды нужно добавить к 100 мл 30%-го раствора соляной кислоты с плотностью 1,15 г/мл, чтобы получить раствор с массовой долей НCl 5%?
22
Приготовление раствора с заданной массовой долей растворенного вещества
Задача
Сколько граммов ВаО надо добавить к 100 г воды, чтобы получить 5%-ный раствор?
23
Приготовление раствора с заданной молярной концентрацией
Задача
Сколько граммов сульфата натрия Na2S04* 10Н20 необходимо для приготовления 0,5 л раствора с молярной концентрацией 0,02 моль/л?
24
Определение формулы органического вещества по данным о массе продуктов реакции
Задача
При полном сгорании 6,0 г органического вещества получено 8,8 г С02 и 3.6 г воды. Плотность паров органического вещества по водороду равна 30. Какова молекулярная формула вещества?
25
Определение молекулярной формулы органического вещества по данным о продукте реакции
Задача
При обработке 14,8 г одноосновной карбоновой кислоты избытком цинка получено 2,24 л водорода. Какова молекулярная формула кислоты?
Автор задач: С.С.Бердоносов
Решение 25 типовых задач по химии. Выберите дальнейшие действия:
- Перейти к следующей теме:
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.