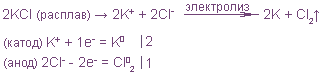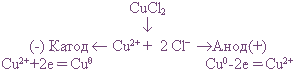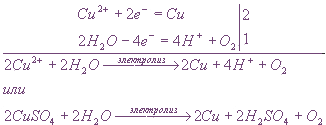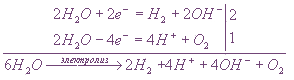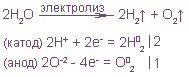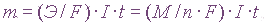Электролиз расплавов

4.5
Средняя оценка: 4.5
Всего получено оценок: 108.
4.5
Средняя оценка: 4.5
Всего получено оценок: 108.
Окислительно-восстановительная реакция, протекающая на электродах при прохождении электрического тока через раствор или расплав, называется электролизом. Отдельно выделяют электролиз растворов и электролиз расплавов. Рассмотрим, как протекает процесс в расплавах.
Суть процесса
Движущей силой электролиза является электричество. Под действием энергии электрического тока осуществляется химическая реакция, которая не происходит самопроизвольно.
Процессы восстановления и окисления протекают раздельно, на различных электродах. В качестве электродов берутся любые материалы, способные проводить электрический ток. Чаще всего это металлы. Из неметаллов используют углерод, из него изготавливают графитовые стержни. В редких случаях в качестве электрода выступают жидкости.
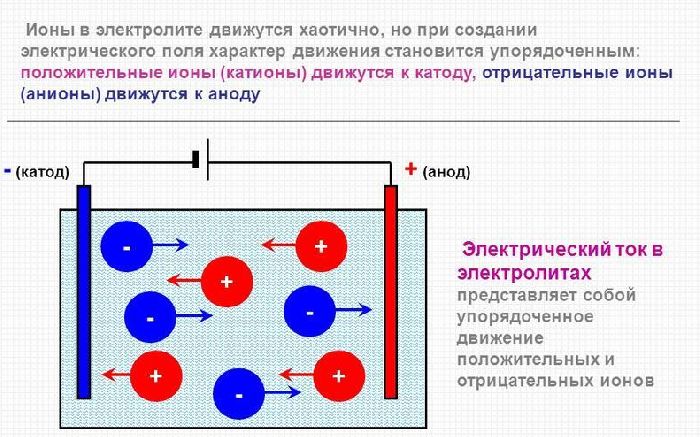
В расплав помещают два противоположно заряженных электрода, к которым движутся разнозаряженные ионы.
Положительно заряженные катионы, в которых количество электронов меньше количества протонов, движутся к отрицательному полюсу электрода – катоду. В качестве катода берут металлическую пластину из меди, латуни, цинка, алюминия.
К аноду – положительному полюсу – движутся анионы. Это отрицательно заряженные ионы, в которых число электронов превышает количество протонов. Анод в процессе электролиза окисляется, то есть растворяется. Поэтому в качестве анода берут материал, не влияющий на химический процесс. Такой анод называется инертным электродом. Подходящие материалы – графит, платина.
Электролиз растворов протекает сложнее, чем расплавов. В растворе участвуют ионы вещества и ионы растворителя, в расплавах – только ионы вещества. Главным продуктом электролиза расплава является металл (всегда катион). Побочные продукты:
- газ – кислород, водород, хлор;
- жидкости – вода, оксид серы (VI), бром.
На катоде происходит процесс восстановления, на аноде – процесс окисления.
Примеры
Рассмотрим схему электролиза на примере расплавов оксидов, оснований и солей в таблице.
|
Расплав |
Описание |
Пример |
|
Оксид |
– Восстановление металла на катоде: Men+ + ne– = Me0; – окисление кислорода на аноде: O-2 – 2e– = O2 |
2K2O = 4K + O2 |
|
Основание |
– Восстановление металла на катоде: Men+ + ne– = Me0; – окисление кислорода в составе гидроксидной группы на аноде: 4OH− – 4e = 2H2O + O2 |
4NaOH = 4Na + 2H2O + O2↑ или NaOH → Na+ + OH– |
|
Бескислородная соль |
– Восстановление металла на катоде: Men+ + ne– = Me0; – окисление бескислородного аниона на аноде: An- – ne– = A0 |
2NaBr = 2Na + Br2 или NaBr → Na+ + Br– |
|
Кислородсодержащая соль |
– Восстановление металла на катоде: Men+ + ne– = Me0; – окисление кислородного аниона на аноде: 2AO2- – 4e– = 2AO2- + O2 |
2Na2SO4 = 4Na + 2SO3↑ + O2↑ или Na2SO4 → 2Na+ + SO42- |
Электролиз является промышленным способом получения металлов, нанесения металлического покрытия, воспроизведения формы предметов.
Что мы узнали?
Электролиз – окислительно-восстановительный процесс при участии электрического тока. В расплавах с помощью электричества исходное вещество разделяется на катионы металла и анионы. Положительно заряженные катионы стремятся к катоду – отрицательно заряженному электроду. Анионы – отрицательно заряженные ионы – оседают на положительно заряженном аноде. Поэтому на катоде происходит восстановление, на аноде – окисление. С помощью электролиза расплава получают металлы, наносят металлическое покрытие и воспроизводят форму объектов.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 108.
А какая ваша оценка?
Содержание
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Электролиз расплавов оксидов
- Электролиз расплавов оснований
- Электролиз расплавов солей
- Составьте схемы электролиза с использованием угольных электродов расплавов и растворов следующих солей — KCl, CuSO4, KI?
- Как изменится реакция раствора у электродов при электролизе раствора BaCl2?
- 1)Составьте схемы электролиза для следующих расплавов : 2)Составьте схемы электролиза растворов ?
- «Напишите электролиз раствора сульфата кадмия (CdSO4) с кадмиевым анодом и угольными электродами?
- Составьте схемы электролиза : а)раствора и расплава хлорида натрия ; b)Раствора и расплава гидроксида калия?
- Схемы электролиза с графитовым электродом расплава и раствора хлорида кальция?
- Помогите решить кр по химии, вопрос не сложный ?
- Составить уравнения электролиза раствора KCL на инертных электродах?
- Составьте уравнения реакций электролиза расплава хлорида калия?
- Составьте схему электролиза раствора следующих солей : CaS, FeSO4?
- Электрохимическое разложение воды происходит при электролизе (электроды инертные) водного раствора : а)Hg(NO₃)₂ б)CuCl₂ в)FeSO₄ г)Ba(NO₃)₂ составьте схему электролиза раствора соответствующей соли?
- Электролиз солей
- Электролизер
- Электролиз расплава NaCl
- Электролиз водного раствора NaCl
- Процесс на катоде
- Процесс на аноде
- Электролиз солей — количественные аспекты
- 1 закон Фарадея
- 2 закон Фарадея
Химия, Биология, подготовка к ГИА и ЕГЭ
Мы уже рассматривали электролиз растворов солей, теперь давайте разберем электролиз расплавов веществ.
В этой лекции мы рассмотрим электролиз расплавов трех видов веществ:
- электролиз расплавов оксидов;
- электролиз расплавов оснований;
- электролиз расплавов солей.
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионыокисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
КАТ од — КАТ ионы (ионы у кат ода)
АН од — АН ионы (ионы у ан ода)
Электролиз расплавов оксидов
На катоде идет восстановление: Me n+ + ne — = Me 0 , т.е. на катоде выделяется металл.
На аноде окисляется кислород: O -2 -2e — = O2
Возьмем для примера электролиз расплава оксида калия: 2K2O -> 4K + O2
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл:
На аноде будет окисляться кислород в составе гидроксид-группы:
Электролиз расплавов солей
1. Электролиз расплава бескислородной соли:
На катоде всегда восстанавливается металл: Me n+ +ne — = Me 0
На аноде окисляется бескислородный анион: A n- — ne — = A 0
Электролиз расплава NaCl: 2NaCl = 2Na + Cl2
2. Электролиз расплава кислородсодержащей соли (элемент аниона не в высшей степени окисления):
На катоде всегда восстанавливается металл: Me n+ +ne — = Me 0
На аноде будет окисляться элемент аниона: SO3 2- — 2e — = SO3
Например, электролиз расплава сульфита натрия:
S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 — SO3
3. Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления):
На катоде все без изменений 🙂
На аноде — т.к. элемент уже в высшей степени окисления, то окисляться будет кислород:
Например, электролиз расплава карбоната натрия:
Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока.
Источник
Составьте схемы электролиза с использованием угольных электродов расплавов и растворов следующих солей — KCl, CuSO4, KI?
Составьте схемы электролиза с использованием угольных электродов расплавов и растворов следующих солей — KCl, CuSO4, KI.
Электролиз расплава хлорида калия :
Электролиз раствора хлорида калия :
Вывод : 2KCl + 2H2O → H2 + Cl2 + 2KOH
Электролиз расплава сульфата меди (II) :
A( + ) : 2SO42 — — 4e → 2SO3 + O2
Вывод : 2CuSO4→ 2Cu + 2SO3 + O2
Электролиз раствора сульфата меди (II) :
Вывод : 2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Электролиз расплава йодида калия :
Электролиз раствора йодида калия :
Вывод : 2KI + 2H2O → H2 + I2 + 2KOH.
Как изменится реакция раствора у электродов при электролизе раствора BaCl2?
Как изменится реакция раствора у электродов при электролизе раствора BaCl2?
1)Составьте схемы электролиза для следующих расплавов : 2)Составьте схемы электролиза растворов ?
1)Составьте схемы электролиза для следующих расплавов : 2)Составьте схемы электролиза растворов :
«Напишите электролиз раствора сульфата кадмия (CdSO4) с кадмиевым анодом и угольными электродами?
«Напишите электролиз раствора сульфата кадмия (CdSO4) с кадмиевым анодом и угольными электродами.
Составьте схемы электролиза : а)раствора и расплава хлорида натрия ; b)Раствора и расплава гидроксида калия?
Составьте схемы электролиза : а)раствора и расплава хлорида натрия ; b)Раствора и расплава гидроксида калия.
Схемы электролиза с графитовым электродом расплава и раствора хлорида кальция?
Схемы электролиза с графитовым электродом расплава и раствора хлорида кальция.
Помогите решить кр по химии, вопрос не сложный ?
Помогите решить кр по химии, вопрос не сложный !
Составте схему электролиза раствора сульфата железа при использовании угольных электродов.
Составить уравнения электролиза раствора KCL на инертных электродах?
Составить уравнения электролиза раствора KCL на инертных электродах.
Составьте уравнения реакций электролиза расплава хлорида калия?
Составьте уравнения реакций электролиза расплава хлорида калия.
Запишите схемы процессов, протекающих на электродах.
Составьте схему электролиза раствора следующих солей : CaS, FeSO4?
Составьте схему электролиза раствора следующих солей : CaS, FeSO4.
Электрохимическое разложение воды происходит при электролизе (электроды инертные) водного раствора : а)Hg(NO₃)₂ б)CuCl₂ в)FeSO₄ г)Ba(NO₃)₂ составьте схему электролиза раствора соответствующей соли?
Электрохимическое разложение воды происходит при электролизе (электроды инертные) водного раствора : а)Hg(NO₃)₂ б)CuCl₂ в)FeSO₄ г)Ba(NO₃)₂ составьте схему электролиза раствора соответствующей соли.
Вопрос Составьте схемы электролиза с использованием угольных электродов расплавов и растворов следующих солей — KCl, CuSO4, KI?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 10 — 11 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
Источник
Электролиз солей
Самопроизвольные окислительно-восстановительные реакции дают возможность создания гальванических элементов, в которых вырабатывается электрическая энергия. Если же реакция несамопроизвольна, то ее осуществление возможно при помощи электрической энергии. Подобные процессы осуществляют в электролизерах и называются они реакциями электролиза (электролиз солей).
Электролизер
Как видно на рисунке ниже, электролизер состоит из двух электродов, погруженных в расплав или водный раствор соли. Источник электрического тока передает электроны в один из электродов и удаляет их с другого электрода. При отдаче электронов электрод заряжается положительно, а при получении электронов – отрицательно.
Электролиз расплава NaCl
При электролизе расплава NaCl на отрицательном электроде (катоде) происходит присоединение электронов ионом натрия Na + и его восстановление. При этом вблизи электрода концентрация ионов Na + уменьшается и, вследствие этого, к электроду перемещается дополнительное количество ионов Na + .
Аналогично происходит миграция ионов Cl — к положительному электроду, где в результате отдачи электронов протекает процесс окисления. Таким образом, на электродах идет накопление продуктов окисления и восстановления.
Как и в гальваническом элементе, процесс восстановления протекает на катоде, а процесс окисления – на аноде.
При электролизе расплава NaCl протекают следующие реакции:
| Анод | 2Cl — -2e — → Cl2 0 |
| Катод | 2Na + + 2e — → 2Na 0 |
| 2Na + + 2Cl — → 2Na 0 + Cl2 0 |
В промышленности таким образом получают натрий, используя электролизер Даунса, представленный на рисунке ниже.
Сложнее протекает электролиз водных растворов электролитов.
Электролиз водного раствора NaCl
Так, например, при электролизе водного раствора хлорида натрия, происходят иные процессы, нежели при электролизе его расплава. На катоде происходит восстановление воды, а не натрия; на аноде происходит окисление хлорид-ионов:
| Анод | 2Cl — -2e — → Cl2 0 |
| Катод | 2H 2 O + 2e — → H2 0 +2OH — |
| 2H2O + 2Cl — → H2 0 + Cl2 0 |
Таким образом, получить натрий путем электролиза водного раствора его соли не удастся: на катоде выделяется водород, а на аноде хлор.
При электролизе водных растворов солей окислительно-восстановительные процессы, протекающие на катоде и аноде зависят от природы катионов металлов и характера аниона соли.
Процесс на катоде
Предсказать результат восстановительного процесса на катоде можно с помощью таблицы стандартных электродных потенциалов металлов:
- Катионы металлов, имеющие большую величину стандартного потенциала и расположенные в ряду после водорода полностью восстанавливаются на катоде и выделяются в виде металлов: Cu 2+ , Hg2 2+ , Ag + , Hg 2+ , Pt 2+ до Pt 4+
- Катионы металлов, имеющие малую величину стандартного потенциала не восстанавливаются на катоде, вместо этого происходит восстановление воды: от Li + , Na + … до Al 3+ включительно.
- Катионы металлов, имеющие среднюю величину стандартного потенциала будут восстанавливаться на катоде вместе с молекулами воды: от Mn 2+ , Zn 2+ … до H
Если имеется смесь катионов, то легче всего на катоде будут восстанавливаться катионы металла с наиболее положительным потенциалом, например, из смеси Cu 2+ , Ag + , Zn 2+ сначала восстановится Ag + (E = +0,79 В), затем Cu 2+ (E = +0,337 В) и только потом Zn 2+ (E = +0,76 В).
Процесс на аноде
Какие процессы будут протекать на аноде зависит от материала анода и самого электролита. Нерастворимые аноды в процессе электролиза не окисляются, тогда как растворимые аноды разрушаются и в виде ионов переходят в раствор.
Рассмотрим процессы, происходящие на инертном (нерастворимом) аноде:
- При электролизебескислородных кислот и их солей (исключение HF и фториды) на аноде окисляются их анионы.
2Cl — -2e — = Cl2
- При электролизекислородсодержащих кислот и их солей c максимальной степенью окисления на аноде происходит окисление воды, в связи с тем, что потенциал окисления воды меньше, чем для таких анионов.
2H2O -4e — = O2 + 4H +
- При электролизе кислородсодержащих кислот и их солей c промежуточной степенью окисления на аноде происходит окисление анионов кислот
SO3 2- + H2O -2e — = SO4 2- + 2H +
В таблице ниже представлены наиболее типичные случаи электролиза с химической точки зрения
| Водный раствор соли малоактивного металла и бескислородной кислоты с инертным анодом |
CuBr2 + H2O = Cu + Br2 + H2O |
| Водный раствор соли активного металла и кислородсодержащей кислоты с инертным анодом |
K2SO4 + 2H2O = K2SO4 + 2H2 + O2
Т.е. происходит разложение воды |
| Водный раствор соли активного металла и бескислородной кислоты с инертным анодом |
KI + H2O = 2KOH + H2 + I2 |
| Водный раствор соли малоактивного металла с анодом из того же металла |
CuSO4
Электролиз солей — количественные аспектыСвязь между количеством вещества, выделившегося при электролизе соли и количеством прошедшего через него электричества отражена в законах Фарадея. 1 закон Фарадея
где k – коэффициент пропорциональности или электрохимический эквивалент, численно равный массе вещества, которое выделяется при прохождении 1 кулона электричества. 2 закон Фарадея
Т.е. чтобы выделился один химический эквивалент любого соединения необходимо приложить одинаковое количество электричества, которое равно 96484,56 Кл/моль. Это величина называется постоянной Фарадея. Э – электрохимический эквивалент, Законы Фарадея имеют большое значение при проведении расчетов, связанных с электролизом. Задачи с решениями на составление уравнений электродных реакций, протекающих при электролизе, а также на применение законов Фарадея приведены в разделе Задачи к разделу Электролиз солей Источник Adblock |
На чтение 10 мин Просмотров 2 Опубликовано 11 апреля 2023 Обновлено 11 апреля 2023
Содержание
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Электролиз расплавов оксидов
- Электролиз расплавов оснований
- Электролиз расплавов солей
- 1. Электролиз расплава хлорида меди (II).
- 2. Электролиз расплава хлорида калия:
- Электролиз растворов
- 1. На аноде могут образовываться следующие продукты:
- 2. На катоде могут образовываться следующие продукты:
- Пример: Электролиз водного раствора нитрата серебра на инертных электродах
- Пример: Электролиз водного раствора хлорида меди на инертных электродах
- Пример: Электролиз водного раствора хлорида магния на инертных электродах
- Пример: Электролиз водного раствора сульфата меди на инертных электродах
- Пример: Диссоциация сульфата калия в водном растворе:
- Электролиз расплава гидроксида натрия
- Закон Фарадея
- Гидролиз неорганических соединений
- Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и силиного основания
- Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и слабого основания
- Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и слабого основания
- Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и сильного основания
Химия, Биология, подготовка к ГИА и ЕГЭ
Мы уже рассматривали электролиз растворов солей, теперь давайте разберем электролиз расплавов веществ.
В этой лекции мы рассмотрим электролиз расплавов трех видов веществ:
- электролиз расплавов оксидов;
- электролиз расплавов оснований;
- электролиз расплавов солей.
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионыокисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
КАТ од — КАТ ионы (ионы у кат ода)
АН од — АН ионы (ионы у ан ода)
Электролиз расплавов оксидов
На катоде идет восстановление: Me n+ + ne — = Me 0 , т.е. на катоде выделяется металл.
На аноде окисляется кислород: O -2 -2e — = O2
Возьмем для примера электролиз расплава оксида калия: 2K2O -> 4K + O2
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл:
На аноде будет окисляться кислород в составе гидроксид-группы:
Электролиз расплавов солей
1. Электролиз расплава бескислородной соли:
На катоде всегда восстанавливается металл: Me n+ +ne — = Me 0
На аноде окисляется бескислородный анион: A n- — ne — = A 0
Электролиз расплава NaCl: 2NaCl = 2Na + Cl2
2. Электролиз расплава кислородсодержащей соли (элемент аниона не в высшей степени окисления):
На катоде всегда восстанавливается металл: Me n+ +ne — = Me 0
На аноде будет окисляться элемент аниона: SO3 2- — 2e — = SO3
Например, электролиз расплава сульфита натрия:
S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 — SO3
3. Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления):
На катоде все без изменений 🙂
На аноде — т.к. элемент уже в высшей степени окисления, то окисляться будет кислород:
Например, электролиз расплава карбоната натрия:
Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока.
Источник
1. Электролиз расплава хлорида меди (II).
Электродные процессы могут быть выражены полуреакциями:
на катоде K(-): Сu 2+ + 2e = Cu 0
Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных полуреакций, и для хлорида меди она выразится уравнением:
При электролизе щелочей и солей оксокислот на аноде выделяется кислород:
2. Электролиз расплава хлорида калия:
Электролиз растворов
Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.
источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является «восстановителем».
происходит отдача электронов анионами, поэтому анод является «окислителем».
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого)
анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
— окисление анионов и гидроксид-ионов,
— восстановление катионов и ионов водорода.
При проведении электролиза с использованием активного (расходуемого)
анода процесс усложняется и конкурирующими реакциями на электродах являются:
— окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода;
— восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода.
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного процесса на аноде и катоде при электролизе растворов солей с инертным электродом используют следующие правила:
1. На аноде могут образовываться следующие продукты:
а) при электролизе растворов, содержащих в своем составе анионы SO4 2- , NО — 3, РО4 3- , а также растворов щелочей на аноде окисляется вода и
б) при окислении анионов Сl — , Вr — , I — выделяются соответственно
2. На катоде могут образовываться следующие продукты:
а) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl 3+ , на катоде восстанавливается вода и
б) если ион металла расположен в ряду напряжений правее водорода, то на катоде
в) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al + и Н + , на катоде могут протекать конкурирующие процессы как
восстановления катионов, так и выделения водорода
Пример: Электролиз водного раствора нитрата серебра на инертных электродах
Диссоциация нитрата серебра:
При электролизе водного раствора АgNО3 на катоде происходит восстановление ионов Аg + , а на аноде — окисление молекул воды:
Составьте схемы электролиза водных растворов: а) сульфата меди; б) хлорида магния; в) сульфата калия.
Во всех случаях электролиз проводится с использованием угольных электродов.
Пример: Электролиз водного раствора хлорида меди на инертных электродах
В растворе находятся ионы Си 2+ и 2Сl — , которые под действием электрического тока направляются к соответствующим электродам:
На катоде выделяется металлическая медь, на аноде — газообразный хлор.
Если в рассмотренном примере электролиза раствора CuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl 0 и выделения хлора протекает окисление анода (меди).
В этом случае происходит растворение самого анода, и в виде ионов Сu 2+ он переходит в раствор.
Электролиз CuCl2 с растворимым анодом можно записать так:
Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
Пример: Электролиз водного раствора хлорида магния на инертных электродах
Диссоциация хлорида магния в водном растворе:
Ионы магния не могут восстанавливаться в водном растворе
Пример: Электролиз водного раствора сульфата меди на инертных электродах
В растворе сульфат меди диссоциирует на ионы:
Ионы меди могут восстанавливаться на катоде в водном растворе.
Сульфат-ионы в водном растворе не окисляются, поэтому на аноде будет протекать окисление воды.
Электролиз водного раствора соли активного металла и кислородсодержащей кислоты (К2SО4) на инертных электродах
Пример: Диссоциация сульфата калия в водном растворе:
Ионы калия и сульфат-ионы не могут разряжаться на электродах в водном растворе, следовательно,
на катоде будет протекать восстановление
(осуществляется при перемешивании),
H2O 
Если пропускать электрический ток через водный раствор соли активного металла и кислородсодержащей кислоты, то ни катионы металла, ни ионы кислотного остатка не разряжаются.
На катоде выделяется водород, а на аноде — кислород, и электролиз сводится к электролитическому разложению воды.
Электролиз расплава гидроксида натрия
проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита — воды):
Закон Фарадея
Зависимость количества вещества, образовавшегося под действием электрического тока, от времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фарадея:
— масса образовавшегося при электролизе вещества (г);
— эквивалентная масса вещества (г/моль);
— молярная масса вещества (г/моль);
— количество отдаваемых или принимаемых электронов;
— продолжительность процесса (с);
— константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества
(F = 96 500 Кл/моль = 26,8 Ач/моль).
Гидролиз неорганических соединений
Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
1. Соль, образованная сильным основанием и сильной кислотой KBr, NaCl, NaNO3)
, гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной.
2. В соли, образованной слабым основанием и сильной кислотой FeCl2, NH4Cl, Al2(SO4)3, MgSO4)
гидролизу подвергается катион:
Fe 2+ + 2Cl — + H + + OH — → FeOH + + 2Cl — + Н +
В результате гидролиза образуется слабый электролит, ион H + и другие ионы. рН раствора
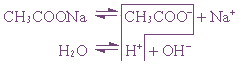
3. Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa)
подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы.
2K + +SiO3 2- + Н + + ОH — → НSiO3 — + 2K + + ОН —
рН таких растворов > 7 ( раствор приобретает щелочную реакцию).
гидролизуется и по катиону, и по аниону. В результате образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания.
Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и силиного основания
Различают несколько вариантов гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания:
Пример 1. Гидролиз ацетата натрия.
или CH3COO – + Na + + H2O ↔ CH3COOH + Na + + OH –
Так как уксусная кислота слабо диссоциирует, ацетат-ион связывает ион H + , и равновесие диссоциации воды смещается вправо согласно принципу Ле Шателье.
В растворе накапливаются ионы OH — ( pH >7)
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато.
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато.
Например, гидролиз карбоната:
Практическое значение обычно имеет только процесс, идущий по первой ступени, которым, как правило, и ограничиваются при оценке гидролиза солей.
Равновесие гидролиза по второй ступени значительно смешено влево по сравнению с равновесием первой ступени, поскольку на первой ступени образуется более слабый электролит (HCO3 – ), чем на второй (H2CO3)
Пример 2 . Гидролиз ортофосфата рубидия.
1. Определяем тип гидролиза:
Рубидий – щелочной металл, его гидроксид — сильное основание, фосфорная кислота, особенно по своей третьей стадии диссоциации, отвечающей образованию фосфатов, — слабая кислота.
2. Пишем ионное уравнение гидролиза, определяем среду:
Продукты — гидрофосфат- и гидроксид-ионы, среда – щелочная.
3. Составляем молекулярное уравнение:
Получили кислую соль – гидрофосфат рубидия.
Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и слабого основания
2. Гидролиз соли сильной кислоты и слабого основания:
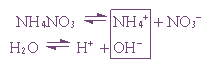
Пример 1. Гидролиз нитрата аммония.
В случае многозарядного катиона гидролиз протекает ступенчато, например:
I ступень : Cu 2+ + HOH ↔ CuOH + + H +
II ступень : CuOH + + HOH ↔ Cu(OH)2 + H +
При этом концентрация ионов водорода и pH среды в растворе также определяются главным образом первой ступенью гидролиза.
Пример 2. Гидролиз сульфата меди(II)
1. Определяем тип гидролиза.
На этом этапе необходимо написать уравнение диссоциации соли:
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты.
2. Пишем ионное уравнение гидролиза, определяем среду:
Образуется катион гидроксомеди(II) и ион водорода,
3. Составляем молекулярное уравнение.
Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два.
Обращаем внимание, что продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названий аниона и катиона, в данном случае соль назовем «сульфат гидроксомеди(II)».
Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и слабого основания
3. Гидролиз соли слабой кислоты и слабого основания:
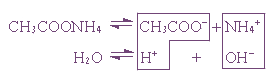
Пример 1. Гидролиз ацетата аммония.
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания.
Если продукты гидролиза могут удаляться из раствора, например, в виде осадка или газообразного вещества, то гидролиз протекает до конца.
Пример 2. Гидролиз сульфида алюминия.
2А l 3+ + 3 S 2- + 6Н2О = 2Аl(OН)3(осадок) + ЗН2S (газ)
Пример 3. Гидролиз ацетата алюминия
1. Определяем тип гидролиза:
Соль образована катионом слабого основания и анионами слабой кислоты.
2. Пишем ионные уравнения гидролиза, определяем среду:
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону.
Следовательно, в растворе будет избыток ионов водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
3 . Составляем молекулярное уравнение:
Это тоже формальное упражнение, для тренировки в составлении формул солей и их номенклатуре. Полученную соль назовем ацетат гидроксоалюминия.
Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и сильного основания
4. Соли, образованные сильной кислотой и сильным основанием
, гидролизу не подвергаются, т.к. единственным малодиссоциирующим соединением является H2O.
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Источник
Электролиз расплавов
05-Апр-2013 | комментариев 14 | Лолита Окольнова
Мы уже рассматривали электролиз растворов солей, теперь давайте разберем электролиз расплавов веществ.
В этой лекции мы рассмотрим электролиз расплавов трех видов веществ:
- электролиз расплавов оксидов;
- электролиз расплавов оснований;
- электролиз расплавов солей.
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионыокисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
-
КАТод — КАТионы (ионы у катода)
-
АНод — АНионы (ионы у анода)
Электролиз расплавов оксидов
На катоде идет восстановление: Me n+ + ne— = Me0, т.е. на катоде выделяется металл.
На аноде окисляется кислород: O-2 -2e— = O2
Возьмем для примера электролиз расплава оксида калия: 2K2O -> 4K + O2
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл:
Me n+ +ne— = Me0
На аноде будет окисляться кислород в составе гидроксид-группы:
4OH− −4e =2H2O + O2
Электролиз расплавов солей
1. Электролиз расплава бескислородной соли:
На катоде всегда восстанавливается металл: Me n+ +ne— = Me0
На аноде окисляется бескислородный анион: A n- — ne— = A0
Электролиз расплава NaCl: 2NaCl = 2Na + Cl2
2. Электролиз расплава кислородсодержащей соли (элемент аниона не в высшей степени окисления):
На катоде всегда восстанавливается металл: Me n+ +ne— = Me0
На аноде будет окисляться элемент аниона: SO3 2- — 2e— = SO3
Например, электролиз расплава сульфита натрия:
Na2SO3 = 2Na + SO3
S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 — SO3
3. Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления):
На катоде все без изменений 🙂
На аноде — т.к. элемент уже в высшей степени окисления, то окисляться будет кислород:
2CO3-2 — 4e—= 2CO2 + O2
Например, электролиз расплава карбоната натрия:
2Na2CO3 = 4Na + 2CO2+ O2
Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока.
Обсуждение: «Электролиз расплавов»
(Правила комментирования)
Электролиз растворов
и расплавов солей (2 ч)
Занятия элективного курса
«Электрохимия»
Цели первого урока: научить писать схемы
электролиза растворов и расплавов солей и
применять полученные знания для решения
расчетных задач; продолжить формирование
навыков работы с учебником, тестовыми
материалами; обсудить применение электролиза в
народном хозяйстве.
П л а н п е р в о г о у р о к а
1. Повторение изученных способов получения
металлов.
2. Объяснение нового материала.
3. Решение задач из учебника Г.Е.Рудзитиса,
Ф.Г.Фельдмана «Химия-9» (М.: Просвещение, 2002), с. 120,
№ 1, 2.
4. Проверка усвоения знаний на тестовых
заданиях.
5. Сообщение о применении электролиза.
Цели первого урока: научить писать схемы
электролиза растворов и расплавов солей и
применять полученные знания для решения
расчетных задач; продолжить формирование
навыков работы с учебником, тестовыми
материалами; обсудить применение электролиза в
народном хозяйстве.
ХОД ПЕРВОГО УРОКА
Повторение изученных
способов получения металлов на примере
получения меди из оксида меди(II).
Запись уравнений соответствующих реакций:
Еще один способ
получения металлов из растворов и расплавов их
солей – электрохимический, или электролиз.
Электролиз – это
окислительно-восстановительный процесс,
происходящий на электродах при пропускании
электрического тока через расплав или раствор
электролита.
Электролиз расплава хлорида натрия:
NaCl Na+ + Cl–;
катод (–) (Na+): Na+ + е = Na0,
анод (–) (Cl–): Cl– – е = Cl0, 2Cl0
= Cl2;
2NaCl = 2Na + Cl2.
Электролиз раствора хлорида натрия:
NaCl Na+ + Cl–,
H2O Н+
+ ОН–;
катод (–) (Na+; Н+): H+ + е = H0,
2H0 = H2
(2H2O + 2е = H2 + 2OH–),
анод (+) (Cl–; OН–): Cl– – е = Cl0,
2Cl0 = Cl2;
2NaCl + 2H2O = 2NaOH + Cl2 + H2
.
Электролиз раствора нитрата меди(II):
Cu(NO3)2 Cu2+ +
Н2O H+
+ OH–;
катод (–) (Cu2+; Н+): Cu2+ + 2е = Cu0,
анод (+) ( OН–): OH– – е = OH0,
4H0 = O2 + 2H2O;
2Cu(NO3)2 + 2H2O = 2Cu + O2
+ 4HNO3.
Эти три примера показывают, почему электролиз
проводить выгоднее, чем осуществлять другие
способы получения металлов: получаются металлы,
гидроксиды, кислоты, газы.
Мы писали схемы электролиза, а теперь попробуем
написать сразу уравнения электролиза, не
обращаясь к схемам, а только используя шкалу
активности ионов:
Примеры уравнений электролиза:
2HgSO4 + 2H2O = 2Hg + O2
+ 2H2SO4;
Na2SO4 + 2H2O = Na2SO4
+ 2H2 + O2
;
2LiCl + 2H2O = 2LiOH + H2 + Cl2
.
Решение задач из
учебника Г.Е.Рудзитиса и Ф.Г.Фельдмана (9-й класс,
с. 120, № 1, 2).
Задача 1. При электролизе раствора хлорида
меди(II) масса катода увеличилась на 8 г. Какой газ
выделился, какова его масса?
Решение
CuCl2 + H2O = Cu + Cl2 + H2O,
(Cu) = 8/64 = 0,125
моль,
(Cu) =
(Сl2) = 0,125 моль,
m(Cl2) = 0,125•71 = 8,875 г.
Ответ. Газ – хлор массой 8,875 г.
Задача 2. При электролизе водного раствора
нитрата серебра выделилось 5,6 л газа. Сколько
граммов металла отложилось на катоде?
Решение
4AgNO3 + 2H2O = 4Ag + O2 + 4HNO3,
(O2) = 5,6/22,4 =
0,25 моль,
(Ag) = 4
(O2) = 4•25 = 1 моль,
m(Ag) = 1•107 = 107 г.
Ответ. 107 г серебра.
Тестирование
Вариант 1
1. При электролизе раствора гидроксида
калия на катоде выделяется:
а) водород; б) кислород; в) калий.
2. При электролизе раствора сульфата меди(II)
в растворе образуется:
а) гидроксид меди(II);
б) серная кислота;
в) вода.
3. При электролизе раствора хлорида бария на
аноде выделяется:
а) водород; б) хлор; в) кислород.
4. При электролизе расплава хлорида
алюминия на катоде выделяется:
а) алюминий; б) хлор;
в) электролиз невозможен.
5. Электролиз раствора нитрата серебра
протекает по следующей схеме:
а) AgNO3 + H2O Ag
+ Н2
+ HNO3;
б) AgNO3 + H2O Ag
+ О2
+ HNO3;
в) AgNO3 + H2O AgNO3
+ Н2 + О2
.
Вариант 2
1. При электролизе раствора гидроксида
натрия на аноде выделяется:
а) натрий; б) кислород; в) водород.
2. При электролизе раствора сульфида натрия
в растворе образуется:
а) сероводородная кислота;
б) гидроксид натрия;
в) вода.
3. При электролизе расплава хлорида ртути(II)
на катоде выделяется:
а) ртуть; б) хлор; в) электролиз невозможен.
4. При электролизе раствора нитрата серебра
на катоде выделяется:
а) серебро; б) водород; в) кислород.
5. Электролиз раствора нитрата ртути(II)
протекает по следующей схеме:
а) Hg(NO3)2 + H2O Hg
+ Н2
+ HNO3;
б) Hg(NO3)2 + H2O Hg
+ О2
+ HNO3;
в) Hg(NO3)2 + H2O Hg(NO3)2 + Н2
+ О2
.
Вариант 3
1. При электролизе раствора нитрата меди(II)
на катоде выделяется:
а) медь; б) кислород; в) водород.
2. При электролизе раствора бромида лития в
растворе образуется:
а) вода;
б) бромоводородная кислота;
в) гидроксид лития.
3. При электролизе расплава хлорида серебра
на катоде выделяется:
а) серебро; б) хлор; в) электролиз невозможен.
4. При электролизе раствора хлорида
алюминия алюминий выделяется на:
а) катоде; б) аноде; в) остается в растворе.
5. Электролиз раствора бромида бария
протекает по следующей схеме:
а) BaBr2 + H2O Br2
+ Н2 + Ba(OH)2;
б) BaBr2 + H2O Br2
+ Ba + H2O;
в) BaBr2 + H2O Br2
+ О2 + Ba(OH)2.
Вариант 4
1. При электролизе раствора гидроксида
бария на аноде выделяется:
а) водород; б) кислород; в) барий.
2. При электролизе раствора йодида калия в
растворе образуется:
а) йодоводородная кислота;
б) вода; в) гидроксид калия.
3. При электролизе расплава хлорида
свинца(II) на катоде выделяется:
а) свинец; б) хлор; в) электролиз невозможен.
4. При электролизе раствора нитрата серебра
на катоде выделяется:
а) серебро; б) водород; в) кислород.
5. Электролиз раствора сульфида натрия
протекает по следующей схеме:
а) Na2S + H2O S
+ Н2
+ NaOH;
б) Na2S + H2O Н2
+ O2
+ Na2S;
в) Na2S + H2O Н2
+ Na2S + NaOH.
Ответы
| Вариант | Вопрос 1 | Вопрос 2 | Вопрос 3 | Вопрос 4 | Вопрос 5 |
| 1 | а | б | б | а | б |
| 2 | б | б | а | а | б |
| 3 | а | в | а | в | а |
| 4 | б | в | а | а | а |
Применение
электролиза в народном хозяйстве
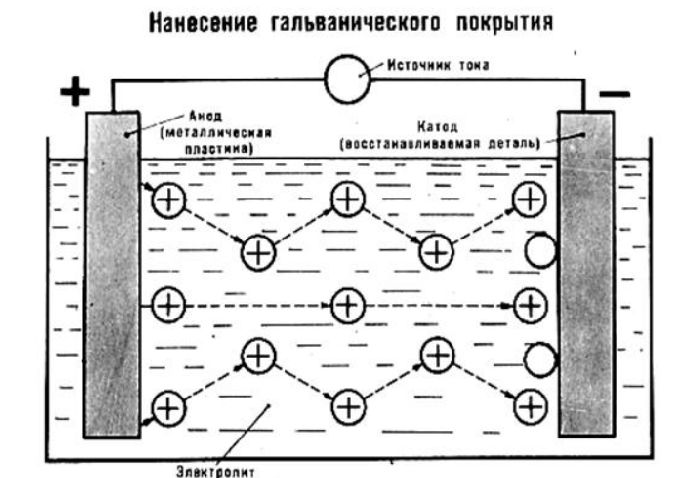
1. Для защиты металлических изделий от
коррозии на их поверхность наносят тончайший
слой другого металла: хрома, серебра, золота,
никеля и т.д. Иногда, чтобы не расходовать дорогие
металлы, производят многослойное покрытие.
Например, внешние детали автомобиля сначала
покрывают тонким слоем меди, на медь наносят
тонкий слой никеля, а на него – слой хрома.
При нанесении покрытий на металл электролизом
они получаются ровными по толщине, прочными.
Таким способом можно покрывать изделия любой
формы. Эту отрасль прикладной электрохимии
называют гальваностегией.
2. Кроме защиты от коррозии гальванические
покрытия придают красивый декоративный вид
изделиям.
3. Другая отрасль электрохимии, близкая по
принципу к гальваностегии, названа
гальванопластикой. Это процесс получения точных
копий различных предметов. Для этого предмет
покрывают воском и получают матрицу. Все
углубления копируемого предмета на матрице
будут выпуклостями. Поверхность восковой
матрицы покрывают тонким слоем графита, делая ее
проводящей электрический ток.
Полученный графитовый электрод опускают в
ванну с раствором сульфата меди. Анодом служит
медь. При электролизе медный анод растворяется, а
на графитовом катоде осаждается медь. Таким
образом получается точная медная копия.
С помощью гальванопластики изготавливают
клише для печати, грампластинки, металлизируют
различные предметы. Гальванопластика открыта
русским ученым Б.С.Якоби (1838).
Изготовление штампов для грампластинок
включает нанесение тончайшего серебряного
покрытия на пластмассовую пластинку, чтобы она
стала электропроводной. Затем на пластинку
наносят электролитическое никелевое покрытие.
Чем следует сделать пластинку в
электролитической ванне – анодом или катодом?
(О т в е т. Катодом.)
4. Электролиз используют для получения
многих металлов: щелочных, щелочно-земельных,
алюминия, лантаноидов и др.
5. Для очистки некоторых металлов от
примесей металл с примесями подключают к аноду.
Металл растворяется в процессе электролиза и
выделяется на металлическом катоде, а примесь
остается в растворе.
6. Электролиз находит широкое применение
для получения сложных веществ (щелочей,
кислородсодержащих кислот), галогенов.
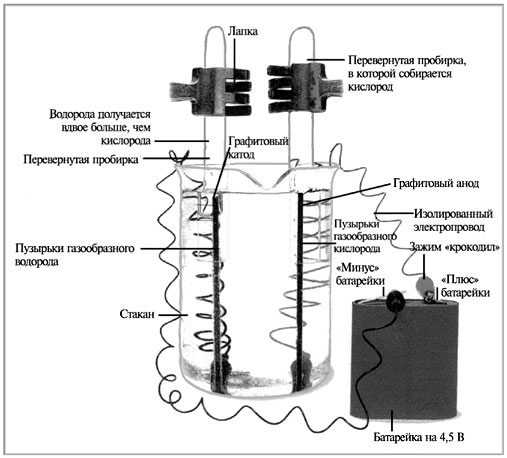 |
Схема электролиза воды |
Практическая работа
(второй урок)
Цели урока. Провести электролиз воды,
показать гальваностегию на практике, закрепить
знания, полученные на первом уроке.
Оборудование. На столах учащихся:
плоская батарейка, два провода с клеммами, два
графитовых электрода, химический стакан,
пробирки, штатив с двумя лапками, 3%-й раствор
сульфата натрия, спиртовка, спички, лучина.
На столе учителя: то же + раствор медного
купороса, латунный ключ, медная трубка (кусок
меди).
Инструктаж учащихся
1. Прикрепить провода клеммами к электродам.
2. Электроды поставить в стакан, чтобы они не
соприкасались.
3. Налить в стакан раствор электролита (сульфата
натрия).
4. В пробирки налить воды и, опустив их в стакан с
электролитом кверху дном, надеть их на
графитовые электроды поочередно, закрепив
верхний край пробирки в лапке штатива.
5. После того как прибор будет смонтирован,
концы проводов прикрепить к батарейке.
6. Наблюдать выделение пузырьков газов: на аноде
их выделяется меньше, чем на катоде. После того
как в одной пробирке почти вся вода вытеснится
выделяющимся газом, а в другой – наполовину,
отсоединить провода от батарейки.
7. Зажечь спиртовку, осторожно снять пробирку,
где вода почти полностью вытеснилась, и поднести
к спиртовке – раздастся характерный хлопок газа.
8. Зажечь лучину. Снять вторую пробирку,
проверить тлеющей лучиной газ.
Задания для учащихся
1. Зарисовать прибор.
2. Написать уравнение электролиза воды и
пояснить, почему надо было проводить электролиз
в растворе сульфата натрия.
3. Написать уравнения реакций, отражающие
выделение газов на электродах.
Учительский демонстрационный
эксперимент
(могут выполнять лучшие ученики класса
при наличии соответствующего оборудования)
1. Подсоединить клеммы проводов к медной трубке
и латунному ключу.
2. Опустить трубку и ключ в стакан с раствором
сульфата меди(II).
3. Подсоединить вторые концы проводов к
батарейке: «минус» батарейки к медной трубке,
«плюс» к ключу!
4. Наблюдать выделение меди на поверхности
ключа.
5. После выполнения эксперимента вначале
отсоединить клеммы от батарейки, затем вынуть
ключ из раствора.
6. Разобрать схему электролиза с растворимым
электродом:
CuSО4 = Сu2+ +
анод (+): Сu0 – 2e = Cu2+,
катод (–): Cu2+ + 2e = Сu0.
Суммарное уравнение электролиза с растворимым
анодом написать нельзя.
Электролиз проводился в растворе сульфата
меди(II), поскольку:
а) нужен раствор электролита, чтобы протекал
электрический ток, т.к. вода является слабым
электролитом;
б) не будут выделяться какие-либо побочные
продукты реакций, а только медь на катоде.
|
|
Ученик 9-го класса проводит
|
7. Для закрепления пройденного написать
схему электролиза хлорида цинка с угольными
электродами:
ZnCl2 = Zn2+ + 2Cl–,
катод (–): Zn2+ + 2e = Zn0,
2H2O + 2e = H2 + 2OH–,
анод (+): 2Cl– – 2e = Cl2.
Суммарное уравнение реакции в данном случае
написать нельзя, т.к. неизвестно, какая часть
общего количества электричества идет на
восстановление воды, а какая – на восстановление
ионов цинка.
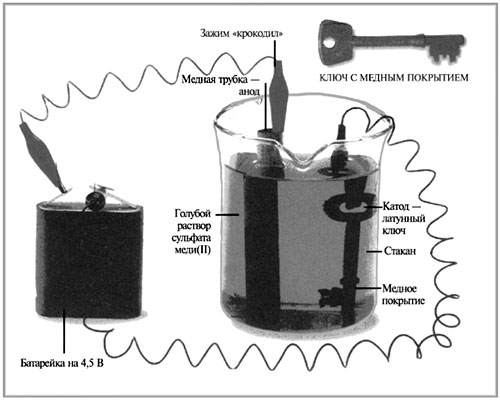 |
Схема демонстрационного
|
Домашнее задание
1. Написать уравнение электролиза раствора,
содержащего смесь нитрата меди(II) и нитрата
серебра, с инертными электродами.
2. Написать уравнение электролиза раствора
гидроксида натрия.
3. Чтобы очистить медную монету, ее надо
подвесить на медной проволоке, присоединенной к
отрицательному полюсу батареи, и опустить в 2,5%-й
раствор NаОН, куда следует погрузить также
графитовый электрод, присоединенный к
положительному полюсу батареи. Объясните, каким
образом монета становится чистой. (Ответ. На
катоде идет восстановление ионов водорода:
2Н+ + 2е = Н2.
Водород вступает в реакцию с оксидом меди,
находящимся на поверхности монеты:
СuО + Н2 = Сu + Н2О.
Этот способ лучше, чем чистка порошком, т.к. не
стирается монета.)