Как вычислять относительную плотность вещества
Такая характеристика, как относительная плотность вещества, показывает, во сколько раз оно тяжелее или легче другого соединения. Этот параметр можно определять по отношению к любому газообразному веществу. В большинстве случаев проводятся расчеты относительно воздуха или водорода. Однако могут попадаться задания, в которых необходимо вычислить относительную плотность и по другим газам, таким как кислород, аммиак или сероводород. В любом случае принцип решения задания един.

Вам понадобится
- — периодическая система химических элементов Д.И. Менделеева;
- — калькулятор.
Инструкция
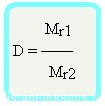
Для того чтобы справиться с задачей, необходимо использовать формулы на определение относительной плотности:
D (воздух) = Mr (газа)/ Mr (воздуха), где:
D (воздух) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (воздуха) — относительная молекулярная масса воздуха.
Все три параметра единиц измерения не имеют.
Mr (воздуха) = 29 (величина постоянная), следовательно формула будет иметь вид:
D (воздух) = Mr (газа)/ 29.
По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что вместо воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.
D (водород) = Mr (газа)/ Mr (водорода);
D (водород) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (водорода) — относительная молекулярная масса водорода.
Mr (водорода) = 2, следовательно и формула будет иметь вид:
D (воздух) = Mr (газа)/ 2.
Пример № 1. Вычислите относительную плотность аммиака по воздуху. Аммиак имеет формулу NH3.
Сначала найдите относительную молекулярную массу аммиака, которую можно рассчитать по таблице Д.И. Менделеева.
Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсюда
Mr (NH3) = 14 + 3 = 17
Подставьте полученные данные в формулу на определение относительной плотности по воздуху:
D (воздух) = Mr (аммиака)/ Mr (воздуха);
D (воздух) = Mr (аммиака)/ 29;
D (воздух) = 17/ 29 = 0, 59.
Пример № 2. Вычислите относительную плотность аммиака по водороду.
Подставьте данные в формулу на определение относительной плотности по водороду:
D (водород) = Mr (аммиака)/ Mr (водорода);
D (водород) = Mr (аммиака)/ 2;
D (водород) = 17/ 2 = 8, 5.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Относительная плотность по… задачи
24-Фев-2013 | комментариев 26 | Лолита Окольнова
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Например:
Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
- Если дана относительная плотность паров по водороду, то Mr (вещества)=Mr(H2)•D=2 гмоль • D;
- если дана относительная плотность по воздуху, то Mr (вещества)=Mr(воздуха)•D=29 гмоль • D (обратите внимание, Mr(воздуха) принята равной 29 гмоль);
и т.д.
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 гмоль • D
Mr(вещества)=29 гмоль • 1.448 = 42 гмоль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 гмоль · 0.8571=36 гмоль
x=Mr(Cx)Ar(C)=36 гмоль ÷ 12 гмоль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 гмоль · 0.1429=6 гмоль
x=Mr(Hy)Ar(H)=6 гмоль ÷ 1 гмоль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.
Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 гмоль ·1.05=42 гмоль
Запишем уравнение горения:
СхHy + O2 = xCO2 + y2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V22,4 лмоль = 33.622.4=1.5
n(H2O)=mMr=2718=1.5
Соотношение х : y2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) + Mr(H)
12n +2n=42
n=3
Наше вещество — C3H6 — пропен
- pадание ЕГЭ по этой теме — задачи С5
Обсуждение: «Относительная плотность по… задачи»
(Правила комментирования)
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Объёмные отношения газов при химических реакциях. Относительная плотность газов
I. Закон объемных отношений
«Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа».
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
V1:V2:V3 = ν1:ν2:ν3.
Примеры:
2CO + O2 → 2CO2
При окислении двух объемов оксида углерода (II) одним объемом кислорода образуется 2 объема углекислого газа, т.е. объем исходной реакционной смеси уменьшается на 1 объем.
V(CO):V(О2):V(CO2) = ν(CO):ν(О2):ν(CO2) = 2 : 1 : 2
При синтезе аммиака из элементов:
N2 + 3H2 → 2NH3
Один объем азота реагирует с тремя объемами водорода; образуется при этом 2 объема аммиака — объем исходной газообразной реакционной массы уменьшится в 2 раза.
V(N2):V(H2):V(NH3) = ν(N2):ν(H2):ν(NH3) = 1 : 3 : 2
II. Решите задачу по образцу
Вычислите объём кислорода, который потребуется для сжигания 5 м3 метана СН4н.у.?
Образец:
Какой объём кислорода (н.у.) потребуется для полного сгорания 10 м3 пропана С3Н8 (н.у.)?
|
Дано: V(С3Н8) = 10 м3 |
Решение: 1. Запишем УХР С3Н8 +5О2 → 3СО2+ 4Н2О 1моль 5моль 2. Согласно закону объёмных отношений для газов: V(С3Н8):V(О2) = ν(С3Н8):ν(О2) = 1 : 5 10 м3 :V(О2) = 1 : 5 V(О2) = (10 · 5) /1= 50 м3 Ответ: для сжигания 10 м3 пропана потребуется 50 м3 кислорода. |
|
Найти: V(О2) = ? |
III. Относительная плотность газов
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро:
2 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей):
Это отношение называется относительной плотностью D ( или d) одного газа по другому.
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Например,
DO2 (газа)= Mr(газа)/Mr(O2)=Mr(газа)/32;
DH2 (газа)= Mr(газа)/Mr(H2)=Mr(газа)/2;
Dвоздуха (газа)= Mr(газа)/Mr(воздуха)=Mr(газа)/29.
Задача
Образец: Найдите относительную плотность газа N2 по воздуху?
|
Дано: N2 М(воздуха) = 29 |
Решение: Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29. Mr(N2) = 2·Ar(N) = 2· 14 = 28 г/моль Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29=28/29= 0,97 |
|
Найти: Dвоздух — ? |
Ответ: газ азот легче воздуха в 0,97 раз Dвоздуха (N2)= 0,97 |
Задачи для самостоятельного решения
- Найдите относительную плотность газа О2 по водороду?
- Найдите относительную плотность газа СО2 по воздуху?
Решите задачуи для закрепления:
- Относительная плотность газа этана по водороду равна 15. Найдите молярную массу этана.
- Найдите относительную плотность газов по воздуху следующих газов: О2, Аr.
- Параграф 39
- Стр. 130 упр. 2,3 (письменно); тест
Перейти к содержанию
Таблица: относительные плотности газов по воздуху по водороду
На чтение 3 мин Просмотров 1.2к. Опубликовано
Относительная плотность или удельный вес – это отношение плотности (масса единицы объема) вещества к плотности данного справочный материал. Удельный вес жидкостей почти всегда измеряется по отношению к воде в ее самой плотной точке (при 4 ° C или 39,2 ° F); для газов эталоном является воздух при комнатной температуре (20 ° C или 68 ° F). Термин «относительная плотность» часто используется в научных целях.

| Газ | Химическая формула | Относительная плотность газа по воздуху | Молекулярный вес | Плотность кг/м³ | Плотность футов/фут³(lb/ft³) |
| Водород / Hydrogen | H2 | 0,07 | 2.016 | 0.08992) | 0.00562) |
| Гелий / Helium | He | 0,14 | 04.фев | 0.16641) | 0.010391) |
| 0.17852) | 0.0111432) | ||||
| Светильный газ угольный газ (горючий газ, состоящий из 20-30% метана и 50% водорода получаемый из каменного угля в процессе его полукоксования и частичного термического крекинга / Coal gas | 0,45 | 0.5802) | |||
| Пригодный газ = натуральный газ / Natural gas | 0,55-0,70 | 19.май | 0.7 – 0.92) | 0.044 – 0.0562) | |
| Метан / Methane | CH4 | 0,56 | 16.043 | 0.6681) | 0.04171) |
| 0.7172) | 0.04472) | ||||
| Аммиак / Ammonia | NH3 | 0,6 | 17.031 | 0.7171) | 0.04481) |
| 0.7692) | 0.04802) | ||||
| Водяной пар / Water Vapor, steam | H2O | 0,67 | 18.016 | 0.804 | 0.048 |
| Неон / Neon | Ne | 0,7 | 20.179 | 0.89992) | 0.0561792) |
| Продукты сгорания = смесь продуктов полного сгорания в виде CO2, Н2О, SO2 и золы + неполного сгорания в виде СО, Н2, и др., а также азота и кислорода / Combustion products | 0,86 | 1.112) | 0.0692) | ||
| Ацетилен = этин / Acetylene (ethyne) | C2H2 | 0,91 | 26 | 1.0921) | 0.06821) |
| 1.1702) | 0.07292) | ||||
| Азот / Nitrogen | N2 | 0,97 | 28.фев | 1.1651) | 0.07271) |
| 1.25062) | 0.0780722) | ||||
| Угарный газ, моноксид углерода / Carbon monoxide | CO | 0,97 | 28.янв | 1.1651) | 0.07271) |
| 1.2502) | 0.07802) | ||||
| Этилен / Ethylene | C2H4 | 0,98 | 28.мар | 1.2602) | 0.07862) |
| Воздух / Air | 1 | 29 | 1.2051) | 0.07521) | |
| 1.2932) | 0.08062) | ||||
| Двукосиь азота / Nitric oxide | NO | 1,04 | 30.0 | 1.2491) | 0.07801) |
| Этан / Ethane | C2H6 | 1,05 | 30.июл | 1.2641) | 0.07891) |
| Кислород / Oxygen | O2 | 1,11 | 32 | 1.3311) | 0.08311) |
| 1.42902) | 0.0892102) | ||||
| Сероводород = сернистый водород / Hydrogen Sulfide | H2S | 1,19 | 34.076 | 1.4341) | 0.08951) |
| Соляная кислота = хлористый водород / Hydrochloric Acid = Hydrogen Chloride | HCl | 1,27 | 36.5 | 1.5281) | 0.09541) |
| Аргон / Argon | Ar | 1,38 | 39.948 | 1.6611) | 0.10371) |
| 1.78372) | 0.1113532) | ||||
| Пропен = пропилен / Propene (propylene) | C3H6 | 1,45 | 42.1 | 1.7481) | 0.10911) |
| Углекислый газ = двуокись углерода, диоксид углерода / Carbon dioxide | CO2 | 1,53 | 44.01 | 1.8421) | 0.11501) |
| 1.9772) | 0.12342) | ||||
| Пропан / Propane | C3H8 | 1,57 | 44.09 | 1.8821) | 0.11751) |
| Веселящий газ, закись азота / Nitrous Oxide | N2O | 1,65 | 44.013 | 1.9801) | 0.114 |
| Озон / Ozone | O3 | 1,78 | 48.0 | 2.142) | 0.125 |
| Оксид серы (II)= диоксид серы = двуокись серы = сернистый ангидрид = сернистый газ / Sulfur Dioxide | SO2 | 1,9 | 64.06 | 2.2791) | 0.17031) |
| 2.9262) | 0.18282) | ||||
| Бутилен = Бутен / Butylene (Butene) | C4H8 | 2,03 | 56.11 | 2.504 | 0.1482) |
| Бутан / Butane | C4H10 | 2,07 | 58.1 | 2.4891) | 0.15541) |
| 2.52) | 0.1562) | ||||
| Хлор / Chlorine | Cl2 | 2,49 | 70.906 | 2.9941) | 0.18691) |
| Бензол / Benzene | C6H6 | 2,9 | 78.11 | 3.486 | 0.20643 |
| Криптон / Krypton | Kr | 2,9 | 83,8 | 3.742) | |
| Метилбензол = толуол / Toluene | C7H8 | 3,42 | 92.141 | 4.111 | 0.2435 |
| Ксенон / Xenon | Xe | 4,54 | 131,293 | 5.862) |
1) NTP – Нормальная температура и давление (Normal Temperature and Pressure) – 20oC (293.15 K, 68oF) при 1 атм ( 101.325 кН/м2, 101.325 кПа, 14.7 psia, 0 psig, 30 in Hg, 760 мм.рт.ст)
2) STP – Стандартная температура и давление (Standard Temperature and Pressure) – 0oC (273.15 K, 32oF) при 1 атм (101.325 кН/м2, 101.325 кПа, 14.7 psia, 0 psig, 30 in Hg, 760 torr=мм.рт.ст)