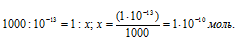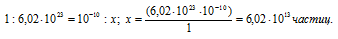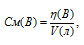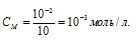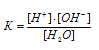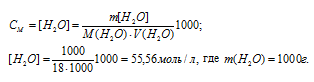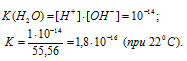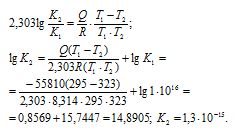Вычисление концентрации ионов водорода и расчет рН раствора электролита
Задача 556.
Сколько ионов водорода содержится в 1 мл раствора, рН которого равен 13: а) 1013; б) 60,2 . 1013; в) 6,02 . 107; г) 6 ,02 . 1010?
Решение:
Согласно условию задачи -lg[H+] = 13, Следовательно, lg[H+] = -13 = 13. По таблице логарифмов находим [H+] = 1 . 10-13 моль/л.
Находим количество ионов водорода, содержащихся в 1 мл раствора из пропорции:
Известно, что один моль любого вещества содержит 6,02 . 1023 молекул. Тогда количество ионов водорода в 1 мл раствора находим из пропорции:
Ответ: б).
Задача 557.
Как изменится рН воды, если к 10 л ее добавить 10-2 моль NаОН; а) возрастет на 2; б) возрастет на 3; в) возрастет на 4; г) уменьшится на 4?
Решение:
Рассчитаем молярную концентрацию полученного раствора по формуле:
где
СМ(В) — молярная концентрация вещества В, моль/л; n(B) — количество растворённого вещества В, моль; V – объём раствора, л (мл).
Отсюда
Едкий натр является сильным электролитом, поэтому степень диссоциации его можно считать равной единице. Тогда концентрация гидроксид-ионов в растворе будет равна концентрации самого электролита — 10-3 моль/л.
Теперь рассчитаем рОН раствора:
pOН = -lgOH=] = -lg10-3 = 3 + lg1 = 3 + 0 = 3.
Отсюда
pH = 14 — pOH = 14 — 3 = 11.
рН чистого раствора воды равна 7. Отсюда найдём разницу между рН чистой воды и рН раствора щёлочи:
pH(H2O) — pH(NaOH) = 11 — 7 = 4.
Таким образом, рН раствора увеличилась на 4.
Ответ: в).
Задача 558.
Чему равен рН нейтрального раствора при 50°С: а) 5,5; б) 6,6; в) 7,0?
Решение:

Количественно диссоциация воды описывается константой диссоциации:
и ионным произведением воды:
KW = [H+] . [OH—] = 10-14(при 220С).
Молярная концентрация воды в 1 л раствора рассчитаем из соотношения:
Константу диссоциации при температуре 220С рассчитаем, решив уравнение относительно ионного произведения воды:
Зная константу равновесия при одной температуре можно рассчитать её значение при другой температуре из соотношения:
Подставив вычисленное значение К2 в уравнение ионного произведения воды, получим:
[H+] . [OH-] = K[H2O]; pH = 13 . 10-15 . 55,81 = 7,2 . 10-14.
Kp(H2O) = -lg7,2 . 10-14 = 14 — lg7,2 = 14 — 0,86 = 13,16.
Находим рН раствора из соотношения Kp(H2O) = pH + pOH и, учитывая, что в нейтральном растворе рН = рОН, получим:
13,16 = pH + pOH; pH = 13,16/2 = 6,58 или 6,6.
Ответ: б).
pH раствора 4,4. Определить концентрацию ионов водорода в этом растворе.
Решение задачи
Перед решением данной задачи хочу напомнить, водородный показатель (pH) раствора численно равен десятичному логарифму концентрации ионов водорода в этом растворе.
Пусть искомая концентрация . Тогда, учитывая, что pH раствора 4,4, найдем концентрацию ионов водорода в этом растворе:
Таким образом,концентрация ионов водорода в растворе равна 4 ∙ 10-5 моль/л.
Ответ: концентрация ионов водорода = 4 ∙ 10-5 моль/л.
Hydrogen ion concentration tells us how acidic or basic any given solution is. More hydrogen ions? More acidic. Fewer hydrogen ions? More basic. Pretty simple, right? Let’s take a look at how to define and calculate hydrogen ion concentration. First, you’ll see how you get hydrogen ions and hydroxide ions in water.
Self-Ionization of Water
Water self-ionizes to a small extent:
This is a simplification, as free hydrogen ions don’t actually exist in solution. This is what it actually looks like:
Through hydrogen bonding, the hydrogen ion associates with a water molecule to create H3O+, or hydronium. Thus when you calculate the hydrogen ion concentration, you are also calculating the hydronium ion concentration.
For water, the water ion product or Kw tells us the concentration of H+ or H3O+ and the concentration of OH— or hydroxide ions.
At 25 degrees Celsius, the experimentally determined value of KW is 1.0 x 10-14 M2.
Let’s take a look at how you can use your knowledge of dissociation and KW to calculate the hydrogen ion concentration for either strong acids or bases.
Calculating the Hydrogen Ion Concentration From Molarity of a Strong Acid
A strong acid increases the hydrogen ion concentration over hydroxide ions present.
An example is HCl:
Since HCl is a strong acid, it dissociates completely in water. So, let’s say that you have a 1.5M HCl solution. What is the hydrogen ion concentration?
Well, this is pretty simple and doesn’t even require any math! Since the acid dissociates completely the hydrogen ion concentration is the same as the molarity of the solution. In this case that means the concentration of hydrogen ions, or [H+], is 1.5M.
A strong base, on the other hand, has more hydroxide ions than hydrogen ions. Let’s say that you have a 0.1M solution of NaOH. What is the concentration of H+ in this case? Now, you’re going to need to use your knowledge of KW.
You know that since this strong base dissociates completely, the hydroxide, or OH-, concentration is equal to the molarity of the solution. [OH-] = 0.1 M.
So,
Solving for [H+] you get:
This makes sense! Since it is a basic solution there are way more hydroxide ions than there are hydrogen ions.
Calculating the Hydrogen Ion Concentration From pH
Now, dealing with scientific notation all the time to discuss hydrogen ion concentration is a little cumbersome. Instead, scientists use the pH scale.
Here is the definition of pH:
pH is the negative log of the hydrogen concentration. The letter p literally means negative log.
So, given a pH value of 5.5 you can find the hydrogen ion concentration:
Diving by negative one and taking the inverse log gives you:
Solving, you get:
The hydrogen ion concentration of a solution with pH = 5.5 is 3.2*10-6M. See, this is why talking about a pH is much easier than the whole long number you got for an answer! A pH of 5.5 tells you about acidity, and you can calculate the molarity if you need it.
What Do pKa Values Mean?
While calculating the concentration of hydrogen ions of strong acids is easy enough since they dissociate completely in solution, calculating the concentration of hydrogen ions in weak acids is just a little trickier. These acids do not completely ionize in water. Each acid has a tendency to lose a hydrogen ion in an aqueous solution. A stronger acid is more likely to lose its hydrogen ion than a weak acid.
Equilibrium constants for ionization reactions are calls acid dissociation constants (Ka). Stronger acids have a higher Ka while weaker acids have a lower Ka. Now, just as with hydrogen ion concentration, where you made the switch to pH instead of just H, scientists use pKa to indicate how strong or weak an acid is. With a higher tendency to lose a proton, the acid is stronger, and so the pKa is smaller.
Tips
-
The higher a pKa value, the weaker the acid; the lower the pKa value the stronger the acid.
Концентрация ионов водорода в растворе является результатом добавления кислоты. Сильные кислоты дают более высокую концентрацию ионов водорода, чем слабые кислоты, и можно рассчитать результирующую концентрацию ионов водорода либо по знанию рН, либо по знанию силы кислоты в растворе. Решение с известным pH легче, чем решение по константе диссоциации кислоты и начальной концентрации.
Решение с известным pH или pOH
Проверьте, содержит ли предоставленная информация pH или pOH раствора.
Рассчитайте концентрацию ионов водорода, взяв 10 к степени отрицательного рН. Например, для раствора с рН 6, 5 концентрация ионов водорода будет 1 * 10 ^ -6, 5, что равно 3, 16 * 10 ^ -7. Ученые определили pH как логарифмическое сокращение концентрации ионов водорода. Это означает, что рН равен отрицательному логарифму концентрации ионов водорода.
Вычтите pOH из 14 (pH и pOH всегда прибавляют до 14), чтобы получить pH, если он сталкивается только с числом pOH, затем завершите приведенный выше расчет, поскольку pOH является отрицательным логарифмом концентрации ионов OH в растворе.,
Решение от постоянной диссоциации кислоты (Ка) и количества
При необходимости переведите из граммов в родинки молярную массу кислоты. Общественный колледж Клакамас предлагает отличное руководство о том, как это сделать (см. Ресурсы). Каждый студент, изучающий химию, должен понимать, что такое преобразование единиц, и последовательно с ними практиковаться.
Определите молярную концентрацию кислоты, рассчитав число молей, деленное на литры: например, 0, 15 моля кислоты на 100 мл будет равно 0, 15, деленному на 0, 100, что равно 1, 5 М раствору.
Используйте исходную концентрацию кислоты в качестве концентрации ионов водорода для сильной кислоты в растворе: вся кислота ионизируется. Ниже перечислены только сильные кислоты: HCl (соляная), HBr (бромистоводородная), HI (иодистоводородная), H2SO4 (серная), HNO3 (азотная) и HClO4 (хлорная).
Используйте константу диссоциации кислоты и калькулятор, чтобы найти концентрацию ионов водорода для слабой кислоты. Запишите это уравнение: Ka = (*) / где концентрация кислоты в равновесии, концентрация ионов водорода, концентрация сопряженного основания или аниона, которая будет равна, а Ka постоянная диссоциации кислоты,
Подключите известное значение для Ka. Тогда уравнение выглядит так: Ka = x ^ 2 / Теперь, так как кислота расщепляется на ионы, молярная концентрация каждого иона в равновесии равна той же величине, которая отсутствует в исходной кислоте. Так что это уравнение равно: Ка = х ^ 2 / (Исходная концентрация минус х).
Переведите это в квадратное уравнение: X ^ 2 + Ka x — (исходная концентрация * Ka) = 0 Используйте квадратную формулу, чтобы найти окончательное значение x.
Загрузить PDF
Загрузить PDF
В быту под pH подразумевают обычно шкалу, используемую для описания нейтральности или, наоборот, недостатка нейтральности того или иного вещества. В научном значении величина pH соответствует количеству ионов в химическом растворе. Если вы изучаете химию или связанные с ней предметы, вам может понадобиться рассчитать уровень pH, основываясь на концентрации веществ в растворе. Значение pH находится по следующей формуле: pH = -lg[H3O+].
-
1
Ознакомьтесь с понятием pH. Величина pH соответствует концентрации ионов водорода в растворе. Раствор с повышенной концентрацией ионов водорода называется кислотным, а раствор с пониженной концентрацией этих ионов – щелочным.[1]
Ионы водорода кратко обозначают как H+. Их можно представлять и в составе соединения, тогда они называются гидроксонием и записываются как H30+.- Ознакомьтесь со шкалой pH. Значения на шкале pH изменяются от 1 до 14. Чем меньше число, тем более кислотным является данный раствор. И наоборот, чем выше значение, тем более щелочным является раствор.[2]
Например, pH апельсинового сока составляет 2, поскольку этот сок представляет собой довольно кислотную жидкость. У хлорного отбеливателя pH равно 12, так как в нем много щелочи.[3]
В середине шкалы располагаются относительно нейтральные растворы, такие как вода, pH которой составляет 7. - Разница между двумя растворами на 1 пункт по шкале pH означает, что они различаются по кислотности в 10 раз. Например, если взять два раствора со значениями pH 6 и 7, кислотность первого раствора с pH 6 будет выше кислотности второго раствора с pH 7 в 10 раз. А, например, кислотность раствора с pH 6 выше кислотности раствора с pH 8 в 100 раз.[4]
- Ознакомьтесь со шкалой pH. Значения на шкале pH изменяются от 1 до 14. Чем меньше число, тем более кислотным является данный раствор. И наоборот, чем выше значение, тем более щелочным является раствор.[2]
-
2
Запомните уравнение для определения pH. Шкала pH вычисляется с помощью отрицательного десятичного логарифма. Отрицательный десятичный логарифм соответствует числу нулей, стоящих перед единицей, включая и ноль целых: например, отрицательный десятичный логарифм числа 0,1 равен 1, числа 0,01 — 2, и так далее.[5]
Формула для нахождения pH выглядит следующим образом: pH = -lg[H3O+].- Иногда формулу записывают в виде pH = -lg[H+]. Неважно, стоит ли в уравнении H3O+ или H+, обе формы записи равноценны.
- Для нахождения pH необязательно уметь рассчитывать десятичный логарифм, так как практически в каждом научном или инженерном калькуляторе есть опция его вычисления.
-
3
Ознакомьтесь с понятием концентрации. Концентрация какого-либо вещества соответствует числу частиц этого вещества, присутствующих в растворе.[6]
Как правило, концентрация выражается в количестве молей на единицу объема и обозначается как m/V, или M. В химических лабораториях концентрации растворов пишут на бутылках с ними. Если вы решаете химическую задачу, концентрация может быть дана в условии, либо ее требуется найти.Реклама
-
1
Вспомните формулу для нахождения pH. Вот эта формула: pH = -lg[H3O+].[7]
Убедитесь в том, что вы знакомы со всеми элементами, входящими в данную формулу. Посмотрите, какая величина соответствует концентрации.- В химии квадратные скобки означают концентрацию чего-либо. Так что формула для расчета pH читается как «pH равно отрицательному логарифму концентрации гидроксоний-ионов».
-
2
Определите действительную концентрацию. Внимательно прочитайте условие задачи. Найдите в исходных данных концентрацию кислоты или щелочи. Запишите полную формулу на листке бумаги, подставив в нее известные величины.[8]
Чтобы не возникло путаницы, рядом с числами всегда указывайте единицы измерения.- Например, если концентрация составляет 1,05 x 105 M, запишите формулу для расчета pH в следующем виде: pH = -lg[1,05 x 105 M]
-
3
Вычислите pH. Для этого удобно использовать научный калькулятор. Сначала введите знак минуса, нажав кнопку «+/-». Затем нажмите кнопку «log», соответствующую десятичному логарифму (в английском языке десятичный логарифм обозначается как log). На экране отобразится «-log».[9]
Затем нажмите левую скобку и введите концентрацию. При необходимости не забудьте указать значение степени.[10]
После этого закройте скобки.[11]
В результате на экране калькулятора вы увидите «-log(1,05×105). Нажмите «=». У вас должно получиться значение pH, приблизительно равное 4,98.Реклама
-
1
Определите, что дано и что требуется найти. Запишите формулу для вычисления pH. После этого выясните известные величины, выписав их значения под формулой. Например, если известно, что pH равно 10,1, запишите это число под pH в формуле.
-
2
Преобразуйте формулу. При этом вам понадобятся знания из школьного курса алгебры. Для вычисления концентрации по известному значению pH необходимо преобразовать формулу так, чтобы концентрация обособленно стояла с какой-либо из двух сторон уравнения. То есть необходимо, чтобы по одну сторону знака равенства было выражение, содержащее величину pH, а по другую — концентрация гидроксония. Сначала умножьте обе части уравнения на -1. Затем возведите 10 в степени, стоящие по обе стороны получившегося равенства.
- Преобразовывая равенство pH = -log[H3O+], получаем формулу +[H3O+] = 10-pH, то есть концентрация ионов равна десяти в степени -pH. Теперь вместо pH подставляем известное значение, в нашем случае 10,1.
-
3
Решите уравнение. Для возведения десяти в степень в калькуляторе предусмотрена определенная процедура. Сначала наберите 10. Затем нажмите клавишу возведения в степень «EXP». Введите знак минуса и значение степени. Нажмите «=».
- В нашем примере pH равно 10,1. Наберите «10» и нажмите клавишу «EXP». После этого нажмите «-/+», меняя знак. И наконец, введите значение pH «10,1» и нажмите клавишу «=». В результате у вас должно получиться 1e-100. Это означает, что концентрация составляет 1,00 x 10-100 M.
-
4
Обдумайте полученный ответ. Имеет ли он физический смысл? Если pH равно 10,1, это значит, что концентрация гидроксония чрезвычайно мала, и у вас щелочной раствор.[12]
Таким образом, найденная очень низкая концентрация соответствуетРеклама
Советы
- Если вычисление уровня pH поначалу кажется вам трудным, не забывайте, что существует множество источников, позволяющих больше узнать об этом вопросе. Воспользуйтесь учебником химии или попросите преподавателя помочь вам.
Реклама
Об этой статье
Эту страницу просматривали 130 279 раз.