Как правильно рассчитать константу диссоциации слабого электролита
Задача 94.
Концентрация ионов Н+ в 0,1 М растворе СН3СООН равна 1,3 · 10–3 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(СН3СООН) = 0,1 моль/дм3;
[H+] = 1,3 · 10–3 моль/дм3;
KD(CH3COOH) = ?
α = ?
1. Вычисление степень диссоциации уксусной кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(CH3COOH) = (1,3 · 10–3)/0,1 = 1,3 · 10–2 или 1,3%.
2. Вычисление константы диссоциации уксусной кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(СН3СООН) = [(α)2 · СМ(СН3СООН)]/(1 — α) = [(1,3 · 10–2)2 · 0,1]/(1 — 1,3 · 10–2) =
= 0,0000169/0,987 = 0,0000171 = 1,71 · 10–5.
Ответ: KD(СН3СООН) = 1,71 · 10–5; альфа = 1,3%.
Задача 95.
Вычислите константу диссоциации НСООН, если в растворе w% = 0,46% и она диссоциирована на 4,2%.
Решение:
М(НСООН) = 46 г/моль;
w% = 0,46%;
α = 4,2% или 0,042
KD(НСООН) = ?
1. Вычисление концентрацию муравьиной кислоты
Концентрацию кислоты находим из вычисления:
СМ(НСООН) = [(w% · 1000г)/100%]/M(НСООН); СМ(НСООН) = [(0,46% · 1000г)/100%]/46 г/моль = 0,1 моль/дм3.
2. Вычисление константы диссоциации НСООН
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(НСООН) = [(0,042)2 · 0,1]/(1 — 0,042) = 0,0001764/0,958 = 0,000184 или 1,84 · 10–4.
Ответ: KD(НСООН) = 1,84 · 10–4.
Задача 96.
Вычислите константу диссоциации диметиламина, если в 0,2 М растворе он диссоциирован на 7,42%.
Решение:
M[(CH3)2NH] = 45,08 г/моль;
CM[(CH3)2NH] = 0,2 М;
α = 7,42% или 0,0742.
1. Вычисление константы диссоциации (CH3)2NH
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD[(CH3)2NH] = [(0,0742)2 · 0,2]/(1 — 0,0742) = 0,0011/0,9258 = 0,0012 или 1,20 · 10–3.
Ответ: KD[(CH3)2NH] = 1,20 · 10–3.
Задача 97.
Концентрация ионов Н+ в 0,2 М растворе C2H5COOH равна 1,2 · 10–2 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(C2H5COOH) = 0,2 моль/дм3;
[H+] = 1,2 · 10–2 моль/дм3;
KD(C2H5COOH) = ?
α = ?
1. Вычисление степень диссоциации этановой кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(C2H5COOH) = (1,2 · 10–2)/0,2 = 6,0 · 10–2 или 6%.
2. Вычисление константы диссоциации этановой кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 — α) = α2CM/(1 — α).
Тогда
KD(C2H5COOH) = [(α)2 · СМ(СН3СООН)]/(1 — α) = [(6,0 · 10–2)2 · 0,2]/(1 — 6,0 · 10–2) = 0,00072/0,94 = 0,0000171 = 7,7 · 10-4.
Ответ: KD(C2H5COOH) = 7,7 · 10-4; α = 0,06%.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10
КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИКЗАДАЧНИК
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3/2004
§ 7.2. Слабые кислоты и основания
Если вы будете заниматься исследовательской
работой, вам понадобится знание среды раствора и
его рН. Сейчас вы познакомитесь с растворами
слабых электролитов, узнаете, как рассчитать рН
раствора, зная концентрацию соли и константу
равновесия диссоциации слабого электролита.
Расчет концентрации ионов водорода и
гидроксид-ионов в растворах слабых кислот и
слабых оснований несколько сложнее, чем расчет
для сильных кислот и оснований (щелочей), и
проводится с использованием констант их
диссоциации.
Уксусная кислота – слабый электролит и в очень
незначительной степени диссоциирует по
уравнению:
СН3СООН = СН3СОО– + Н+.
Константа диссоциации (равновесия) К
уксусной кислоты:
Ккисл = [СН3СОО–]
[Н+]/[СН3СООН].
Учитывая, что в растворе уксусной кислоты
концентрации ионов водорода и ацетат-ионов
равны, т.е. [СН3СОО–] = [Н+], а сама
она – слабый электролит и поэтому в состоянии
диссоциации находится лишь малая часть ее
молекул, концентрацию непродиссоциировавших
молекул СН3СООН можно считать равной
концентрации кислоты скисл. Тогда
получаем:
Ккисл = [Н+]2/скисл,
откуда
Пример. Константа диссоциации
уксусной кислоты (данные справочника) равна:
Ккисл = 1,86•10–5. Требуется
рассчитать концентрацию ионов водорода и рН в 0,1М
и 0,01М растворах уксусной кислоты.
Для 0,1М раствора имеем:
рН = –lg (1,36•10–3) = 2,87.
Посмотрим, как скажется на концентрации ионов
водорода и рН раствора разбавление в 10 раз.
Для 0,01М раствора имеем:
рН = –lg (4,31•10–4) = 3,37.
Разбавление уксусной кислоты в 10 раз привело к
понижению концентрации ионов водорода в 1,36•10–3/4,31•10–4
= 3,1 раза, при этом рН повысился на 3,37 – 2,87 = 0,5
единицы рН.
Вспомните, как изменится концентрация ионов
водорода и рН при разбавлении в 10 раз 0,1М
раствора соляной кислоты.
Аналогично определяют
концентрацию ионов водорода и рН раствора
гидроксида аммония:
NH4OH = + OH–,
константа диссоциации которого равна Косн
= 1,79•10–5. Сначала рассчитывают
концентрацию гидроксид-ионов:
и рОН. затем – концентрацию ионов водорода:
[Н+] = Кв/[ОН–] = 10–14/[ОН–]
и определяют рН = 14 – рОН. В 0,01М растворе
гидроксида аммония рН = 10,6. Проверьте.
Если в растворе сильной кислоты или сильного
основания увеличить концентрацию одноименного
иона введением соответствующей соли, например в
раствор НСl или NаОН добавить хлорид натрия NаCl, то
концентрации ионов водорода или гидроксид-ионов
практически не изменяются. Если же такую
операцию, т. е. увеличение концентрации
одноименного иона, провести с раствором слабой
кислоты или слабого основания, то наблюдается
резкое изменение рН раствора.
Рассмотрим, как изменится рН раствора уксусной
кислоты при введении в раствор ацетата натрия
NаСН3СОО, т. е. одноименного
ацетат-иона СН3СОО–.
Согласно принципу Ле Шателье равновесие реакции
диссоциации
сместится влево в результате увеличения
концентрации ацетат-ионов СН3СОО–,
образующихся при полной диссоциации ацетата
натрия как сильного электролита. Такое смещение
равновесия диссоциации уксусной кислоты
означает уменьшение концентрации ионов
водорода, т. е. увеличение рН раствора.
Пример. Рассчитать рН 0,01М
раствора уксусной кислоты, содержащей 0,01 моль/л
ацетата натрия NаСН3СОО.
В выражении константы равновесия
Ккисл = [СН3СОО–][Н+]/[СН3СООН]
= 1,86•10–5
концентрация ацетат-ионов определяется в
основном концентрацией хорошо диссоциирующей
соли NаСН3СОО. Поэтому можно записать:
Из этого соотношения находим концентрацию
ионов водорода:
Откуда рН = 4,73.
Таким образом, в результате введения в 1 л 0,01М
раствора уксусной кислоты 0,01 моль
NаСН3СОО концентрация ионов водорода
уменьшилась в 23 раза (4,31•10–4/1,86•10–5 =
23), а значение рН возросло на 1,36 (4,73 – 3,37 = 1,36)
единицы (значение рН = 3,37 из предыдущего примера).
Аналогично при введении в раствор
слабого основания NН4ОН хлорида аммония NH4Cl
положение равновесия диссоциации гидроксида
аммония смещается в менее основную область и
среда раствора становится более кислотной:
Следовательно, одноименный ион (за исключением
иона водорода и гидроксид-иона), введенный в
раствор слабой кислоты или слабого основания,
изменяет рН таким образом, что среда раствора
приближается к нейтральной. Одноименные ионы в
такого типа системах ведут себя как
нейтрализующие агенты: анион нейтрализует
слабую кислоту, выполняя роль основания, а катион
нейтрализует слабое основание, выполняя роль
кислоты. Такое необычное, с нашей точки зрения,
поведение веществ характерно для многих явлений
природы, показывая нам всеобщую связь и
взаимозависимость объектов окружающего нас мира
и нас самих от него.
О.С.ЗАЙЦЕВ
Внешняя диссоциация ионная константа кислоты также является прямым следствием лежащей в основе термодинамики реакции диссоциации; pK a прямо пропорционально стандартному изменению свободной энергии Гиббса для реакции. Значение pK a изменяется с температурой и может быть понято качественно на основе принципа Ле Шателье : когда реакция эндотермическая, K a увеличивается, а pK a размер с повреждением температуры; обратное для экзотермических верно фактор.
Значение pK a также во многом зависит от молекулярной структуры кислоты. Например, Полинг два правила: одно для последовательного pK a полипротонных кислот (см. Полипротонные кислоты ниже), а второе для оценки pK a оксикислот на основе количества = O и -OH групп (см. Факторы, влияющие на pK a значения ниже). Другие структурные факторы, влияющие на константы диссоциации кислоты, включают индукционные, мезомерные эффекты и водородные эффекты. Уравнения типа Хаммета часто используются для оценки pK a.
Количественное поведение кислот и оснований в растворе можно понять, только если известны их значения pK a. В частности, pH раствор можно предсказать, если известны аналитические свойства и значения pK a всех кислот и оснований; и наоборот, можно рассчитать равновесную концентрацию кислот и оснований в растворе, если известен pH. Эти расчеты находят применение во многих областях химии, биологии, медицины и геологии. Например, многие соединения, используемые для лечения, являются слабыми кислотами или основаниями, и знание значений pK a вместе с коэффициентами распределения октанол-вода можно использовать для оценки степени, в которой соединение попадает в кровоток. Константы кислотной диссоциации также важны в водной химии и химической океанографии, где кислотность воды играет фундаментальную роль. В живых организмах кислотно-основной гомеостаз и кинетика фермента зависит от значений pK a многих кислот и оснований, присутствующих в клетке и организме. В химии знание значений pK a необходимо для приготовления буферных растворов, а также для количественного понимания взаимодействия между кислотами или основаниями и ионами металлов с образованием . Экспериментально значения pK a могут быть определены потенциометрическим (pH) титрованием, но для значений pK a менее 2 или примерно примерно 11, спектрофотометрические или ЯМР измерения могут потребоваться из практических трудностей с измерением pH.
Определения
Согласно методическому определению Аррениуса, кислота — это вещество, которое диссоциирует в водном растворе, высвобождая ион водорода H (протон):
- HA ⇌ A + H.
Константа равновесия для этой реакции диссоциации известна как константа диссоциации. Освободившийся протон соединяется с молекулами воды, давая ионная гидроксония (или оксония) H3O (обнаженные протоны не существуют в растворе), и поэтому Аррениус позже использует диссоциацию в виде кислотно-основная реакция :
- HA + H 2 O ⇌ A + H 3O.
Уксусная кислота, слабая кислота, отдает протон (ион водорода, выделен зеленый) в воде в равновесной реакции с образованием иона ацетат и иона гидроксония. Красный: кислород, черный: углерод, белый: водород.
Бренстед и Лоури обобщили эту реакцию на реакцию протонного обмена:
- кислота + основание ⇌ сопряженное основание + сопряженная кислота.
Кислота теряет протон, оставив сопряженное основание; протон переносится на основание, образуя сопряженную кислоту. Для водных растворов кислотной ГК основанием является вода; сопряженное основание представляет собой А, аряженная кислота представляет собой ионный гидроксония. Определение Бренстеда — Лоури применимо к другим растворителям, как диметилсульфоксид : растворитель S действует как основание, протон и образуя сопряженную кислоту SH.
- HA + S ⇌ A + SH.
В химии растворов обычно используют H как сокращение для сольватированного иона независимого от растворителя. В водном растворе H обозначает сольватированный ионный гидроксония, а не протон.
Обозначение кислоты или основания как «конъюгата» зависит от контекста. Конъюгированная кислота BH основания B диссоциирует согласно
- BH + OH ⇌ B + H 2O
, что является обратным равновесием
- H2O (кислота) + B (основание) ⇌ OH (конъюгированное основание) + BH (конъюгированная кислота).
Ион гидроксида OH, хорошо известное основание, действует здесь как сопряженное основание кислой воды. Таким образом, кислоты и основания просто как доноры и акцепторы протонов соответственно.
Более широкое определение кислотной диссоциации включает гидролиз, при котором протоны образуются путем расщепления молекул воды. Например, борная кислота (B (OH) 3 ) производит H 3 O, как если бы она была донором протонов, но это было подтверждено Рамановская спектроскопия, что это связано с равновесием гидролиза:
- B (OH) 3 + 2 H 2 O ⇌ B (OH) 4 + H 3O.
Аналогично, гидролиз новых металлов заставляет ионы, такие как [Al (H 2O)6]], вести себя как слабые кислоты:
- [Al (H 2O)6] + H 2 O ⇌ [Al (H 2O)5(OH)] + H 3O.
Согласно первоначальному определению Льюиса, кислота — это вещество, которое принимает электрон пара для образования координационной ковалентной связи.
Константа равновесия
Константа диссоциации кислоты является частным примером константы равновесия . Диссоциация монопротоновая кислота, HA, в разбавленном растворе может быть записана как
- HA ⇌ A + H
Константа термодинамического равновесия, K ⊖ { displaystyle K ^ { ominus}}
- K ⊖ = {A -} {H +} {HA} { displaystyle K ^ { ominus} = { frac { {{ ce {A ^ -}} } {{ ce {H +}} }} {{ ce { {HA }}}}}}
где {X} представляет действие в состоянии равновесия химического вещества X. К ⊖ { displaystyle K ^ { ominus}}
Изменение pK a уксусной кислоты в зависимости от ионной силы.
Показано активность произведением и коэффициент (γ), может также быть записано как
- К ⊖ = [A -] [H +] [HA] Γ, Γ = γ A — γ H + γ HA { Displaystyle K ^ { ominus} = {{ frac {[{ ce {A ^ -}}] [{ ce {H +}}]} { { ce {[HA]}}}} Gamma}, quad Gamma = { frac { gamma _ {{ ce {A ^ -}}} gamma _ {{ ce {H +} }}} { gamma _ {{ ce {HA}}} }}}
где [HA] представляет концентрацию HA и Γ { displaystyle Gamma}
Чтобы избежать осложнений, связанных с использованием активностей, константы диссоциации определить, где это возможно, в среде с высокой ионной силой, то есть в условиях, в которых Γ { displaystyle Gamma}
- К a = К ⊖ Γ = [A -] [H +] [HA] { displaystyle K _ { text {a}} = { frac {K ^ { ominus}} { Гамма}} = mathrm { frac {[A ^ {-}] [H ^ {+}]} {[HA]}}}
- p K a = — log 10 [A -] [H + ] [HA] = журнал 10 [HA] [A -] [H +] { displaystyle mathrm {p} K _ {{ ce {a}}} = — log _ {10} { frac { [{ ce {A ^ -}}] [{ ce {H ^ +}}]} {[{ ce {HA}}]}} = log _ {10} { frac {{ ce { [HA]}}} {[{ ce {A ^ -}}] [{ ce {H +}}]}}}
получено. Обратите внимание, однако, что все опубликованные значения константы диссоциации, используемые при их определении, что разные значения получены при разных условиях, как показано уксусной кислоты на иллюстрации выше. Указанные константы к ионной силе, отличной от той, которая требуется для конкретного применения, они могут быть скорректированы с помощью специфического (SIT) и других теорий.
Накопительная и ступенчатая константы
Накопленная константа равновесия, обозначенная β { displaystyle beta}

- H 2 A ↽ — — ⇀ A 2 — + 2 H + { displaystyle { ce {H_2A <=>A ^ {2 -} {+} 2H ^ +}}}
- β 2 = [H 2 A] [A 2 -] [H +] 2 { displaystyle beta _ {2} = { frac {{ ce {[H_2A]}}} {[{ ce {A ^ {2 -}}}] [{ ce {H +}}] ^ {2}}}}
- журнал β 2 = п К a 1 + п К a 2 { displaystyle log beta _ {2} = mathrm {p} K _ {{ ce {a1}}} + mathrm {p} K _ {{ ce {a2} }}}
Обратите внимание, что в контексте образования комплексов металл-лиганд константы равновесия для образования комплексов металлов обычно определяет как константы ассоциации. конс тант диссоциации; в этом примере log β 1 = p K a 2 { displaystyle log beta _ {1} = mathrm {p} K _ {{ ce {a2}}}}
Константы ассоциации и диссоциации
При обсуждении свойств кислотности Обычно константы равновесия указываются как константы кислотной диссоциации, обозначаемые K a , с числовыми значениями, обозначенными символом pK a.
- K disoc = [A -] [H + ] [HA]: p K a = — журнал K disoc { displaystyle K _ { text {disoc}} = mathrm { frac {[A ^ {-}] [H ^ {+}]} {[ HA]}}: mathrm {p} K _ { text {a}} = — log K _ { text {disoc}}}
С другой стороны, константы ассоциации используются для баз.
- ассоциированный = [HA] [A -] [H +]: p K b = — журнал K assoc { displaystyle K _ { text {assoc}} = mathrm { frac {[HA]} {[A ^ {-}] [H ^ {+}]}}: mathrm {p} K _ { text {b}} = — log K _ { text {assoc}}}
Однако компьютерные программы общего назначения, которые используются для достижения значений константного равновесия из экспериментальных данных, используют константы ассоциации как для кислот, так и для оснований. Указано как константы ассоциации, протонирование лиганда также указано как реакция ассоциации. Определения показывают, что значение константы диссоциации кислоты обратно пропорционально значению константы ассоциации.
- Kдиссок = 1 / K ассоциированный
- лог K диссок = −log K ассоциированный
- pKдиссок = лог К ассоциированный
Примечания
- Для кислоты данной модели pK a + pK b = pK w , константа самоионизации воды.
- Константа ассоциации для образования супрамолекулярного комплекса может быть обозначена как K a ; в таких случаях «а» означает «ассоциация», а не «кислота».
Для полипротонных кислот нумерация констант ступенчатой ассоциации является обратной нумерации констант диссоциации. Например, для фосфорной кислоты (подробности см. В #polyprotic acid ниже)
- log K assoc, 1 = p K disoc, 3 { displaystyle log K _ { { text {assoc}}, 1} = mathrm {p} K _ {{ text {disoc}}, 3}}
- журнал K assoc, 2 = p K disoc, 2 { displaystyle log K_ {{ text {assoc}}, 2} = mathrm {p} K _ {{ text {disoc}}, 2}}
- журнал K assoc, 3 = p K disoc, 1 { displaystyle log K_ {{ text {assoc}}, 3} = mathrm {p} K _ {{ text {disoc}}, 1}}
Температурная зависимость
Все константы равновесия изменяются в от температуры в соответствии с уравнением Ван ‘т Гоффа
- d ln (K) d T = Δ H ⊖ RT 2 { displaystyle { frac { operatorname {d } ln left (K right)} { operatorname {d} T}} = { frac { Delta H ^ { ominus}} {RT ^ {2}}}}
R — газовая постоянная, а Т — абсолютная температура. Таким образом, является для экзотермических параметров стандартное изменение энтальпии, Δ H ⊖ { displaystyle Delta H ^ { ominus}}

Стандартное изменение энтальпии закон само по себе является функцией температуры, согласно у термохимии Кирхгофа :
- (∂ Δ H ∂ T) p = Δ C p { displaystyle left ({ frac { частичная Delta H} { partial T}} right) _ {p} = Delta C_ {p}}
где ΔC p — теплоемкость изменение при постоянном давлении. На практике Δ H ⊖ { displaystyle Delta H ^ { ominus}}
Размерность
В уравнении
- K a = [A -] [H +] [HA] { displaystyle K _ { mathrm {a}} = mathrm { frac {[A ^ {-}] [H ^ {+}]} {[HA]}}}
Ka, похоже, имеет размер концентрации. Однако, поскольку Δ G = — RT ln K { displaystyle Delta G = -RT ln K}

- Предположим, что частные коэффициентов активности имеет числовое значение 1, так что K { displaystyle K}
имеет то же числовое значение, что и константа термодинамического равновесия K ⊖ { displaystyle K ^ { ominus}}
.
- Выразите значение концентрации как отношение c / c, где c — значение в [гипотет] стандартном состоянии, с числовым значением 1 по определению.
- Выразите по шкале мольных долей. Измерение мольная доля не имеет размеров, отношение концентраций по определению будет чистым числом.
Процедуры (1) и (2) дают идентичные числовые значения для константы равновесия. ci { displaystyle c_ {i}}

- ci = xi ρ M { displaystyle c_ {i} = { frac {x_ {i} rho} {M}}}
и поскольку молярная масса M { displaystyle M}
В биохимии разрешено указывать значение с размером, например, «K a = 30 мМ», чтобы указать масштаб, миллимолярные (мМ) или микромолярные (мкМ) значения использовал, использованный для его расчета.
Сильные кислоты и основания
Кислота классифицируется как «сильная», если ее недиссоциированных частиц слишком мала для измерения. Любая водная кислота со значением pK a менее 0 почти полностью депротонирована и считается сильной кислотой. Все такие кислоты переносят свои протоны в воде и образуют разновидности катионов растворителя (H 3 O в водном растворе), так что все они имеют по существу одинаковую кислотность, явление, известное как выравнивание уровня растворителя. Считается, что они полностью диссоциированы в водном растворе, потому что количество недиссоциированной кислоты в равновесии с продуктами диссоциации предела обнаружения. Аналогичным образом, любое водное основание с константой ассоциации pKbпримерно 0, настоящее pK a больше примерно 14, превращается в ОН и считается сильныманием.
Азот. кислота, со значением pK ок. -1,7, ведет как сильная кислота в водных растворах с pH больше 1. При более низких значениях pH ведет себя какая кислота. Значения
pKaдля сильных кислотаны теоретически. Например, pK a водного раствора HCl было оценено как -9,3.
Монопротоновые кислоты
Изменение% образования монопротоновой кислоты, AH, и ее конъюгированного основания, A, в зависимости от разницы между pH и pK a кислоты.
После преобразования выражения определяющего K a , и положив pH = −log 10 [H], получаем
- p H = p K a + log [A — ] [HA] { displaystyle mathrm {pH} = mathrm {p} K _ { text {a}} + log mathrm { frac {[A ^ {-}]} {[HA]}} }
Это уравнение Хендерсона – Хассельбаха, из которого можно сделать следующие выводы.
- При половинной нейтрализации отношение [A] / [HA] = 1; поскольку log (1) = 0, pH при полунейтрализации численно равен pK a. И наоборот, когда pH = pK a , концентрация HA равна концентрации A.
- Буферная область простирается в приблизительном диапазоне pK a ± 2. Слабая буферность за пределами диапазона pK a ± 1. При pH ≤ pK a — 2 считается, что вещество полностью протонировано, а при pH ≥ pK a + 2, он полностью диссоциирован (депротонирован).
- Если pH известен, соотношение можно рассчитать. Это соотношение не зависит от аналитической концентрации кислоты.
В воде измеряемые значения pK a находятся в диапазоне от примерно -2 для сильной кислоты до примерно 12 для очень слабой кислоты (или сильного основания).
A буферный раствор с желаемым pH может быть приготовлен как смесь слабой кислоты и ее конъюгированного основания основания. На практике смесь может быть получена путем растворения кислоты в воде и добавления необходимого количества сильной кислоты или основания. Если pK a и аналитическая технология кислоты известна, степень диссоциации и pH раствора монопротоновой кислоты можно легко рассчитать с помощью таблицы ICE.
Полипротонных кислот
Состав фосфорной кислоты
Полипротонная кислота — это соединение, которое может терять более 1 протона. Каждая константа ступенчатой диссоциации определяет для одного потери протона. Константа диссоциации первого протона может быть обозначена как K a1 , а константы диссоциации последовательных протонов как K a2 и т.д. Фосфорная кислота, H 3PO4, представляет собой пример полипротонной кислоты, поскольку она может терять три протона.
-
Равновесие определение и значение pK H. 3PO. 4⇌ H. 2PO. 4+ H p K a 1 = log 10 [H 3 PO 4] [H 2 PO 4 -] [H +] = 2,14 { displaystyle mathrm {p} K _ { ce {a1}}} = log _ {10} { frac {[{ ce {H_3PO_4}}]} {[{ ce {H_2PO_4 ^ {-}}}] [{ ce {H ^ +}}]}} = 2,14} H. 2PO. 4⇌ HPO. 4+ H p K a 2 = log 10 [ H 2 PO 4 -] [HPO 4 2 -] [H +] = 7.2 { displaystyle mathrm {p} K _ { ce {a2}}} = log _ {10} { frac {[{ ce {H_2PO_4 ^ {-}}}]} {[{ ce {HPO_4 ^ {2 -}}}] [{ ce {H ^ +}}]}} = 7.2} HPO. 4⇌ PO. 4+ ЧАС п К a 3 = журнал 10 [HPO 4 2 -] [PO 4 3 -] [H +] = 12,37 { displaystyle mathrm {p} K _ { ce {a3}}} = log _ {10} { frac {[{ ce {HPO_4 ^ {2 -}}}]} {[{ ce {PO_4 ^ {3 -}}}] [{ ce {H ^ +}}]}} = 12.37}
Когда разница между последовательными значениями pK составляет около четырех или более, как в этом примере, каждый вид может рассматриваться как отдельная кислота; Фактически соль H. 2PO. 4может кристаллизоваться из раствора путем доведения pH до примерно 5,5, путем соли HPO. 4может кристаллизоваться из раствора путем доведения pH до примерно 10. Диаграмма распределения частиц показывает, что концентрация двух иона максимальны при pH 5, 5 и 10. Образование
% частиц, рассчитанное с помощью программы HySS для 10-миллимолярного раствора лимонной кислоты. pK a1 = 3,13, pK a2 = 4,76, pK a3 = 6,40.
Если разница между последовательными значениями pK меньше примерно четырех, перекрываются между диапазонами способов существования в равновесии. Чем меньше разница, тем больше перекрытие. Пример лимонной кислоты показан справа; растворы лимонной кислоты забуферены во всем диапазоне pH от 2,5 до 7,5.
Согласно первому правилу Полинга, последовательные значения pK данная кислоты увеличиваются (pK a2 >pK a1 ). Для оксикислот с более чем одним ионизируемым водородом у одного и того же атома значения pK a часто увеличивается примерно на 5 единиц на каждый удаленный протон, как в примере с фосфорной кислотой выше.
Из приведенной выше таблицы можно увидеть, что второй протон удален из отрицательно заряженной частицы. Предлагаемый протон предлагает заряд, для его удаления требуется дополнительная работа. Вот почему pK a2 больше, чем pK a1. pK a3 больше, чем pK a2 , потому что происходит дальнейшее разделение зарядов. Когда обнаруживается исключение из правил Полинга, это указывает на то, что также происходит серьезное изменение в структуре. В случае VO 2 (водн.) Ванадий является октаэдрическим, 6-координатным, тогда как ванадиевая кислота тетраэдрическим, 4-координатным. Это означает, что четыре «первые частицы» высвобождаются при диссоциации, но только две «частицы» высвобождаются при других диссоциациях, что приводит к гораздо большему вкладу энтропии в стандартное изменение свободной энергии Гиббса для первой реакции, чем для других.
-
Равновесие pKa [ВО 2(H2O)4] ⇌ H 3VO4+ H + 2H 2O p K a 1 = 4,2 { displaystyle mathrm {p} K_ {a_ {1}} = 4 , 2} H3VO4⇌ H. 2VO. 4+ H p K a 2 = 2,60 { displaystyle mathrm {p} K_ {a_ {2}} = 2,60} H. 2VO. 4⇌ HVO. 4+ H p К a 3 = 7,92 { displaystyle mathrm {p} K_ {a_ {3}} = 7,92} HVO. 4⇌ VO. 4+ H p K a 4 = 13,27 { displaystyle mathrm {p} K_ {a_ {4}} = 13,27}
Изоэлектрическая точка
Для веществ в растворе изоэлектрическая точка (pI) определяется как pH, при котором сумма, взвешенная по величине заряда, концентраций положительно заряженных частиц размерной сумме концентраций отрицательно заряженных частиц. В случае наличия одного вида типа изоэлектрическая точка может быть получена непосредственно из значений pK. Возьмем, к примеру, глицин, обозначенный как AH. Следует рассмотреть два равновесия диссоциации.
- AH. 2⇌ АН + Н; [AH] [H] = K 1 [AH. 2]
- AH ⇌ A + H; [A] [H] = K 2 [AH]
Подставьте выражение для [AH] из второго уравнения в первое уравнение
- [A] [H] = K 1K2[AH. 2]
В изоэлектрической точке положительно заряженных частиц, AH 2 , показывает отрицательно заряженных частиц, A, поэтому
- [H] = K 1K2
следовательно, взяв одекологарифмы, pH определяется как
- p I = p K 1 + p K 2 2 { displaystyle mathrm {p} I = { frac { mathrm {p} K_ {1} + mathrm {p} K_ {2} } {2}}}
Значения pI для игры в протеиногенной аминокислоте. Когда более двух заряженных видов находятся в равновесии друг с другом, может потребоваться полный расчет видообразования.
Основания и основность
Константа равновесия K b для основания обычно определяется как константа ассоциации для протонирования основания B с образованием конъюгированной кислоты, HB.
- B + H 2 O ⇌ HB + OH
Используя рассуждения, аналогично используемым до
- K b = [HB +] [OH -] [B] p K b = — журнал 10 (К b) { displaystyle { begin {align} K _ { text {b}} & = mathrm { frac {[HB ^ {+}] [OH ^ {-}]} {[B ]}} \ mathrm {p} K _ { text {b}} & = — log _ {10} left (K _ { text {b}} right) end {align}}}
Kbотносится к K a для конъюгированной кислоты. В воде концентрацией иона гидроксида, [OH], связ с концентрацией и водородом K w = [H] [OH], поэтому
- [OH -] = К вес [ Н +] { Displaystyle mathrm {[OH ^ {-}]} = { гидроразрыва {K _ { mathrm {w}}} { mathrm {[H ^ {+}]}}}}
Подстановка выражения для [OH] в выражении для K b дает
- K b = [HB +] K w [B] [H +] = K w К a { displaystyle K _ { text {b}} = { frac {[ mathrm {HB ^ {+}}] K _ { text {w}}} { mathrm {[B] [H ^ {+}]}}} = { frac {K _ { text {w}}} {K _ { text {a}}}}}
Когда K a , K b и K w определяет при одинаковых условиях температуры и ионной силы, из этого, следует, кологарифмы, что pK b = pK w — pK а. В водных растворах при 25 ° C pK w равно 13,9965, поэтому
- p K b ≈ 14 — p K a { displaystyle mathrm {p} K _ { text {b}} приблизительно 14- mathrm {p} K _ { text {a}}}
с достаточной точностью для большинства практических целей. Фактически нет определения pK b отдельно от pK a , но это делается здесь, поскольку часто только значения pK b можно найти в более старой литературе.
Для гидролизованного иона металла K b также можно определить как константу ступенчатой диссоциации
- M p (OH) q ⇋ M p (OH) q — 1 + OH { displaystyle M_ {p} (OH) _ {q} leftrightharpoons M_ {p} (OH) _ {q-1} + OH}
(ионные заряды опускаются в общих выражениях)
- K б знак равно [M п (OH) q — 1] [OH] [M p (OH) q] { displaystyle K _ { mathrm {b}} = mathrm { frac {[M_ {p} (OH) _ { q-1}] [OH]} {[M_ {p} (OH) _ {q}]}}}
Это обратная величина константы ассоциации для образования комплекса.
Соотношение pK b = pK w — pK a выполняется только в водных растворах (хотя аналогичные отношения применимы и для других растворителей), Поддисциплины химии, такие как органическая химия, которые обычно используют дело с неводными растворами, обычно используют pK b в качестве меры основности. Вместо этого pK a конъюгированной кислоты, обозначаемой pK aH , указывается, когда необходимо количественно определить основность. Более высокое значение pK aH соответствует более сильному основанию. Например, значения pK aH(C5H5N) = 5,25 и pK aH ((CH 3CH2)3N) = 10,75 указывают на то, что триэтиламин является более сильным основанием, чем пиридин.
Амфотерные вещества
амфотерное вещество — это вещество, которое может действовать как кислота или как основание, в зависимости от pH. бикарбонат ион HCO. 3, который является сопряженным основанием угольной кислоты молекулы H 2CO3в равновесии
- H2CO3+ H 2 O ⇌ HCO. 3+ H 3O
, но такжеряженная кислота карбонат иона CO. 3в (обратном) равновесии
- HCO. 3+ OH ⇌ CO. 3+ H 2O.
Равновесие угольной кислоты важно для кислотно-основного гомеостаза в организме человека.
Аминокислота также является амфотерной с дополнительным осложнением, заключающимся в том, что нейтральный молекула находится во внутреннем кислотно- в основном равновесии, в котор ом основная аминогруппа притягивает и связывает протон из кислой карбоксильной группы, для окружения цвиттер-иона.
- NH2CHRCO 2 H ⇌ NH. 3CHRCO. 2
При pH менее примерно 5 протонируются как карбоксилатная группа , так и аминогруппа. По мере увеличения pH кислота диссоциирует согласно
- NH. 3CHRCO. 2H ⇌ NH. 3CHRCO. 2+ H
При высоком pH может иметь место вторая диссоциация.
- NH. 3CHRCO. 2⇌ NH. 2CHRCO. 2+ H
Таким образом, молекула аминокислоты является амфотерной, потому что она может быть протонированной или депротонированной.
Самоионизация воды
Молекула воды может либо получить, либо потерять протон. Считается, что он амфипротон. Ионизационное равновесие можно записать в виде
- H2O ⇌ OH + H
, где в водном растворе H обозначает сольватированный протон. Часто это записывается как ион гидроксония H 3 O, но эта формула не является точной, поскольку на самом деле существует сольватация более чем одной молекулы воды и такими видами, как H 5O2, H 7O3и H 9O4также присутствуют.
Константа равновесия определяется как
- К a = [H +] [OH -] [H 2 O] { displaystyle K_ { text {a}} = mathrm { frac {[H ^ {+}] [OH ^ {-}]} {[H_ {2} O]}}}
С растворами, в которых растворенных веществ равны не очень высокая концентрация [H 2 O ] может считаться постоянной, независимо от растворенного вещества (веществ); это выражение затем можно заменить на
- К w = [H +] [OH -] { displaystyle K _ { text {w}} = [ mathrm {H} ^ {+}] [ mathrm {OH} ^ {-}] ,}
Константа самоионизации воды, K w , таким образом, является просто частным случаем константы диссоциации кислоты. Логарифмическая форма, аналогичная pK a , также может быть определена
- p K w = — log 10 (K w) { displaystyle mathrm {p} K _ { text {w}} = — log _ {10} left (K _ { text {w}} right)}
| T (° C) | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| pKw | 14,943 | 14,734 | 14,535 | 14,346 | 14,167 | 13,997 | 13,830 | 13,680 | 13,535 | 13,396 | 13,262 |
Эти данные могут быть аппроксимированы параболой с
- pKw= 14,94 — 0,04209T + 0,0001718T
Из этого уравнения pK w = 14 при 24,87 ° C. При этой температуре ионы водорода и гидроксид-ионы имеют концентрацию 10 М.
Кислотность в неводных растворах
Растворитель с большей вероятностью будет способствовать ионизации растворенной кислой молекулы в следующих случаях:
- Это протонный растворитель, способный образовывать водородные связи.
- Он имеет высокое донорное число, что делает его сильным основанием Льюиса.
- Он имеет высокую диэлектрическую постоянную (относительную диэлектрическую проницаемость), что делает его хорошим растворителем для ионных частиц.
pKaзначения органических соединений часто получают с использованием апротонных растворителей диметилсульфоксида (ДМСО) и ацетонитрил (ACN).
| Растворитель | Число донора | Диэлектрическая проницаемость |
|---|---|---|
| Ацетонитрил | 14 | 37 |
| Диметилсульфоксид | 30 | 47 |
| Вода | 18 | 78 |
ДМСО широко используется в качестве альтернативы воде, поскольку он имеет более низкую диэлектрическую проницаемость, чем вода, и менее полярен, поэтому растворяет неполярные , гидрофобный bic вещества легче. Он имеет измеряемый диапазон pK a от примерно 1 до 30. Ацетонитрил менее щелочной, чем ДМСО, поэтому, как правило, кислоты слабее, а основания сильнее в этом растворителе. Некоторые значения pK a при 25 ° C для ацетонитрила (ACN) и диметилсульфоксида (DMSO). показаны в следующих таблицах. Значения для воды включены для сравнения.
| HA ⇌ A + H | ACN | DMSO | Вода |
|---|---|---|---|
| п-толуолсульфоновая кислота | 8,5 | 0,9 | Сильный |
| 2,4-динитрофенол | 16,66 | 5,1 | 3,9 |
| Бензойная кислота | 21,51 | 11,1 | 4,2 |
| Уксусная кислота | 23,51 | 12,6 | 4,756 |
| Фенол | 29,14 | 18,0 | 9,99 |
| BH ⇌ B + H | ACN | ДМСО | Вода |
| пирролидин | 19,56 | 10,8 | 11,4 |
| Триэтиламин | 18,82 | 9,0 | 10,72 |
| Протонная губка | 18,62 | 7,5 | 12,1 |
| Пиридин | 12,53 | 3,4 | 5,2 |
| Анилин | 10,62 | 3,6 | 4,6 |
Ионизация кислот в кислотном растворителе меньше, чем в воде. Например, хлористый водород представляет собой слабую кислоту при растворении в уксусной кислоте. Это связано с тем, что уксусная кислота — гораздо более слабое основание, чем вода.
- HCl + CH 3CO2H ⇌ Cl + CH. 3C (OH). 2
- кислота + основание ⇌ конъюгат основания + конъюгат кислота
вызывает эту реакцию с тем, что происходит, когда уксусная кислота растворяется в более кислотном растворителе чистая серная кислота
H2SO4+ CH 3CO2H ⇌ HSO. 4+ CH. 3C (OH). 2
Димеризация карбоновой кислоты.
Маловероятная форма геминального диола CH. 3C (OH). 2стабильна в этих средах. Для водных растворов шкала pH является наиболее удобной функцией кислотности. Для неводных сред были предложены другие функции кислотности, наиболее известными из которых являются функция кислотности Гаммета, H 0 , для суперслотной среды и ее модифицированной версии H — для сверхосновной среды.
В апротонных растворителях, олигомеры, такие как хорошо известный димер уксусной кислоты , может быть образован водородной связью. Кислота может также образовывать водородные связи со своим сопряженным основанием. Этот процесс, известный как гомоконъюгирование, имеет эффект увеличения кислотности кислоты, снижение их эффективных значений pK a за счет стабилизации конъюгированного основания. Гомоконъюгация увеличивает протонодонорную способность толуолсульфоновой кислоты в растворе ацетонитрила почти в 800 раз.
В водных растворах гомоконъюгирование не происходит, поскольку вода образует более сильные водородные связи с основанием конъюгата, чем кислота.
Смешанные растворители
pKaуксусной кислоты в смесях диоксан / вода. Данные Pine et al.
при 25 ° C. Когда соединение ограничено растворимость в воде, имеет обычную практичность (например, в фармацевтической промышленности) является определение значений pK a в смеси растворителей, такой как вода / диоксан или вода / мет ханол, в котором более соединение растворимо. В, показанном справа, значение pK a резко возрастает пример процентного значения диоксана по мере уменьшения диэлектрической проницаемости смеси.
Значение pK , полученное в смешанном растворителе, нельзя использовать непосредственно для водных растворов. Причина этого в том, что когда растворитель находится в стандартном состоянии, его активность определяется как единица. Например, стандартное состояние смеси вода: диоксан с использованием смешения 9: 1 представляет собой именно такую смесь растворителей без добавления растворенных веществ. Чтобы получить значение pK a для использования с водными растворами, оно должно быть экстраполировано до нулевой концентрации сорастворителя из значений, полученных для различных смесей сорастворителей.
Эти факты неясны из-за отсутствия растворителя в выражении, которое обычно используется для определения pK a , но значения pK a , полученные в данном смешанном контексте. можно сравнить друг с другом, давая относительную концентрацию кислоты. То же самое справедливо для значений pK a , полученное в конкретном неводном растворителе, таком как ДМСО.
Универсальная, не зависящая от растворителя шкала для констант диссоциации кислоты не хватает, так как не существует методов сравнения стандартных двух различных методов методов.
Факторы, влияющие на значения pK a
Второе правило Полинга заключается в том, что первый pK a для кислоты формулы XO m (OH) n зависит в первую очередь от количества оксогрупп m и зависит от гидроксильных групп, а также от центрального атома X. Приблизительные значения pK a равны 8 для m = 0 , 2 для m = 1, −3 для m = 2 и < −10 for m = 3. Alternatively, various numerical formulas have been proposed including pKa = 8-5m (известное как правило Белла ), pK a = 7-5 м, или pK a = 9-7 м. Зависимость от m коррелирует со степенью окисления центрального атома X: чем выше степень окисления, тем сильнее оксикислота. Например, pK a для HClO равно 7,2, для HClO 2 равно 2,0, для HClO 3 равно -1 и HClO 4 равно сильная кислота (pK a ≪ 0). Повышенная кислотность при добавлении оксогруппы происходит из-за стабилизации конъюгированного основания за счет делокализации его отрицательного заряда по дополнительному атому кислорода. Это правило может помочь определить молекулярную реакцию: например, фосфористая кислота (H3PO3) имеет pK a около 2, признано, что это структура HPO (OH) 2 , как позже подтверждено ЯМР-спектроскопией, а не P (OH) 3 , который, как ожидается, должен иметь pK a около 8.
Фумаровая кислота Малеиновая кислота Протонная губка
С органическими кислотами индукционные эффекты и мезомерные эффекты влияющие на значения pK a. Простой пример — это эффект замены водорода в уксусной кислоте на более электроотрицательный атом хлора. Электроноакцепторный эффект заместителя облегчает ионизацию, поэтому последовательные значения pK a уменьшаются в ряду 4,7, 2,8, 1,4 и 0,7, когда присутствуют 0, 1, 2 или 3 атома хлора. Уравнение Хамметта дает общее выражение для влияния заместителей.
- журнал (K a ) = log (K. a) + ρσ.
Ka- это константа диссоциации замещенного соединения, K. a- константа диссоциации, когда заместителем является водород, ρ — свойство незамещенного соединения, а σ имеет конкретное значение для каждого заместителя. График зависимости log (K a ) от σ представляет собой прямую линию с отрезком log (K. a) и наклоном ρ. Это пример линейной зависимости свободной энергии, поскольку log (K a ) пропорционален стандартному изменению свободной энергии. Хэмметт сформулировал взаимосвязь с данными для бензойной кислоты с различными заместителями в орто — и пара — положениях: некоторые числовые значения находятся в уравнении Хаммета. Это и другие исследования позволили упорядочить заместители в соответствии с их электроноакцепторной или высвобождающей электроны способностью и провести различие между индуктивным и мезомерным эффектами.
Спирты обычно не ведут себя как кислоты в воде, но двойные связи, вспомогательная с группой ОН, может существенно снизить pK a по механизму кето-енольной таутомерии. Аскорбиновая кислота является примером этого эффекта. Дикетон 2,4-пентандион (ацетилацетон ) также является слабой кислотой из-за кето-енольного равновесия. В ароматических соединениях, таких как фенол, имеют заместители ОН, конъюгация с ароматическим кольцом в целом увеличивает стабильность депротонированной формы.
Структурные эффекты также могут иметь значение. Классическим примером является разница между фумаровой кислотой и малеиновой кислотой. Фумаровая кислота представляет собой (E) -1,4-2-ендиовую кислоту, транс изомер, тогда как малеиновая кислота представляет собой соответствующий цис-изомер, т.е. (Z) -1,4-бут-2- ендиовая кислота (см. цис-транс-изомерия ). Фумаровая кислота имеет значения pK a приблизительно 3,0 и 4,5. Напротив, малеиновая кислота имеет значения pK a приблизительно 1,5 и 6,5. Причина такого большого различия заключается в том, что при удалении одного протона из цис-изомера (малеиновой кислоты) образуется прочная внутримолекулярная водородная связь с соседней оставшейся карбоксильной группой. Это способствует образованию малеата H и препятствует удалению второго протона из этого вещества. В транс-изомере две карбоксильные группы всегда расположены далеко друг от друга, поэтому водородная связь не наблюдается.
Протонная губка, 1,8-бис (диметиламино) нафталин, имеет pK a значение 12,1. Это одно из самых сильных известных аминовых оснований. Высокое напряжение основность объясняется снятием при протонировании и сильной внутренней водородной связью.
В этом разделе также следует дымнуть влияние растворителя и сольватации. Оказывается, эти более тонкие, чем упомянутой выше диэлектрической среды. Например, ожидаемый (с помощью электронных эффектов метильных заместителей) и наблюдаемый в газовой фазе порядок основности метиламинов, Me 3 N>Me 2 NH>MeNH 2 >NH 3 , заменяется водой на Me 2 NH>MeNH 2 >Me 3 N>NH 3. Нейтральные молекулы метила связаны водородными связями с молекулами воды, главным образом, посредством одного акцептора, N — HOH, взаимодействия и лишь иногда еще одной донорной связи, NH — OH 2. Следовательно, метиламины стабилизируются примерно в одинаковой степени за счет гидратации независимо от количества метильных групп. Напротив, соответствующие катионы метиламмония всегда используют вседоступные протоны для донорной связи NH-OH 2. Таким образом, относительная стабилизация. Метиламмония в области количества метильных групп, объясняющих порядок основности воды метиламинов.
Термодинамика
Константа равновесия связана со стандартной энергией Гиббса для изменения реакции, поэтому для константы диссоциации кислоты
- Δ G ⊖ = — RT ln K a ≈ 2,303 RT п К a { displaystyle Delta G ^ { ominus} = — RT ln K _ { текст {a}} приблизительно 2.303RT mathrm {p} K _ { text {a}}}
.
R — газовая постоянная, а T — абсолютная температура. Обратите внимание, что pK a = −log (K a ) и 2.303 ≈ ln (10). При 25 ° C ΔG в кДж · моль ≈ 5,708 пК a (1 кДж · моль = 1000 джоулей на моль ). Свободная энергия состоит из члена энтальпии и члена энтропии.
- Δ G ⊖ знак равно Δ H ⊖ — T Δ S ⊖ { displaystyle Delta G ^ { ominus} = Delta H ^ { ominus} -T Delta S ^ { ominus}}
Стандартное изменение энтальпии может быть определено с помощью калориметрии или с помощью van ‘t Уравнение Хоффа, хотя калориметрический метод предпочтительнее. Когда рассчитано и стандартное изменение энтальпии, и константа диссоциации кислоты, стандартное изменение энтропии легко приводится по приведенному выше уравнению. В следующей таблице энтропийные члены из экспериментальных значений pK a и ΔH. Данные были тщательно отобраны и к 25 ° C и нулевой ионной силе в воде.
| Соединение | Равновесие | pKa | ΔG (кДж · моль) | ΔH (кДж · моль) | -TΔS (кДж · моль) |
|---|---|---|---|---|---|
| HA = Уксусная кислота | HA ⇌ H + A | 4,756 | 27,147 | -0,41 | 27,56 |
| H2A = Глицин H | H2A ⇌ HA + H | 2,351 | 13,420 | 4,00 | 9,419 |
| HA ⇌ H + A | 9,78 | 55,825 | 44,20 | 11,6 | |
| H2A = Малеиновая кислота | H2A ⇌ HA + H | 1,92 | 10,76 | 1,10 | 9,85 |
| HA ⇌ H + A | 6,27 | 35,79 | -3,60 | 39,4 | |
| H3A = Лимонная кислота | H3A ⇌ H 2 A + H | 3,128 | 17,855 | 4,07 | 13,78 |
| H2A ⇌ HA + H | 4,76 | 27,176 | 2,23 | 24,9 | |
| HA ⇌ A + H | 6,40 | 36,509 | -3,38 | 39,9 | |
| H3A = Борная кислота | H3A ⇌ H 2 A + H | 9,237 | 52,725 | 13,80 | 38,92 |
| H3A = Фосфорная кислота | H3A ⇌ H 2 A + H | 2,148 | 12,261 | -8,00 | 20,26 |
| H2A ⇌ HA + H | 7,20 | 41,087 | 3,60 | 37,5 | |
| HA ⇌ A + H | 12,35 | 80,49 | 16,00 | 54,49 | |
| HA = сероводород | HA ⇌ A + H | 1,99 | 11,36 | -22,40 | 33,74 |
| H2A = щавелевая кислота | H2A ⇌ HA + H | 1,27 | 7,27 | — 3,90 | 11,15 |
| HA ⇌ A + H | 4,266 | 24,351 | -7,00 | 31,35 |
| Соединение | Равновесие | pKa | ΔH (кДж · моль) | -TΔS (кДж · моль) |
|---|---|---|---|---|
| B = Аммиак | HB ⇌ B + H | 9,245 | 51,95 | 0,8205 |
| B = Метиламин | HB ⇌ B + H | 10,645 | 55,34 | 5,422 |
| B = Триэтиламин | HB ⇌ B + H | 10,72 | 43,13 | 18,06 |
Первы © указатель следует отметить, что, pK a положительно, стандартное изменение свободной энергии для положительной реакции диссоциации также. Во-вторых, некоторые реакции являются экзотермическими, а некоторые — эндотермическими, но, когда ΔH отрицательно, TΔS является доминирующим фактором, определяющим положительное значение ΔG. Ионизация нейтральной кислоты включает образование двух основных, так что энтропия уменьшен (ΔS < 0). On the second ionization of the same acid, there are now three ions and the anion has a charge, so the entropy again decreases.
). Обратите внимание, что стандартное изменение свободной энергии для реакций относится к изменениям от реагентов в их стандартных состояниях до продуктов в их стандартных состояниях..
Экспериментальное определение
Расчетная кривая титрования щавелевой кислоты, титрованной раствор гидроксид натрия
Экспериментальное определение значений pK a обычно выполняется с помощью титрования в среде с высокой ионной силой и при постоянной температуре. среде полностью подкисляют сильную кислоту до точки, когда соединение полностью протонируется. Затем раствор титруют сильным основанием, пока не будут удалены все протоны. В каждой точке титрования pH измеряется с помощью стеклянного электрода и pH-метра. Константы равновесия находятся путем подгонки расчетных значений pH к наблюдаемым значениям с использованием метода наименьших квадратов.
. Общий объем добавленного сильного основания должен быть небольшим по сравнению с начальным объемом для титрования, чтобы сохранить ионная сила почти постоянна. Это гарантирует, что pK a останется неизменным во время титрования.
Рассчитанная кривая титрования для щавелевой щелевой справа. Щавелевая кислота имеет значения pK a 1,27 и 4,27. Следовательно, буферные области будут центрированы при pH 1,3 и 4,3. Буферные области несут информацию, используемые для достижения значений pK a , когда используются почвы и основания конъюгата изменяются вдоль буферной области.
Между двумя буферными областями имеется конечная точка, или точка эквивалентности, примерно при pH 3. Эта конечная точка не резкой и типична для дипротонной кислоты, буферные области которой перекрытие на небольшую часть: pK a2 — pK a1 в этом примере составляет около трех. (Если бы разница в значениях pK была около двух или меньше, конечная точка не была бы заметна.) Вторая конечная точка начинается примерно при pH 6,3 и является резкой. Это указывает на то, что все протоны удалены. Когда это так, раствор не забуферивается, и pH резко повышается при добавлении небольшого количества сильного основания. Однако повышение pH не продолжается бесконечно. Новая буферная область начинается примерно при pH 11 (pK w — 3), где самоионизация воды становится известной.
Очень трудно измерить значения pH менее двух в водном растворе с помощью стеклянного электрода, потому что уравнение Нернста не работает при таких низких значениях pH. Для определения значений pK менее примерно 2 или более примерно 11 спектрофотометрические или ЯМР Измерение Измерения вместо pH или в сочетании с ними.
Когда стеклянный электрод нельзя использовать, как в случае с неводными растворами, часто используются спектрофотометрические методы. Они могут быть измерениями оптической плотности или флуоресценции. В обоих случаях, что измеряемая величина пропорциональна сумме вкладов от каждого фотоактивного вещества; при измерении оптической плотности, что применяется закон Бера-Ламберта.
Изотермическая калориметрия титрования (ITC) может быть установка для определения как значения pK, так и традиционная энтальпии диссоциации кислоты. Программное обеспечение для выполнения расчетов поставляется производителями приборов для простых систем.
Водные растворы с нормальной водой нельзя использовать для измерений H ЯМР, но вместо них следует использовать тяжелую воду, D 2 O. Однако данные 13С ЯМР можно использовать в нормальной воде, а спектры ЯМР 1Н можно использовать с неводными средами. Количества, измеренные с помощью ЯМР, представляют собой усредненные по времени химические сдвиги, поскольку обмен протонами происходит быстро по шкале времени ЯМР. Могут быть измерены другие химические сдвиги, например, P.
Микроконстанты
Цистеин
Для некоторых молекул диссоциация (или ассоциация) может происходить более чем в одном неэквивалентном месте, и наблюдаемая макроскопическая константа равновесия или макроконстанта представляет собой комбинацию микроконстант с участием различных видов. Когда один реагент образует два продукта, макроконстанта представляет собой сумму двух микроконстантов, K = K X + K Y { displaystyle K = K_ {X} + K_ {Y}}
Спермин
Аналогично, такое основание, как спермин, имеет более место на сайте, где может происходить протонирование. Значения K b для диссоциации спермина, протонированного на одном или другом сайте, являются примерами микроконстант. Они не могут быть определены непосредственно посредством измерений pH, оптической плотности, флуоресценции или ЯМР; измеренное значение K b представляет собой сумму значений K для микрореакций.
- K b = K-концевой + K внутренний { displaystyle K _ { text {b}} = K _ { text {terminal}} + K _ { text {internal}}}
Тем не менее, место протонирования очень важно для биологической функции, поэто му математические методы были разработаны для определения микроконстант.
Когда два реагента образуют один продукт параллельно, макроконстанта 1 / K = 1 / KX + 1 / KY { displaystyle 1 / K = 1 / K_ {X} + 1 / K_ {Y}}



Когда реагент претерпевает две последовательные реакции, макроконстанта для комбинированной реакции является произведением микроконстанты для двух стадий. Например, вышеупомянутый цвиттерион цистеина может потерять два протона, один из серы и один из азота, а общая макроконстанта потери двух протонов является произведением двух констант диссоциации K = K a (-SH) K а (-NH 3 ). Это также может быть записано в терминах логарифмических констант как pK = pK a (-SH) + pK a (-NH 3 ).
Области применения и значение
Знание значений pK a важно для количественной обработки систем, включающих кислотно-основное равновесие в растворе. В биохимии существует множество приложений; например, значения pK a белков и аминокислот боковых цепей имеют большое значение для активности ферментов и стабильности белков. Protein pK a значения не всегда могут быть измерены напрямую, но могут быть рассчитаны с использованием теоретических методов. Буферные растворы широко используются для получения растворов с физиологическим или близким к нему pH для исследования биохимических реакций; разработка этих решений зависит от знания значений pK a их компонентов. Важные буферные растворы включают MOPS, который обеспечивает раствор с pH 7,2, и трицин, который используется в гель-электрофорезе. Буферизация является важной частью кислотно-щелочной физиологии, включая кислотно-щелочной гомеостаз, и является ключом к пониманию таких нарушений, как кислотно-щелочной дисбаланс. Изоэлектрическая точка данной молекулы является функцией ее значений pK, поэтому разные молекулы имеют разные изоэлектрические точки. Это позволяет использовать метод, называемый изоэлектрическое фокусирование, который используется для разделения белков с помощью 2-D гель-электрофореза в полиакриламидном геле.
Буферные растворы также играют ключевую роль в аналитической химии. Они используются всякий раз, когда необходимо установить определенное значение pH раствора. По сравнению с водным раствором pH буферного раствора относительно нечувствителен к добавлению небольшого количества сильной кислоты или сильного основания. Буферная емкость простого буферного раствора максимальна при pH = pK a. В кислотно-щелочной экстракции эффективность экстракции соединения в органическую фазу, такую как эфир, можно оптимизировать, регулируя pH водной фазы с помощью подходящего буфера.. При оптимальном pH концентрация электрически нейтральных частиц максимальна; такой вид более растворим в органических растворителях, имеющих низкую диэлектрическую постоянную , чем в воде. Этот метод используется для очистки слабых кислот и оснований.
A индикатор pH представляет собой слабую кислоту или слабое основание, которое меняет цвет в переходном диапазоне pH, который составляет приблизительно pK a ± 1 Конструкция универсального индикатора требует сочетания индикаторов, чьи соседние значения pK a отличаются примерно на два, так что их переходные диапазоны pH просто перекрываются.
В фармакологии ионизация соединения изменяет его физическое поведение и макросвойства, такие как растворимость и липофильность, log p). Например, ионизация любого соединения увеличивает растворимость в воде, но снижает липофильность. Это используется в разработке лекарств для увеличения концентрации соединения в крови путем регулирования pK a ионизируемой группы.
Знание pK Значения a важны для понимания координационных комплексов, которые образуются в результате взаимодействия иона металла M, действующего как кислота Льюиса, с лиганд, L, действующий как основание Льюиса. Однако лиганд может также подвергаться реакциям протонирования, поэтому образование комплекса в водном растворе может быть символически представлено реакцией
- [M (H 2O)n] + LH ⇌ [M (H 2O)n-1 L] + H 3O
Чтобы определить константу равновесия для этой реакции, в которой лиганд теряет протон, необходимо знать pK a протонированного лиганда. На практике лиганд может быть полипротонным; например, EDTA может принимать четыре протона; в этом случае должны быть известны все значения pK a. Кроме того, ион металла подвергается гидролизу, то есть он ведет себя как слабая кислота, поэтому значения pK для реакций гидролиза также должны быть известны.
Оценка опасности, связанной с кислотой или основанием, может потребовать знания значений pK a. Например, цианистый водород является очень токсичным газом, потому что ион цианида ингибирует железосодержащий фермент цитохром с оксидазу. Циа нистый водород представляет собой слабую кислоту в водном растворе. ион с pK a около 9. В сильно щелочных растворах, скажем, с pH выше 11, следует, что цианид натрия «полностью диссоциирован», поэтому опасность, связанная с газообразным цианистым водородом, значительно снижается. С другой стороны, кислый раствор очень опасен, поскольку весь цианид находится в кислотной форме. Попадание цианида внутрь потенциально опасно, независимо от pH, из-за реакции с цитохром с оксидазой.
В науке об окружающей среде кислотно-щелочное равновесие важно для озер и рек; например, гуминовые кислоты — важные компоненты природных вод. Другой пример встречается в химической океанографии : чтобы количественно оценить растворимость железа (III) в морской воде при различных соленостях, значения pK a для образования были определены продукты гидролиза железа (III) Fe (OH), Fe (OH). 2и Fe (OH) 3 вместе с произведением растворимости железа гидроксид.
Значения для обычных веществ
Существует несколько методов определения pK a химического вещества, что приводит к некоторым расхождениям между различными источниками. Хорошо измеренные значения обычно находятся в пределах 0,1 единицы друг от друга. Представленные здесь данные получены при 25 ° C в воде. Дополнительные значения можно найти в разделе Термодинамика выше. Таблицу pK a углеродных кислот, измеренных в ДМСО, можно найти на странице карбанионы.
| Химическиевещества | Равновесие | pKa |
|---|---|---|
| BH = аденин. | BH ⇌ B + H | 4,17 |
| BH. 2⇌ BH + H | 9,65 | |
| H3A = мышьяковая кислота | H3A ⇌ H 2 A + H | 2,22 |
| H2A ⇌ HA + H | 6,98 | |
| HA ⇌ A + H | 11 , 53 | |
| HA = Бензойная кислота | HA ⇌ H + A | 4,204 |
| HA = Масляная кислота | HA ⇌ H + A | 4,82 |
| H2A = Хромовая кислота | H2A ⇌ HA + H | 0,98 |
| HA ⇌ A + H | 6,5 | |
| B = Кодеин | BH ⇌ B + H | 8,17 |
| HA = Крезол | HA ⇌ H + A | 10,29 |
| HA = Муравьиная кислота | HA ⇌ H + A | 3,751 |
| HA = плавиковая кислота | HA ⇌ H + A | 3 , 17 |
| HA = синильная кислота | HA ⇌ H + A | 9,21 |
| HA = Селенид водорода | HA ⇌ H + A | 3,89 |
| HA = Пероксид водорода (90%) | HA ⇌ H + A | 11,7 |
| HA = Молочная кислота | HA ⇌ H + A | 3,86 |
| HA = пропионовая кислота | HA ⇌ H + A | 4,87 |
| HA = фенол | HA ⇌ H + A | 9,99 |
| H2A = L— (+) — аскорбиновая кислота | H2A ⇌ HA + H | 4,17 |
| HA ⇌ A + H | 11,57 |
См. Также
- Ацидоз
- Кислоты в вине : винная, яблочная и лимонная. основные кислоты в вине.
- Алкалоз
- Газы артериальной крови
- Химическое равновесие
- Электролитическая проводимость
- Механизм Гроттуса : как протоны передаются между ионами гидроксония и молекулами воды с учетом исключительно высокой ионной подвижности протона (анимация).
- функция кислотности Гаммета : мера кислотности, которая используется для очень концентрированных растворов сильных кислот, включая суперкислоты.
- число переноса на
- Подкисление океана : растворение атмосферного диоксида влияет на pH морской воды. Реакция зависит от общего неорганического углерода и от равновесия растворимости с твердыми карбонатами, такими как известняк и доломит.
- Закон разбавления
- pCO2
- pH
- Диаграмма преобладания : относится к равновесию с участием полиоксианионов. Для построения этих диаграмм необходимы значения pK a.
- Сродство к протону : мера основности в газовой фазе.
- Константы устойчивости комплексов : образование комплекса может часто рассматриваться как конкуренция между протоном ионом металла за лиганд, который является продуктом диссоциации кислоты.
Примечания
Ссылки
Дополнительная литература
- Albert, A.; Сержант, Э. (1971). Определение констант ионизации: лабораторное руководство. Чепмен и Холл. ISBN 0-412-10300-1.(Предыдущее издание опубликовано как Константы ионизации кислот и оснований. Лондон (Великобритания): Метуэн, 1962 г. )
- Atkins, PW; Джонс, Л. (2008). Chemical Principles: The Quest for Insight (4-е изд.). WH Freeman. ISBN 978-1-4292-0965- 6.
- Housecroft, CE; Sharpe, AG (2008). Inorganic Chemistry (3-е изд.). Prentice Hall. ISBN 978-0-13-175553-6.(Non-водные растворители)
- Hulanicki, A. (1987). Реакции кислот и оснований в аналитической химии. Horwood. ISBN 0-85312-330-6.(редактор перевода : Мэри Р. Массон)
- Perrin, DD; Dempsey, B.; Serjeant, EP (1981). PKa Prediction for Organic Acids and Bases. Chapman & Hall. ISBN 0-412 -22190 -X.
- Reichardt, C. (2003). Растворители эффектов и растворителей в органической химии (3-е изд.). Wiley-VCH. ISBN 3-527-30618- 8.Глава 4: Влияние растворителя на положение гомогенного химического равновесия.
- Скуг, Д.А.; Уэст, Д.М.; Хо ller, J.F.; Крауч, С. (2004). Основы аналитической химии (8-е изд.). Томсон Брукс / Коул. ISBN 0-03-035523-0.
Внешние ссылки
- Данные о кислотности и основности в неводных растворителях Обширная библиография значений pK a в ДМСО, ацетонитрил, THF, гептан, 1,2-дихлорэтан и в газовой фазе
- Curtipot Универсальное бесплатное программное обеспечение для расчета pH и кислотно-основного равновесия, а также для моделирования и анализа кривых потенциометрического титрования с таблицами
- Калькулятор физических / химических свойств SPARC Включает базу данных со значениями pK a в водной, неводной и газовой фазах, которые можно найти с помощью значений SMILES или регистров CAS
- Константы водного равновесия pKaдля различных кислот и оснований. Включает таблицу некоторых растворимости
- Бесплатное руководство по интерпретации и измерению pK a и log p Объяснение значимости этих свойств для фармакологии
- инструмент онлайн-прогнозирования (Marvin) pKa, log p, log d и т. Д. Из ChemAxon
- Chemicalize.org : Список свойств на основе предсказанной структуры
- Evans pK a Диаграмма [1]
Цель
лабораторной работы
– определить константу диссоциации
уксусной кислоты кондуктометрическим
методом при температуре 25 oС.
В
водных растворах уксусная кислота
гидролизуется с образованием ионов
ацетата и гидроксония
.
Константа
равновесия реакции гидролиза, выраженная
через активности, определяется уравнением
(1.10)
где
СА
– исходная концентрация кислоты в
моль / л;
– степень гидролиза;
– концентрация воды; fi
– коэффициенты актив-ности;
СА
<<.
СВ.
Поскольку
в разбавленном растворе концентрация
воды постоянна, её можно включить в
константу равновесия, которая в этом
случае называется константой диссоциации
.
Если
считать, что неидеальность раствора
обусловлена только эффектами теории
Дебая – Хюккеля, то коэффициенты
активности незаряженных частиц: воды
и недиссоциированной кислоты, можно
положить равными единице, а произведение
коэффициентов активности катиона и
аниона найти, вводя среднеионный
коэффициент активности
:
,
,
где
I
– ионная сила раствора; A
и B
– константы;
–десятичный логарифм. При 25 oС
для водного раствора 1,1-валентного
электролита
A
= 0,509, B
1.
Уравнение (10) можно
переписать как
Учтено,
что для 1,1-валентного
электролита
ионная сила равна произведению его
концентрации на степень диссоциации.
Для
нахождения степени диссоциации нужно
использовать уравнение
Дебая – Хюккеля – Онзагера
(1.6), которое можно представить в виде
Для
его решения можно воспользоваться
методом итераций, в качестве первого
приближения принять, что
Это
приближение состоит в том, что единственной
причиной отличия
от 0
полагается неполная диссоциация
электролита.
Для
последующих приближений следует
пользоваться выражением
Обычно
достаточно вычислить
во втором приближении.
Проведение
измерений и обработка результатов
При
выполнении лабораторной работы
используются:
– готовый
контрольный раствор KCl
0,01 N,
приготовленный из фиксанала;
– два
исходных готовых раствора уксусной
кислоты (
0,5 N
и
0,1 N,
точное значение концентрации указано
на склянках с растворами);
– две бюретки;
– свежекипячёная
дистиллированная вода;
– мерные
колбы на 100 мл – 10 шт;
– штативы;
– измерительная
ячейка;
– термостат;
– кондуктометр
«Анион-4120» с выносным датчиком.
Подготовка к
проведению измерений
В
мерных колбах на 100 мл готовят рабочие
растворы уксусной кислоты аналитическим
разбавлением исходных растворов СН3СООН
кипячёной дистиллированной водой. Всего
готовят 10 растворов с концентрациями
от 0,3 до 0,005 моль / л. Рекомендуемые
концентрации: 0,3 N;
0,25 N;
0,2 N;
0,15 N;
0,1 N;
0,075 N;
0,05 N;
0,03 N;
0,01 N;
0,005 N.
Растворы термостатируют при 25 oС.
Концентрации этих растворов должны
быть известны с точностью до третьего
знака, однако, не нужно стремиться к
тому, чтобы они выражались круглыми
числами.
Освобождают
бюретку от находившегося в ней раствора
и заполняют бюретку до метки раствором
(
0,5 N)
из бутыли. В мерные колбы на 100 мл наливают
при помощи бюретки рассчитанные
количества растворов СН3СООН,
доводят до метки водой.
Первые
три приготовленных раствора ставят
термостатироваться и готовят остальные
растворы, повторяя те же самые операции.
Для приготовления последних трёх
растворов используют исходный раствор
кислоты с концентрацией
0,1 N.
Заливают
в измерительную ячейку контрольный
раствор KCl,
измеряют УЭП. Результат используют для
проверки калибровки кондуктометра и
введения дополнительной поправки.
Проведение
измерений
Через
10 минут извлекают из термостата колбу
с раствором №1 и заливают его в
измерительную ячейку над стаканом для
слива излишка раствора. Погружают в
ячейку датчик. Перед установкой ячейки
в термостат следует осушить её снаружи
фильтровальной бумагой. На освободившееся
место устанавливают в термостат колбу
с раствором №4. На дисплее кондуктометра
отображается температура раствора в
ячейке. После установления температуры
25 oС,
измеряют значения удельной
электропроводности. Затем проводят
измерение с раствором №2 и т. д. Данные
заносят в таблицу, рассчитывают степень
диссоциации кислоты.
Таблица
1.1
Расчёт степени
диссоциации кислоты
|
Номер |
Конц. кислоты, СА моль/л |
Удельная См |
Эквивалентная Смсм2моль–1 |
Степень 1 |
Степень (второе 2 |
|
1 |
|||||
|
… |
|||||
|
10 |
Для
определения константы диссоциации
заполняют таблицу 1.2.
Таблица 1.2
Расчёт константы диссоциации кислоты
|
Номер опыта |
СА моль |
2 |
|
|
|
lgKa |
Ka |
|
1 |
|||||||
|
… |
|||||||
|
10 |
Отчёт о работе
должен содержать заполненные табл. 1.1
и 1.2, рассчитанное значение константы
диссоциации уксусной кислоты, и справочное
значение константы диссоциации уксусной
кислоты.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

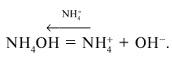

![{ Displaystyle К ^ { ominus} = {{ гидроразрыва {[{ ce {A ^ -} }] [{ ce {H +}}]} {{ ce {[HA]}}}} Gamma}, quad Gamma = { frac { gamma _ {{ ce {A ^ -} }} gamma _ {{ ce {H +}}}} { gamma _ {{ ce {HA}}} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e9373db7091aeb4f51a26757a677b420f0a8418)
![{ displaystyle K _ { text {a}} = { frac {K ^ { ominus}} { Gamma}} = mathrm { frac {[A ^ {-}] [H ^ { +}]} {[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2a5a59c740de89347ec4c96d982292fc05c64b2f)
![{ displaystyle mathrm {p} K _ {{ ce {a}}} = - log _ {10} { frac {[{ ce {A ^ -}}] [{ ce {H ^ +}}]} {[{ ce {HA}}]}} = log _ {10} { frac {{ ce {[HA] }}} {[{ ce {A ^ -}}] [{ ce {H +}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bed5fbab82167a42994a6d735931d08b06f1e7a5)
![{ displaystyle beta _ {2} = { frac {{ ce {[H_2A]}}} {[{ ce {A ^ {2 -}}}] [{ ce {H +}}] ^ {2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3306fbf9ccf8d12352eab96dfb5461897f2c3a15)


![{ стиль отображения К _ { т ext {disoc}} = mathrm { frac {[A ^ {-}] [H ^ {+}]} {[ HA]}}: mathrm {p} K _ { text {a}} = - журнал K _ { text {disoc}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c5f9c1efd45de9edf690ebf6a72cc806eb2b0331)
![{ displaystyle K _ { text {assoc}} = mathrm { frac {[HA]} {[A ^ {-}] [H ^ {+}]}}: mathrm {p} K _ { text {b}} = - log K _ { text {assoc}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/77a0453338b1d420214ac7c127d3faa13374fce0)





![{ displaystyle K _ { mathrm {a}} = mathrm { frac {[A ^ {-}] [H ^ {+}]} {[HA]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4df1424aa532585fc7ad6dd660a596705ee31a2b)


![{ displaystyle mathrm {pH} = mathrm {p} K _ { text {a}} + log mathrm { frac { [A ^ {-}]} {[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/25e874f2b8ea8e4127605788c356393cfd7fff37)
![{ displaystyle mathrm {p} K _ { ce {a1}}} = log _ {10} { frac {[{ ce {H_3PO_4}}]} {[ { ce {H_2PO_4 ^ {-}}}] [{ ce {H ^ +}}]}} = 2,14}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dff6e67381cb8a691b8873fbf884dad30b001352)
![{ displaystyle mathrm {p} K _ {{ ce {a2}}} = log _ {10} { frac {[{ ce {H_2PO_4 ^ {-}}}]} {[{ ce {HPO_4 ^ {2 -}}}] [{ ce {H ^ +}}]}} = 7.2}](https://wikimedia.org/api/rest_v1/media/math/render/svg/efe9f5a620a62c8de4a6567f58faf01e66829903)
![{ displaystyle mathrm {p} K _ { ce {a3}}} = log _ {10} { frac {[{ ce {HPO_4 ^ {2 -}}} ]} {[{ ce {PO_4 ^ {3 -}}}] [{ ce {H ^ +}}]}} = 12,37}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf6cf97c1d47ba55db3a383374b9d8cd4eda22ee)





![{ displaystyle { begin {align} K _ { text {b}} & = mathrm { frac {[HB ^ {+}] [ OH ^ {-}]} {[B]}} \ mathrm {p} K _ { text {b}} & = - log _ {10} left (K _ { text {b}} right) end {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5dea1aac629a595476e18c042a8f4365a50f0efc)
![{ displaystyle mathrm {[OH ^ {-}]} = { frac {K _ { mathrm {w}}} { mathrm {[H ^ {+}]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab7f583da9f8b50145990ffa4342919930edfa16)
![{ displaystyle K _ { text {b}} = { frac {[ mathrm {HB ^ {+}}] K _ { text {w}}} { mathrm {[B] [H ^ {+}]}}} = { frac {K _ { text {w}}} {K _ { text {a}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/921c3abd37a1c5c00c31831509d3b090394c0d47)

 (ионные заряды опускаются в общих выражениях)
(ионные заряды опускаются в общих выражениях)![{ displaystyle K _ { mathrm {b}} = mathrm { frac {[M_ {p} (OH) _ { q-1}] [OH]} {[M_ {p} (OH) _ {q}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8cbfccb80ce8c2075e5423896b4c90d23fc7f8ef)
![{ displaystyle K _ { text {a}} = mathrm { frac {[H ^ {+}] [OH ^ {-}]} {[H_ {2} O]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cdc540ad193c8f1661c1897698be93153fc5fb84)
![{ displaystyle K _ { text {w}} = [ mathrm {H} ^ {+}] [ mathrm {OH} ^ {-}] ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c0039f77db244ea2f6d03d3475dc7a232a8ccb16)

 .
.
