Как определять квантовые числа
Квантовое численное значение какой-либо квантованной переменной микроскопического объекта, характеризующее состояние частицы, называется квантовым числом. Атом химического элемента состоит из ядра и электронной оболочки. Состояние электрона характеризуется его квантовыми числами.

Вам понадобится
- таблица Менделеева
Инструкция
Квантовое число электрона n называется главным. Оно определяет энергию электрона в о атоме водорода и в одноэлектронных системах (например, в водородоподобных ионах гелия и.т.д.). Энергия электрона равна E = -13,6/(n^2) эВ, где n принимает натуральные значения.В многоэлектронных уровнях электроны с одинаковыми значениями n образуют электронную оболочку или электронный уровень. Уровни обозначаются заглавными латинскими буквами K, L, M…, которые соответствуют квантовому числу n = 1, 2 ,3…Таким образом, зная на каком уровне расположен электрон, можно определить его квантовое число n. Максимально возможное число электронов на каждом уровне зависит от n — оно равно 2*(n^2).
Орбитальное квантовое число l принимает значения от 0 до n-1 и характеризует форму орбиталей. Оно определяет подоболочку, на которой расположен электрон. Квантовое число l также имеет буквенное обозначение. Квантовым числам l = 0, 1, 2, 3, 4 соответствуют обозначения l = s, p, d, f, g… Буквенные обозначения присутствуют в записи электронного конфигурации химического элемента, по ним можно определить квантовое число l. Всего на подоболочке может быть 2(2l+1) электронов.
Квантовое число ml называется магнитным (l записывается cнизу, как индекс). Оно определяет пространственное значение атомной орбитали и принимает целые значения от -l до l через единицу, то есть всего (2l+1) значений.
Электрон является фермионом, то есть имеет полуцелый спин, равный 1/2. Поэтому его спиновое квантовое число ms (s записывается снизу, как индекс) принимает два возможных значения — 1/2 и -1/2,представляющие собой две проекции углового момента электрона на выделенную ось.
Источники:
- Квантовые числа электрона
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Доброго времени суток, уважаемые форумчане!! Хотелось бы разобраться в необыкновенно интересной теме:
Необходимо указать все квантовые числа формирующего электрона для As.
Мои рассуждения складываются из следующего:
Электрон, который последним заполняет орбитали атома, называется формирующим и элемент относится к группе, называемой по формирующему электрону
.мышьяк 33As 1s 22s 22p 63s 23p 6 4s 23d 104p 3
Следовательно, у мышьяка формирующим является р- электрон.
Для формирующего электрона n = 4, l = 1, m = 0, s = -1/2 либо +1/2. права ли я??
и еще : какие элементы являются электронными аналогами по формирующему электрону 4s2?Вот с этим как-то не получается разобраться.
Заранее благодарю за внимание к моей теме.
Материалы портала onx.distant.ru
Квантовые числа
Общая характеристика квантовых чисел
Принцип (запрет) Паули
Правило Хунда
Примеры решения задач
Задачи для самостоятельного решения
Общая характеристика квантовых чисел
Главное квантовое число n характеризует энергию электрона в атоме и размер электронной орбитали. Оно соответствует также номеру электронного слоя, на котором находится электрон. Совокупность электронов в атоме с одинаковым значением главного квантового числа n называют электронным слоем (энергетическим уровнем). n – принимает значения 1, 2, 3, …, ∞ . Энергетические уровни обозначают прописными латинскими буквами:
| Значение n | 1 | 2 | 3 | 4 | 5 | 6 |
| Обозначение слоя | K | L | M | N | O | P |
Различия в энергиях электронов, принадлежащих к различным подуровням данного энергетического уровня, отражает побочное (орбитальное) квантовое число l. Электроны в атоме с одинаковыми значениями n и l составляют энергетический подуровень (электронную оболочку). Максимальное число электронов в оболочке Nl:
Nl = 2(2l + 1). (1)
Побочное квантовое число принимает целые значения 0, 1, … (n – 1). Обычно l обозначается не цифрами, а буквами:
| Значение l | 0 | 1 | 2 | 3 | 4 |
| Обозначение орбитали | s | p | d | f | g |
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, форму орбитали, орбитальный момент импульса электрона.
Таким образом, электрон, обладая свойствами частицы и волны, движется вокруг ядра, образуя электронное облако, форма которого зависит от значения l. Так, если l = 0, (s-орбиталь), то электронное облако имеет сферическую симметрию. При l = 1 (p-орбиталь) электронное облако имеет форму гантели. d-орбитали имеют различную форму: dz2 — гантель, расположенная по оси Z с тором в плоскости X – Y, dx2 — y2 — две гантели, расположенные по осям X и Y; dxy, dxz, dyz, — две гантели, расположенные под 45o к соответствующим осям.
- Формы электронных облаков для различных состояний электронов в атомах
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, а также определяет величину проекции орбитального момента импульса на ось Z. ml принимает значения от +l до — l, включая 0. Общее число значений ml равно числу орбиталей в данной электронной оболочке.
Магнитное спиновое квантовое число ms характеризует проекцию собственного момента импульса электрона на ось Z и принимает значения +1/2 и –1/2 в единицах h/2p (h – постоянная Планка).
Принцип (запрет) Паули
В атоме не может быть двух электронов со всеми четырьмя одинаковыми квантовыми числами. Принцип Паули определяет максимальное число электронов Nn, на электронном слое с номером n:
Nn = 2n2. (2)
На первом электронном слое может находиться не более двух электронов, на втором – 8, на третьем – 18 и т. д.
Правило Хунда
Заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным. Например, три р-электрона на орбиталях р-оболочки располагаются следующим образом:
Таким образом, каждый электрон занимает одну р-орбиталь.
Примеры решения задач
Задача 1. Охарактеризуйте квантовыми числами электроны атома углерода в невозбужденном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома углерода: 1s22s22p2. В первом слое атома углерода находятся два s-электрона с антипараллельными спинами, для которых n = 1. Для двух s-электронов второго слоя n = 2. Спины двух р-электронов второго слоя параллельны; для них m s= +1/2.
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
| 6 | 2 | 1 | 0 | +1/2 |
Задача 2. Охарактеризуйте квантовыми числами внешние электроны атома кислорода в основном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома кислорода: 1s22s22p4. Во внешнем слое у этого атома находятся 6 электронов 2s22p4. Значения их квантовых чисел приведены в таблице.
| № электрона | n | l | ml | ms |
| 1 | 2 | 0 | 0 | +1/2 |
| 2 | 2 | 0 | 0 | –1/2 |
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | 0 | +1/2 |
| 5 | 2 | 1 | –1 | +1/2 |
| 6 | 2 | 1 | 1 | –1/2 |
Задача 3. Охарактеризуйте квантовыми числами пять электронов, находящихся в состоянии 4d. Ответ представьте в виде таблицы.
Решение. Согласно правилу Хунда электроны в квантовых ячейках располагаются следующим образом:
Значения главного, побочного и спинового квантовых чисел у электронов одинаковы и равны n=4, l=2, ms=+1/2. Рассматриваемые электроны отличаются значениями квантовых чисел ml.
| № электрона | n | l | ml | ms |
| 1 | 4 | 2 | 2 | +1/2 |
| 2 | 4 | 2 | 1 | +1/2 |
| 3 | 4 | 2 | 0 | +1/2 |
| 4 | 4 | 2 | –1 | +1/2 |
| 5 | 4 | 2 | –2 | +1/2 |
Задача 4. Рассчитайте максимальное число электронов в электронном слое с n = 4.
Решение. Максимальное число электронов, обладающих данным значением главного квантового числа, рассчитываем по формуле (2). Следовательно, в третьем энергетическом уровне может быть не более 32 электронов.
Задача 5. Рассчитайте максимальное число электронов в электронной оболочке с l = 3.
Решение:
Максимальное число электронов в оболочке определяется выражением (1). Таким образом, максимальное число электронов в электронной оболочке с l = 3 равно 14.
Задачи для самостоятельного решения
1. Охарактеризуйте квантовыми числами электроны атома бора в основном состоянии. Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
2. Охарактеризуйте квантовыми числами d-электроны атома железа в основном состоянии. Ответ представьте в виде таблиц:
Расположение 3d-электронов атома железа на орбиталях:
| ? | ? | ? | ? | ? |
Значения квантовых чисел этих электронов:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
Шесть 3d-электронов атома железа располагаются на орбиталях следующим образом
Квантовые числа этих электронов приведены в таблице
| № электрона | n | l | ml | ms |
| 1 | 3 | 2 | 2 | +1/2 |
| 2 | 3 | 2 | 1 | +1/2 |
| 3 | 3 | 2 | 0 | +1/2 |
| 4 | 3 | 2 | — 1 | +1/2 |
| 5 | 3 | 2 | — 2 | +1/2 |
| 6 | 3 | 2 | 2 | — 1/2 |
3. Каковы возможные значения магнитного квантового числа ml, если орбитальное квантовое число l = 3?
Ответ: ml = +3; +2; +1; 0, — 1, — 2, — 3.
4. Охарактеризуйте квантовыми числами находящиеся во втором электронном слое электроны:
Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
| 7 | ? | ? | ? | ? |
Ответ: Электронная конфигурация 2s22p5. Главное квантовое число для всех электронов равно 2. Для s электронов l = 0, для р-электронов l = 1.
| № электрона | n | l | ml | ms |
| 1 | 2 | 0 | 0 | +1/2 |
| 2 | 2 |
0 |
0 | — 1/2 |
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | 0 | +1/2 |
| 5 | 2 | 1 | — 1 | +1/2 |
| 6 | 2 | 1 | 1 | — 1/2 |
| 7 | 2 | 1 | 0 |
— 1/2 |
5. Определите максимальное число электронов на электронном слое, для которого главное квантовое число n = 6.
6. Определите максимальное число электронов на электронной оболочке, для которой побочное квантовое число l = 4.
7. Определите максимальное число электронов на третьем слое.
8. Определите максимальное число электронов на 5d электронной оболочке.
9. Какие значения может принимать орбитальное (побочное) квантовое число l?
Квантовые числа электронов
Существует четыре квантовых числа электронов и о каждом из них — по порядку.
Главное квантовое число N характеризует энергетический уровень, другими словами это размер энергетического уровня,
чем больше число N — тем больше радиус, на котором находятся электроны.
Орбитальное квантовое число L обозначает форму той области, в которой может находится электрон, число L имеет
значения s (L=0),p (L=1), d (L=2),f (L=3) и также называется энергетической оболочкой или энергетическим подуровнем.
На каждой орбитали находится «2·L + 1» орбиталей, магнитное квантовое число Ml
обозначает орбиталь, на котором находится электрон. Ml может принимать значения ±L.
И последнее квантовое число — спин, он принимает два значения: +½ и -½, обозначающий соответственно
прямое и обратное вращение электрона.
Квантовые числа элемента, или квантовые числа электрона — это четыре квантовых числа, характеризующих состояние
внешнего электрона в атоме, ниже дана таблица квантовых чисел электронов любого атома:
1
H
водород
1s 1
N = 1 L = 0 Ml = 0 Ms = +½
2
He
гелий
1s 2
N = 1 L = 0 Ml = 0 Ms = -½
3
Li
литий
2s 1
N = 2 L = 0 Ml = 0 Ms = +½
4
Be
бериллий
2s 2
N = 2 L = 0 Ml = 0 Ms = -½
5
B
бор
2p 1
N = 2 L = 1 Ml = -1 Ms = +½
6
C
углерод
2p 2
N = 2 L = 1 Ml = 0 Ms = +½
7
N
азот
2p 3
N = 2 L = 1 Ml = 1 Ms = +½
8
O
кислород
2p 4
N = 2 L = 1 Ml = -1 Ms = -½
9
F
фтор
2p 5
N = 2 L = 1 Ml = 0 Ms = -½
10
Ne
неон
2p 6
N = 2 L = 1 Ml = 1 Ms = -½
11
Na
натрий
3s 1
N = 3 L = 0 Ml = 0 Ms = +½
12
Mg
магний
3s 2
N = 3 L = 0 Ml = 0 Ms = -½
13
Al
алюминий
3p 1
N = 3 L = 1 Ml = -1 Ms = +½
14
Si
кремний
3p 2
N = 3 L = 1 Ml = 0 Ms = +½
15
P
фосфор
3p 3
N = 3 L = 1 Ml = 1 Ms = +½
16
S
сера
3p 4
N = 3 L = 1 Ml = -1 Ms = -½
17
Cl
хлор
3p 5
N = 3 L = 1 Ml = 0 Ms = -½
18
Ar
аргон
3p 6
N = 3 L = 1 Ml = 1 Ms = -½
19
K
калий
4s 1
N = 4 L = 0 Ml = 0 Ms = +½
20
Ca
кальций
4s 2
N = 4 L = 0 Ml = 0 Ms = -½
21
Sc
скандий
3d 1
N = 3 L = 2 Ml = -2 Ms = +½
22
Ti
титан
3d 2
N = 3 L = 2 Ml = -1 Ms = +½
23
Vd
ванадий
3d 3
N = 3 L = 2 Ml = 0 Ms = +½
24
Cr
хром
3d 5
N = 3 L = 2 Ml = 2 Ms = +½
25
Mn
марганец
3d 5
N = 3 L = 2 Ml = 2 Ms = +½
26
Fe
железо
3d 6
N = 3 L = 2 Ml = -2 Ms = -½
27
Co
кобальт
3d 7
N = 3 L = 2 Ml = -1 Ms = -½
28
Ni
никель
3d 8
N = 3 L = 2 Ml = 0 Ms = -½
29
Cu
медь
3d 10
N = 3 L = 2 Ml = 2 Ms = -½
30
Zn
цинк
3d 10
N = 3 L = 2 Ml = 2 Ms = -½
31
Ga
галлий
4p 1
N = 4 L = 1 Ml = -1 Ms = +½
32
Ge
германий
4p 2
N = 4 L = 1 Ml = 0 Ms = +½
33
As
мышьяк
4p 3
N = 4 L = 1 Ml = 1 Ms = +½
34
Se
селен
4p 4
N = 4 L = 1 Ml = -1 Ms = -½
35
Br
бром
4p 5
N = 4 L = 1 Ml = 0 Ms = -½
36
Kr
криптон
4p 6
N = 4 L = 1 Ml = 1 Ms = -½
37
Rb
рубидий
5s 1
N = 5 L = 0 Ml = 0 Ms = +½
38
Sr
стронций
5s 2
N = 5 L = 0 Ml = 0 Ms = -½
39
Y
иттрий
4d 1
N = 4 L = 2 Ml = -2 Ms = +½
40
Zr
цирконий
4d 2
N = 4 L = 2 Ml = -1 Ms = +½
41
Nb
ниобий
4d 4
N = 4 L = 2 Ml = 1 Ms = +½
42
Mo
молибден
4d 5
N = 4 L = 2 Ml = 2 Ms = +½
43
Tc
технеций
4d 5
N = 4 L = 2 Ml = 2 Ms = +½
44
Ru
рутений
4d 7
N = 4 L = 2 Ml = -1 Ms = -½
45
Rh
родий
4d 8
N = 4 L = 2 Ml = 0 Ms = -½
46
Pd
палладий
4d 10
N = 4 L = 2 Ml = 2 Ms = -½
47
Ag
серебро
4d 10
N = 4 L = 2 Ml = 2 Ms = -½
48
Cd
кадмий
4d 10
N = 4 L = 2 Ml = 2 Ms = -½
49
In
индий
5p 1
N = 5 L = 1 Ml = -1 Ms = +½
50
Sn
олово
5p 2
N = 5 L = 1 Ml = 0 Ms = +½
51
Sb
сурьма
5p 3
N = 5 L = 1 Ml = 1 Ms = +½
52
Te
теллур
5p 4
N = 5 L = 1 Ml = -1 Ms = -½
53
I
йод
5p 5
N = 5 L = 1 Ml = 0 Ms = -½
54
Xe
ксенон
5p 6
N = 5 L = 1 Ml = 1 Ms = -½
55
Cs
цезий
6s 1
N = 6 L = 0 Ml = 0 Ms = +½
56
Ba
барий
6s 2
N = 6 L = 0 Ml = 0 Ms = -½
57
La
лантан
5d 1
N = 5 L = 2 Ml = -2 Ms = +½
58
Ce
церий
4f 2
N = 4 L = 3 Ml = -2 Ms = +½
59
Pr
празеодим
4f 3
N = 4 L = 3 Ml = -1 Ms = +½
60
Nd
неодим
4f 4
N = 4 L = 3 Ml = 0 Ms = +½
61
Pm
прометий
4f 5
N = 4 L = 3 Ml = 1 Ms = +½
62
Sm
самарий
4f 6
N = 4 L = 3 Ml = 2 Ms = +½
63
Eu
европий
4f 7
N = 4 L = 3 Ml = 3 Ms = +½
64
Gd
гадолиний
5d 1
N = 5 L = 2 Ml = -2 Ms = +½
65
Tb
тербий
4f 9
N = 4 L = 3 Ml = -2 Ms = -½
66
Dy
диспрозий
4f 10
N = 4 L = 3 Ml = -1 Ms = -½
67
Ho
гольмий
4f 11
N = 4 L = 3 Ml = 0 Ms = -½
68
Er
эрбий
4f 12
N = 4 L = 3 Ml = 1 Ms = -½
69
Tm
тулий
4f 13
N = 4 L = 3 Ml = 2 Ms = -½
70
Yb
иттербий
4f 14
N = 4 L = 3 Ml = 3 Ms = -½
71
Lu
лютеций
5d 1
N = 5 L = 2 Ml = -2 Ms = +½
72
Hf
гафний
5d 2
N = 5 L = 2 Ml = -1 Ms = +½
73
Ta
тантал
5d 3
N = 5 L = 2 Ml = 0 Ms = +½
74
W
вольфрам
5d 4
N = 5 L = 2 Ml = 1 Ms = +½
75
Re
рений
5d 5
N = 5 L = 2 Ml = 2 Ms = +½
76
Os
осмий
5d 6
N = 5 L = 2 Ml = -2 Ms = -½
77
Ir
иридий
5d 7
N = 5 L = 2 Ml = -1 Ms = -½
78
Pt
платина
5d 9
N = 5 L = 2 Ml = 1 Ms = -½
79
Au
золото
5d 10
N = 5 L = 2 Ml = 2 Ms = -½
80
Hg
ртуть
5d 10
N = 5 L = 2 Ml = 2 Ms = -½
81
Tl
таллий
6p 1
N = 6 L = 1 Ml = -1 Ms = +½
82
Pb
свинец
6p 2
N = 6 L = 1 Ml = 0 Ms = +½
83
Bi
висмут
6p 3
N = 6 L = 1 Ml = 1 Ms = +½
84
Po
полоний
6p 4
N = 6 L = 1 Ml = -1 Ms = -½
85
At
астат
6p 5
N = 6 L = 1 Ml = 0 Ms = -½
86
Rn
радон
6p 6
N = 6 L = 1 Ml = 1 Ms = -½
87
Fr
франций
7s 1
N = 7 L = 0 Ml = 0 Ms = +½
88
Ra
радий
7s 2
N = 7 L = 0 Ml = 0 Ms = -½
89
Ac
актиний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
90
Th
торий
7d 2
N = 7 L = 2 Ml = -1 Ms = +½
91
Pa
протактиний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
92
U
уран
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
93
Np
нептуний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
94
Pu
плутоний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
95
Am
америций
5f 7
N = 5 L = 3 Ml = 3 Ms = +½
96
Cm
кюрий
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
97
Bk
берклий
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
98
Cf
калифорний
5f 10
N = 5 L = 3 Ml = -1 Ms = -½
99
Es
эйнштейний
5f 11
N = 5 L = 3 Ml = 0 Ms = -½
100
Fm
фермий
5f 12
N = 5 L = 3 Ml = 1 Ms = -½
101
Md
менделеевий
5f 13
N = 5 L = 3 Ml = 2 Ms = -½
102
No
нобелий
5f 14
N = 5 L = 3 Ml = 3 Ms = -½
103
Lr
лоуренсий
6d 1
N = 6 L = 2 Ml = -2 Ms = +½
104
Rf
резерфордий
6d 2
N = 6 L = 2 Ml = -1 Ms = +½
105
Db
дубний
6d 3
N = 6 L = 2 Ml = 0 Ms = +½
106
Sg
сиборгий
6d 4
N = 6 L = 2 Ml = 1 Ms = +½
107
Bh
борий
6d 5
N = 6 L = 2 Ml = 2 Ms = +½
108
Hs
хассий
6d 6
N = 6 L = 2 Ml = -2 Ms = -½
109
Mt
мейтнерий
6d 7
N = 6 L = 2 Ml = -1 Ms = -½
110
Ds
дармштадтий
6d 8
N = 6 L = 2 Ml = 0 Ms = -½
111
Rg
рентгений
6d 9
N = 6 L = 2 Ml = 1 Ms = -½
112
Cn
коперниций
6d 10
N = 6 L = 2 Ml = 2 Ms = -½
113
Nh
нихоний
7p 1
N = 7 L = 1 Ml = -1 Ms = +½
114
Fl
флеровий
7p 2
N = 7 L = 1 Ml = 0 Ms = +½
115
Mc
московий
7p 3
N = 7 L = 1 Ml = 1 Ms = +½
116
Lv
ливерморий
7p 4
N = 7 L = 1 Ml = -1 Ms = -½
117
Ts
теннесcин
7p 5
N = 7 L = 1 Ml = 0 Ms = -½
118
Og
оганесон
7p 6
N = 7 L = 1 Ml = 1 Ms = -½
Электронная конфигурация атомов химических элементов
Волновая
функция, являющаяся решением уравнения
Шредингера, называется орбиталью.
Для решения этого уравнения вводятся
три квантовых числа (n,
l
и ml
)
Главное
квантовое число n.
оно
определяет энергию электрона и размеры
электронных облаков. Энергия электрона
главным образом зависит от расстояния
электрона от ядра: чем ближе к ядру
находится электрон, тем меньше его
энергия. Поэтому можно сказать, что
главное квантовое число n
определя-
ет
расположение электрона на том или ином
энергетическом уровне. Главное квантовое
число имеет значения ряда целых чисел
от 1
до ∞.
При значении главного квантового числа,
равного 1
(n
=
1),
электрон находится на первом энергетическом
уровне, расположенном на минимально
возможном расстоянии от ядра. Общая
энергия такого электрона наименьшая.
Электрон,
находящийся на наиболее удаленном от
ядра энергетическом уровне, обладает
максимальной энергий. Поэтому при
переходе электрона с более удаленного
энергетического уровня на более близкий
выделяется энергия. Энергетические
уровни обозначают прописными буквами
согласно схеме:
Значение
n
…. 1 2 3 4 5
Обозначение K L M N Q
Орбитальное
квантовое число l.
Согласно
квантово-механическим расчетам
электронные облака отличаются не только
размерами, но и формой. Форму электронного
облака характеризует орбитальное или
побочное квантовое число. Различная
форма электронных облаков обусловливает
изменение энергии электрона в пределах
одного энергетического уровня, т.е. ее
расщепления на энергетические подуровни.
Каждой форме электронного облака
соответствует определенное значение
механического момента движения электрона
,
определяемого орбитальным квантовым
числом:
Определенной
форме электронного облака соответствует
вполне определенное значение орбитального
момента количества движения электрона
.
Так как
может принимать только дискретные
значения, задаваемые квантовым числом
l,
то и формы электронных облаков не могут
быть произвольными: каждому возможному
значению
l
соответствует вполне определенная
форма электронного облака.
Рис.
5. Графическая интерпретация момента
движения электрона, гдеμ
— орбитальный момент количества
движения
электрона
Орбитальное
квантовое число может иметь значения
от 0
до n
— 1,
всего n
– значений.
Энергетические
подуровни обозначены буквами:
Значение
l 0 1 2 3 4
Обозначение s p d f g
Магнитное
квантовое число ml.
Из
решения уравнения Шредингера следует,
что электронные облака ориентированы
определенным образом в пространстве.
Пространственная ориентация электронных
облаков характеризуется магнитным
квантовым числом.
Магнитное
квантовое число может принимать любые
целочисленные значения как положительные,
так и отрицательные в пределах от –l
до +l,
а всего это число может принимать (2l+1)
значений для данного l,
включая нулевое. Например, если l
= 1,
то возможны три значения m
(–1,0,+1)
орбитальный момент
,
есть вектор,
величина которого квантована и
определяется значением l.
Из уравнения Шредингера следует, что
не только величина µ,
но и направление этого вектора,
характеризующее пространственную
ориентацию электронного облака,
квантовано. Каждому направлению вектора
заданной
длины соответствует
определенное значение его проекции на
ось z,
характеризующее некоторое направление
внешнего магнитного поля. Значение этой
проекции характеризует ml.
Спин электрона.
Изучение
атомных спектров показало, что три
квантовых числа n,
l
и ml
не являются
полной характеристикой поведения
электронов в атомах. С развитием
спектральных методов исследований и
повышением разрешающей способности
спектральных приборов была обнаружена
тонкая структура спектров. Оказалось,
что линии спектров расщепляются. Для
объяснения этого явления было введено
четвертое квантовое число, связанное
с поведением самого электрона. Это
квантовое число было названо спином
с обозначением ms
и принимающее всего два значения +½
и –½
в зависимости от одной из двух возможных
ориентаций спина электрона в магнитном
поле. Положительное и отрицательное
значения спина связаны с его направлением.
Поскольку спин
величина векторная, то его условно
обозначают стрелкой, направленной вверх
или ↑ или вниз ↓ .Электроны, имеющие
одинаковое направление спина называются
параллельными,
при
противоположных значениях спинов –
антипараллельныи.
Наличие спина у
электрона было доказано экспериментально
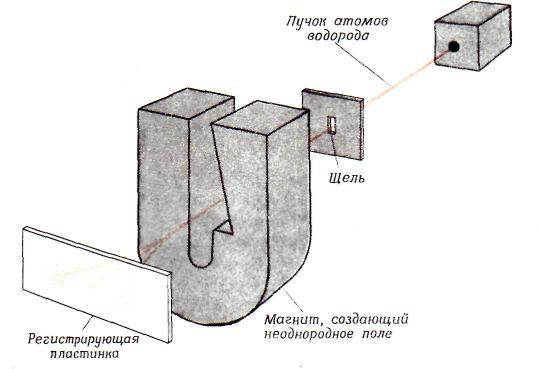
в 1921 г., В. Герлахом и О. Штерном, которые
сумели разделить пучок атомов водорода
на две части, соответствующие ориентации
электронного спина. Схема их эксперимента
показана на рис. 6. Когда атомы водорода
пролетают через область сильного
магнитного поля, электрон каждого атома
взаимодействует с магнитным полем, и
это заставляет атом отклоняться от
исходной прямолинейной траектории,
Направление, в котором отклоняется
атом, зависит от ориентации спина его
электрона. Спин у электрона не зависит
от внешних условий и не может быть
уничтожен или изменен.
Таким образом,
было окончательно установлено, что
полностью состояние электрона в атоме
характеризуется четырьмя квантовыми
числами n,
l,
ml.
и ms,
Рис. 6. Схема
эксперимента Штерна — Герлаха
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #