Молекулярная масса и размеры белков. Методы определения молекулярной массы белков. Необходимость применения комплекса методов для точной оценки молекулярной массы белков
Белки относятся
к высокомолекулярным соединениям, в
состав которых входят сотни и даже
тысячи аминокислотных остатков,
объединенных в макромолекулярную
структуру. Молекулярная масса белков
колеблется от 6000 (нижний предел) до
1000000 и выше в зависимости от количества
отдельных полипептидных цепей в составе
единой молекулярной структуры белка.
Такие полипептидные цепи называются
субъединицами. Их молекулярная масса
варьирует в широких пределах: от 6000 до
100000 и более. Для выражения молекулярной
массы белков используют также специальную
единицу – дальтон.
Дальтон (Да) –
единица массы, практически равная массе
атома водорода (т.е. 1,0000 по шкале атомных
масс). Терминами «дальтон» и «молекулярная
масса» пользуются как взаимозаменяемыми:
например, белок в 20000 дальтон имеет
молекулярную массу 20000. Наименование
дано в честь Джона Дальтона, разработавшего
атомарную теорию строения материи.
Килодальтон (кДа) – единица массы, равная
1000 дальтон. Масса большинства белков
лежит в пределах от 10 до 100 кДа.
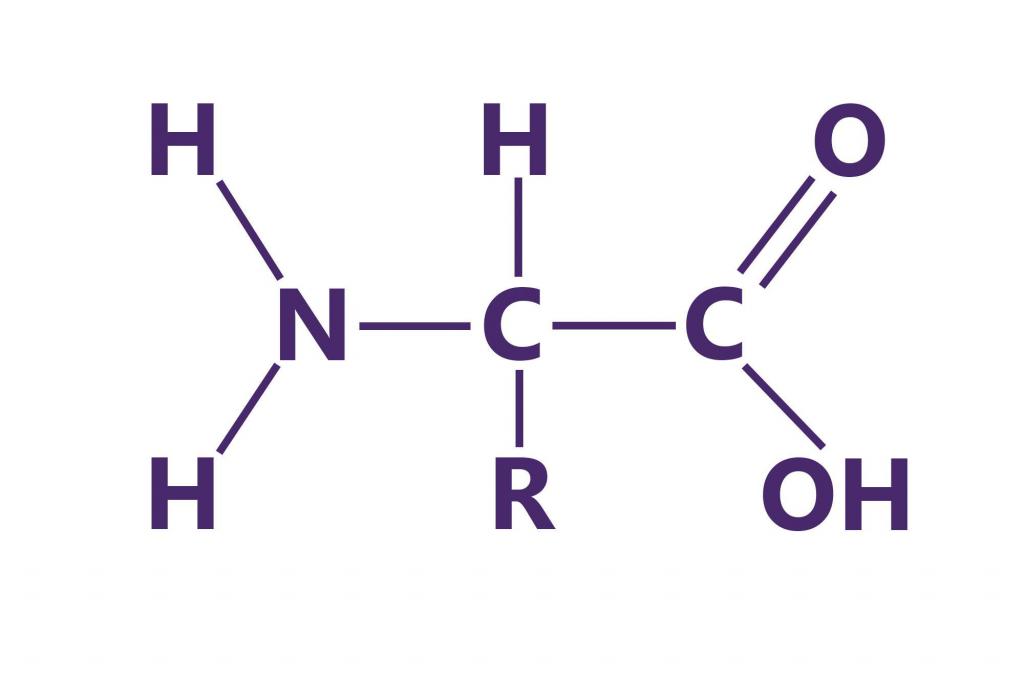
Аминокислотный
состав и последовательность аминокислот
выяснены для многих тысяч белков. В
связи с этим стало возможным вычисление
их молекулярной массы химическим путем
с высокой точностью. Однако для огромного
количества встречающихся в природе
белков химическое строение не выяснено,
поэтому основными методами определения
молекулярной массы все еще остаются
физико-химические методы (гравиметрические,
осмометрические, вискозиметрические,
электрофоретические, оптические и др.).
На практике чаще всего используются
методы седиментационного анализа,
гель-хроматография и гель-электрофорез.
При определении
молекулярной массы белков методами
седиментационного анализа используют
аналитические ультрацентрифуги (первая
ультрацентрифуга была сконструирована
в 1923 г. Т. Сведбергом), в которых удается
создать центробежные ускорения (g), в
200000 и более раз превышающие ускорение
земного притяжения. Обычно молекулярную
массу вычисляют по скорости седиментации
молекул белка или седиментационному
равновесию. По мере перемещения молекул
от центра к периферии образуется резкая
граница «растворитель-белок»
(регистрируется автоматически). Оптические
свойства растворителя и белка используются
при определении скорости седиментации;
которую выражают через константу
седиментации s, зависящую как от массы,
так и от формы белковой частицы:
v
S = —— ,
ω2 ∙ r
где v – скорость
перемещения границы растворитель-белок,
см/с; ω – угловая скорость ротора, рад/с;
r – расстояние от центра ротора до
середины ячейки с раствором белка, см.
Константа седиментации имеет размерность
времени (ее выражают в секундах). Величина
константы седиментации, равная 1·10–13
с, условно принята за единицу и названа
сведбергом (S). Значения констант
седиментации большинства белков лежат
в пределах 1–50 S, хотя в ряде случаев эти
значения превышают 100 S.
Для вычисления
молекулярной массы, помимо константы
седиментации, необходимы дополнительные
сведения о плотности растворителя и
белка и другие согласно уравнению
Сведберга:
RTS
M = ————
D (1- v ρ)
где R – газовая
постоянная, эрг/(моль∙гр.); Т – абсолютная
температура (по шкале Кельвина); S
– константа седиментации; ρ – плотность
растворителя; v – парциальный удельный
объем молекулы белка; D ‒ коэффициент
диффузии.
Определение
молекулярной массы белков методом
ультрацентрифугирования требует много
времени и дорогостоящей аппаратуры.
Поэтому в последние годы разработаны
простые методы (гель-хроматография и
электрофорез).
Гель-хроматографию
проводят при заполнении колонки пористым
гелем сефадекса. Через колонку пропускают
ряд белков с известной молекулярной
массой и строят график зависимости
логарифма молекулярной массы от значений
их элюционных объемов. Между логарифмом
молекулярной массы белка, имеющего
сферическую форму, и элюционным объемом
существует прямая зависимость. Легко
определить молекулярную массу исследуемого
белка, зная его объем элюции.
Второй разновидностью
этого метода является тонкослойная
гель-хроматография. Длина пробега белка
через тонкий слой сефадекса находится
в логарифмической зависимости от его
молекулярной массы (рис.7.1).
Рис.7.1. Зависимость
между длиной пробега белковых частиц
при гель-хроматографии в тонком слое
сефадекса G-150
и их молекулярными массами
При использовании
диск-электрофореза в полиакриламидном
геле строят график зависимости между
логарифмом молекулярной массы
калибровочных белков и подвижностью
белковых частиц в полиакриламидном
геле, а затем, определив подвижность
исследуемого белка, по графику находят
его массу (рис.7.2).
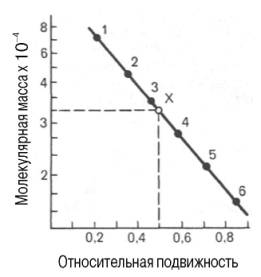
Рис.7.2. Зависимость
между молекулярной массой и относительной
подвижностью белка при диск-электрофорезе
в полиакриламидном геле. присутствии
додецилсульфата натрия
Электрофорез
проводят в присутствии детергента –
додецилсульфата натрия (SDS), т.к. только
в этом случае наблюдается прямая
пропорциональная зависимость между
логарифмом молекулярной массы и
подвижностью белков.
Додецилсульфат
натрия
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
Молекулярная масса белков
Белки
относятся к высокомолекулярным соединениям, в состав которых входят сотни и
даже тысячи аминокислотных остатков, объединенных в макромолекулярную структуру.
Молекулярная масса белков колеблется от 6000 (нижний предел) до 1000000 и выше
в зависимости от количества отдельных полипептидных цепей в составе единой
молекулярной структуры белка. Такие полипептидные цепи получили название
субъединиц. Их мол. масса варьирует в широких пределах – от 6000 до 100000 и
более.
Аминокислотный
состав и последовательность аминокислот выяснены для многих тысяч белков. В
связи с этим стало возможным вычисление их молекулярной массы химическим путем
с высокой точностью. Однако для огромного количества встречающихся в природе
белков химическое строение не выяснено, поэтому основными методами определения
молекулярной массы все еще остаются физико-химические методы (гравиметрические,
осмометрические, вискозиметрические, электрофоретические, оптические и др.). На
практике наиболее часто используются методы седиментационного анализа,
гель-хроматография и гель-электрофорез. Определение молекулярной массы белков
методами седиментационного анализа проводят в ультрацентрифугах , в которых
удается создать центробежные ускорения (g), превышающие в 200000 и более раз ускорение
земного притяжения. Обычно вычисляют молекулярную массу по скорости
седиментации молекул белка или седиментационному равновесию. По мере
перемещения молекул от центра к периферии образуется резкая граница
растворитель-белок (регистрируется автоматически). Оптические свойства
растворителя и белка используются при определении скорости седиментации;
последнюю выражают через константу седиментации s, которая
зависит как от массы, так и от формы белковой частицы:
где v – скорость перемещения границы
растворитель-белок, см/с; ω – угловая скорость
ротора, рад/с; r – расстояние от центра ротора до середины
ячейки с раствором белка, см. Константа седиментации имеет размерность времени
(ее выражают в секундах). Величина константы седиментации, равная 1•10–13
с, условно принята за единицу и названа сведбергом (S). Значения
констант седиментации большинства белков лежат в пределах 1–50 S, хотя
в ряде случаев эти значения превышают 100 S.
Для
вычисления молекулярной массы (М), помимо константы седиментации, необходимы
дополнительные сведения о плотности растворителя и белка и другие согласно
уравнению Сведберга:
где R – газовая постоянная, эрг/(моль•град); Т – абсолютная температура (по шкале
Кельвина); s – константа седиментации; ρ –
плотность растворителя; v –
парциальный удельный объем молекулы белка; D — коэффициент диффузии.
Определение
молекулярной массы белков методом ультрацентрифугирования требует много времени
и сложной и дорогостоящей аппаратуры. Поэтому в последние годы разработаны два
более простых метода (гель-хроматография и электрофорез). При использовании
гель-хроматографии в первую очередь требуется откалибровать колонку. Для этого
через колонку с сефадексом пропускают несколько белков с известными
молекулярными массами и строят график, откладывая значения логарифмов
молекулярной массы против их элюционных объемов, которые находят, как показано
на рис. 1.9.
Известно, что
между логарифмом молекулярной массы белка, имеющего сферическую форму, и
элюционным объемом существует прямая зависимость. Поэтому легко определить
молекулярную массу исследуемого белка, зная его объем элюции. Второй
разновидностью этого метода является тонкослойная гель-хроматография. Длина
пробега белка (в миллиметрах) через тонкий
слой сефадекса находится в логарифмической зависимости от молекулярной массы
белка (рис. 1.10).
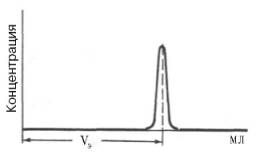
Рис. 1.9. Измерение
объема элюции (VЭ).
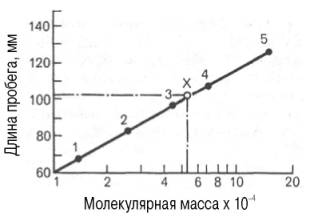
Рис. 1.10. Зависимость
между длиной пробега белковых частиц при гель-хроматографии в тонком слое
сефадекса Г-150 (сверхтонкого) и их молекулярными массами (в
полулогарифмической системе координат).
1 —
рибонуклеаза; 2 — химотрипсиноген; 3 -яичный альбумин; 4 — сывороточный
альбумин; 5 — γ-глобулин; Х — белок с неизвестной молекулярной массой.
Гель-хроматография,
кроме простоты и быстроты, имеет дополнительное преимущество: не требуется
выделять белок в чистом виде, так как примеси других белков не мешают
определению, поскольку каждый из них проходит через колонку со свойственной ему
скоростью, определяемой молекулярной массой. Это обстоятельство широко
используется в энзимологии, когда оказывается возможным определение
молекулярной массы даже очень небольшого количества фермента в присутствии
других белков, не обладающих аналогичной каталитической активностью.
При
использовании диск-электрофореза в полиакриламидном геле для определения
молекулярной массы белков также строят график зависимости между логарифмом
молекулярной массы калибровочных белков и подвижностью белковых частиц в
полиакриламидном геле, а затем, определив подвижность исследуемого белка, по
графику находят его массу (рис. 1.11). Электрофорез проводят в присутствии
детергента додецилсульфата натрия, так как только в этом случае наблюдается
прямая пропорциональная зависимость между молекулярной массой и подвижностью
белков. Белки с четвертичной структурой при этих условиях распадаются на
субъединицы, поэтому метод находит широкое применение для определения
молекулярной массы субъединиц белка.
Рис. 1.11. Зависимость
между молекулярной массой и относительной подвижностью белка при
диск-электрофорезе в полиакриламидном геле в присутствии додецилсульфата натрия
(в полулогарифмической системе координат).
1 —
сывороточный альбумин; 2 — яичный альбумин; 3 — пепсин; 4 — химотрипсиноген; 5
— мио-глобин; 6 — цитохром с; Х —
белок с неизвестной молекулярной массой.
Недавно
предложен новый масс-спектрометрический метод (так называемый лазерный
десорбционно-ионизационный метод), позволяющий определять молекулярную массу
небольших пептидов (вазопрессин, инсулин) и крупных биополимерных молекул и,
кроме того, структуру биомолекул.
Методы нахождения молекулярной массы белка бывают химическими, физико-химическими и физическими. Самыми распространенными физико-химическими методами являются гель-хроматография (как колоночная, так и тонкослойная) и электрофорез в среде полиакриламидного геля в присутствии натрия додецилсульфата. Они не требуют сложного оборудования и больших количеств исследуемого материала.
Характеристика белков
Белки представляют собой высокомолекулярные полимеры биологического происхождения. Они состоят из аминокислот, соединенных последовательно пептидными связями. Размеры белков зависят от количества этих самых аминокислот. Средние значения элементного состава белков в %:
- углерода – в интервале 50,6-54,5;
- кислорода – в пределах 21,5-23,5;
- азота – около 15,0-17,6;
- водорода –в интервале 6,5-7,3;
- серы – в пределах 0,3-2,5;
- минеральных веществ – не более 0,5.
Белки подразделяют на простые, состоящие только из остатков аминокислот, и сложные, включающие простетические группы. Небелковые компоненты могут быть углеводами, липидами, нуклеиновыми кислотами, производными витаминов, ионами металлов, гемом и др. Различают четыре структуры белков.
Аминокислотный состав белков находят путем кислотного гидролиза, сочетаемого с последующим разделением освободившихся аминокислот с помощью ионообменной хроматографии.
Количественные показатели каждой из аминокислот определяют нин-гидриновым методом. Выявление размещения аминокислот в молекуле белка осуществляют путем последовательного отщепления концевых аминокислот с помощью ферментов и их идентификацией, что позволяет определить структуру белковой молекулы. Идентификация основана на их различных физико-химических свойствах. Нередко для этого используют цветные реакции на те или иные аминокислоты и хроматографию.
Колоночная гель-хроматография
Этот метод основывается на линейной зависимости логарифма молекулярной массы многих глобулярных белков и объема элюирования с заполненной гелем (определенного размера пор). Таким образом, для определения молекулярной массы белка следует лишь найти объем его элюции с откалиброванной заранее колонки. Калибровку выполняют методом пропускания через колонку белков с заранее известными массами молекул и замеряя объемы элюции каждого из них. Если в качестве заполнителя используют сефадекс G-75, то расчет молекулярной массы ведут по найденному экспериментальным путем уравнению:
lg M = 5,624 – 0,752 · (Vэ / Vo),
где М – искомая молекулярная масса; Vэ – выходящий из колонки объем раствора с исследуемым веществом; Vo – объем свободной колонки.
Для проведения анализа понадобятся раствор голубого декстрана (1%), раствор NaCl (0,1 моль/л), сефадекс G-75 (4 г), раствор гемоглобина (1%).
Выполнение анализа
Подготовленную колонку заполняют гелем сефадекса G-75 и промывают раствором NaCl. После того как сольют раствор NaCl, поднимающийся выше уровня геля, на его поверхность аккуратно помещают 0,5 мл раствора голубого декстрана. Затем собирают выходящие из колонки жидкости в мерный цилиндр, где их сохраняют до конца эксперимента. Начинающий вытекать раствор с голубой окраской собирают по 20 капель в подготовленные заранее пробирки. Элюат из них от первого до самого интенсивно окрашенного сливают в тот же мерный цилиндр, в котором уже собраны неокрашенные фракции. Объем пробирок ослабевающей окраской раствора не учитывают.
Объем жидкости, собранной в мерный цилиндр, составляется свободным объемом колонки (Vo). Далее повторяют заполнение колонки, но вместо голубого декстрина используют раствор гемоглобина. Объем элюата в мерном цилиндре до выхода раствора с максимально розовой окраской является величиной Vэ. Найденные значения Vo и Vэ подставляют в соответствующее уравнение и вычисляют массу белка. Аминокислотный состав белков находят подобными методиками.
Тонкослойная гель-хроматография
Принцип этого метода заключается в том, что в ходе продвижения раствора белков по пластине с тончайшим слоем сефадекса, смесь их распределяется неравномерно. По расстоянию, пройденному каждым из белков от исходной стартовой линии, находят логарифмы их молекулярных масс. Для определения молекулярной массы белка методом тонкослойной гель-хроматографии строят калибровочный график, отражающий зависимость пройденных маркерными белками расстояний от логарифмов их молекулярных масс. Уже по нему находят длину пути исследуемого белка и массу его молекулы.
Для выполнения эксперимента потребуется столик с изменяющимся углом наклона, а также хроматографическая камера. Из реактивов понадобятся сефадекс G-200 или G-150, натрий-фосфатный буфер, pH 7,4 (0,1 моль/л), раствор бромфенолового синего (0,1%), раствор СН3СООН (5%), раствор CH3COONa (2 %), набор маркерных белков, хроматографическая бумага.
Выполнение эксперимента
Сначала необходимо приготовить гель сефадекса, для чего сухую его массу 4 г суспендируют в избыточном количестве натрий-фосфатного буфера, а затем оставляют для набухания в течение 3 суток при н.у. Стеклянную пластинку со сторонами 20х40 см тщательно промывают. Перед нанесением на нее сефадекса буфер над ним декантуют, а затем гель хорошо перемешивают. На горизонтально расположенную пластину его наносят фарфоровой ложечкой, а затем распределяют прокатыванием стеклянной палочки размером 1х22 см. Прокатывание повторяют до равномерного распределения слоя геля без комков и пузырьков толщиной 1 мм. Подготовленную пластинку просушивают на воздухе 15 мин., а потом помещают в хроматографическую камеру.
В крайние емкости заливают фосфатный буфер, гель соединяют с буфером хроматографической бумагой. Далее камеру закрывают и помещают на специальную подставку. Угол ее наклона устанавливают на 7-10°. Для насыщения камеру оставляют на ночь.
Растворы белков, молекулярная масса которых известна, так же, как и исследуемые образцы, наносят микропипеткой, объем каждой порции должен быть по 0,02 мл. Пластинку возвращают в горизонтальное положение и наносят порции белка в определенные точки. Расстояние между ними и от верхнего края должно быть 3 см. Затем камеру закрывают и ставят под углом 7–10°. Гель-хроматографический анализ проводят 4 ч.
По истечении отведенного времени камеру ставят горизонтально, хроматографическую бумагу удаляют. Стеклянную пластинку помещают на подставку в горизонтальном положении и снимают «реплику» на бумагу для хроматографии. Для этого ее сворачивают в трубочку и накладывают на тонкий гелевый слой, постепенно разворачивая. При этом бумага должна прилипнуть к нему, но делать это нужно аккуратно, чтобы сохранить его в целости. Бумагу оставляют на поверхности пластинки 1 мин., после этого высушивают при температуре 90 °С 20 мин. и помещают в специальную кювету для окрашивания.
Расшифровка результатов
Чтобы идентифицировать белковые зоны, «реплику» помещают в раствор бромфенолового синего на 3 минуты. Далее краситель нужно отмыть дважды раствором уксусной кислоты и закрепить ацетатом натрия. После этого хроматографическую бумагу тщательно промывают в холодной проточной воде и высушивают. Далее приступают к измерению расстояния, пройденного каждым белком от исходной точки до центра пятна.
По полученным данным выстраивают калибровочный график, путем откладывания по оси абсцисс lа/lст (где индекс а относится к анализируемому, а ст — к стандартному белку), по оси ординат – lgM. Замерив расстояние белковой области исследуемого образца от старта, по выстроенному графику определяют молекулярную массу и предполагаемую структуру белковой молекулы.
Молекулярная масса белков
Белки относятся к высокомолекулярным соединениям, в состав которых входят сотни и даже тысячи аминокислотных остатков, объединенных в макромолекулярную структуру. Молекулярная масса белков колеблется от 6000 (нижний предел) до 1000000 и выше в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. Такие полипептидные цепи получили название субъединиц. Их мол. масса варьирует в широких пределах – от 6000 до 100000 и более.
где v – скорость перемещения границы растворитель-белок, см/с; ω – угловая скорость ротора, рад/с; r – расстояние от центра ротора до середины ячейки с раствором белка, см. Константа седиментации имеет размерность времени (ее выражают в секундах). Величина константы седиментации, равная 1•10 –13 с, условно принята за единицу и названа сведбергом (S). Значения констант седиментации большинства белков лежат в пределах 1–50 S, хотя в ряде случаев эти значения превышают 100 S.
Для вычисления молекулярной массы (М), помимо константы седиментации, необходимы дополнительные сведения о плотности растворителя и белка и другие согласно уравнению Сведберга:
Определение молекулярной массы белков методом ультрацентрифугирования требует много времени и сложной и дорогостоящей аппаратуры. Поэтому в последние годы разработаны два более простых метода (гель-хроматография и электрофорез). При использовании гель-хроматографии в первую очередь требуется откалибровать колонку. Для этого через колонку с сефадексом пропускают несколько белков с известными молекулярными массами и строят график, откладывая значения логарифмов молекулярной массы против их элюционных объемов, которые находят, как показано на рис. 1.9.
Известно, что между логарифмом молекулярной массы белка, имеющего сферическую форму, и элюционным объемом существует прямая зависимость. Поэтому легко определить молекулярную массу исследуемого белка, зная его объем элюции. Второй разновидностью этого метода является тонкослойная гель-хроматография. Длина пробега белка (в миллиметрах) через тонкий слой сефадекса находится в логарифмической зависимости от молекулярной массы белка (рис. 1.10).
Рис. 1.9. Измерение объема элюции (VЭ).
Рис. 1.10. Зависимость между длиной пробега белковых частиц при гель-хроматографии в тонком слое сефадекса Г-150 (сверхтонкого) и их молекулярными массами (в полулогарифмической системе координат).
Гель-хроматография, кроме простоты и быстроты, имеет дополнительное преимущество: не требуется выделять белок в чистом виде, так как примеси других белков не мешают определению, поскольку каждый из них проходит через колонку со свойственной ему скоростью, определяемой молекулярной массой. Это обстоятельство широко используется в энзимологии, когда оказывается возможным определение молекулярной массы даже очень небольшого количества фермента в присутствии других белков, не обладающих аналогичной каталитической активностью.
При использовании диск-электрофореза в полиакриламидном геле для определения молекулярной массы белков также строят график зависимости между логарифмом молекулярной массы калибровочных белков и подвижностью белковых частиц в полиакриламидном геле, а затем, определив подвижность исследуемого белка, по графику находят его массу (рис. 1.11). Электрофорез проводят в присутствии детергента додецилсульфата натрия, так как только в этом случае наблюдается прямая пропорциональная зависимость между молекулярной массой и подвижностью белков. Белки с четвертичной структурой при этих условиях распадаются на субъединицы, поэтому метод находит широкое применение для определения молекулярной массы субъединиц белка.
Рис. 1.11. Зависимость между молекулярной массой и относительной подвижностью белка при диск-электрофорезе в полиакриламидном геле в присутствии додецилсульфата натрия (в полулогарифмической системе координат).
Недавно предложен новый масс-спектрометрический метод (так называемый лазерный десорбционно-ионизационный метод), позволяющий определять молекулярную массу небольших пептидов (вазопрессин, инсулин) и крупных биополимерных молекул и, кроме того, структуру биомолекул.
Источник
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ БЕЛКОВ
Методы определения молекулярной массы белка можно разделить на химические, физико-химические и физические. К наиболее распространенным физико-химическим методам определения молекулярной массы белков относятся гель-хроматография (на колонках и в тонком слое), а также электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия. Использование этих методов не требует сложной аппаратуры и большого количества исследуемого материала.
МЕТОД ГЕЛЬ-ХРОМАТОГРАФИИ НА КОЛОНКАХ
Принцип метода. Метод основан на том, что для большого числа глобулярных белков имеется линейная зависимость между логарифмом молекулярной массы и объемом элюирования с колонки, заполненной гелем с определенной величиной пор. Поэтому для определения молекулярной массы глобулярного белка достаточно определить объем его элюции с предварительно откалиброванной колонки. Калибровку колонки проводят, пропуская через нее белки с известной молекулярной массой и определяя объемы элюции для каждого из них.
Для сефадекса G-75 экспериментальным путем получено уравнение для расчета молекулярной массы:
где М – молекулярная масса; Vэ – объем раствора, в котором из колонки выходит исследуемое вещество; Vo – свободный объем колонки.
Реактивы: 1. 1 % раствор голубого декстрана.
2. 0,1 моль/л раствор NaCl.
3. Сефадекс G-75 – 4 г.
4. 1 % раствор гемоглобина.
Ход работы.Подготовку колонки проводят аналогично тому, как это описано для метода гель-хроматографии. После заполнения колонки гелем сефадекса G-75 ее промывают 0,1 моль/л раствором NaCl.
Открывают зажим на колонке и сливают 0,1 моль/л раствором NaCl, находящийся над гелем. Зажим закрывают и на поверхность геля аккуратно наносят 0,5 мл раствора голубого декстрана. Открывают зажим и собирают вытекающую из колонки жидкость в мерный цилиндр, сохраняя ее до конца опыта.
Как только из колонки начнет вытекать окрашенный (голубой) раствор, начинают сбор элюата в заранее подготовленные пробирки по 20 капель в каждую пробирку. Элюат из этих пробирок от начала ряда, включая пробирку с самой интенсивной окраской, сливают в мерный цилиндр, где уже собраны предыдущие (неокрашенные) фракции. Объем остальных пробирок, в которых окраска начинает ослабевать, не учитывается. Таким образом, объем элюата от начала опыта до появления наиболее яркой голубой окраской составляет свободный объем колонки (Vo).
Закончив определение свободного объема, колонку отмывают от следов голубого декстрана. После этого в колонку вносят 0,5 мл 1 % раствора гемоглобина и повторяют ход работы, описанный для голубого декстрана. Объем элюата от начала эксперимента с гемоглобином до появления в пробирке максимально розовой окраски определяют как Vэ.
Полученные значения Vo и Vэ подставляют в приведенное выше уравнение и находят молекулярную массу, используя таблицу логарифмов.
ГЕЛЬ-ХРОМАТОГРАФИЯ В ТОНКОМ СЛОЕ СЕФАДЕКСА
Принцип метода. По мере продвижения раствора по пластинке с нанесенным на нее тонким слоем геля сефадекса смесь белков распределяется в нем таким образом, что расстояние, пройденное каждым белком от линии старта, пропорционально логарифму его молекулярной массы. Построив калибровочный график зависимости расстояния, пройденного белками-маркерами, от логарифма их молекулярной массы и определив длину пути, пройденного исследуемым белком, можно определить его молекулярную массу.
Оборудование: 1. Столик с переменным углом наклона (рис. 6).
2. Хроматографическая камера.
Рис. 6 – Оборудование для хроматографического разделения белков в тонком слое сефадекса:
а – столик с переменным углом наклона; б – хроматографическая камера (1, 3 – отсеки, заполненные буферным раствором; 2 – отсек, в который помещают стеклянную пластинку), 4 – стеклянная пластинка, покрытая гелем сефадекса; 5 – соединительные мостики из фильтровальной бумаги; в – скользящая крышка
Реактивы: 1.Сефадекс G-200 или G-150.
2. 0,1 моль/л натрий-фосфатный буфер, pH 7,4.
3.0,1 % раствор бромфенолового синего, приготовленного на смеси этанол : концентрированная уксусная кислота (9:1).
4. 5 % раствор СН3СООН.
5. 2 % раствор СН3СООNa, приготовленный на 10 % растворе СН3СООН.
6. Набор белков-маркеров с известной молекулярной массой: сывороточный альбумин (70 000 Да), рибонуклеаза (12 700 Да), яичный альбумин (45 000 Да), трипсин (23 800 Да), креатинкиназа из мышц кролика (80 000 Да), глицеральдегидфосфатдегидрогеназа (144 000 Да), пируваткиназа (237 000 Да).
7. Хроматографическая бумага.
Ход работы. 4 г сухого сефадекса суспендируют в избытке натрий-фосфатного буфера и оставляют набухать в течение 3 сут при комнатной температуре или в течение нескольких часов при 60 °С. Перед нанесением на стеклянную пластинку (20 × 40 см), которая должна быть вымыта с особой тщательностью, избыток буфера над гелем декантируют, а гель перемешивают и наносят фарфоровой ложкой на пластинку, расположенную на столике со строго горизонтальной поверхностью. Слой геля распределяют по пластинке стеклянной палочкой размером 1 × 22 см с надетой на концы резиновой трубкой, прокатывая палочку вдоль пластинки несколько раз для получения равномерного слоя геля толщиной 1 мм (без комочков и пузырьков воздуха). Пластинку подсушивают на воздухе в течение 15 мин, а затем помещают в средний отсек камеры, как показано на рис. 6.
Крайние резервуары заливают 0,1 моль/л фосфатным буфером (pH 7,4), слой геля соединяют с буферным раствором полосками хроматографической бумаги, камеру закрывают скользящей крышкой и помещают на подставку с переменным углом. Угол наклона камеры устанавливают равным 7 – 10°. Камеру оставляют для насыщения на ночь при комнатной температуре.
Убедившись в равномерности слоя сефадекса, наносят микропипеткой по 0,02 мл растворов (5 мг/мл) исследуемого белка и белков-свидетелей. Для этого пластинку устанавливают горизонтально и наносят белки в отдельные точки на расстоянии 3 см от верхнего края пластинки и друг от друга. Закрывают камеру крышкой и устанавливают ее под углом 7 – 10°. Гель-хроматографию проводят в течение 4 ч при комнатной температуре. Затем камеру устанавливают горизонтально, полоски хроматографической бумаги удаляют, пластинку помещают на горизонтальную подставку и снимают “реплику” на хроматографическую бумагу. Для этого бумагу свертывают в трубочку и, постепенно разворачивая, накладывают на тонкий слой так, чтобы бумага прилипла к нему. Не следует сильно надавливать на бумагу, чтобы не повредить слой сефадекса. Бумагу оставляют на пластинке 1 мин, затем высушивают при 90 °С в течение 20 мин и помещают в кювету для окрашивания.
Для идентификации белковых зон “ реплику ” помещают на 3 – 5 мин в раствор бромфенолового синего; краситель отмывают дважды 5 % раствором СН3СООН и закрепляют 2 % раствором уксуснокислого натрия, приготовленного на 10 % растворе СН3СООН.
После тщательного промывания в холодной проточной воде хроматографическую бумагу высушивают и измеряют расстояние, пройденное каждым белком от точки нанесения до центра белкового пятна. Строят калибровочный график, откладывая по оси абсцисс величину отношения lа : lст (lа – длина пути, пройденного данным белком; lст – расстояние, пройденное стандартным белком, например сывороточным альбумином), по оси ординат – логарифм молекулярной массы данного белка. Определив расстояние белковой зоны исследуемого белка от старта, по калибровочному графику находят его молекулярную массу.
3.3. ЭЛЕКТРОФОРЕЗ В ПОЛИАКРИЛАМИДНОМ ГЕЛЕ В ПРИСУТСТВИИ ДОДЕЦИЛСУЛЬФАТА НАТРИЯ
Принцип метода. Белки, обработанные концентрированным раствором додецилсульфата натрия в присутствии β-меркаптоэтанола, распадаются на отдельные полипептидные цепи и приобретают отрицательный заряд, значительно превышающий собственный заряд белковой молекулы. При последующем разделении с помощью диск-электрофореза в полиакриламидном геле белковые зоны распределяются на электрофореграммах таким образом, что подвижность белковой зоны обратно пропорциональна логарифму молекулярной массы. Метод дает возможность определять молекулярные массы субъединиц олигомерных белков. Электрофоретическое разделение можно проводить различными методами. Ниже описаны два из них: метод Вебера и Осборн, а также метод, предложенный Лэммли.
В методе Вебера и Осборн буферные растворы для приготовления геля и электродный не отличаются между собой. Обычно используют 0,1 или 0,05 моль/л натрий-фосфатный буфер. В методе Лэммли гелевый и электродный буферные растворы отличаются друг от друга по составу и величине pH. Кроме того, используют два типа гелей –концентрирующий и разделяющий. Эти модификации приводят к тому, что на границе между концентрирующим и разделяющим гелем весь белковый образец собирается в виде узкого диска. Это способствует более четкому разделению белков.
3.3.1. МЕТОД ВЕБЕРА И ОСБОРН
Реактивы: 1. 30 % раствор акриламида, содержащий 0,6 % раствор метиленбисакриламида.
Внимание! Работу с акриламидом проводят под тягой, в перчатках!
2. Буфер для приготовления геля: 0,2 моль/л натрий-фосфатный буфер (pH 7,2).
3. Буфер для приготовления образцов: 0,02 моль/л натрий-фосфатный буфер (pH 7,2).
4. Электродный буфер: 0,05 моль/л натрий-фосфатный буфер (pH 7,2).
5. Раствор персульфата аммония – 15 мг/мл (готовят непосредственно перед употреблением).
7. 40 % раствор сахарозы.
8. 70 % раствор изопропилового спирта.
9. 0,04 % раствор кумасси R-250, приготовленный на 20 % растворе изопропанола и 10 % растворе СН3СООН.
10. 10 % раствор уксусной кислоты.
11. 10 % раствор додецилсульфата натрия (ДСН).
13. Набор белков-маркеров с известной молекулярной массой. В качестве белков-маркеров можно использовать следующие белки: фосфорилаза (91 000 Да), бычий сывороточный альбумин (68 000 Да), яичный альбумин (42 000 Да), химотрипсиноген А (27 000 Да), РНКаза (14 000 Да), цитохром с (12 000 Да) – 5 мг/мл.
Готовят гель.Для этогов эрленмейеровскую колбочку сливают 10 мл раствора акриламида, 15 мл фосфатного буфера, содержащего 30 мг ДСН, 3,5 мл Н2О, 1,5 мл персульфата аммония и 0,04 мл ТЕМЕД.
Разделение белка можно проводить как в трубочках, так и на пластинах для вертикального электрофореза. После обработки ДСН к образцам добавляют сахарозу (до концентрации 10 %) и в качестве лидирующего красителя — бромфеноловый синий (до концентрации 0,001 %).
Образцы исследуемых белков и белков-маркеров наносят на поверхность геля в объеме от 20 до 100 мкл (каждого или смеси нескольких образцов) и осторожно наслаивают электродный буфер. Нагрузка на гель определяется методом окраски гелей, а также способностью того или иного белка связывать используемый краситель. Как правило, при электрофорезе в трубочках удается обнаружить от 20 до 100 мкг белка, при электрофорезе в пластинке – от 4 до 15 мкг.
В электродный буфер катодного отделения добавляют ДСН до концентрации 0,1 %. Электрофоретическое разделение проводят при комнатной температуре и силе тока 8 мА на трубочку. При этом сначала устанавливают силу тока – 2 мА на трубочку (напряжение около 50 В), напряжение поднимают до 100 – 200 В лишь после того, как образцы войдут в гель. Разделение проводят до тех пор, пока краситель не пройдет 4/5 всей длины геля. Обычно это занимает 4 – 6 ч.
После этого электрофорез прекращают, вынимают гель и помещают его для фиксации в 70 % раствор изопропанола на 1 ч. Затем гели прокрашивают раствором кумасси R-250 в течение 2 ч. Избыток краски удаляют промыванием 10 % раствором СН3СООН.
После окончания отмывки геля проводят обработку электрофореграмм. Определяют расстояние, пройденное каждым белком от стартовой линии. Определение можно проводить визуально или с помощью денситометра при 550 – 600 нм. Строят калибровочный график, откладывая по оси абсцисс длину пути 1а, пройденного данным белком, а по оси ординат – логарифм его молекулярной массы. Определив длину пути, пройденного белком с неизвестной молекулярной массой 1 x, пользуясь калибровочным графиком, определяют молекулярную массу исследуемого белка. При проведении электрофореза в трубочках часто трудно получить хорошо воспроизводимые результаты на разных трубках. В этом случае определяют не абсолютную, а относительную подвижность белков. Для этого определяют отношение длины пробега белковой зоны либо к общей длине геля, либо к длине пробега лидирующего красителя. После этого строят зависимость относительной подвижности белков от логарифма их молекулярной массы.
МЕТОД ЛЭММЛИ
Реактивы: 1. 30 % раствор акриламида, приготовленного на 0,4 % растворе метиленбисакриламида; 29,6 г акриламида и 0,4 г метиленбисакриламида растворяют в воде и объем раствора доводят до 100 мл.
Внимание! Работу с акриламидом проводят под тягой, в пер чатках!
2. Буфер для приготовления разделяющего геля: 1,5 моль/л трис-НС1 буфер, содержащий 0,4 % раствор ДСН (pH 8,8).
3. Буфер для приготовления концентрирующего геля: 0,5 моль/л трис-НС1 буфер, содержащий 0,4 % раствор ДСН (pH 6,8).
4. Электродный буфер: 0,025 трис-0,192 моль/л глицин (pH 8,6). Необходимую навеску глицина растворяют в воде и добавляют сухой трис до pH 8,6, после чего объем раствора доводят водой до нужной величины. Электродный буфер катодного отделения камеры содержит помимо указанных компонентов ДСН в концентрации 0,1 %.
5. Буфер для приготовления образцов: 0,0625 моль/л трис-НС1 буфер (pH 6,8), 2 % раствор ДСН, 10 % раствор сахарозы (или глицерин), 0,001 % раствор бромфенолового синего. Перед употреблением в указанный раствор добавляют β-меркаптоэтанол до конечной концентрации 5 %.
6. Раствор персульфата аммония – 15 мг/мл.
8. 70 % раствор изопропилового спирта.
9. 10 % раствор уксусной кислоты.
10. 0,04 % раствор кумасси R-250, приготовленного на смеси: изопропанол: этанол: уксусная кислота: вода в соотношении 2:1:1:6.
11. Набор белков-маркеров с известной молекулярной массой. В качестве белков-маркеров можно использовать следующие белки: фосфорилаза (91 000 Да), бычий сывороточный альбумин (68 000 Да), яичный альбумин (42 000 Да), химотрипсиноген А (27 000 Да), РНКаза (14 000 Да), цитохром с (12 000 Да) – 5 мг/мл.
Ход работы. Для полимеризации 30 мл разделяющего геля (12,5 %) смешивают 12,5 мл раствора акриламида, 7,5 мл буфера разделяющего геля и 10 мл воды. К смеси добавляют 16 мг персульфата аммония и 18 мкл ТЕМЕД.
Полученный раствор заливают либо в гелевую ячейку для вертикального электрофореза в пластине, либо в трубки. На поверхность раствора наслаивают дистиллированную воду. После полимеризации удаляют воду шприцем или фильтровальной бумагой.
Готовят смесь для концентрирующего геля. Смешивают 4 мл 30 % раствора акриламида с 5 мл буфера концентрирующего геля и добавляют 11 мл воды (суммарный объем 20 мл). К полученной смеси добавляют 15 мг персульфата аммония и 16 мкл ТЕМЕД и наносят на вершину уже заполимеризовавшегося разделяющего геля. Обычно длина концентрирующего геля в 5 – 6 раз меньше длины разделяющего геля. На поверхность полимеризуемых гелей наслаивают воду.
Исследуемые и стандартные белки-маркеры растворяют в буферном растворе для приготовления образцов в концентрации 5 мг/мл и кипятят на водяной бане 5 мин. Электрофорез и обработку электрофореграмм проводят, как описано для метода Вебера и Осборн.
Дата добавления: 2019-02-26 ; просмотров: 1156 ; Мы поможем в написании вашей работы!
Источник
Молекулярная масса белков
Белки относятся к высокомолекулярным соединениям, в состав которых входят сотни и даже тысячи аминокислотных остатков, объединенных в макромолекулярную структуру. Молекулярная масса белков колеблется от 6000 (нижний предел) до 1000000 и выше в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. Такие полипептидные цепи получили название субъединиц. Их мол. масса варьирует в широких пределах – от 6000 до 100000 и более.
.%3C/p%3E%20%3Cp%3E%D0%9D%D0%B5%D0%B4%D0%B0%D0%B2%D0%BD%D0%BE%20%D0%BF%D1%80%D0%B5%D0%B4%D0%BB%D0%BE%D0%B6%D0%B5%D0%BD%20%D0%BD%D0%BE%D0%B2%D1%8B%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81-%D1%81%D0%BF%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BC%D0%B5%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9%20%D0%BC%D0%B5%D1%82%D0%BE%D0%B4%20(%D1%82%D0%B0%D0%BA%20%D0%BD%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D0%BC%D1%8B%D0%B9%20%D0%BB%D0%B0%D0%B7%D0%B5%D1%80%D0%BD%D1%8B%D0%B9%20%D0%B4%D0%B5%D1%81%D0%BE%D1%80%D0%B1%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D0%BE-%D0%B8%D0%BE%D0%BD%D0%B8%D0%B7%D0%B0%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%B9%20%D0%BC%D0%B5%D1%82%D0%BE%D0%B4),%20%D0%BF%D0%BE%D0%B7%D0%B2%D0%BE%D0%BB%D1%8F%D1%8E%D1%89%D0%B8%D0%B9%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D1%8F%D1%82%D1%8C%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%83%D1%8E%20%D0%BC%D0%B0%D1%81%D1%81%D1%83%20%D0%BD%D0%B5%D0%B1%D0%BE%D0%BB%D1%8C%D1%88%D0%B8%D1%85%20%D0%BF%D0%B5%D0%BF%D1%82%D0%B8%D0%B4%D0%BE%D0%B2%20(%D0%B2%D0%B0%D0%B7%D0%BE%D0%BF%D1%80%D0%B5%D1%81%D1%81%D0%B8%D0%BD,%20%D0%B8%D0%BD%D1%81%D1%83%D0%BB%D0%B8%D0%BD)%20%D0%B8%20%D0%BA%D1%80%D1%83%D0%BF%D0%BD%D1%8B%D1%85%20%D0%B1%D0%B8%D0%BE%D0%BF%D0%BE%D0%BB%D0%B8%D0%BC%D0%B5%D1%80%D0%BD%D1%8B%D1%85%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%20%D0%B8,%20%D0%BA%D1%80%D0%BE%D0%BC%D0%B5%20%D1%82%D0%BE%D0%B3%D0%BE,%20%D1%81%D1%82%D1%80%D1%83%D0%BA%D1%82%D1%83%D1%80%D1%83%20%D0%B1%D0%B8%D0%BE%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB.%3C/p%3E%20%3Cp%3E%3Ca%20href=)
Методы нахождения молекулярной массы белка бывают химическими, физико-химическими и физическими. Самыми распространенными физико-химическими методами являются гель-хроматография (как колоночная, так и тонкослойная) и электрофорез в среде полиакриламидного геля в присутствии натрия додецилсульфата. Они не требуют сложного оборудования и больших количеств исследуемого материала.
Характеристика белков
Белки представляют собой высокомолекулярные полимеры биологического происхождения. Они состоят из аминокислот, соединенных последовательно пептидными связями. Размеры белков зависят от количества этих самых аминокислот. Средние значения элементного состава белков в %:
- углерода – в интервале 50,6-54,5;
- кислорода – в пределах 21,5-23,5;
- азота – около 15,0-17,6;
- водорода –в интервале 6,5-7,3;
- серы – в пределах 0,3-2,5;
- минеральных веществ – не более 0,5.
Белки подразделяют на простые, состоящие только из остатков аминокислот, и сложные, включающие простетические группы. Небелковые компоненты могут быть углеводами, липидами, нуклеиновыми кислотами, производными витаминов, ионами металлов, гемом и др. Различают четыре структуры белков.
Виды белков в организме. Строение, функции и свойства полипептидных молекул. Денатурация и…
Аминокислотный состав белков находят путем кислотного гидролиза, сочетаемого с последующим разделением освободившихся аминокислот с помощью ионообменной хроматографии.
Количественные показатели каждой из аминокислот определяют нин-гидриновым методом. Выявление размещения аминокислот в молекуле белка осуществляют путем последовательного отщепления концевых аминокислот с помощью ферментов и их идентификацией, что позволяет определить структуру белковой молекулы. Идентификация основана на их различных физико-химических свойствах. Нередко для этого используют цветные реакции на те или иные аминокислоты и хроматографию.
Колоночная гель-хроматография
Этот метод основывается на линейной зависимости логарифма молекулярной массы многих глобулярных белков и объема элюирования с заполненной гелем (определенного размера пор). Таким образом, для определения молекулярной массы белка следует лишь найти объем его элюции с откалиброванной заранее колонки. Калибровку выполняют методом пропускания через колонку белков с заранее известными массами молекул и замеряя объемы элюции каждого из них. Если в качестве заполнителя используют сефадекс G-75, то расчет молекулярной массы ведут по найденному экспериментальным путем уравнению:
Наша статья будет посвящена изучению свойств веществ, являющихся основой феномена жизни на Земле….
lg M = 5,624 – 0,752 · (Vэ / Vo),
где М – искомая молекулярная масса; Vэ – выходящий из колонки объем раствора с исследуемым веществом; Vo – объем свободной колонки.
Для проведения анализа понадобятся раствор голубого декстрана (1%), раствор NaCl (0,1 моль/л), сефадекс G-75 (4 г), раствор гемоглобина (1%).
Выполнение анализа
Подготовленную колонку заполняют гелем сефадекса G-75 и промывают раствором NaCl. После того как сольют раствор NaCl, поднимающийся выше уровня геля, на его поверхность аккуратно помещают 0,5 мл раствора голубого декстрана. Затем собирают выходящие из колонки жидкости в мерный цилиндр, где их сохраняют до конца эксперимента. Начинающий вытекать раствор с голубой окраской собирают по 20 капель в подготовленные заранее пробирки. Элюат из них от первого до самого интенсивно окрашенного сливают в тот же мерный цилиндр, в котором уже собраны неокрашенные фракции. Объем пробирок ослабевающей окраской раствора не учитывают.
Макромолекула — это высокомолекулярное соединение, имеющее значение для жизнедеятельности…
Объем жидкости, собранной в мерный цилиндр, составляется свободным объемом колонки (Vo). Далее повторяют заполнение колонки, но вместо голубого декстрина используют раствор гемоглобина. Объем элюата в мерном цилиндре до выхода раствора с максимально розовой окраской является величиной Vэ. Найденные значения Vo и Vэ подставляют в соответствующее уравнение и вычисляют массу белка. Аминокислотный состав белков находят подобными методиками.
Тонкослойная гель-хроматография
Принцип этого метода заключается в том, что в ходе продвижения раствора белков по пластине с тончайшим слоем сефадекса, смесь их распределяется неравномерно. По расстоянию, пройденному каждым из белков от исходной стартовой линии, находят логарифмы их молекулярных масс. Для определения молекулярной массы белка методом тонкослойной гель-хроматографии строят калибровочный график, отражающий зависимость пройденных маркерными белками расстояний от логарифмов их молекулярных масс. Уже по нему находят длину пути исследуемого белка и массу его молекулы.
Для выполнения эксперимента потребуется столик с изменяющимся углом наклона, а также хроматографическая камера. Из реактивов понадобятся сефадекс G-200 или G-150, натрий-фосфатный буфер, pH 7,4 (0,1 моль/л), раствор бромфенолового синего (0,1%), раствор СН3СООН (5%), раствор CH3COONa (2 %), набор маркерных белков, хроматографическая бумага.
Выполнение эксперимента
Сначала необходимо приготовить гель сефадекса, для чего сухую его массу 4 г суспендируют в избыточном количестве натрий-фосфатного буфера, а затем оставляют для набухания в течение 3 суток при н.у. Стеклянную пластинку со сторонами 20х40 см тщательно промывают. Перед нанесением на нее сефадекса буфер над ним декантуют, а затем гель хорошо перемешивают. На горизонтально расположенную пластину его наносят фарфоровой ложечкой, а затем распределяют прокатыванием стеклянной палочки размером 1х22 см. Прокатывание повторяют до равномерного распределения слоя геля без комков и пузырьков толщиной 1 мм. Подготовленную пластинку просушивают на воздухе 15 мин., а потом помещают в хроматографическую камеру.
В крайние емкости заливают фосфатный буфер, гель соединяют с буфером хроматографической бумагой. Далее камеру закрывают и помещают на специальную подставку. Угол ее наклона устанавливают на 7-10°. Для насыщения камеру оставляют на ночь.
Растворы белков, молекулярная масса которых известна, так же, как и исследуемые образцы, наносят микропипеткой, объем каждой порции должен быть по 0,02 мл. Пластинку возвращают в горизонтальное положение и наносят порции белка в определенные точки. Расстояние между ними и от верхнего края должно быть 3 см. Затем камеру закрывают и ставят под углом 7–10°. Гель-хроматографический анализ проводят 4 ч.
По истечении отведенного времени камеру ставят горизонтально, хроматографическую бумагу удаляют. Стеклянную пластинку помещают на подставку в горизонтальном положении и снимают «реплику» на бумагу для хроматографии. Для этого ее сворачивают в трубочку и накладывают на тонкий гелевый слой, постепенно разворачивая. При этом бумага должна прилипнуть к нему, но делать это нужно аккуратно, чтобы сохранить его в целости. Бумагу оставляют на поверхности пластинки 1 мин., после этого высушивают при температуре 90 °С 20 мин. и помещают в специальную кювету для окрашивания.
Расшифровка результатов
Чтобы идентифицировать белковые зоны, «реплику» помещают в раствор бромфенолового синего на 3 минуты. Далее краситель нужно отмыть дважды раствором уксусной кислоты и закрепить ацетатом натрия. После этого хроматографическую бумагу тщательно промывают в холодной проточной воде и высушивают. Далее приступают к измерению расстояния, пройденного каждым белком от исходной точки до центра пятна.
По полученным данным выстраивают калибровочный график, путем откладывания по оси абсцисс lа/lст (где индекс а относится к анализируемому, а ст — к стандартному белку), по оси ординат – lgM. Замерив расстояние белковой области исследуемого образца от старта, по выстроенному графику определяют молекулярную массу и предполагаемую структуру белковой молекулы.




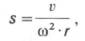
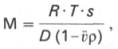





.%20%D0%92%D0%B5%D0%BB%D0%B8%D1%87%D0%B8%D0%BD%D0%B0%20%D0%BA%D0%BE%D0%BD%D1%81%D1%82%D0%B0%D0%BD%D1%82%D1%8B%20%D1%81%D0%B5%D0%B4%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D0%B8,%20%D1%80%D0%B0%D0%B2%D0%BD%D0%B0%D1%8F%201%E2%80%A210%E2%80%9313%20%D1%81,%20%D1%83%D1%81%D0%BB%D0%BE%D0%B2%D0%BD%D0%BE%20%D0%BF%D1%80%D0%B8%D0%BD%D1%8F%D1%82%D0%B0%20%D0%B7%D0%B0%20%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D1%83%20%D0%B8%20%D0%BD%D0%B0%D0%B7%D0%B2%D0%B0%D0%BD%D0%B0%20%D1%81%D0%B2%D0%B5%D0%B4%D0%B1%D0%B5%D1%80%D0%B3%D0%BE%D0%BC%20(S).%20%D0%97%D0%BD%D0%B0%D1%87%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BA%D0%BE%D0%BD%D1%81%D1%82%D0%B0%D0%BD%D1%82%20%D1%81%D0%B5%D0%B4%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D0%B8%20%D0%B1%D0%BE%D0%BB%D1%8C%D1%88%D0%B8%D0%BD%D1%81%D1%82%D0%B2%D0%B0%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%20%D0%BB%D0%B5%D0%B6%D0%B0%D1%82%20%D0%B2%20%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B0%D1%85%201%E2%80%9350%20S,%20%D1%85%D0%BE%D1%82%D1%8F%20%D0%B2%20%D1%80%D1%8F%D0%B4%D0%B5%20%D1%81%D0%BB%D1%83%D1%87%D0%B0%D0%B5%D0%B2%20%D1%8D%D1%82%D0%B8%20%D0%B7%D0%BD%D0%B0%D1%87%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BF%D1%80%D0%B5%D0%B2%D1%8B%D1%88%D0%B0%D1%8E%D1%82%20100%20S.%3C/p%3E%20%3Cp%3E%D0%94%D0%BB%D1%8F%20%D0%B2%D1%8B%D1%87%D0%B8%D1%81%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20(%D0%9C),%20%D0%BF%D0%BE%D0%BC%D0%B8%D0%BC%D0%BE%20%D0%BA%D0%BE%D0%BD%D1%81%D1%82%D0%B0%D0%BD%D1%82%D1%8B%20%D1%81%D0%B5%D0%B4%D0%B8%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D0%B8,%20%D0%BD%D0%B5%D0%BE%D0%B1%D1%85%D0%BE%D0%B4%D0%B8%D0%BC%D1%8B%20%D0%B4%D0%BE%D0%BF%D0%BE%D0%BB%D0%BD%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5%20%D1%81%D0%B2%D0%B5%D0%B4%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BE%20%D0%BF%D0%BB%D0%BE%D1%82%D0%BD%D0%BE%D1%81%D1%82%D0%B8%20%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%B8%D1%82%D0%B5%D0%BB%D1%8F%20%D0%B8%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0%20%D0%B8%20%D0%B4%D1%80%D1%83%D0%B3%D0%B8%D0%B5%20%D1%81%D0%BE%D0%B3%D0%BB%D0%B0%D1%81%D0%BD%D0%BE%20%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8E%20%D0%A1%D0%B2%D0%B5%D0%B4%D0%B1%D0%B5%D1%80%D0%B3%D0%B0:%3C/p%3E%20%3Cp%20style=)
.%20%D0%9F%D1%80%D0%B8%20%D0%B8%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B8%20%D0%B3%D0%B5%D0%BB%D1%8C-%D1%85%D1%80%D0%BE%D0%BC%D0%B0%D1%82%D0%BE%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D0%B8%20%D0%B2%20%D0%BF%D0%B5%D1%80%D0%B2%D1%83%D1%8E%20%D0%BE%D1%87%D0%B5%D1%80%D0%B5%D0%B4%D1%8C%20%D1%82%D1%80%D0%B5%D0%B1%D1%83%D0%B5%D1%82%D1%81%D1%8F%20%D0%BE%D1%82%D0%BA%D0%B0%D0%BB%D0%B8%D0%B1%D1%80%D0%BE%D0%B2%D0%B0%D1%82%D1%8C%20%D0%BA%D0%BE%D0%BB%D0%BE%D0%BD%D0%BA%D1%83.%20%D0%94%D0%BB%D1%8F%20%D1%8D%D1%82%D0%BE%D0%B3%D0%BE%20%D1%87%D0%B5%D1%80%D0%B5%D0%B7%20%D0%BA%D0%BE%D0%BB%D0%BE%D0%BD%D0%BA%D1%83%20%D1%81%20%D1%81%D0%B5%D1%84%D0%B0%D0%B4%D0%B5%D0%BA%D1%81%D0%BE%D0%BC%20%D0%BF%D1%80%D0%BE%D0%BF%D1%83%D1%81%D0%BA%D0%B0%D1%8E%D1%82%20%D0%BD%D0%B5%D1%81%D0%BA%D0%BE%D0%BB%D1%8C%D0%BA%D0%BE%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%20%D1%81%20%D0%B8%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D1%8B%D0%BC%D0%B8%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%BC%D0%B8%20%D0%BC%D0%B0%D1%81%D1%81%D0%B0%D0%BC%D0%B8%20%D0%B8%20%D1%81%D1%82%D1%80%D0%BE%D1%8F%D1%82%20%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D0%BA,%20%D0%BE%D1%82%D0%BA%D0%BB%D0%B0%D0%B4%D1%8B%D0%B2%D0%B0%D1%8F%20%D0%B7%D0%BD%D0%B0%D1%87%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BB%D0%BE%D0%B3%D0%B0%D1%80%D0%B8%D1%84%D0%BC%D0%BE%D0%B2%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%BF%D1%80%D0%BE%D1%82%D0%B8%D0%B2%20%D0%B8%D1%85%20%D1%8D%D0%BB%D1%8E%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D1%85%20%D0%BE%D0%B1%D1%8A%D0%B5%D0%BC%D0%BE%D0%B2,%20%D0%BA%D0%BE%D1%82%D0%BE%D1%80%D1%8B%D0%B5%20%D0%BD%D0%B0%D1%85%D0%BE%D0%B4%D1%8F%D1%82,%20%D0%BA%D0%B0%D0%BA%20%D0%BF%D0%BE%D0%BA%D0%B0%D0%B7%D0%B0%D0%BD%D0%BE%20%D0%BD%D0%B0%20%D1%80%D0%B8%D1%81.%201.9.%3C/p%3E%20%3Cp%3E%D0%98%D0%B7%D0%B2%D0%B5%D1%81%D1%82%D0%BD%D0%BE,%20%D1%87%D1%82%D0%BE%20%D0%BC%D0%B5%D0%B6%D0%B4%D1%83%20%D0%BB%D0%BE%D0%B3%D0%B0%D1%80%D0%B8%D1%84%D0%BC%D0%BE%D0%BC%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0,%20%D0%B8%D0%BC%D0%B5%D1%8E%D1%89%D0%B5%D0%B3%D0%BE%20%D1%81%D1%84%D0%B5%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D1%83%D1%8E%20%D1%84%D0%BE%D1%80%D0%BC%D1%83,%20%D0%B8%20%D1%8D%D0%BB%D1%8E%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%BC%20%D0%BE%D0%B1%D1%8A%D0%B5%D0%BC%D0%BE%D0%BC%20%D1%81%D1%83%D1%89%D0%B5%D1%81%D1%82%D0%B2%D1%83%D0%B5%D1%82%20%D0%BF%D1%80%D1%8F%D0%BC%D0%B0%D1%8F%20%D0%B7%D0%B0%D0%B2%D0%B8%D1%81%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D1%8C.%20%D0%9F%D0%BE%D1%8D%D1%82%D0%BE%D0%BC%D1%83%20%D0%BB%D0%B5%D0%B3%D0%BA%D0%BE%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D1%82%D1%8C%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%83%D1%8E%20%D0%BC%D0%B0%D1%81%D1%81%D1%83%20%D0%B8%D1%81%D1%81%D0%BB%D0%B5%D0%B4%D1%83%D0%B5%D0%BC%D0%BE%D0%B3%D0%BE%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0,%20%D0%B7%D0%BD%D0%B0%D1%8F%20%D0%B5%D0%B3%D0%BE%20%D0%BE%D0%B1%D1%8A%D0%B5%D0%BC%20%D1%8D%D0%BB%D1%8E%D1%86%D0%B8%D0%B8.%20%D0%92%D1%82%D0%BE%D1%80%D0%BE%D0%B9%20%D1%80%D0%B0%D0%B7%D0%BD%D0%BE%D0%B2%D0%B8%D0%B4%D0%BD%D0%BE%D1%81%D1%82%D1%8C%D1%8E%20%D1%8D%D1%82%D0%BE%D0%B3%D0%BE%20%D0%BC%D0%B5%D1%82%D0%BE%D0%B4%D0%B0%20%D1%8F%D0%B2%D0%BB%D1%8F%D0%B5%D1%82%D1%81%D1%8F%20%D1%82%D0%BE%D0%BD%D0%BA%D0%BE%D1%81%D0%BB%D0%BE%D0%B9%D0%BD%D0%B0%D1%8F%20%D0%B3%D0%B5%D0%BB%D1%8C-%D1%85%D1%80%D0%BE%D0%BC%D0%B0%D1%82%D0%BE%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D1%8F.%20%D0%94%D0%BB%D0%B8%D0%BD%D0%B0%20%D0%BF%D1%80%D0%BE%D0%B1%D0%B5%D0%B3%D0%B0%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0%20(%D0%B2%20%D0%BC%D0%B8%D0%BB%D0%BB%D0%B8%D0%BC%D0%B5%D1%82%D1%80%D0%B0%D1%85)%20%D1%87%D0%B5%D1%80%D0%B5%D0%B7%20%D1%82%D0%BE%D0%BD%D0%BA%D0%B8%D0%B9%20%D1%81%D0%BB%D0%BE%D0%B9%20%D1%81%D0%B5%D1%84%D0%B0%D0%B4%D0%B5%D0%BA%D1%81%D0%B0%20%D0%BD%D0%B0%D1%85%D0%BE%D0%B4%D0%B8%D1%82%D1%81%D1%8F%20%D0%B2%20%D0%BB%D0%BE%D0%B3%D0%B0%D1%80%D0%B8%D1%84%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9%20%D0%B7%D0%B0%D0%B2%D0%B8%D1%81%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D0%B8%20%D0%BE%D1%82%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0%20(%D1%80%D0%B8%D1%81.%201.10).%3C/p%3E%20%3Cp%20style=)
.%3C/p%3E%20%3Cp%20style=)
%20%D0%B8%20%D0%B8%D1%85%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%BC%D0%B8%20%D0%BC%D0%B0%D1%81%D1%81%D0%B0%D0%BC%D0%B8%20(%D0%B2%20%D0%BF%D0%BE%D0%BB%D1%83%D0%BB%D0%BE%D0%B3%D0%B0%D1%80%D0%B8%D1%84%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9%20%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B5%20%D0%BA%D0%BE%D0%BE%D1%80%D0%B4%D0%B8%D0%BD%D0%B0%D1%82).%3C/p%3E%20%3Cp%3E%D0%93%D0%B5%D0%BB%D1%8C-%D1%85%D1%80%D0%BE%D0%BC%D0%B0%D1%82%D0%BE%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D1%8F,%20%D0%BA%D1%80%D0%BE%D0%BC%D0%B5%20%D0%BF%D1%80%D0%BE%D1%81%D1%82%D0%BE%D1%82%D1%8B%20%D0%B8%20%D0%B1%D1%8B%D1%81%D1%82%D1%80%D0%BE%D1%82%D1%8B,%20%D0%B8%D0%BC%D0%B5%D0%B5%D1%82%20%D0%B4%D0%BE%D0%BF%D0%BE%D0%BB%D0%BD%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5%20%D0%BF%D1%80%D0%B5%D0%B8%D0%BC%D1%83%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE:%20%D0%BD%D0%B5%20%D1%82%D1%80%D0%B5%D0%B1%D1%83%D0%B5%D1%82%D1%81%D1%8F%20%D0%B2%D1%8B%D0%B4%D0%B5%D0%BB%D1%8F%D1%82%D1%8C%20%D0%B1%D0%B5%D0%BB%D0%BE%D0%BA%20%D0%B2%20%D1%87%D0%B8%D1%81%D1%82%D0%BE%D0%BC%20%D0%B2%D0%B8%D0%B4%D0%B5,%20%D1%82%D0%B0%D0%BA%20%D0%BA%D0%B0%D0%BA%20%D0%BF%D1%80%D0%B8%D0%BC%D0%B5%D1%81%D0%B8%20%D0%B4%D1%80%D1%83%D0%B3%D0%B8%D1%85%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%20%D0%BD%D0%B5%20%D0%BC%D0%B5%D1%88%D0%B0%D1%8E%D1%82%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B5%D0%BD%D0%B8%D1%8E,%20%D0%BF%D0%BE%D1%81%D0%BA%D0%BE%D0%BB%D1%8C%D0%BA%D1%83%20%D0%BA%D0%B0%D0%B6%D0%B4%D1%8B%D0%B9%20%D0%B8%D0%B7%20%D0%BD%D0%B8%D1%85%20%D0%BF%D1%80%D0%BE%D1%85%D0%BE%D0%B4%D0%B8%D1%82%20%D1%87%D0%B5%D1%80%D0%B5%D0%B7%20%D0%BA%D0%BE%D0%BB%D0%BE%D0%BD%D0%BA%D1%83%20%D1%81%D0%BE%20%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B5%D0%BD%D0%BD%D0%BE%D0%B9%20%D0%B5%D0%BC%D1%83%20%D1%81%D0%BA%D0%BE%D1%80%D0%BE%D1%81%D1%82%D1%8C%D1%8E,%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D1%8F%D0%B5%D0%BC%D0%BE%D0%B9%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D0%BE%D0%B9.%20%D0%AD%D1%82%D0%BE%20%D0%BE%D0%B1%D1%81%D1%82%D0%BE%D1%8F%D1%82%D0%B5%D0%BB%D1%8C%D1%81%D1%82%D0%B2%D0%BE%20%D1%88%D0%B8%D1%80%D0%BE%D0%BA%D0%BE%20%D0%B8%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D1%83%D0%B5%D1%82%D1%81%D1%8F%20%D0%B2%20%D1%8D%D0%BD%D0%B7%D0%B8%D0%BC%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D0%B8,%20%D0%BA%D0%BE%D0%B3%D0%B4%D0%B0%20%D0%BE%D0%BA%D0%B0%D0%B7%D1%8B%D0%B2%D0%B0%D0%B5%D1%82%D1%81%D1%8F%20%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D1%8B%D0%BC%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%B4%D0%B0%D0%B6%D0%B5%20%D0%BE%D1%87%D0%B5%D0%BD%D1%8C%20%D0%BD%D0%B5%D0%B1%D0%BE%D0%BB%D1%8C%D1%88%D0%BE%D0%B3%D0%BE%20%D0%BA%D0%BE%D0%BB%D0%B8%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%B0%20%D1%84%D0%B5%D1%80%D0%BC%D0%B5%D0%BD%D1%82%D0%B0%20%D0%B2%20%D0%BF%D1%80%D0%B8%D1%81%D1%83%D1%82%D1%81%D1%82%D0%B2%D0%B8%D0%B8%20%D0%B4%D1%80%D1%83%D0%B3%D0%B8%D1%85%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2,%20%D0%BD%D0%B5%20%D0%BE%D0%B1%D0%BB%D0%B0%D0%B4%D0%B0%D1%8E%D1%89%D0%B8%D1%85%20%D0%B0%D0%BD%D0%B0%D0%BB%D0%BE%D0%B3%D0%B8%D1%87%D0%BD%D0%BE%D0%B9%20%D0%BA%D0%B0%D1%82%D0%B0%D0%BB%D0%B8%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9%20%D0%B0%D0%BA%D1%82%D0%B8%D0%B2%D0%BD%D0%BE%D1%81%D1%82%D1%8C%D1%8E.%3C/p%3E%20%3Cp%3E%D0%9F%D1%80%D0%B8%20%D0%B8%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B8%20%D0%B4%D0%B8%D1%81%D0%BA-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D1%84%D0%BE%D1%80%D0%B5%D0%B7%D0%B0%20%D0%B2%20%D0%BF%D0%BE%D0%BB%D0%B8%D0%B0%D0%BA%D1%80%D0%B8%D0%BB%D0%B0%D0%BC%D0%B8%D0%B4%D0%BD%D0%BE%D0%BC%20%D0%B3%D0%B5%D0%BB%D0%B5%20%D0%B4%D0%BB%D1%8F%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%20%D1%82%D0%B0%D0%BA%D0%B6%D0%B5%20%D1%81%D1%82%D1%80%D0%BE%D1%8F%D1%82%20%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D0%BA%20%D0%B7%D0%B0%D0%B2%D0%B8%D1%81%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D0%B8%20%D0%BC%D0%B5%D0%B6%D0%B4%D1%83%20%D0%BB%D0%BE%D0%B3%D0%B0%D1%80%D0%B8%D1%84%D0%BC%D0%BE%D0%BC%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D0%BA%D0%B0%D0%BB%D0%B8%D0%B1%D1%80%D0%BE%D0%B2%D0%BE%D1%87%D0%BD%D1%8B%D1%85%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%20%D0%B8%20%D0%BF%D0%BE%D0%B4%D0%B2%D0%B8%D0%B6%D0%BD%D0%BE%D1%81%D1%82%D1%8C%D1%8E%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2%D1%8B%D1%85%20%D1%87%D0%B0%D1%81%D1%82%D0%B8%D1%86%20%D0%B2%20%D0%BF%D0%BE%D0%BB%D0%B8%D0%B0%D0%BA%D1%80%D0%B8%D0%BB%D0%B0%D0%BC%D0%B8%D0%B4%D0%BD%D0%BE%D0%BC%20%D0%B3%D0%B5%D0%BB%D0%B5,%20%D0%B0%20%D0%B7%D0%B0%D1%82%D0%B5%D0%BC,%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D0%B2%20%D0%BF%D0%BE%D0%B4%D0%B2%D0%B8%D0%B6%D0%BD%D0%BE%D1%81%D1%82%D1%8C%20%D0%B8%D1%81%D1%81%D0%BB%D0%B5%D0%B4%D1%83%D0%B5%D0%BC%D0%BE%D0%B3%D0%BE%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0,%20%D0%BF%D0%BE%20%D0%B3%D1%80%D0%B0%D1%84%D0%B8%D0%BA%D1%83%20%D0%BD%D0%B0%D1%85%D0%BE%D0%B4%D1%8F%D1%82%20%D0%B5%D0%B3%D0%BE%20%D0%BC%D0%B0%D1%81%D1%81%D1%83%20(%D1%80%D0%B8%D1%81.%201.11).%20%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D1%84%D0%BE%D1%80%D0%B5%D0%B7%20%D0%BF%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D1%8F%D1%82%20%D0%B2%20%D0%BF%D1%80%D0%B8%D1%81%D1%83%D1%82%D1%81%D1%82%D0%B2%D0%B8%D0%B8%20%D0%B4%D0%B5%D1%82%D0%B5%D1%80%D0%B3%D0%B5%D0%BD%D1%82%D0%B0%20%D0%B4%D0%BE%D0%B4%D0%B5%D1%86%D0%B8%D0%BB%D1%81%D1%83%D0%BB%D1%8C%D1%84%D0%B0%D1%82%D0%B0%20%D0%BD%D0%B0%D1%82%D1%80%D0%B8%D1%8F,%20%D1%82%D0%B0%D0%BA%20%D0%BA%D0%B0%D0%BA%20%D1%82%D0%BE%D0%BB%D1%8C%D0%BA%D0%BE%20%D0%B2%20%D1%8D%D1%82%D0%BE%D0%BC%20%D1%81%D0%BB%D1%83%D1%87%D0%B0%D0%B5%20%D0%BD%D0%B0%D0%B1%D0%BB%D1%8E%D0%B4%D0%B0%D0%B5%D1%82%D1%81%D1%8F%20%D0%BF%D1%80%D1%8F%D0%BC%D0%B0%D1%8F%20%D0%BF%D1%80%D0%BE%D0%BF%D0%BE%D1%80%D1%86%D0%B8%D0%BE%D0%BD%D0%B0%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F%20%D0%B7%D0%B0%D0%B2%D0%B8%D1%81%D0%B8%D0%BC%D0%BE%D1%81%D1%82%D1%8C%20%D0%BC%D0%B5%D0%B6%D0%B4%D1%83%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D0%BE%D0%B9%20%D0%B8%20%D0%BF%D0%BE%D0%B4%D0%B2%D0%B8%D0%B6%D0%BD%D0%BE%D1%81%D1%82%D1%8C%D1%8E%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%BE%D0%B2.%20%D0%91%D0%B5%D0%BB%D0%BA%D0%B8%20%D1%81%20%D1%87%D0%B5%D1%82%D0%B2%D0%B5%D1%80%D1%82%D0%B8%D1%87%D0%BD%D0%BE%D0%B9%20%D1%81%D1%82%D1%80%D1%83%D0%BA%D1%82%D1%83%D1%80%D0%BE%D0%B9%20%D0%BF%D1%80%D0%B8%20%D1%8D%D1%82%D0%B8%D1%85%20%D1%83%D1%81%D0%BB%D0%BE%D0%B2%D0%B8%D1%8F%D1%85%20%D1%80%D0%B0%D1%81%D0%BF%D0%B0%D0%B4%D0%B0%D1%8E%D1%82%D1%81%D1%8F%20%D0%BD%D0%B0%20%D1%81%D1%83%D0%B1%D1%8A%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D1%8B,%20%D0%BF%D0%BE%D1%8D%D1%82%D0%BE%D0%BC%D1%83%20%D0%BC%D0%B5%D1%82%D0%BE%D0%B4%20%D0%BD%D0%B0%D1%85%D0%BE%D0%B4%D0%B8%D1%82%20%D1%88%D0%B8%D1%80%D0%BE%D0%BA%D0%BE%D0%B5%20%D0%BF%D1%80%D0%B8%D0%BC%D0%B5%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%B4%D0%BB%D1%8F%20%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F%20%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B9%20%D0%BC%D0%B0%D1%81%D1%81%D1%8B%20%D1%81%D1%83%D0%B1%D1%8A%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%20%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0.%3C/p%3E%20%3Cp%20style=)




