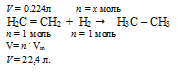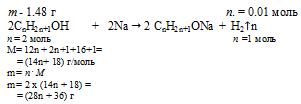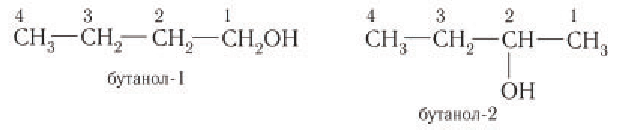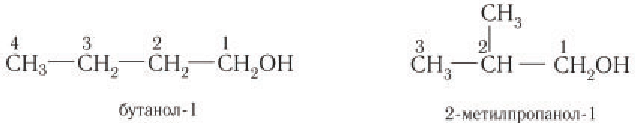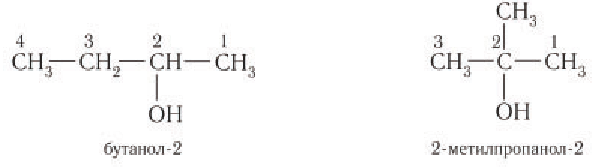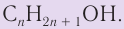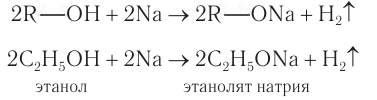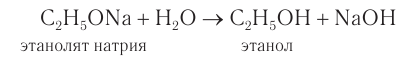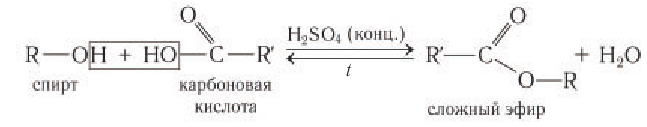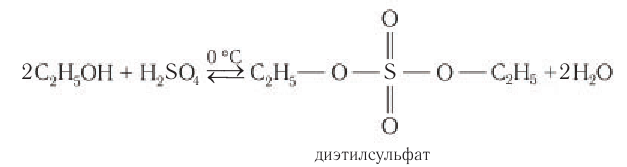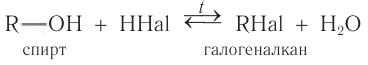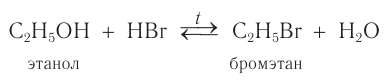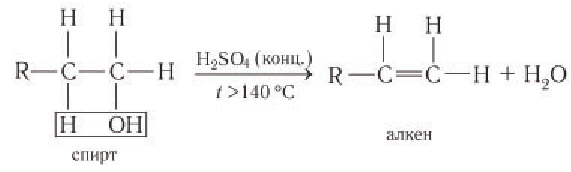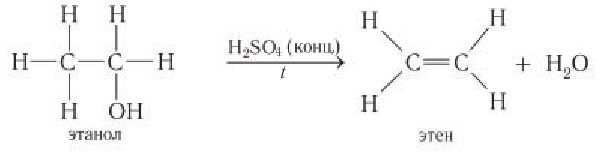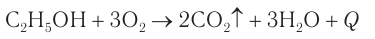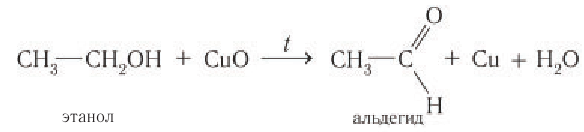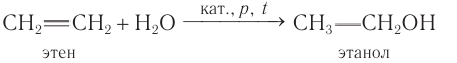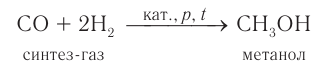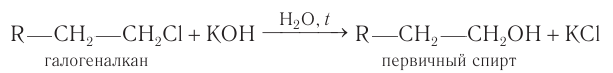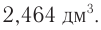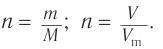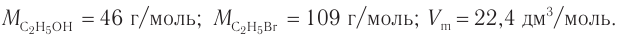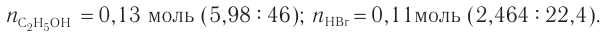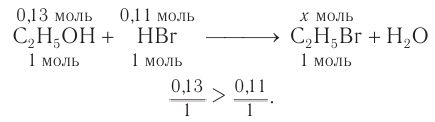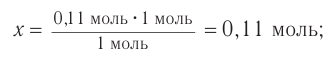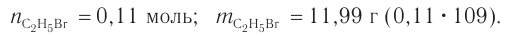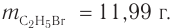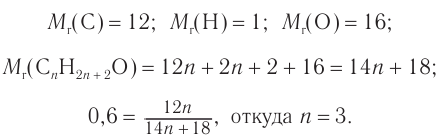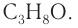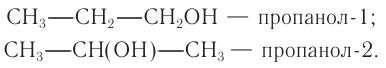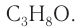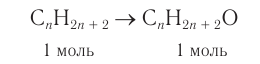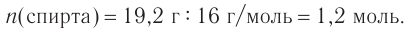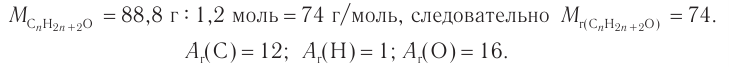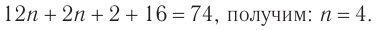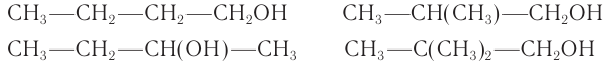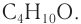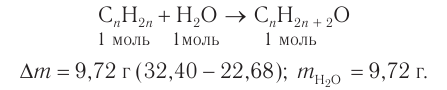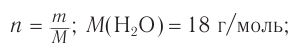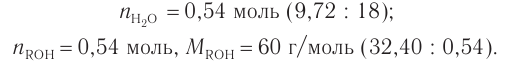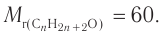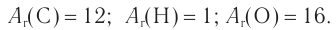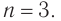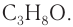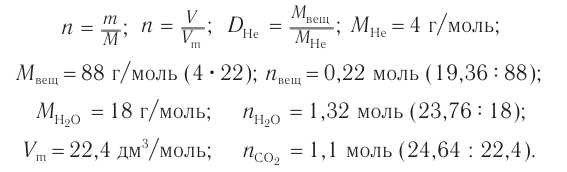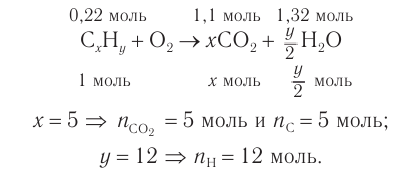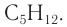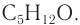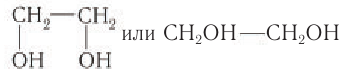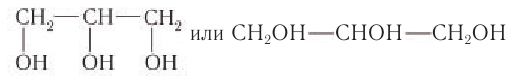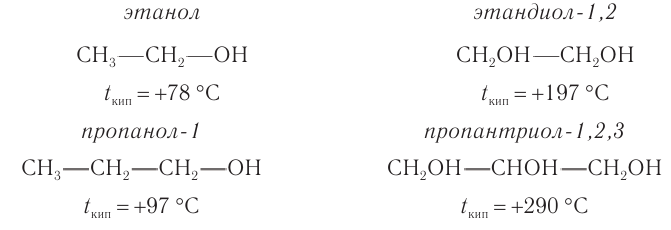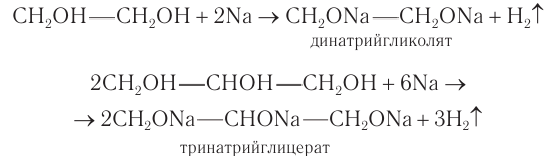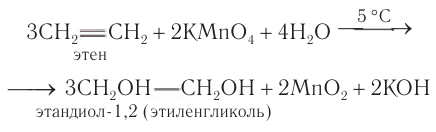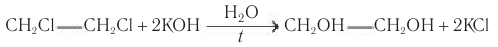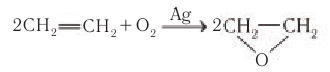Определение молекулярной формулы спирта
Наиболее распространены в тестах ЕГЭ задачи, в которых расчет ведется по уравнению реакции. Рассмотрим наиболее сложную из них.
Задача 2.6.
При взаимодействии 1,48 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 224 мл этилена (н.у.). Определите молекулярную формулу спирта.
Дано:
масса предельного одноатомного спирта: m(спирта) = 1,48 г;
объем этилена (н.у.): V(С2Н4) = 224 мл.
Найти: формулу исходного спирта.
Решение:
Шаг 1. В состав предельного одноатомного спирта входят углерод, водород и один атом кислорода. Общая формула имеет вид: СnH2n+1ОН.
Шаг 2. В условии описаны две последовательные химические реакции:
2СnH2n+1ОН + 2Na —> 2СnH2n+1ОNa + H2
Водород, выделившийся в первой реакции, участвует, во взаимодействии с этиленом:
Н2С = СН2 + Н2 —> Н3С – СН3
Шаг 3 и 4. Соотношение атомов и простейшая формула спирта однозначно определяется по общей формуле, но эти данные не помогут нам при выявлении истинной формулы.
Шаг 5. Для выявления значения «n» в общей формуле спирта необходимо сопоставить массу спирта с количеством образовавшегося водорода по первому уравнению реакции. Количество образовавшегося водорода можно определить по второй реакции гидрирования.
а) Определение количества вещества водорода1:
Составляем пропорцию:
0,224 л Н2С = СН2 взаимодействуют с х моль Н2 (по условию)
22,4 л Н2С = СН2 взаимодействуют с 1 моль Н2 (по уравнению)
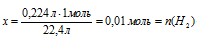
б) Водород, принявший участие в реакции с этиленом, выделился в первой реакции спирта с металлическим натрием. Следовательно, можно использовать полученные данные для сопоставления с массой исходного спирта.
Составляем пропорцию:
1,48 г СnH2n+1ОН дает 0,01 моль Н2 (по условию)
(28n + 36) г СnH2n+1ОН дает 1 моль Н2 (по уравнению)
1,48 . 1 = (28n + 36) . 0,01
Получили математическое уравнение с одним неизвестным. Решая его, получаем: n = 4.
Подставляем это значение в общую формулу спирта:
С4Н9ОН.
Ответ: С4Н9ОН.
Данная задача была осложнена двумя последовательными уравнениями реакций. Для сопоставления данных с целью определения неизвестного индекса в общей формуле нам
пришлось проводить дополнительный расчет по второму химическому уравнению. В большинстве задач ЕГЭ в условии описана лишь одна реакция и присутствуют данные о двух веществах в ней. После записи уравнения с использованием общей формулы можно сразу приступать к сопоставлению данных и выявлению неизвестных индексов.
Комментарии:
1 Объем газообразного этилена в условии выражен в миллилитрах. Для использования этого данного в пропорции необходимо перевести его в литры, т.к. молярный объем измеряется в л/моль. Ошибку, связанную с приведением данных к одним единицам измерения делают многие учащиеся.
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.

locer
+10
Решено
8 лет назад
Химия
10 — 11 классы
плотность паров спирта по кислороду равна 2,75. Определите молекулярную формулу спирта
решите , плиз
Смотреть ответ
1
Ответ
5
(2 оценки)
2
DashaNikitina451
8 лет назад
Светило науки — 459 ответов — 0 раз оказано помощи
Формула спирта общая: CnH2n+1OH
M(CnH2n+1OH) = D(по кислороду)*M(O2) = 2,75*32 = 88 г/моль
12n+2n+1+16+1 = 88
14n = 70
n = 5 => C5H11OH
12,1,16 — атомные массы соответственно C ,H,O из таблицы Менделеева. n — их количество.
(2 оценки)
https://vashotvet.com/task/8691883
-
Типы задач в задании С5.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Ответы и комментарии к задачам для самостоятельного решения.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
к оглавлению ▴
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол С2Н6О С:Н:О = 2:6:1 С2Н6О Бутен С4Н8 С:Н = 1:2 СН2 Уксусная кислота С2Н4О2 С:Н:О = 1:2:1 СН2О Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29 - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
а молярную массу газа можно найти, умножая плотность на молярный объём. - Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы CnH2n+2 — Алкены CnH2n CnH2n+1–CH=CH2 Алкины CnH2n−2 CnH2n+1–C≡CH Диены CnH2n−2 — Гомологи бензола CnH2n−6 С6Н5–СnH2n+1 Предельные одноатомные спирты CnH2n+2O CnH2n+1–OH Многоатомные спирты CnH2n+2Ox CnH2n+2−x(OH)x Предельные альдегиды CnH2nO Кетоны CnH2nO O // CnH2n+1– C– O–CmH2m+1 Фенолы CnH2n−6O С6Н5(СnH2n)–OH Предельные карбоновые кислоты CnH2nO2 Сложные эфиры CnH2nO2 O // CnH2n+1– C– O–CmH2m+1 Амины CnH2n+3N СnH2n+1NH2 Аминокислоты (предельные одноосновные) CnH2n+1NO2 O // NH2– CH– C– OH C nH 2n+1
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
-
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Ответ: С8Н18.
-
Пример 2.
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
-
Пример 3.
Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•1023 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
-
Пример 4.
Определить формулу дихлоралкана, содержащего 31,86 % углерода.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Ответ: С3Н6Cl2, дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль. - При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль. - Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана С4Н10.
Ответ: С4Н10.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у) и 12,6 г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
СхНуОz + О2 → CO2 + H2O
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду. - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.ν(C) = 0,7 моль
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль. - Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы С и Н.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов. - Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2. - Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул N2 и его молярная масса 28 г/моль):
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Ответ: С4Н8.
-
Пример 7.
Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г CO2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду — 22,5. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2 → CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = m / M = 17,6 / 44 = 0,4 моль.
ν(C) = 0,4 моль.
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.
ν(H) = 0,7 • 2 = 1,4 моль. - Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы С и Н.m(C) = 0,4 • 12 = 4,8 г,
m(H) = 1,4 • 1 = 1,4 гМасса всего вещества 9,8 г.
m(N) = 9 − 4,8 − 1,4 = 2,8 г ,
ν(N) = m /M = 2,8 / 14 = 0,2 моль. - C : H : N = 0,4 : 1,4 : 0,2 = 2 : 7 : 1
Простейшая формула — С2Н7N.
Истинная молярная масса
М = Dпо Н2 • М(Н2) = 22,5 • 2 = 45 г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
Ответ: С2Н7N.
-
Пример 8.
Вещества содержит С, Н, О и S. При сгорании 11 г его выделилось 8,8 г CO2, 5,4 г Н2О, а сера была полностью переведена в сульфат бария, масса которого оказалась равна 23,3 г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
ν(CO2) = m/M = 8,8/44 = 0,2 моль.
ν(C) = 0,2 моль.
ν(Н2О) = m / M = 5,4 / 18 = 0,3 моль.
ν(H) = 0,6 моль.
ν(BaSO4) = 23,3 / 233 = 0,1 моль.
ν(S) = 0,1 моль. - Рассчитываем предполагаемую массу кислорода в исходном веществе:
m(C) = 0,2 • 12 = 2,4 г
m(H) = 0,6 • 1 = 0,6 г
m(S) = 0,1 • 32 = 3,2 г
m(O) = mвещества − m(C) − m(H) − m(S) = 11 − 2,4 − 0,6 − 3,2 = 4,8 г,
ν(O) = m / M = 4,8 / 16 = 0,3 моль - Находим мольное соотношение элементов в веществе:
C : H : S : O = 0,2 : 0,6 : 0,1 : 0,3 = 2 : 6 : 1 : 3
Формула вещества C2H6SO3.
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы (С4Н12S2O6) получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
Ответ: C2H6SO3.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветить 80 г 2%-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль. - Так как количество брома, вступившего в реакцию, в 2 раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
0,005 0,01 СnH2n−2 + 2Br2 → СnH2n−2Br4 Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.Это пентадиен С5Н8.
Ответ: C5H8.
-
Пример 10.
При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2CnH2n+1OH + 2Na
→
2CnH2n+1ONa + H2
C3H6 + H2→
C3H8
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
ν(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль,
νспирта = 0,005 • 2 = 0,01 моль. - Находим молярную массу спирта и n:
Mспирта = m / ν = 0,74 / 0,01 = 74 г/моль,
14n + 18 = 74
14n = 56
n = 4.Спирт — бутанол С4Н7ОН.
Ответ: C4H7OH.
-
Пример 11.
Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH.
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:mH2O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г
νH2O = m / M = 0,54 / 18 = 0,03 мольСоответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:Мкислоты = m / ν = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.Получим два уравнения, из которых найдём m и n:
MCnH2n+1COOH = 14n + 46 = 60, n = 1 — уксусная кислота
MCmH2m+1OH = 14m + 18 = 46, m = 2 — этанол.Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: CH3COOC2H5.
-
Пример 12.
Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:M(аминокислоты NH2–CH(R)–COOH) = 74 + МR
M(соли NH2–CH(R)–COONa) = 96 + МR
νаминокислоты = 8,9 / (74 + МR),
νсоли = 11,1 / (96 + МR)
8,9 / (74 + МR) = 11,1 / (96 + МR)
МR = 15Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1.
Это аланин — аминопропановая кислота.
Ответ: NH2–CH(CH3)–COOH.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
1–4. 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77 % кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204•1022 молекул.
2–3. Углекислый газ, полученный при сгорании 3,4 г углеводорода, пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего С, Н и хлор, выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он 5,6 г его при присоединении воды образуют 7,4 г спирта.
3–2. Для окисления 2,9 г предельного альдегида до кислоты потребовалось 9,8 г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой 3 г с избытком бромоводорода образует 6,24 г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой 2,7 г с избытком калия выделилось 0,672 л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили 9,73 г альдегида, 8,65 г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1. С3Н8
1–2. С3Н6(NH2)2
1–3. C2H4(COOH)2
1–4. C4H6
1–5. (HCOO)2Ca — формиат кальция, соль муравьиной кислоты
2–1. С8Н16О
2–2. С3Н7NO
2–3. С5Н8 (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. C3H7Cl (не забудьте, что атомы водорода содержатся не только в воде, но и в HCl)
2–5. C4H11N
3–1. С4Н8
3–2. С3Н6О
3–3. С2Н5NO2
3–4. C4H8(OH)2
3–5. C4H9OH
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Химия, часть С. Задача С5. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.05.2023
Решение
задач на спирты
2. Предельный простой эфир массой 10 г при
нормальных условиях занимает объем 4.87 л. Выведите молекулярную
формулу эфира.
3. Относительная плотность паров
органического соединения по воздуху равна 2,552. Массовая доля углерода в этом
веществе равна 64,86%, массовая доля водорода равна 13,51%,
массовая доля кислорода равна 21,63%. Выведите молекулярную формулу этого
вещества.
4. Относительная плотность паров
органического соединения по водороду равна 65. Массовая доля углерода в этом
веществе равна 73,85%, массовая доля водорода равна 13,85%, массовая доля
кислорода равна 12,3%. Выведите молекулярную
формулу этого вещества.

Относительная плотность паров органического соединения по водороду равна 51.
При сжигании 30,6 г этого вещества образовалось 79,2 г диоксида углерода и 37,8
г воды. Выведите молекулярную формулу органического соединения.
6. Относительная плотность паров
органического соединения по кислороду равна 3,625.11ри сжигании 29 г этого
вещества образуется 39,2 л углекислого газа (н. у.) и 36 г воды. Выведите
молекулярную формулу органического соединения.
Учитель: А
кто помнит где используется фенол?
Учитель. Хорошо.
Знаете ли вы, что в результате гидролиза аспирина образуется образуется фенол? Это
должные знать те хозяйки, которые любят консервировать огурцы и помидоры и
вместо уксусной кислоты добавляют таблетки аспирина.
НООС-С6Н4-О-СО-СН3 (аспирин) + Н2О (t) =
НООС-С6Н4-ОН (гидроксибензойная к-та) + СН3СООН (уксусная к-та)
При нагревании салициловая кислота легко
декарбоксилируется с образованием фенола:
С6H4(OH)COOH=C6H5OH
+ CO2
Но фенол и его производные без труда
проникают в организм человека через кожу и желудочно-кишечный тракт, а пары
фенола – через легкие. В организме фенол легко образует соединения с другими
веществами, присутствующими в организме. Чем выше концентрация фенола в крови,
тем сильнее его неблагоприятное влияние на здоровье человека. Продукты
взаимодействия фенола с другими веществами, а также часть несвязанного фенола
выводятся с мочой.
7. Задача: Найти формулу вещества по
следующим данным: плотность вещества по водороду 31, массовые доли С – 38,7%,
кислорода – 51,6% , водорода – 9,7%
Решение задачи.
- Находим количественный состав
вещества ﻻ= - Ач(С) – 12г/моль
Ач(О) – 16г/моль
Ач(H) – 1г/моль
- Подставляем числовые данные CxHyOz
- x:y:z=
(C):
(O):
(H)=
- Простейшая формула: (CH3O)*2
M=31г/моль - М (ист) = p(H)*M(H2)=32*2=62г/моль
- Ответ: М.ф. вещества C2H6O2
1.
Относительная плотность паров предельного одноатомного спирта по кислороду
равна 2,75. Выведите молекулярную
формулу спирта.
2.
Предельный простой эфир массой 10 г при нормальных условиях занимает объем 4.87
л. Выведите молекулярную
формулу эфира.
3.
Относительная плотность паров органического соединения по воздуху равна 2,552.
Массовая доля углерода в этом
веществе равна 64,86%, массовая доля водорода равна 13,51%,
массовая доля кислорода равна 21,63%. Выведите молекулярную формулу этого
вещества.
4.
Относительная плотность паров органического соединения по водороду равна 65.
Массовая доля углерода в этом веществе равна 73,85%, массовая доля водорода
равна 13,85%, массовая доля кислорода равна 12,3%. Выведите молекулярную
формулу этого вещества.
5.
Относительная плотность паров органического соединения по водороду равна 51.
При сжигании 30,6 г этого вещества образовалось 79,2 г диоксида углерода и 37,8
г воды. Выведите молекулярную формулу органического соединения.
6.
Относительная плотность паров органического соединения по кислороду равна
3,625.11ри сжигании 29 г этого вещества образуется 39,2 л углекислого газа (н.
у.) и 36 г воды. Выведите молекулярную формулу органического соединения.
Задача:
При действии избытка натрия на
раствор фенола в метаноле выделилось 1176 мл газа (н. у.).
Для нейтрализации такого же
количества раствора потребовалось 10 мл водного раствора NaОН с концентрацией
20 мг/мл.
Чему равна массовая доля фенола в
исходном растворе?
Решение:
Для
начала давайте распишем все химические процессы в задаче:
1. Во
второй реакции проявляется то самое различие между спиртами и фенолами — из
второй реакции, в которой метанол не взаимодействует с щелочью, мы можем
найти количество моль фенола,
2. в
условии сказано, что такое же количество прореагировало с Na в первой реакции —
в этой реакции и спирт и фенол реагируют с Na одинаково.
3.
Значит, мы можем найти то количество водорода (газ), которое соответствует
фенолу,
4.
найти остаток водорода и вычислить количество моль метанола.
В
вопросе сказано найти массовую долю фенола, значит, используем стандартную
формулу для массовой доли вещества в растворе
Давайте
напишем подробное решение:
1.
Дано 10 мл водного раствора NaОН с концентрацией 20 мг/мл. Значит,
находим количество моль:
n (NaOH) = mMr=V*C(концентрация)Mr = 10 (мл) *
0,020( гмл) 40 (гмоль) = 0,005 моль
Значит, по уравнению реакции, n(фенола) = 0,005 моль
2.
Значит, количество фенола, вступившего в первую реакцию тоже 0,05 моль
3.
Водорода по уравнению реакции получается в 2 раза меньше, чем фенола:
4. При
действии избытка натрия на раствор фенола в метаноле выделилось 1176 мл газа
(н. у.). Нам нужно найти количество моль водорода.
n(H2)=V22,4 (лмоль) = 1.176 (л) 22.4
(лмоль) = 0.0525 моль
Значит,
в реакции с метанолом выделилось 0.0525 — 0.0025 = 0,05 моль
водорода
n
(метанола) = 0.1 моль
Находим массовую долю:
m(фенола) = 0,05 (моль)*94 (гмоль) = 0,47 г
m(метанола) = 0,1 (моль) * 32 (гмоль) = 3,2 г
w(фенола) = m(фенола) (m(фенола) + m(метанола)
)*100%= 0,47 (г) 3,67 (г)*100% = 12,8%
Содержание:
Спирты:
Углеводороды образуют различные функциональные производные при замещении в молекуле одного или нескольких атомов водорода на функциональную группу
Спирты и фенолы относятся к монофункциональным гидроксилпроизвод-ным углеводородов.
Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильную группу —ОН.
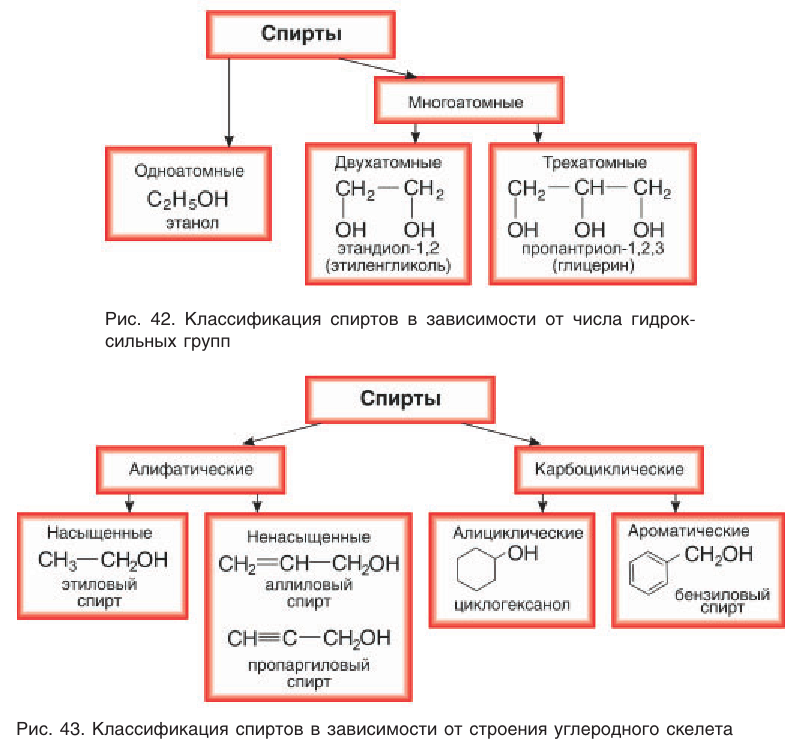
Классификация спиртов
В зависимости от числа гидроксильных групп в молекуле спирты подразделяют на одноатомные, двухатомные, трехатомные, четырехатомные и т. д. (рис. 42). Например:
Спирты, содержащие несколько гидроксильных групп, объединяют общим названием многоатомные спирты.
В зависимости от строения углеродного скелета различают спирты насыщенные, ненасыщенные, ароматические (рис. 43).
Насыщенные спирты — производные алканов, например 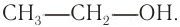
Некоторые одноатомные ненасыщенные спирты, содержащиеся в винограде, из которого производят вина, определяют характерный аромат ряда мускатных вин и рислингов. В процессе старения этих вин одноатомные спирты превращаются в двухатомные. По концентрации образовавшегося двухатомного спирта можно судить о степени старения вина.
К ароматическим относят спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, которые связаны друг с другом через атом углерода, например:
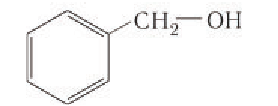
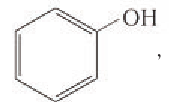
Если в молекулах органических соединений гидроксильные группы связаны непосредственно с атомом углерода бензольного кольца, например:
то такие соединения относят к другому классу органических соединений фенолам.
В лепестках розы (рис. 44) содержится ароматический фенилэтиловый спирт, формула которого 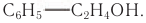
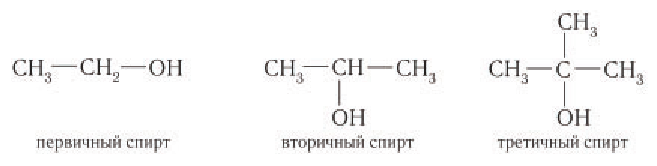
В зависимости от типа атома углерода, с которым связана гидроксильная группа, спирты классифицируют как первичные, вторичные, третичные.
Гидроксильная группа в молекулах первичных спиртов связана с первичным атомом углерода, в молекулах вторичных спиртов — с вторичным атомом углерода и в молекулах третичных спиртов — с третичным атомом углерода. Например:
Спирты — производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильную группу —ОН.
Спирты различают по числу гидроксильных групп (атомность спиртов), строению углеродного скелета, типу атома углерода, связанного с гидроксильной группой.
Насыщенные одноатомные спирты
Строение: Насыщенными одноатомными спиртами называют производные алканов, в молекулах которых один атом водорода замещен на гидроксильную группу и содержатся только 
В органической химии известно большое число насыщенных одноатомных спиртов, химический состав и строение которых выражается общей формулой 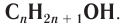
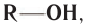
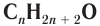
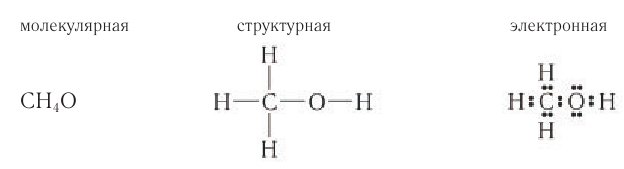
Простейшим представителем данного класса спиртов является метанол 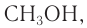
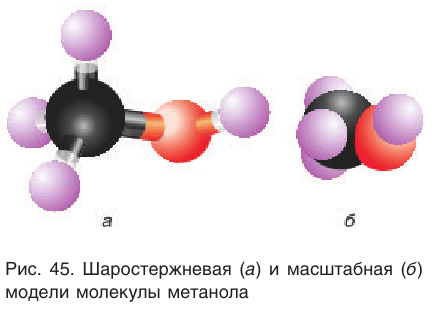
Шаростержневая и масштабная модели молекулы метанола представлены на рисунке 45.
Так как электронное строение алканов и соответствующих им алкильных групп вами уже изучено, то при изучении спиртов — производных алканов — будет рассматриваться только электронное строение функциональной группы спиртов 
В состав функциональной группы спиртов входит атом кислорода, который обладает большой электроотрицательностью и в силу этого оттягивает к себе электронную плотность 
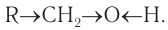
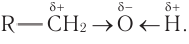
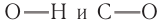
Номенклатура: По правилам номенклатуры ИЮПАК, названия насыщенных одноатомных спиртов образуются от названий соответствующих алканов с добавлением суффикса -ол. Например, 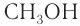
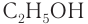
Систематическая номенклатура допускает употребление названий, связанных с названием алкильных групп, для низших членов ряда. Например,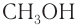
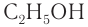
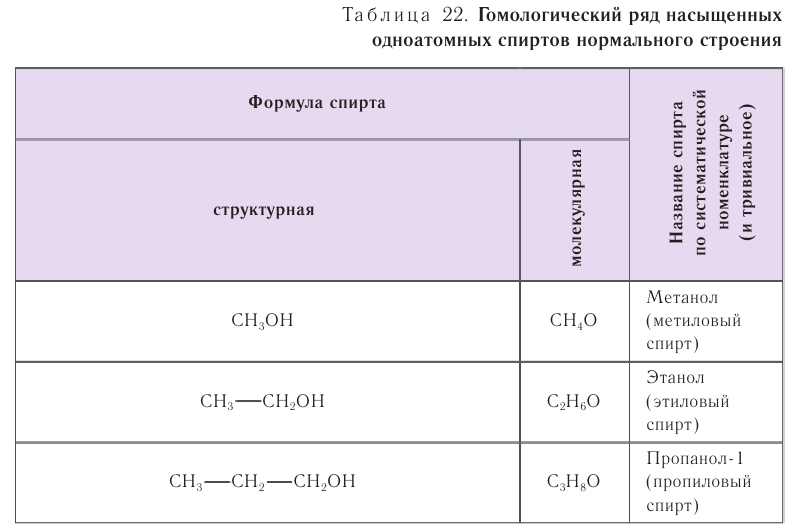
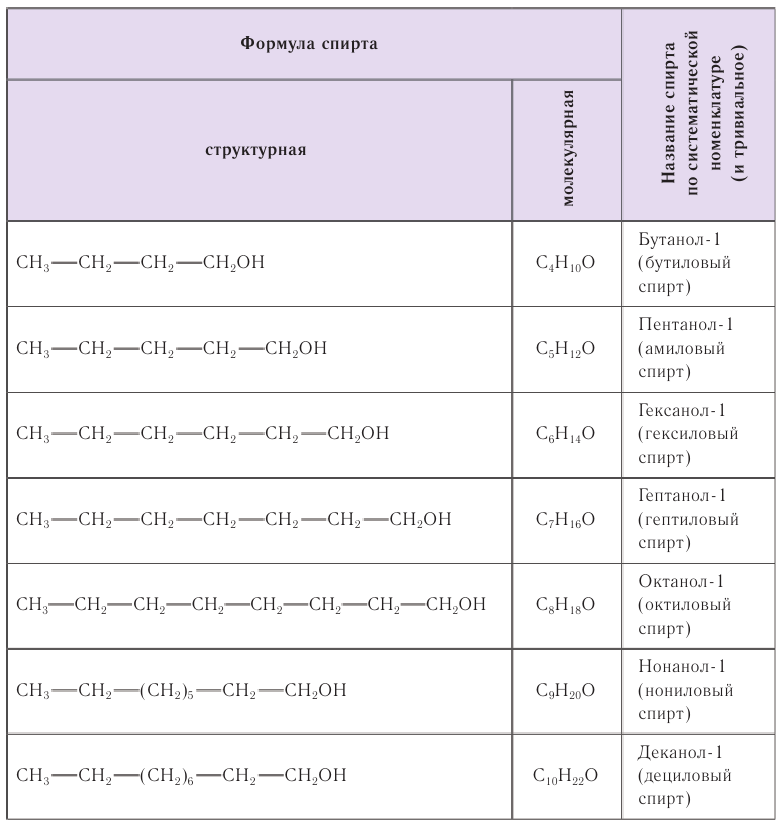
В таблице 22 приведены названия первых десяти представителей гомологического ряда спиртов, у которых функциональная группа —ОН находится у первичного атома углерода, по номенклатуре ИЮПАК и тривиальные.
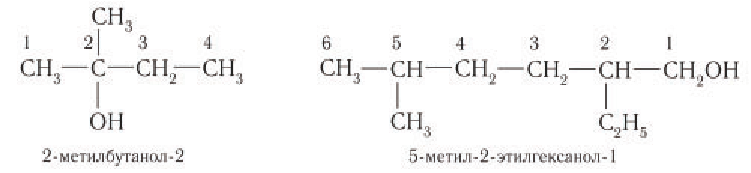
При названии спиртов с неразветвленной углеродной цепью, начиная с пропанола, цифрой указывается атом углерода, с которым связана гидроксильная группа. Нумерация углеродных атомов начинается с того конца, ближе к которому расположена гидроксильная группа. Названия спиртов образуют, добавляя суффикс -ол к названию соответствующего алкана, цифрой указывается положение гидроксильной группы в цепи. Например:
Для названий спиртов с разветвленной углеродной цепью выбирают самую длинную цепь, содержащую функциональную гидроксильную группу, и нумеруют с того конца, ближе к которому расположена гидроксильная группа. Названия спиртов образуют, добавляя суффикс -ол к назанию алкана, соответствующего самой длинной цепи, цифрой указываются атомы углерода, с которыми связана гидроксильная группа и заместители. Названия заместителей перечисляются в алфавитном порядке. Например:
Изомерия: Для насыщенных одноатомных спиртов характерна структурная изомерия. Структурная изомерия спиртов обусловлена изомерией углеродного скелета и изомерией положения гидроксильной группы. Первые два члена гомологического ряда — метанол 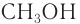
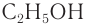
Рассмотрим примеры изомеров спиртов состава 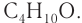
В зависимости от положения гидроксильной группы при том и другом углеродном скелете возможны еще два изомерных спирта:
Общее число структурных изомеров спиртов состава 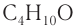
Физические свойства: Первые представители класса насыщенных одноатомных спиртов 
Низшие спирты обладают характерным алкогольным запахом, запах спиртов, стоящих в середине гомологического ряда, сильный и часто неприятный, а высшие спирты (более 
Низшие спирты (
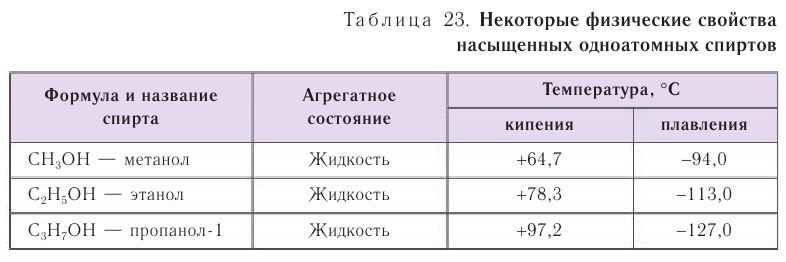
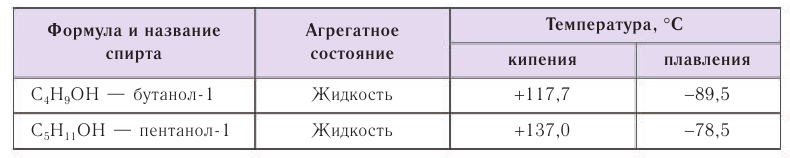
Спирты обладают аномально высокими температурами кипения по сравнению с представителями алканов с приблизительно такой же относительной молекулярной массой. Например, температура кипения этанола 78,3 °С, а пропана -42,2 °С. В таблице 23 приводятся температуры кипения, плавления и агрегатное состояние некоторых спиртов.
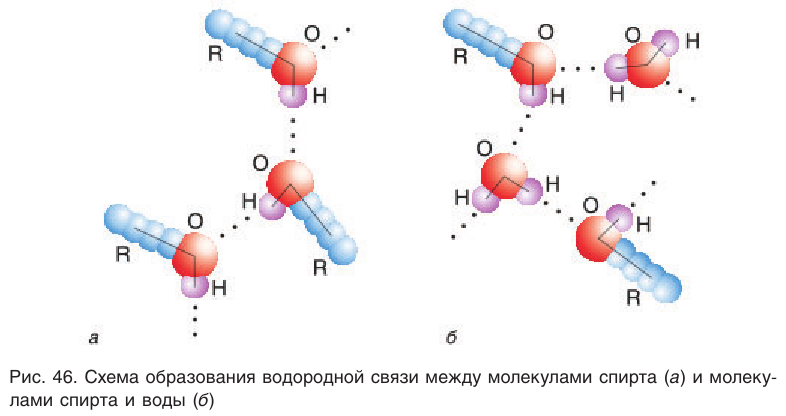
Причиной отсутствия газообразных спиртов при нормальных условиях, а также более высоких температур кипения спиртов по сравнению с алканами с одинаковой относительной молекулярной массой являются межмолекулярные водородные связи, характерные для спиртов. Как отмечалось, связь 
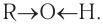
Образованием межмолекулярных водородных связей между молекулами спиртов и полярными молекулами воды (рис. 46, б) объясняется хорошая растворимость низших спиртов, в отличие от углеводородов, которые из-за малой полярности связей С—Н не образуют с водой водородных связей. С увеличением длины цепи алкильных групп растворимость спиртов понижается, и октанол уже не смешивается с водой.
Насыщенными одноатомными спиртами называют производные алканов, в молекулах которых один атом водорода замещен на гидроксильную группу.
Общая формула насыщенных одноатомных спиртов
Структурная изомерия спиртов обусловлена строением углеродного скелета и различным положением гидроксильной группы при одинаковой углеродной цепи.
На физические свойства спиртов большое влияние оказывает водородная связь между молекулами спиртов или молекулами спиртов и воды в их растворах.
Химические свойства спиртов
Характерные реакции спиртов определяются наличием в составе их молекул гидроксильиой группы, атом кислорода которой смещает электронную плотность как от атома водорода, так и от атома углерода. Такая поляризация может способствовать разрыву связей 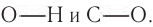
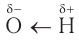
Рассмотрим важнейшие химические свойства спиртов на примере алифатических насыщенных одноатомных спиртов.
Взаимодействие со щелочными металлами: При взаимодействии щелочных металлов 

Спирты — очень слабые электролиты, слабее даже, чем вода. Поэтому алкокеиды (алкоголяты) легко разлагаются водой:
При взаимодействии с металлами у спиртов проявляются кислотные свойства, но к классу кислот спирты не относят, так как степень их диссоциации незначительна. Поэтому спирты с водными растворами щелочей взаимодействуют обратимо.
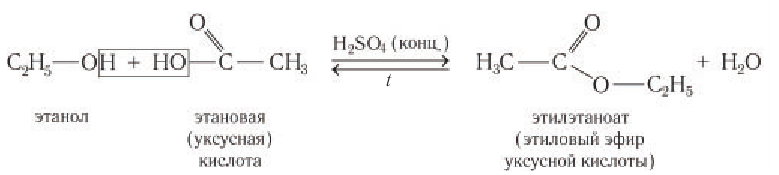
Взаимодействие с карбоновыми и кислородсодержащими минеральными кислотами с образованием сложных эфиров.
В реакции с карбоновыми кислотами от молекулы спирта отщепляется атом водорода, а от молекулы карбоновой кислоты — гидроксильная группа с образованием молекулы воды. Реакция обратима, но равновесие смещается вправо в присутствии концентрированной серной кислоты и при выводе воды из зоны реакции:
В реакциях с кислородсодержащими минеральными кислотами спирты образуют сложные эфиры этих кислот:
Взаимодействие с галогеноводородами с образованием галогеналканов
В реакции с галогеноводородами в молекуле спирта происходит разрыв связи 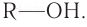
Данная реакция обратима. В этой реакции проявляются слабые основные свойства спирта.
При взаимодействии этанола с бромоводородом образуется бромэтан — тяжелая жидкость:
Внутримолекулярная дегидратация с образованием алкена
Первичные спирты дегидратируются под действием катализатора — концентрированной серной кислоты — при высоких температурах (выше 140 °С) с образованием алкена:
Реакция дегидратации обусловлена отщеплением водорода в виде протона и гидроксильной группы от соседних атомов углерода.
Например, в результате внутримолекулярного отщепления молекулы воды от молекулы этанола (под действием катализатора — концентрированной серной кислоты) образуется этен:
Реакции окисления
Спирты горят на воздухе или в кислороде некоптящим пламенем с выделением большого количества теплоты (рис. 48):
С более слабым, чем кислород, окислителем, например с оксидом меди(II), происходит частичное окисление спиртов, при этом первичные спирты окисляются до альдегидов.
Если в пробирку с этанолом опустить раскаленную скрученную в спираль медную проволоку, покрытую черным налетом оксида меди(II), то черный налет на проволоке исчезает. Спираль приобретает розово-красный цвет, при этом чувствуется неприятный запах образовавшегося альдегида:
Под действием таких окислителей, как подкисленный раствор перманганата калия или дихромата калия, первичные спирты окисляются до карбоновых кислот.
Кислотно-основные свойства насыщенных одноатомных спиртов обусловлены наличием в их молекулах функциональной гидроксильной группы.
Спирты взаимодействуют со щелочными металлами, галогеноводородами, карбоновыми и минеральными кислотами; вступают в реакции дегидратации и окисления.
Получение и применение спиртов
Получение: Для промышленного получения спиртов используют ненасыщенные углеводороды, извлекаемые из нефтепродуктов, или галогеналканы.
Познакомимся с основными общими промышленными и лабораторными способами получения насыщенных одноатомных спиртов и специфическими способами получения этанола и метанола.
1) Одним из наиболее важных общих промышленных способов получения спиртов является гидратация алкенов.
Этанол получают гидратацией этена водяными парами при повышенной температуре (280—300 °С), повышенном давлении (7—8 мПа) и в присутствии катализатора
Спирт, полученный из этена, называют синтетическим.
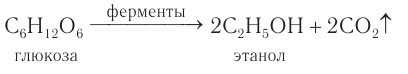
2) В пищевой промышленности этанол получают характерным только для него способом при спиртовом брожении глюкозы под действием ферментов, выделяемых некоторыми видами дрожжевых грибков:
Брожению подвергают виноградный сок, содержащий глюкозу, а также картофельный крахмал, который превращается в глюкозу под действием особого фермента. Этанол, полученный при ферментативном расщеплении различных пищевых продуктов, используют в основном для изготовления спиртных напитков.
В промышленности этанол производят гидролизным способом из древесных опилок, отходов целлюлозно-бумажной промышленности и т. д. Содержащуюся в древесине целлюлозу подвергают гидролизу с образованием глюкозы, которую далее подвергают брожению, и получают этанол, называемый гидролизным спиртом.
3) В промышленности метанол получают характерным только для него способом при взаимодействии водорода с угарным газом (СО) при повышенном давлении и высокой температуре в присутствии катализатора:
Смесь угарного газа и водорода, взятых в количественном соотношении 1 : 2, называют синтез-газом.
Историческое название метанола — древесный спирт. Оно указывает на старый способ получения спирта — сухую перегонку древесины твердых пород дерева (нагревание древесины без доступа воздуха).
Для получения спиртов в лаборатории используют галогеналканы.
При гидролизе моногалогеналканов с галогеном при первичном атоме углерода в водных растворах щелочей при нагревании образуются первичные спирты:
Гидролиз галогеналканов, проводимый в присутствии щелочи, является практически необратимым процессом и используется как общий метод получения первичных насыщенных спиртов в лаборатории.
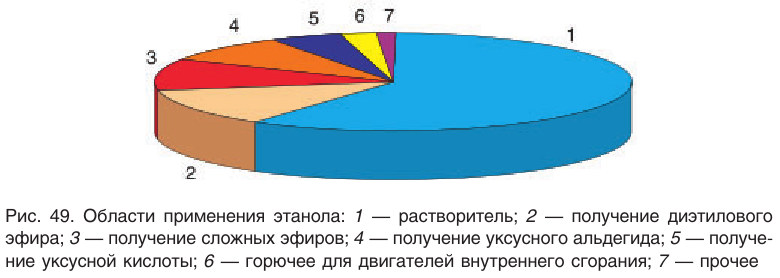
Применение: Спирты находят широкое применение. В химической промышленности спирты — исходные вещества для разнообразных синтезов. Во многих производствах спирты применяют в качестве растворителей. Рассмотрим несколько примеров промышленного использования важнейших насыщенных одноатомных спиртов.
Метанол (метиловый спирт) 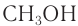
Метанол — прекрасный растворитель для многих органических и неорганических веществ.
Необходимо знать, что метанол — сильнейший яд. Употребление даже нескольких граммов метанола приводит к слепоте, а затем и смерти. Вот поэтому на банках, в которых хранится этот спирт, используемый для технических нужд, имеется надпись: «Метанол — яд». Это должно служить серьезным предостережением при работе с ним.
Этанол (этиловый спирт) 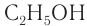
Этанол является исходным веществом в промышленном органическом синтезе (диэтиловый эфир, этилацетат и другие эфиры и т. д.), окислением этанола получают пищевую уксусную кислоту.
Спирт-ректификат, получаемый в промышленности, представляет собой смесь этанола (массовая доля 95,6 %) и воды (массовая доля 4,4 %). Безводный спирт называют абсолютным спиртом.
Следует помнить, что этанол — своего рода наркотик, возбуждающе действующий на организм человека. Даже небольшие дозы снижают остроту зрения, замедляют реакции и уменьшают способность здраво рассуждать. Длительное употребление спирта вызывает тяжелые заболевания нервной и сердечно-сосудистой систем, разрушение печени и приводит к преждевременной смерти.
В этанол, применяемый для технических целей, специально добавляют небольшие количества трудноотделяемых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатуратом. Употребление денатурата смертельно опасно.
Другие (низшие) спирты используются в качестве растворителей при изготовлении различных лаков и красок на предприятиях лакокрасочной промышленности, одним из которых является ОАО «Лакокраска» в Лиде.
Высшие спирты (
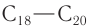


Ненасыщенный аллиловый спирт 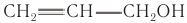
В промышленном масштабе этанол получают гидратацией этена, гидролизным способом, в процессе спиртового брожения глюкозы.
Метанол в промышленных масштабах в основном получают из синтез-газа.
В лаборатории первичные насыщенные одноатомные спирты получают в процессе щелочного гидролиза моногалогеналканов.
Спирты используют для синтеза многих органических веществ.
Решение расчетных задач
В параграфе рассмотрены образцы решения задач таких типов, как расчеты по химическим уравнениям, если одно из реагирующих веществ взято в избытке, и определение молекулярных формул органических веществ на основании качественного и количественного состава.
Пример 1.
Определите массу бромэтана, полученного в реакции, для которой был взят этанол массой 5,98 г и бромоводород объемом (н. у.)
Решение
1. Общие формулы, используемые при расчетах:
2. Значения молярных масс веществ, молярный объем:
3. Определяем химические количества спирта и бромоводорода, взятых для реакции:
4. На основе анализа уравнения реакции определяем, какое из веществ взято в избытке, а затем рассчитываем химическое количество и массу продукта реакции:
Следовательно, спирт взят в избытке. Расчеты продукта реакции проводятся исходя из данных о химическом количестве хлороводорода:
Ответ:
Пример 2.
Массовая доля углерода в насыщенном одноатомном спирте равна 0,6. Определите молекулярную формулу спирта. Составьте структурные формулы возможных изомеров и назовите их по номенклатуре ИЮПАК.
Решение
1. Для решения задачи используем общую формулу 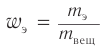
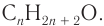
2. Определяем формулу искомого спирта.
Общая формула 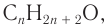
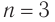
Изомеры:
Ответ:
Пример 3.
В результате ряда последовательных реакций из алкана массой 69,6 г получен первичный насыщенный одноатомный спирт массой 88,8 г с тем же числом атомов углерода в молекуле, что и у алкана (алкан 

Решение
1. Из алкана химическим количеством 1 моль получают спирт химическим количеством 1 моль:
2. Разница масс взятого и полученного веществ равна 19,2 г (88,8 — 69,6). Разница молярных масс спирта и алкана равна 16, что хорошо видно при анализе общих формул алканов и насыщенных одноатомных спиртов:
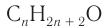
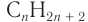
3. Используя общую формулу 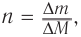
4. Зная химическое количество и массу спирта, определяем его молярную массу и молекулярную формулу:
Решая уравнение
Следовательно, молекулярная формула спирта — 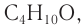
Ответ:
Пример 4.
При гидратации алкена массой 22,68 г получили вторичный насыщенный одноатомный спирт массой 32,40 г. Определите молекулярную формулу спирта, составьте структурную формулу и назовите спирт по номенклатуре ИЮПАК.
Решение
1. Анализ уравнения реакции гидратации, записанного в общем виде, показывает, что для гидратации алкена химическим количеством 1 моль требуется вода химическим количеством 1 моль. Следовательно, разница масс алкена и спирта и есть масса присоединенной воды:
2. Определяем химическое количество воды и спирта, далее молярную массу и молекулярную формулу спирта:
Следовательно,
Решая уравнение 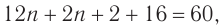
Молекулярная формула спирта — 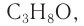
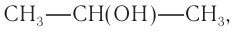
Ответ:
Пример 5.
Определите молекулярную формулу органического вещества, относительная плотность паров которого по гелию равна 22, если при сгорании его массой 19,36 г образовались углекислый газ объемом (н. у.) 2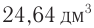
Решение
1. Определяем молярную массу неизвестного вещества, его химическое количество, а также химические количества образовавшихся оксида углерода (IV) и воды:
2. Проанализируем схему реакции горения вещества, предположив, что сожгли углеводород химическим количеством 1 моль. На основе данных о продуктах реакции рассчитаем количественный состав вещества:
Формула вещества —
3. Молярная масса вещества 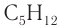
Ответ:
Многоатомные спирты
Строение: Производные углеводородов, в молекулах которых два и более атомов водорода у соседних атомов углерода замещены на гидроксильные группы, называют многоатомными спиртами.
Гидроксильные группы во всех устойчивых многоатомных спиртах связаны с соседними атомами углерода.
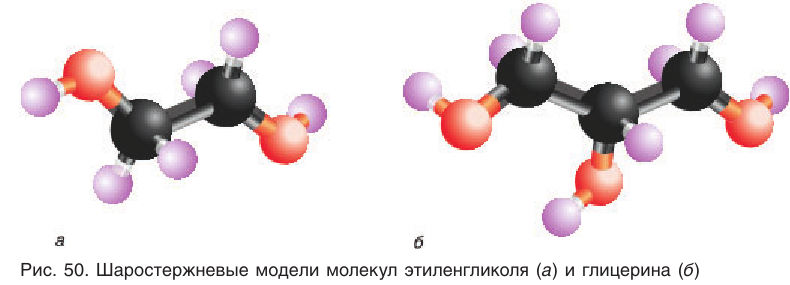
Простейшим представителем двухатомных спиртов (гликолей) является этиленгликоль, структурная формула которого:
Шаростержневая модель молекулы этиленгликоля приведена на рисунке 50, а.
Простейшим представителем трехатомных спиртов (глицеринов) является глицерин (от греч. glykeros — сладкий), структурная формула которого:
Шаростержневая модель молекулы глицерина приведена на рисунке 50, б.
На примере этих двух спиртов вы познакомитесь с основными характеристиками многоатомных спиртов.
Номенклатура: По номенклатуре ИЮНАК двухатомный спирт 
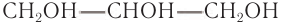
Физические свойства: Этиленгликоль и глицерин — бесцветные вязкие жидкости, тяжелее воды, неограниченно растворимы в воде, хорошо растворяются в этаноле. Эти свойства присущи и другим многоатомным спиртам.
Этиленгликоль ядовит, его водные растворы не кристаллизуются при низких температурах, что позволяет применять его как компонент незамерзающих жидкостей — антифризов. Глицерин имеет сладковатый вкус, гигроскопичен, нелетуч.
Впервые глицерин был получен из оливкового масла шведским химиком и фармацевтом К. Шееле в 1783 г.
Хорошая растворимость этиленгликоля и глицерина в воде объясняется наличием межмолекулярных водородных связей между молекулами спиртов и воды. Число таких связей больше, чем у одноатомных спиртов, из-за большего числа гидроксильных групп в молекулах.
Температуры кипения этих спиртов по сравнению с одноатомными спиртами с таким же числом атомов угелерода в молекуле намного выше:
Причиной более высоких температур кипения многоатомных спиртов является большее число межмолекулярных водородных связей между молекулами спиртов за счет большего числа гидроксильных групп в составе молекул.
Химические свойства: Для этиленгликоля и глицерина характерны все реакции одноатомных спиртов, обусловленные наличием функциональной группы —ОН, и особые свойства, обусловленные одновременным присутствием в молекуле нескольких гидроксильных групп.
1) Взаимодействие со щелочными металлами. Многоатомные спирты реагируют с активными металлами с образованием соединений, которые по аналогии с алкоголятами называют гликолятами и глицератами. Названия «гликоляты» и «глицераты» допускаются в номенклатуре ИЮНАК.
В реакциях могут участвовать одна или более гидроксильных групп. Многоатомные спирты, как и одноатомные, проявляют кислотные свойства в реакциях со щелочными металлами.
2) Взаимодействие с основаниями. В отличие от одноатомных спиртов, этиленгликоль и глицерин реагируют не только со щелочными металлами, но и с нерастворимыми гидроксидами тяжелых металлов. Такие реакции возможны для многоатомных спиртов, потому что из-за взаимного влияния гидроксильных групп в молекуле их кислотность выше, чем у одноатомных спиртов.
Если в стакан с раствором щелочи добавить несколько капель раствора сульфата меди(II) и к образовавшемуся гидроксиду меди(II) прилить многоатомный спирт, например глицерин, то образуется прозрачный раствор ярко-синего цвета (рис. 51). Цвет раствора обусловлен образованием комплексного соединения меди.
Реакция со свежеприготовленным гидроксидом меди(II) является качественной реакцией на многоатомные спирты с гидроксильными группами, находящимися у соседних атомов углерода. Из-за сложности строения образовавшегося глицерата меди уравнение реакции не приводится.
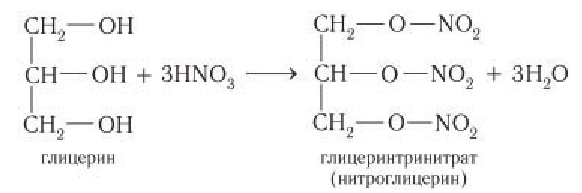
3) Образование сложных эфиров. Для многоатомных спиртов, как и для одноатомных, характерно образование сложных эфиров при взаимодействии с кислородсодержащими минеральными кислотами и карбоновыми кислотами. В частности, в реакции глицерина с избытком азотной кислоты в присутствии каталитических количеств серной кислоты образуется глицеринтринитрат, известный под названием нитроглицерин:
Название «нитроглицерин» относится к тривиальным названиям, оно не отражает строение вещества. Известно, что в химии к нитросоединениям относят вещества, в которых группа —
Реакцию глицерина с карбоновыми кислотами е образованием сложных эфиров вы будете рассматривать при изучении темы «Жиры».
Получение: Двухатомные и трехатомные спирты можно получать теми же способами, что и одноатомные спирты. В качестве исходных веществ используются алкены и галогеналканы.
Лабораторные способы: Общим способом получения гликолей является окисление алкенов раствором перманганата калия в слабощелочной или нейтральной среде:
Этиленмиколь также получают гидролизом соответствующего дигалогеналкана:
Промышленные способы. Глицерин получают в процессе гидролиза жиров и синтетическим способом из пропена, образующегося при крекинге нефтепродуктов.
Этиленгликоль в промышленных масштабах получают гидратацией эпоксида 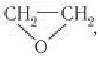
Применение: Этиленгликоль используют для синтеза полимерных материалов, синтетических волокон, например лавсана; в качестве антифризов (от анти — против и англ. freeze — морозить, замерзать) — жидкостей, добавляемых в воду, чтобы понизить температуру замерзания. Антифризы заливаются в системы охлаждения, в частности автомобильных двигателей. Температура замерзания антифриза с объемной долей этиленгликоля 52,5 % равна -40 °С. Этиленгликоль применяют для получения пластификаторов (смягчителей), используемых в лакокрасочной промышленности.
Применение глицерина основано на его гигроскопичности. Его используют для приготовления мазей, в кожевенном производстве — для предохранения кож от высыхания, в текстильной промышленности — для отделки тканей с целью придания им мягкости и эластичности и др. Глицерин применяют при изготовлении косметики, где он играет роль смягчающего и успокаивающего средства; как добавку к зубной пасте, клеям, чтобы предохранить их от быстрого высыхания; для приготовления антифризов.
Незамерзание клеточной жидкости иногда объясняют усиленной выработкой глицерина в растительных клетках.
Большое количество глицерина идет на получение нитроглицерина, который служит сырьем при производстве бездымных порохов и динамита.
Нитроглицерин токсичен, но в малых дозах используется как лечебное средство, так как расширяет кровеносные сосуды сердечной мышцы и тем самым улучшает кровоснабжение сердца.
Многоатомными спиртами называют производные углеводородов, в молекулах которых содержится несколько гидроксильных групп, связанных с соседними атомами углерода.
Многоатомные спирты взаимодействуют с активными металлами, щелочами, гидроксидами тяжелых металлов, кислородсодержащими неорганическими кислотами и карбоновыми кислотами.
Реакция с гидроксидом меди(II) используется для качественного обнаружения многоатомных спиртов.
Этиленгликоль применяют для получения синтетического волокна лавсан, в качестве антифриза; глицерин используется во многих отраслях промышленности.
- Фенолы в химии
- Альдегиды в химии
- Карбоновые кислоты в химии
- Сложные эфиры в химии
- Теория химического строения органических соединений А. М. Бутлерова
- Насыщенные углеводороды
- Ненасыщенные углеводороды
- Ароматические углеводороды