1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Содержание
- Молочная кислота: история и влияние на организм человека
- История открытия молочной кислоты
- Основные свойства молочной кислоты
- Химические и физические свойства молочной кислоты
- Получение молочной кислоты
- Влияние молочной кислоты на человека
- Воздействие молочной кислоты на организм
- Молочная кислота и спорт
- СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ Российский патент 2000 года по МПК C12P7/56
- Описание патента на изобретение RU2149188C1
- Похожие патенты RU2149188C1
- Иллюстрации к изобретению RU 2 149 188 C1
- Реферат патента 2000 года СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ
- Формула изобретения RU 2 149 188 C1
Молочная кислота: история и влияние на организм человека
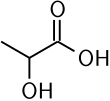
Молочная кислота — еще один вид карбоновых кислот, органическое соединение, содержащее гидроксильную группу, а также три атома углерода.
История открытия молочной кислоты
В 1780 году в Швеции химиком-фармацевтом Карлом Шееле была получена молочная кислота. В своей работе Шееле выделил молочную кислоту в виде коричневого сиропа из прокисшего молока. Позже французский химик-фармацевт Анри Браконно подтвердил, что молочная кислота образуется при молочнокислом брожении.
Дальнейшую эстафету по нахождению молочной кислоты подхватил шведский химик-минералог Йенс Якоб Берцелиус, который в 1807 году выделил цинковую соль молочной кислоты находящуюся в мышцах.
В Советском Союзе разработки по получению молочной кислоты осуществлялись в 1930 году и были очень успешными. Советским ученым, осуществляющим поиски на основе уже имеющихся работ Сергея Костычева и Владимира Буткевича, удалось получить молочную кислоту высшего качества. Такую молочную кислоту называют фармакопейной за особую чистоту и использование в фармацевтике. Она не содержит (или содержит минимальные) следы железа, в ее производстве применяется аппаратура из углеродистой стали только с дополнительной защитой.
Советские ученые получали фармакопейную молочную кислоту методом дистилляции перегретым паром с последующей ректификацией в медных аппаратах покрытых изнутри серебром. Сборники для уже готовой молочной кислоты высшего качества использовали чугунные, но покрытые эмалью.
Основные свойства молочной кислоты
Химические и физические свойства молочной кислоты
| Химическая формула | CH3CH(OH)COOH |
| Рациональная формула | C3H6O3 |
| Молярная масса | 90,08 г/моль |
| Плотность | 1,225 г/см³ |
Молочная кислота является карбоновой кислотой, обладает свойствами хиральных кислот, позволяющей молекуле молочной кислоты не совмещаться в пространстве с собственным зеркальным отражением. Химические соединения этой кислоты, представляющие зеркальные отражения друг друга существуют в плюсе и минусе. Трудности с определением температуры плавления молочной кислоты обусловлены высокой способностью поглощать водяные пары из воздуха, в связи с чем температуру плавления принято указывать в диапазоне 18 до 33°С.
Молочная кислота растворима в воде, спирте, эфире, органических растворителях. Не растворима в бензоле, хлороформе. При окислении превращается в другие виды кислот: муравьиную, уксусную, щавелевую, пировиноградную.
Получение молочной кислоты
Существует два основных способа получения молочной кислоты.
Ферментативный способ заключается в обработке углеродного сырья (глюкозы, кукурузного сиропа, мелассы, сока сахарной свёклы, крахмала) с необходимыми микроорганизмами и питательными веществами (пептидами и аминокислотами, фосфатами, солями аммония и витаминами), а также гидроксидом кальция, карбонатом кальция, аммиаком, гидроксидом натрия, — для поддержания необходимого pH.
Данный вид получения молочной кислоты гарантирует получение более чистого продукта. Именно таким способом получают молочную кислоту для фармацевтической отрасли. В процессе очистки такой молочной кислоты побочными продуктами становятся уксусная и муравьиная кислота.
Молочную кислоту как рецемат производят синтетическим способом. Так кислоту получают при помощи органических соединений класса альдегидов с синильной кислотой, а также через гидролиз с получением лактонитрила.
Влияние молочной кислоты на человека
Воздействие молочной кислоты на организм
Молочная кислота содержится в человеческом организме и играет важную роль в:
- Обмене веществ
- Работе мышц
- Функционировании нервной системы
- Работе мозга
Среди пищевых продуктов, молочная кислота известна как регулятор кислотности E270. Подробнее про пищевую добавку можно узнать в соответствующей статье.
Тяжелые физические нагрузки на человеческий организм приводят к расщеплению глюкозы и образованию аденозинтрифосфорной и молочной кислоты. Такой процесс важен для сердечной мышцы. Кроме того, обратный процесс окисления молочной кислоты важен при образовании глюкозы обеспечивающей необходимую энергию человеческому организму. Глюкоза питает мозг и нервную систему. А ее расщепление важный показатель для производства АТФ, который влияет на сокращение мышц при физических нагрузках.
По определенным значениям содержания молочной кислоты в организме человека принято судить о содержании кислорода в человеческом организме. Ее превышение может говорить о кислородном дефиците, сахарном диабете, болезнях печени. Однако увеличение количества молочной кислоты в организме человека может быть обусловлено возрастом и тяжелыми физическими нагрузками.
Молочная кислота и спорт
Как уже было написано ранее, молочная кислота является источником энергии. Ее производство во время тренировочных процессов способствует накоплению мышечной массы. Однако известным фактом является и то, что молочная кислота вызывает неприятные ощущения в мышцах. Но именно она является сигналом для сердца распределения крови по телу, а соответственно и кислорода.
Особенно важна молочная кислота для спортсменов, которые достигают результата при помощи многочасовых тренировок: бегунов на длинные дистанции, футболистов, пловцов, велосипедистов и др. Во время тренировки мышцам необходимо много глюкозы, что приводит к повышенному углеводному обмену и выработке молочной кислоты.
Компания «Эверест» предлагает оптовые поставки молочной кислоты со склада в Санкт-Петербурге и Москве. Вы можете купить молочную кислоту по низкой цене оставив заявку или связавшись по телефону: +7 (812) 448-47-55.
Источник
СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ Российский патент 2000 года по МПК C12P7/56
Описание патента на изобретение RU2149188C1
Изобретение относится к пищевой промышленности, а именно к способам получения молочной кислоты на основе микробиологического синтеза.
Известен способ получения молочной кислоты, включающий сбраживание сахаросодержащего раствора, приготовленного из тростникового сахара — сырца, молочнокислыми бактериями Lactobacillus delbriickii штамма БДШ при температуре около 50 o C в присутствии солодовых ростков, нестерильных или прошедших пастеризацию в приготовлении сахаросодержащем растворе при 70 o C, или обработанных 6%-ным раствором молочной кислоты, и нейтрализацию образующейся молочной кислоты углекислым кальцием до достижения уровня титруемой кислотности раствора 0,4 — 0,6%. Наибольшая эффективность сбраживания по этому способу достигается при использовании нестерильных солодовых ростков и характеризуется следующими показателями: содержание лактата кальция в сброженном растворе — 10%, выход молочной кислоты от внесенного сахара — около 83% /1/.
К недостаткам данного способа можно отнести инфицирование сахаросодержащего раствора при внесении нестерильных солодовых ростков, недостаточно высокие технологические показатели процесса брожения.
Известен способ получения молочной кислоты сбраживанием гидролизата крахмала с помощью Lactobacillus delbriickii в присутствии Lactobacillus leichmanni при температуре около 120 o Ф (приблизительно 67 o C) при использовании молока натурального цельного или обезжиренного, или порошкообразного в качестве источника питательных веществ для молочнокислых бактерий. Продолжительность сбраживания по этому способу составляет 6-7 суток /2/.
Недостатками этого способа являются достаточно высокие энергозатраты для обеспечения температуры брожения и использование дорогостоящего молока.
Наиболее близким к предлагаемому является способ получения молочной кислоты, предусматривающий сбраживание сахаросодержащего раствора, приготовленного из смеси тростникового сахара-сырца, рафинадной патоки и свекловичной мелассы, молочнокислыми бактериями Lactobacillus delbriickii штамма Л-3 при температуре 48-50 o C в присутствии нестерильных солодовых ростков и нейтрализацию образующейся молочной кислоты мелом для поддержания титруемой кислотности сброженного раствора на уровне 0,3 — 0,4%. Основные показатели процесса сбраживания сахаросодержащего раствора по этому способу следующие: среднесуточное накопление лактата кальция — 1,5%, продолжительность процесса — 6-8 суток, выход молочной кислоты от введенного сахара — около 85% /3/.
К недостаткам прототипа можно отнести использование нестерильных солодовых ростков при приготовлении питательной среды, а также недостаточно высокие показатели процесса брожения.
Техническим результатом предлагаемого изобретения является повышение выхода молочной кислоты и среднесуточного накопления лактата кальция в процессе сбраживания при использовании отечественного сахаросодержащего сырья.
Указанный технический результат достигается тем, что в известном способе получения молочной кислоты, включающем сбраживание сахаросодержащего раствора молочнокислыми бактериями Lactobacillus delbruckii в присутствии солодовых ростков и нейтрализацию образующейся молочной кислоты, питательную среду готовят из смеси сахара-песка и гидролизата крахмала в соотношении от 60:40 до 40: 60 мас% по внесенному количеству редуцирующих сахаров и из солодовых ростков, обработанных раствором молочной кислоты концентрацией 0,8 — 1,0%, а при нейтрализации поддерживают титруемую кислотность на уровне 0,7 — 1,0%.
Способ осуществляют следующим образом.
Для приготовления питательной среды предварительно готовят сахаросодержащий раствор концентрацией 10-13% из сахара — песка (ГОСТ 21-94) и гидролизата крахмала (ГОСТ 24583-81), затем в соответствии с действующей технологической инструкцией по производству молочной кислоты (ТИ 18-8-1-83) /4/ раствор нагревают до 85-90 o C, выдерживают не менее 1 ч и охлаждают до 48-50 o C.
Солодовые ростки погружают в раствор молочной кислоты указанной в способе концентрации, выдерживают в течение 0,5 — 2,0 ч при 48-50 o C. Обработанные солодовые ростки вводят в подготовленный сахаросодержащий раствор.
Полученную питательную среду засевают культурой молочнокислых бактерий Lactobacillus delbruckii штамма Л-3, проводят сбраживание при температуре 48-50 o C, нейтрализуют образующуюся молочную кислоту мелом для поддержания титруемой кислотности сбраживаемой среды на определенном уровне.
В примерах 1-4 приведены данные, подтверждающие возможность осуществления предлагаемого способа получения молочной кислоты.
Пример 1
Сбраживание сахаросодержащего раствора, состоящего из сахара-песка для промышленной переработки (ГОСТ 21-94) и гидролизата крахмала, молочнокислыми бактериями проводили периодическим методом в аппаратах вместимостью 1 л при температуре 48-50 o C. В процессе молочнокислого брожения осуществляли нейтрализацию образующейся молочной кислоты мелом.
Сахаросодержащий раствор (1 л), приготовленный из 72 г сахара-песка и 120 г гидролизата крахмала (48 г редуцирующих сахаров) в соотношении по внесенному количеству редуцирующих сахаров 60:40, нагревали до 90 o C, охлаждали до 50 o C. Солодовые ростки (20 г) обрабатывали 0,8%-ным раствором молочной кислоты, выдерживали в течение 2 ч при 50 o C и вносили в подготовленный сахаросодержащий раствор. В полученную питательную среду вносили закваску молочнокислых бактерий (100 г), содержащую 3,1 г лактата кальция, 4,3 г редуцирующих сахаров и 1,6 г молочной кислоты.
В процессе брожения титруемую кислотность поддерживали на уровне 0,7%.
Сброженный раствор содержал лактата кальция — 13%, редуцирующих сахаров — 0,3%, молочной кислоты — 0,7%.
Показатели процесса молочнокислого брожения следующие: среднесуточное накопление лактата кальция — 2,2%; продолжительность — 144 ч (6 суток); выход молочной кислоты от введенного сахара — 88,5%.
Пример 2
Сбраживание сахаросодержащего раствора проводили аналогично описанному в примере 1.
Приготовление питательной среды, включающей сахаросодержащий раствор из 48 г сахара-песка и 180 г гидролизата крахмала (72 г редуцирующих сахаров) в соотношении 40: 60 по внесенному количеству редуцирующих сахаров, солодовые ростки, обработанные 1,0%-ным раствором молочной кислоты, проводили аналогично описанному в примере 1.
В процессе брожения титруемую кислотность поддерживали на уровне 1,0%.
Сброженный раствор содержал 12,3% лактата кальция, 0,4% редуцирующих сахаров, 1,0% молочной кислоты.
Показатели процесса следующие: среднесуточное накопление лактата кальция — 2,0%; продолжительность — 158 ч (6,6 суток); выход молочной кислоты от введенного сахара — 86,4%.
Пример 3
Сбраживание сахаросодержащего раствора проводили аналогично описанному в примере 1.
Приготовление питательной среды, включающей сахаросодержащий раствор из 36 г сахара-песка и 210 г гидролизата крахмала (84 г редуцирующих сахаров) в соотношении 30: 70 по внесенному количеству редуцирующих сахаров, солодовые ростки, обработанные 1,6%-ным раствором молочной кислоты, проводили так же, как в примере 1.
В процессе брожения титруемую кислотность поддерживали на уровне 0,6%.
Сброженный раствор содержал 12,0% лактата кальция, 0,4% редуцирующих сахаров 0,6%, молочной кислоты.
Показатели процесса молочнокислого брожения следующие: среднесуточное накопление лактата кальция — 1,4%; продолжительность — 210 ч (8,8 суток); выход молочной кислоты от введенного сахара — 81,1%.
Пример 4
Сбраживание сахаросодержащего раствора проводили аналогично примеру 1.
Приготовление питательной среды, включающей сахаросодержащий раствор из 72 г сахара-песка и 120 г гидролизата крахмала (48 г редуцирующих сахаров) в соотношении 60: 40 по внесенному количеству редуцирующих сахаров, солодовые ростки, обработанные 1,2%-ным раствором молочной кислоты, проводили как в примере 1.
Титруемую кислотность в процессе брожения поддерживали на уровне 1,2%.
Сброженный раствор содержал 11,7% лактата кальция, 0,4% редуцирующих сахаров и 1,2% молочной кислоты.
Показатели процесса молочнокислого брожения следующие: среднесуточное накопление лактата кальция — 1,7%; продолжительность — 180 ч (7,5 суток); выход молочной кислоты от введенного сахара — 84,0%.
Пример 5 (по прототипу)
Аналогичен примеру 1, но в питательную среду (1 л) входит сахаросодержащий раствор, приготовленный из 87,5 г сахара-сырца, 46,2 г рафинадной патоки, 26,7 г свекловичной мелассы, содержащих соответственно 84, 24 и 12 г редуцирующих сахаров в соотношении 70:20:10, и 20 г нестерильных солодовых ростков.
Титруемую кислотность в процессе брожения поддерживали на уровне 0,3 — 0,4%.
Сброженный раствор содержал 12,8% лактата кальция, 0,4% редуцирующих сахаров и 0,4% молочной кислоты.
Показатели процесса сбраживания сахаросодержащего раствора следующие: среднесуточное накопление лактата кальция — 1,5%, продолжительность — 197 г (8,2 суток), выход молочной кислоты от введенного сахара — 84,8%.
Результаты опытов, приведенных в примерах, представлены в таблице.
Ведение процесса молочнокислого брожения с использованием питательной среды, включающей сахар-песок и гидролизует крахмала в соотношении по введенному сахару от 40: 60 до 60:40, солодовые ростки, обработанные 0,8 — 1,0%-ным раствором молочной кислоты, а также с поддержанием титруемой кислотности при нейтрализации образующейся молочной кислоты мелом на уровне 0,7 — 1,0%, позволяет повысить эффективность процесса по сравнению с прототипом: сократить продолжительность процесса на 39-53 ч; увеличить выход молочной кислоты от введенного сахара на 1,6 — 3,7% и среднесуточное накопление лактата кальция на 0,5 — 0,7%. Это обеспечивается благоприятными условиями для поддержания продуцента в активном физиологическом состоянии с максимальной способностью биосинтеза молочной кислоты.
Осуществление процесса сбраживания среды, в состав которой входит по количеству редуцирующих веществ менее 40% сахара-песка и более 60% гидролиза крахмала, а также солодовые ростки, обработанные раствором молочной кислоты концентрацией более 1,0%, при поддержании уровня титруемой кислотности выше 1,0% приводит к подавлению жизнедеятельности молочнокислых бактерий, в результате чего снижаются основные технологические показатели процесса.
При использовании среды, содержащей более 60% сахара-песка и менее 40% гидролизата крахмала по внесенному сахару, а также солодовые ростки, обработанные раствором молочной кислоты концентрацией менее 0,8%, и поддержании титруемой кислотности в процессе нейтрализации на уровне, не достигшем 0,7%, снижаются кислотообразующая активность продуцента, создаются условия для развития посторонних микроорганизмов, что приводит к снижению показателей процесса молочнокислого брожения.
Источники информации
1. Голубчина Р.Н., Никулина И.Д., Бондаренко А.Н., Смирнов В.А. Рациональное использование солодовых ростков в производстве молочной кислоты // Хлебопекарная и кондитерская промышленность. — 1971. — N 12. с.24-25.
2. Патент США 2143358, НКИ 195-48. Lactic Acid Fermentation Process /James F. Walsh, Haskell C. Needle (США). Заявл. 27.07.37 N 155925, опубл. 10.01.39.
3. Смирнов В.А. Пищевые кислоты. — М.: Легкая и пищевая промышленность, 1983. — 264 с.
4. ТИ 18-8-1-83. Технологическая инструкция по производству пищевой молочной кислоты. Взамен Технол. инструкции по произв. пищевой молочной кислоты, 1963; введ. 01.07.83. — Л., 1983. — 48 с.
Похожие патенты RU2149188C1
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ | 2005 |
|
RU2306340C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОРМОВОЙ ДОБАВКИ | 1991 |
|
RU2032358C1 |
| ШТАММ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ LACTOBACILLUS DELBRUECKII — ПРОДУЦЕНТ МОЛОЧНОЙ КИСЛОТЫ | 2004 |
|
RU2283345C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ | 1986 |
|
RU1381989C |
| СПОСОБ ИЗГОТОВЛЕНИЯ ГИПСОВОЛОКНИСТЫХ ИЗДЕЛИЙ | 1994 |
|
RU2095328C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ | 1990 |
|
RU1767878C |
| СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ | 1984 |
|
RU1243354C |
| СПОСОБ ПОЛУЧЕНИЯ ОСНОВЫ ДЛЯ ИЗГОТОВЛЕНИЯ АРОМАТИЗАТОРА С АРОМАТОМ РЫБЫ | 1999 |
|
RU2165152C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИМОННОЙ КИСЛОТЫ | 1999 |
|
RU2159286C1 |
| СПОСОБ КОНСЕРВИРОВАНИЯ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ Lactobacillus delbrueckii | 2011 |
|
RU2475527C1 |
Иллюстрации к изобретению RU 2 149 188 C1
Реферат патента 2000 года СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ
Изобретение относится к технологии получения молочной кислоты на основе микробиологического синтеза. Молочную кислоту получают сбраживанием смеси сахара-песка и гидролизата крахмала в соотношении от 60:40 до 40:60 мас.% по внесенному сахару в присутствии обработанных молочной кислотой солодовых ростков. Уровень титруемой кислотности поддерживают от 0,7 до 1,0%. Способ позволяет увеличить показатели процесса сбраживания: среднесуточное накопление лактата кальция до 2,0 — 2,2%, выход молочной кислоты от внесенного сахара до 86,4-88,5%. 1 табл.
Формула изобретения RU 2 149 188 C1
Способ получения молочной кислоты, включающий сбраживание сахаросодержащей питательной среды молочнокислыми бактериями Lactobacillus delbruckii в присутствии солодовых ростков и нейтрализацию образующейся молочной кислоты, отличающийся тем, что питательную среду готовят из смеси сахара-песка и гидролизата крахмала в соотношении от 60 : 40 до 40 : 60 мас.% по внесенному количеству редуцирующих сахаров и из солодовых ростков, обработанных раствором молочной кислоты концентрацией 0,8 — 1,0%, а при нейтрализации поддерживают титруемую кислотность на уровне 0,7 — 1,0%.
Источник
Задать вопрос
Задать вопрос
Ваш вопрос
Вопрос должен состоять из 4 и более символов (не считая знаков препинания)
Подробное описание
Можно ввести 4000 cимволов
Темы
Темы обязательны для заполнения
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
Выберите причину жалобы и оставьте комментарий
Содержит грамматические или орфографические ошибкиСпамНе соответствует тематике сайтаНарушает закон РФМожет показаться обиднымНеверно указана темаПлохо сформулированДругое
Опишите, пожалуйста, подробно причину для более быстрой
обработки вашей жалобы:
Можно ввести 4000 cимволов
E-mail для обратной связи
Отправить
Нажимая кнопку «Отправить», вы принимаете условия пользовательского соглашения
Спасибо
Ваша заявка будет рассмотрена в течение 5 рабочих дней.
From Wikipedia, the free encyclopedia
|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
2-Hydroxypropanoic acid[1] |
||
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
|
Beilstein Reference |
1720251 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.000.017 |
|
| EC Number |
|
|
| E number | E270 (preservatives) | |
|
Gmelin Reference |
362717 | |
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 3265 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
C3H6O3 | |
| Molar mass | 90.078 g·mol−1 | |
| Melting point | 18 °C (64 °F; 291 K) | |
| Boiling point | 122 °C (252 °F; 395 K) at 15 mmHg | |
|
Solubility in water |
Miscible[2] | |
| Acidity (pKa) | 3.86,[3] 15.1[4] | |
| Thermochemistry | ||
|
Std enthalpy of |
1361.9 kJ/mol, 325.5 kcal/mol, 15.1 kJ/g, 3.61 kcal/g | |
| Pharmacology | ||
|
ATC code |
G01AD01 (WHO) QP53AG02 (WHO) | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 [5] [5]
|
|
|
Hazard statements |
H315, H318[5] | |
|
Precautionary statements |
P280, P305+P351+P338[5] | |
| Related compounds | ||
|
Other anions |
Lactate | |
|
Related carboxylic acids |
|
|
|
Related compounds |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Lactic acid is an organic acid. It has a molecular formula CH3CH(OH)COOH. It is white in the solid state and it is miscible with water.[2] When in the dissolved state, it forms a colorless solution. Production includes both artificial synthesis as well as natural sources. Lactic acid is an alpha-hydroxy acid (AHA) due to the presence of a hydroxyl group adjacent to the carboxyl group. It is used as a synthetic intermediate in many organic synthesis industries and in various biochemical industries. The conjugate base of lactic acid is called lactate (or the lactate anion). The name of the derived acyl group is lactoyl.
In solution, it can ionize by loss of a proton to produce the lactate ion CH
3CH(OH)CO−
2. Compared to acetic acid, its pKa is 1 unit less, meaning lactic acid is ten times more acidic than acetic acid. This higher acidity is the consequence of the intramolecular hydrogen bonding between the α-hydroxyl and the carboxylate group.
Lactic acid is chiral, consisting of two enantiomers. One is known as L-lactic acid, (S)-lactic acid, or (+)-lactic acid, and the other, its mirror image, is D-lactic acid, (R)-lactic acid, or (−)-lactic acid. A mixture of the two in equal amounts is called DL-lactic acid, or racemic lactic acid. Lactic acid is hygroscopic. DL-Lactic acid is miscible with water and with ethanol above its melting point, which is about 16 to 18 °C (61 to 64 °F). D-Lactic acid and L-lactic acid have a higher melting point. Lactic acid produced by fermentation of milk is often racemic, although certain species of bacteria produce solely D-lactic acid.[citation needed] On the other hand, lactic acid produced by anaerobic respiration in animal muscles has the (L) enantiomer and is sometimes called «sarcolactic» acid, from the Greek sarx, meaning «flesh».
In animals, L-lactate is constantly produced from pyruvate via the enzyme lactate dehydrogenase (LDH) in a process of fermentation during normal metabolism and exercise.[6] It does not increase in concentration until the rate of lactate production exceeds the rate of lactate removal, which is governed by a number of factors, including monocarboxylate transporters, concentration and isoform of LDH, and oxidative capacity of tissues.[6] The concentration of blood lactate is usually 1–2 mM at rest, but can rise to over 20 mM during intense exertion and as high as 25 mM afterward.[7][8] In addition to other biological roles, L-lactic acid is the primary endogenous agonist of hydroxycarboxylic acid receptor 1 (HCA1), which is a Gi/o-coupled G protein-coupled receptor (GPCR).[9][10]
In industry, lactic acid fermentation is performed by lactic acid bacteria, which convert simple carbohydrates such as glucose, sucrose, or galactose to lactic acid. These bacteria can also grow in the mouth; the acid they produce is responsible for the tooth decay known as caries.[11][12][13][14] In medicine, lactate is one of the main components of lactated Ringer’s solution and Hartmann’s solution. These intravenous fluids consist of sodium and potassium cations along with lactate and chloride anions in solution with distilled water, generally in concentrations isotonic with human blood. It is most commonly used for fluid resuscitation after blood loss due to trauma, surgery, or burns.
History[edit]
Swedish chemist Carl Wilhelm Scheele was the first person to isolate lactic acid in 1780 from sour milk.[15] The name reflects the lact- combining form derived from the Latin word lac, meaning «milk». In 1808, Jöns Jacob Berzelius discovered that lactic acid (actually L-lactate) also is produced in muscles during exertion.[16] Its structure was established by Johannes Wislicenus in 1873.
In 1856, the role of Lactobacillus in the synthesis of lactic acid was discovered by Louis Pasteur. This pathway was used commercially by the German pharmacy Boehringer Ingelheim in 1895.
In 2006, global production of lactic acid reached 275,000 tonnes with an average annual growth of 10%.[17]
Production[edit]
Lactic acid is produced industrially by bacterial fermentation of carbohydrates, or by chemical synthesis from acetaldehyde.[18] As of 2009, lactic acid was produced predominantly (70–90%)[19] by fermentation. Production of racemic lactic acid consisting of a 1:1 mixture of D and L stereoisomers, or of mixtures with up to 99.9% L-lactic acid, is possible by microbial fermentation. Industrial scale production of D-lactic acid by fermentation is possible, but much more challenging.
Fermentative production[edit]
Fermented milk products are obtained industrially by fermentation of milk or whey by Lactobacillus bacteria: Lactobacillus acidophilus, Lacticaseibacillus casei (Lactobacillus casei), Lactobacillus delbrueckii subsp. bulgaricus (Lactobacillus bulgaricus), Lactobacillus helveticus, Lactococcus lactis , Bacillus amyloliquefaciens, and Streptococcus salivarius subsp. thermophilus (Streptococcus thermophilus).
As a starting material for industrial production of lactic acid, almost any carbohydrate source containing C
5 (Pentose sugar) and C
6 (Hexose sugar) can be used. Pure sucrose, glucose from starch, raw sugar, and beet juice are frequently used.[20] Lactic acid producing bacteria can be divided in two classes: homofermentative bacteria like Lactobacillus casei and Lactococcus lactis, producing two moles of lactate from one mole of glucose, and heterofermentative species producing one mole of lactate from one mole of glucose as well as carbon dioxide and acetic acid/ethanol.[21]
Chemical production[edit]
Racemic lactic acid is synthesized industrially by reacting acetaldehyde with hydrogen cyanide and hydrolysing the resultant lactonitrile. When hydrolysis is performed by hydrochloric acid, ammonium chloride forms as a by-product; the Japanese company Musashino is one of the last big manufacturers of lactic acid by this route.[22] Synthesis of both racemic and enantiopure lactic acids is also possible from other starting materials (vinyl acetate, glycerol, etc.) by application of catalytic procedures.[23]
Biology[edit]
Molecular biology[edit]
L-Lactic acid is the primary endogenous agonist of hydroxycarboxylic acid receptor 1 (HCA1), a Gi/o-coupled G protein-coupled receptor (GPCR).[9][10]
Exercise and lactate[edit]
During power exercises such as sprinting, when the rate of demand for energy is high, glucose is broken down and oxidized to pyruvate, and lactate is then produced from the pyruvate faster than the body can process it, causing lactate concentrations to rise. The production of lactate is beneficial for NAD+ regeneration (pyruvate is reduced to lactate while NADH is oxidized to NAD+), which is used up in oxidation of glyceraldehyde 3-phosphate during production of pyruvate from glucose, and this ensures that energy production is maintained and exercise can continue. During intense exercise, the respiratory chain cannot keep up with the amount of hydrogen ions that join to form NADH, and cannot regenerate NAD+ quickly enough.
The resulting lactate can be used in two ways:
- Oxidation back to pyruvate by well-oxygenated muscle cells, heart cells, and brain cells
- Pyruvate is then directly used to fuel the Krebs cycle
- Conversion to glucose via gluconeogenesis in the liver and release back into circulation; see Cori cycle[24]
- If blood glucose concentrations are high, the glucose can be used to build up the liver’s glycogen stores.
However, lactate is continually formed at rest and during all exercise intensities. Lactate serves as a metabolic fuel being produced and oxidatively disposed in resting and exercising muscle. Some causes of this are metabolism in red blood cells that lack mitochondria, and limitations resulting from the enzyme activity that occurs in muscle fibers having high glycolytic capacity.[24] Lactic acidosis is a physiological condition characterized by accumulation of lactate (especially L-lactate), with formation of an excessively low pH in the tissues – a form of metabolic acidosis.
Lactic acidosis during exercise may occur due to the H+ from ATP hydrolysis (ATP4− + H2O → ADP3− + HPO2−
4 + H+), and that reducing pyruvate to lactate (pyruvate− + NADH + H+ → lactate− + NAD+) actually consumes H+.[25] The causative factors of the increase in [H+] result from the production of lactate− from a neutral molecule, increasing [H+] to maintain electroneutrality.[26] A contrary view is that lactate− is produced from pyruvate−, which has the same charge. It is pyruvate− production from neutral glucose that generates H+:
| C6H12O6 + 2 NAD+ + 2 ADP3− + 2 HPO2− 4 |
→ | 2 CH 3COCO− 2 + 2 H+ + 2 NADH + 2 ATP4− + 2 H2O |
|
| Subsequent lactate− production absorbs these protons: | |||
| 2 CH 3COCO− 2 + 2 H+ + 2 NADH |
→ | 2 CH 3CH(OH)CO− 2 + 2 NAD+ |
|
| Overall: | |||
| C6H12O6 + 2 NAD+ + 2 ADP3− + 2 HPO2− 4 |
→ | 2 CH 3COCO− 2 + 2 H+ + 2 NADH + 2 ATP4− + 2 H2O |
|
| → | 2 CH 3CH(OH)CO− 2 + 2 NAD+ + 2 ATP4− + 2 H2O |
Although the reaction glucose → 2 lactate− + 2 H+ releases two H+ when viewed on its own, the H+ are absorbed in the production of ATP. On the other hand, the absorbed acidity is released during subsequent hydrolysis of ATP: ATP4− + H2O → ADP3− + HPO2−
4 + H+. So once the use of ATP is included, the overall reaction is
- C6H12O6 → 2 CH
3COCO−
2 + 2 H+
The generation of CO2 during respiration also causes an increase in [H+].
Neural tissue energy source[edit]
Although glucose is usually assumed to be the main energy source for living tissues, there are a few reports that indicate that it is lactate, and not glucose, that is preferentially metabolized by neurons in the brain of several mammalian species (the notable ones being mice, rats, and humans).[27][28][non-primary source needed] According to the lactate-shuttle hypothesis, glial cells are responsible for transforming glucose into lactate, and for providing lactate to the neurons.[29][30] Because of this local metabolic activity of glial cells, the extracellular fluid immediately surrounding neurons strongly differs in composition from the blood or cerebrospinal fluid, being much richer with lactate, as was found in microdialysis studies.[27]
Brain development metabolism[edit]
Some evidence suggests that lactate is important at early stages of development for brain metabolism in prenatal and early postnatal subjects, with lactate at these stages having higher concentrations in body liquids, and being utilized by the brain preferentially over glucose.[27] It was also hypothesized that lactate may exert a strong action over GABAergic networks in the developing brain, making them more inhibitory than it was previously assumed,[31] acting either through better support of metabolites,[27] or alterations in base intracellular pH levels,[32][33] or both.[34]
Studies of brain slices of mice show that β-hydroxybutyrate, lactate, and pyruvate act as oxidative energy substrates, causing an increase in the NAD(P)H oxidation phase, that glucose was insufficient as an energy carrier during intense synaptic activity and, finally, that lactate can be an efficient energy substrate capable of sustaining and enhancing brain aerobic energy metabolism in vitro.[35] The study «provides novel data on biphasic NAD(P)H fluorescence transients, an important physiological response to neural activation that has been reproduced in many studies and that is believed to originate predominantly from activity-induced concentration changes to the cellular NADH pools.»[36]
Lactate can also serve as an important source of energy for other organs, including the heart and liver. During physical activity, up to 60% of the heart muscle’s energy turnover rate derives from lactate oxidation.[15]
Blood testing[edit]
Blood tests for lactate are performed to determine the status of the acid base homeostasis in the body. Blood sampling for this purpose is often arterial (even if it is more difficult than venipuncture), because lactate levels differ substantially between arterial and venous, and the arterial level is more representative for this purpose.
| Lower limit | Upper limit | Unit | |
|---|---|---|---|
| Venous | 4.5[37] | 19.8[37] | mg/dL |
| 0.5[38] | 2.2[38] | mmol/L | |
| Arterial | 4.5[37] | 14.4[37] | mg/dL |
| 0.5[38] | 1.6[38] | mmol/L |
During childbirth, lactate levels in the fetus can be quantified by fetal scalp blood testing.
Uses[edit]
Polymer precursor[edit]
Two molecules of lactic acid can be dehydrated to the lactone lactide. In the presence of catalysts lactide polymerize to either atactic or syndiotactic polylactide (PLA), which are biodegradable polyesters. PLA is an example of a plastic that is not derived from petrochemicals.
Pharmaceutical and cosmetic applications[edit]
Lactic acid is also employed in pharmaceutical technology to produce water-soluble lactates from otherwise-insoluble active ingredients. It finds further use in topical preparations and cosmetics to adjust acidity and for its disinfectant and keratolytic properties.
Lactic acid containing bacteria have shown promise in reducing oxaluria with its descaling properties on calcium compounds.[39]
Foods[edit]
Fermented food[edit]
Lactic acid is found primarily in sour milk products, such as kumis, laban, yogurt, kefir, and some cottage cheeses. The casein in fermented milk is coagulated (curdled) by lactic acid. Lactic acid is also responsible for the sour flavor of sourdough bread.
In lists of nutritional information lactic acid might be included under the term «carbohydrate» (or «carbohydrate by difference») because this often includes everything other than water, protein, fat, ash, and ethanol.[40] If this is the case then the calculated food energy may use the standard 4 kilocalories (17 kJ) per gram that is often used for all carbohydrates. But in some cases lactic acid is ignored in the calculation.[41] The energy density of lactic acid is 362 kilocalories (1,510 kJ) per 100 g.[42]
Some beers (sour beer) purposely contain lactic acid, one such type being Belgian lambics. Most commonly, this is produced naturally by various strains of bacteria. These bacteria ferment sugars into acids, unlike the yeast that ferment sugar into ethanol. After cooling the wort, yeast and bacteria are allowed to «fall» into the open fermenters. Brewers of more common beer styles would ensure that no such bacteria are allowed to enter the fermenter. Other sour styles of beer include Berliner weisse, Flanders red and American wild ale.[43][44]
In winemaking, a bacterial process, natural or controlled, is often used to convert the naturally present malic acid to lactic acid, to reduce the sharpness and for other flavor-related reasons. This malolactic fermentation is undertaken by lactic acid bacteria.
While not normally found in significant quantities in fruit, lactic acid is the primary organic acid in akebia fruit, making up 2.12% of the juice.[45]
Separately added[edit]
As a food additive it is approved for use in the EU,[46] United States[47] and Australia and New Zealand;[48] it is listed by its INS number 270 or as E number E270. Lactic acid is used as a food preservative, curing agent, and flavoring agent.[49] It is an ingredient in processed foods and is used as a decontaminant during meat processing.[50] Lactic acid is produced commercially by fermentation of carbohydrates such as glucose, sucrose, or lactose, or by chemical synthesis.[49] Carbohydrate sources include corn, beets, and cane sugar.[51]
Forgery[edit]
Lactic acid has historically been used to assist with the erasure of inks from official papers to be modified during forgery.[52]
Cleaning products[edit]
Lactic acid is used in some liquid cleaners as a descaling agent for removing hard water deposits such as calcium carbonate, forming the lactate, calcium lactate. Owing to its high acidity, such deposits are eliminated very quickly, especially where boiling water is used, as in kettles. It is used in some antibacterial soaps and dish detergents as a replacement for triclosan.
See also[edit]
- Category: Salts of lactic acid
- Category:Lactate esters
- Acids in wine
- Alanine cycle
- Biodegradable plastic
- Dental caries
- MCT1, a lactate transporter
- Thiolactic acid
- Methacrylic acid
References[edit]
- ^ a b «CHAPTER P-6. Applications to Specific Classes of Compounds». Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 748. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ a b Record in the GESTIS Substance Database of the Institute for Occupational Safety and Health
- ^ Dawson RM, et al. (1959). Data for Biochemical Research. Oxford: Clarendon Press.
- ^ Silva AM, Kong X, Hider RC (October 2009). «Determination of the pKa value of the hydroxyl group in the alpha-hydroxycarboxylates citrate, malate and lactate by 13C NMR: implications for metal coordination in biological systems». Biometals. 22 (5): 771–8. doi:10.1007/s10534-009-9224-5. PMID 19288211. S2CID 11615864.
- ^ a b c Sigma-Aldrich Co., DL-Lactic acid.
- ^ a b Summermatter S, Santos G, Pérez-Schindler J, Handschin C (May 2013). «Skeletal muscle PGC-1α controls whole-body lactate homeostasis through estrogen-related receptor α-dependent activation of LDH B and repression of LDH A». Proceedings of the National Academy of Sciences of the United States of America. 110 (21): 8738–43. Bibcode:2013PNAS..110.8738S. doi:10.1073/pnas.1212976110. PMC 3666691. PMID 23650363.
- ^ «Lactate Profile». UC Davis Health System, Sports Medicine and Sports Performance. Retrieved 23 November 2015.
- ^ Goodwin ML, Harris JE, Hernández A, Gladden LB (July 2007). «Blood lactate measurements and analysis during exercise: a guide for clinicians». Journal of Diabetes Science and Technology. 1 (4): 558–69. doi:10.1177/193229680700100414. PMC 2769631. PMID 19885119.
- ^ a b Offermanns S, Colletti SL, Lovenberg TW, Semple G, Wise A, IJzerman AP (June 2011). «International Union of Basic and Clinical Pharmacology. LXXXII: Nomenclature and Classification of Hydroxy-carboxylic Acid Receptors (GPR81, GPR109A, and GPR109B)». Pharmacological Reviews. 63 (2): 269–90. doi:10.1124/pr.110.003301. PMID 21454438.
- ^ a b Offermanns S, Colletti SL, IJzerman AP, Lovenberg TW, Semple G, Wise A, Waters MG. «Hydroxycarboxylic acid receptors». IUPHAR/BPS Guide to Pharmacology. International Union of Basic and Clinical Pharmacology. Retrieved 13 July 2018.
- ^ Badet C, Thebaud NB (2008). «Ecology of lactobacilli in the oral cavity: a review of literature». The Open Microbiology Journal. 2: 38–48. doi:10.2174/1874285800802010038. PMC 2593047. PMID 19088910.
- ^ Nascimento MM, Gordan VV, Garvan CW, Browngardt CM, Burne RA (April 2009). «Correlations of oral bacterial arginine and urea catabolism with caries experience». Oral Microbiology and Immunology. 24 (2): 89–95. doi:10.1111/j.1399-302X.2008.00477.x. PMC 2742966. PMID 19239634.
- ^ Aas JA, Griffen AL, Dardis SR, Lee AM, Olsen I, Dewhirst FE, Leys EJ, Paster BJ (April 2008). «Bacteria of dental caries in primary and permanent teeth in children and young adults». Journal of Clinical Microbiology. 46 (4): 1407–17. doi:10.1128/JCM.01410-07. PMC 2292933. PMID 18216213.
- ^ Caufield PW, Li Y, Dasanayake A, Saxena D (2007). «Diversity of lactobacilli in the oral cavities of young women with dental caries». Caries Research. 41 (1): 2–8. doi:10.1159/000096099. PMC 2646165. PMID 17167253.
- ^ a b Parks, Scott K.; Mueller-Klieser, Wolfgang; Pouysségur, Jacques (2020). «Lactate and Acidity in the Cancer Microenvironment». Annual Review of Cancer Biology. 4: 141–158. doi:10.1146/annurev-cancerbio-030419-033556.
- ^ Roth SM. «Why does lactic acid build up in muscles? And why does it cause soreness?». Scientific American. Retrieved 23 January 2006.
- ^ «NNFCC Renewable Chemicals Factsheet: Lactic Acid». NNFCC.
- ^ H. Benninga (1990): «A History of Lactic Acid Making: A Chapter in the History of Biotechnology». Volume 11 of Chemists and Chemistry. Springer, ISBN 0792306252, 9780792306252
- ^ Endres H (2009). Technische Biopolymere. München: Hanser-Verlag. p. 103. ISBN 978-3-446-41683-3.
- ^ Groot W, van Krieken J, Slekersl O, de Vos S (19 October 2010). «Chemistry and production of lactic acid, lactide and poly(lactic acid)». In Auras R, Lim L, Selke SE, Tsuji H (eds.). Poly(Lactic acid). Hoboken: Wiley. p. 3. ISBN 978-0-470-29366-9.
- ^ König H, Fröhlich J (2009). Lactic acid bacteria in Biology of Microorganisms on Grapes, in Must and in Wine. Springer-Verlag. p. 3. ISBN 978-3-540-85462-3.
- ^ Westhoff, Gerrit; Starr, John N. (2012). «Lactic Acids». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_097.pub3.
- ^ Shuklov IA, Dubrovina NV, Kühlein K, Börner A (2016). «Chemo-Catalyzed Pathways to Lactic Acid and Lactates». Advanced Synthesis and Catalysis. 358 (24): 3910–3931. doi:10.1002/adsc.201600768.
- ^ a b McArdle WD, Katch FI, Katch VL (2010). Exercise Physiology: Energy, Nutrition, and Human Performance. Wolters Kluwer/Lippincott Williams & Wilkins Health. ISBN 978-0-683-05731-7.
- ^ Robergs RA, Ghiasvand F, Parker D (September 2004). «Biochemistry of exercise-induced metabolic acidosis». American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 287 (3): R502–R516. doi:10.1152/ajpregu.00114.2004. PMID 15308499. S2CID 2745168.
- ^ Lindinger MI, Kowalchuk JM, Heigenhauser GJ (September 2005). «Applying physicochemical principles to skeletal muscle acid-base status». American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 289 (3): R891–4, author reply R904–910. doi:10.1152/ajpregu.00225.2005. PMID 16105823.
- ^ a b c d Zilberter Y, Zilberter T, Bregestovski P (September 2010). «Neuronal activity in vitro and the in vivo reality: the role of energy homeostasis». Trends in Pharmacological Sciences. 31 (9): 394–401. doi:10.1016/j.tips.2010.06.005. PMID 20633934.
- ^ Wyss MT, Jolivet R, Buck A, Magistretti PJ, Weber B (May 2011). «In vivo evidence for lactate as a neuronal energy source» (PDF). The Journal of Neuroscience. 31 (20): 7477–85. doi:10.1523/JNEUROSCI.0415-11.2011. PMC 6622597. PMID 21593331.
- ^ Gladden LB (July 2004). «Lactate metabolism: a new paradigm for the third millennium». The Journal of Physiology. 558 (Pt 1): 5–30. doi:10.1113/jphysiol.2003.058701. PMC 1664920. PMID 15131240.
- ^ Pellerin L, Bouzier-Sore AK, Aubert A, Serres S, Merle M, Costalat R, Magistretti PJ (September 2007). «Activity-dependent regulation of energy metabolism by astrocytes: an update». Glia. 55 (12): 1251–62. doi:10.1002/glia.20528. PMID 17659524. S2CID 18780083.
- ^ Holmgren CD, Mukhtarov M, Malkov AE, Popova IY, Bregestovski P, Zilberter Y (February 2010). «Energy substrate availability as a determinant of neuronal resting potential, GABA signaling and spontaneous network activity in the neonatal cortex in vitro». Journal of Neurochemistry. 112 (4): 900–12. doi:10.1111/j.1471-4159.2009.06506.x. PMID 19943846. S2CID 205621542.
- ^ Tyzio R, Allene C, Nardou R, Picardo MA, Yamamoto S, Sivakumaran S, Caiati MD, Rheims S, Minlebaev M, Milh M, Ferré P, Khazipov R, Romette JL, Lorquin J, Cossart R, Khalilov I, Nehlig A, Cherubini E, Ben-Ari Y (January 2011). «Depolarizing actions of GABA in immature neurons depend neither on ketone bodies nor on pyruvate». The Journal of Neuroscience. 31 (1): 34–45. doi:10.1523/JNEUROSCI.3314-10.2011. PMC 6622726. PMID 21209187.
- ^ Ruusuvuori E, Kirilkin I, Pandya N, Kaila K (November 2010). «Spontaneous network events driven by depolarizing GABA action in neonatal hippocampal slices are not attributable to deficient mitochondrial energy metabolism». The Journal of Neuroscience. 30 (46): 15638–42. doi:10.1523/JNEUROSCI.3355-10.2010. PMC 6633692. PMID 21084619.
- ^ Khakhalin AS (September 2011). «Questioning the depolarizing effects of GABA during early brain development». Journal of Neurophysiology. 106 (3): 1065–7. doi:10.1152/jn.00293.2011. PMID 21593390. S2CID 13966338.
- ^ Ivanov A, Mukhtarov M, Bregestovski P, Zilberter Y (2011). «Lactate Effectively Covers Energy Demands during Neuronal Network Activity in Neonatal Hippocampal Slices». Frontiers in Neuroenergetics. 3: 2. doi:10.3389/fnene.2011.00002. PMC 3092068. PMID 21602909.
- ^ Kasischke K (2011). «Lactate fuels the neonatal brain». Frontiers in Neuroenergetics. 3: 4. doi:10.3389/fnene.2011.00004. PMC 3108381. PMID 21687795.
- ^ a b c d Blood Test Results – Normal Ranges Archived 2 November 2012 at the Wayback Machine Bloodbook.Com
- ^ a b c d Derived from mass values using molar mass of 90.08 g/mol
- ^ Campieri, C.; Campieri, M.; Bertuzzi, V.; Swennen, E.; Matteuzzi, D.; Stefoni, S.; Pirovano, F.; Centi, C.; Ulisse, S.; Famularo, G.; De Simone, C. (September 2001). «Reduction of oxaluria after an oral course of lactic acid bacteria at high concentration». Kidney International. 60 (3): 1097–1105. doi:10.1046/j.1523-1755.2001.0600031097.x. ISSN 0085-2538. PMID 11532105.
- ^ «USDA National Nutrient Database for Standard Reference, Release 28 (2015) Documentation and User Guide» (PDF). 2015. p. 13.
- ^ For example, in this USDA database entry for yoghurt the food energy is calculated using given coefficients for carbohydrate, fat, and protein. (One must click on «Full report» to see the coefficients.) The calculated value is based on 4.66 grams of carbohydrate, which is exactly equal to the sugars.
- ^ Greenfield H, Southgate D (2003). Food Composition Data: Production, Management and Use. Rome: FAO. p. 146. ISBN 9789251049495.
- ^ «Brewing With Lactic Acid Bacteria». MoreBeer.
- ^ Lambic (Classic Beer Style) – Jean Guinard
- ^ Li, Li; Yao, Xiaohong; Zhong, Caihong; Chen, Xuzhong (January 2010). «Akebia: A Potential New Fruit Crop in China». HortScience. 45 (1): 4–10. doi:10.21273/HORTSCI.45.1.4.
- ^ «Current EU approved additives and their E Numbers». UK Food Standards Agency. Retrieved 27 October 2011.
- ^ «Listing of Food Additives Status Part II». US Food and Drug Administration. Retrieved 27 October 2011.
- ^ «Standard 1.2.4 – Labelling of ingredients». Australia New Zealand Food Standards Code. Retrieved 27 October 2011.
- ^ a b «Listing of Specific Substances Affirmed as GRAS:Lactic Acid». US FDA. Retrieved 20 May 2013.
- ^ «Purac Carcass Applications». Purac. Archived from the original on 29 July 2013. Retrieved 20 May 2013.
- ^ «Agency Response Letter GRAS Notice No. GRN 000240». FDA. US FDA. Retrieved 20 May 2013.
- ^ Druckerman P (2 October 2016). «If I Sleep for an Hour, 30 People Will Die». The New York Times.
External links[edit]
- Corn Plastic to the Rescue Archived 21 November 2013 at the Wayback Machine
- Lactic Acid: Information and Resources
- Lactic Acid Is Not Muscles’ Foe, It’s Fuel
- Fitzgerald M (26 January 2010). «The Lactic Acid Myths». Competitor Running. Archived from the original on 25 August 2018.