| Бромоводород | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
бромоводород | |
| Традиционные названия | Бромистый водород, гидробромид; водорода бромид | |
| Хим. формула | HBr | |
| Рац. формула | HBr | |
| Физические свойства | ||
| Состояние | бесцветный газ | |
| Молярная масса | 80,91 г/моль | |
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ | |
| Энергия ионизации | 11,62 ± 0,01 эВ[1] | |
| Термические свойства | ||
| Температура | ||
| • плавления | –86.80 °C | |
| • кипения | –66.38 °C | |
| Критическая точка | 90,0 °C, 8,54 МПа | |
| Энтальпия | ||
| • образования | -34,1 кДж/моль | |
| Давление пара | 20 ± 1 атм[1], 20,003 бар[2], 26,5 бар[2] и 40,7 бар[2] | |
| Химические свойства | ||
Константа диссоциации кислоты  |
≈ –9 | |
| Растворимость | ||
| • в воде | 193 (20 °C) | |
| Структура | ||
| Дипольный момент | 0,24 Д | |
| Классификация | ||
| Рег. номер CAS | 10035-10-6 | |
| PubChem | 260 | |
| Рег. номер EINECS | 233-113-0 | |
| SMILES |
Br |
|
| InChI |
InChI=1S/BrH/h1H CPELXLSAUQHCOX-UHFFFAOYSA-N |
|
| RTECS | MW3850000 | |
| ChEBI | 47266 | |
| Номер ООН | 1048 | |
| ChemSpider | 255 | |
| Безопасность | ||
| Пиктограммы СГС |
|
|
| NFPA 704 |
0 3 0 COR |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
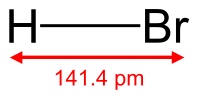
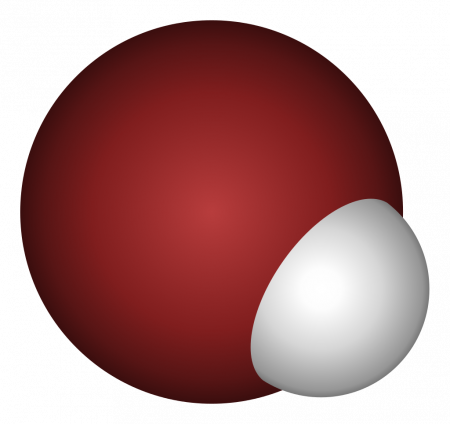
Бро́моводоро́д (гидробромид, брóмистый водорóд, HBr) — неорганическое вещество, бинарное соединение брома с водородом.
Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
Получение[править | править код]
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений.
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства[править | править код]
Бромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C).
Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
- HBr·H2O — устойчив при −15,5÷-3,3 °C
- HBr·2H2O — плавится при −11,2 °C
- HBr·4H2O — плавится при −55,8 °C
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства[править | править код]
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
Применение[править | править код]
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка[править | править код]
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность[править | править код]
Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
Примечания[править | править код]
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0331.html
- ↑ 1 2 3 Hydrogen bromide
Литература[править | править код]
- ГОСТ 2062-77 Кислота бромистоводородная
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л.: Химия, 1966. — Т. 1. — 1072 с.
- Гринвуд Н., Эрншо А. Химия элементов. — Бином. Лаборатория знаний, 2008. — Т. 2. — 666 с.
- Неорганическая химия. В 3 т. / Под ред. Ю. Д. Третьякова. — М.: Изд. центр «Академия», 2004. — Т. 2. — 368 с. — ISBN 5-7695-1436-1.
- Ахметов Н. С. Общая и неорганическая химия: Учеб. для химико-технол. вузов. — 2-е изд., перераб. и доп. — М: Высш. шк., 1988. — 640 с., ил.
- Относительная молекулярная масса HBr: 80.91194
- Молярная масса HBr: 80.91194 г/моль (0.08091 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| H (водород) | 1 | 1.00794 | 1.00794 |
| Br (бром) | 1 | 79.904 | 79.904 |
| 80.91194 |
Расчёт молярной и относительной молекулярной массы HBr
- Mr[HBr] = Ar[H] + Ar[Br] = 1.00794 + 79.904 = 80.91194
- Молярная масса (в кг/моль) = Mr[HBr] : 1000 = 80.91194 : 1000 = 0.08091 кг/моль
Расчёт массовых долей элементов в HBr
- Массовая доля водорода (H) = 1.00794 : 80.91194 * 100 = 1.246 %
- Массовая доля брома (Br) = 79.904 : 80.91194 * 100 = 98.754 %
Калькулятор массы
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
| Бромоводород | ||
|---|---|---|
|
||
| Систематическое наименование |
бромоводород | |
| Традиционные названия | Бромистый водород | |
| Хим. формула | HBr | |
| Рац. формула | HBr | |
| Состояние | бесцветный газ | |
| Молярная масса | 80,91 г/моль | |
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ | |
| Энергия ионизации | 11,62 ± 0,01 эВ | |
| Температура | ||
| • плавления | –86.80 °C | |
| • кипения | –66.38 °C | |
| Критическая точка | 90,0 °C, 8,54 МПа | |
| Энтальпия | ||
| • образования | -34,1 кДж/моль | |
| Давление пара | 20 ± 1 атм, 20,003 бар, 26,5 бар и 40,7 бар | |
| Константа диссоциации кислоты pKa | ≈ –9 | |
| Растворимость | ||
| • в воде | 193 (20 °C) | |
| Дипольный момент | 0,24 Д | |
| Рег. номер CAS | 10035-10-6 | |
| PubChem | 260 | |
| Рег. номер EINECS | 233-113-0 | |
| SMILES |
Br |
|
| InChI |
1S/BrH/h1H CPELXLSAUQHCOX-UHFFFAOYSA-N |
|
| RTECS | MW3850000 | |
| ChEBI | 47266 | |
| Номер ООН | 1048 | |
| ChemSpider | 255 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Бромоводород (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Транспортировка
- 6 Токсичность
Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
- H2 + Br2 →200−400oC,Pt2 HBr
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
- PBr3 + 3H2O ⟶ H3PO3 + 3HBr
- PBr5 + 4H2O ⟶ H3PO4 + 5HBr
Восстановление брома несколькими способами:
- 3Br2 + S + 4H2O →100−150oC H2SO4 + 6HBr
- Br2 + KNO2 + H2O → KNO3 + 2HBr
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
- KBr + H2SO4 →H2O KHSO4 + HBr↑
Физические свойства
Бромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
- HBr·H2O — устойчив при −15,5÷-3,3 °C
- HBr·2H2O — плавится при −11,2 °C
- HBr·4H2O — плавится при −55,8 °C
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
- HBr + H2O ⇄ Br− + H3O + pK =−9
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
- 2HBr ⇄ H2 + Br2
Как кислота реагирует с металлами, их оксидами, основаниями:
- 2HBr + Mg → MgBr2 + H2↑
- 2HBr + CaO → CaBr2 + H2O
- 2HBr + Ba(OH)2 → BaBr2 + 2H2O
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
- 4HBr + O2 →τoC 2Br2 + 2H2O
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность
Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
|
Галогеноводороды |
|---|
|
|
Соединения брома |
|---|
|
Бро́моводоро́д (гидробромид, брóмистый водорóд, HBr) — неорганическое вещество, бинарное соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
| Бромоводород | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
бромоводород | |
| Традиционные названия | Бромистый водород, гидробромид; водорода бромид | |
| Хим. формула | HBr | |
| Рац. формула | HBr | |
| Физические свойства | ||
| Состояние | бесцветный газ | |
| Молярная масса | 80,91 г/моль | |
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ | |
| Энергия ионизации | 11,62 ± 0,01 эВ[1] | |
| Термические свойства | ||
| Температура | ||
| • плавления | −86.80 °C | |
| • кипения | −66.38 °C | |
| Критическая точка | 90,0 °C, 8,54 МПа | |
| Энтальпия | ||
| • образования | −34,1 кДж/моль | |
| Давление пара | 20 ± 1 атм[1], 20,003 бар[2], 26,5 бар[2] и 40,7 бар[2] | |
| Химические свойства | ||
| Константа диссоциации кислоты
|
≈ −9 | |
| Растворимость | ||
| • в воде | 193 (20 °C) | |
| Структура | ||
| Дипольный момент | 0,24 Д | |
| Классификация | ||
| Рег. номер CAS | 10035-10-6 | |
| PubChem | 260 | |
| Рег. номер EINECS | 233-113-0 | |
| SMILES |
Br |
|
| InChI |
InChI=1S/BrH/h1H CPELXLSAUQHCOX-UHFFFAOYSA-N |
|
| RTECS | MW3850000 | |
| ChEBI | 47266 | |
| Номер ООН | 1048 | |
| ChemSpider | 255 | |
| Безопасность | ||
| Пиктограммы СГС |
|
|
| NFPA 704 |
0 3 0 COR |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
|
Медиафайлы на Викискладе |
Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений.
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства
Бромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
- HBr·H2O — устойчив при −15,5…−3,3 °C,
- HBr·2H2O — плавится при −11,2 °C,
- HBr·4H2O — плавится при −55,8 °C.
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C: a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм[источник не указан 87 дней].
Токсичность
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0331.html
- ↑ 1 2 3 Hydrogen bromide
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л.: Химия, 1966. — Т. 1. — 1072 с.
- Гринвуд Н., Эрншо А. Химия элементов. — Бином. Лаборатория знаний, 2008. — Т. 2. — 666 с.
- Неорганическая химия. В 3 т. / Под ред. Ю. Д. Третьякова. — М.: Изд. центр «Академия», 2004. — Т. 2. — 368 с. — ISBN 5-7695-1436-1.
- Ахметов Н. С. Общая и неорганическая химия: Учеб. для химико-технол. вузов. — 2-е изд., перераб. и доп. — М: Высш. шк., 1988. — 640 с., ил.
Бромоводород, Бро, моводоро, гидробромид, брóмистый, водорóд, неорганическое, вещество, бинарное, соединение, брома, водородом, Бесцветный, тяжёлый, токсичный, газ, образует, туман, сыром, воздухе, ОбщиеСистематическоенаименование, бромоводородТрадиционные, на. Bro movodoro d gidrobromid bromistyj vodorod HBr neorganicheskoe veshestvo binarnoe soedinenie broma s vodorodom Bescvetnyj tyazhyolyj toksichnyj gaz obrazuet tuman v syrom vozduhe BromovodorodObshieSistematicheskoenaimenovanie bromovodorodTradicionnye nazvaniya Bromistyj vodorod gidrobromid vodoroda bromidHim formula HBrRac formula HBrFizicheskie svojstvaSostoyanie bescvetnyj gazMolyarnaya massa 80 91 g molPlotnost gaz 25 C 3 307 g l zhidkij 68 C 2 17 g sm Energiya ionizacii 11 62 0 01 eV 1 Termicheskie svojstvaTemperatura plavleniya 86 80 C kipeniya 66 38 CKriticheskaya tochka 90 0 C 8 54 MPaEntalpiya obrazovaniya 34 1 kDzh molDavlenie para 20 1 atm 1 20 003 bar 2 26 5 bar 2 i 40 7 bar 2 Himicheskie svojstvaKonstanta dissociacii kisloty p K a displaystyle pK a 9Rastvorimost v vode 193 20 C StrukturaDipolnyj moment 0 24 DKlassifikaciyaReg nomer CAS 10035 10 6PubChem 260Reg nomer EINECS 233 113 0SMILES BrInChI InChI 1S BrH h1HCPELXLSAUQHCOX UHFFFAOYSA NRTECS MW3850000ChEBI 47266Nomer OON 1048ChemSpider 255BezopasnostPiktogrammy SGSNFPA 704 030CORPrivedeny dannye dlya standartnyh uslovij 25 C 100 kPa esli ne ukazano inoe Mediafajly na Vikisklade Soderzhanie 1 Poluchenie 2 Fizicheskie svojstva 3 Himicheskie svojstva 4 Primenenie 5 Transportirovka 6 Toksichnost 7 Primechaniya 8 LiteraturaPoluchenie PravitV etom razdele ne hvataet ssylok na istochniki informacii Informaciya dolzhna byt proveryaema inache ona mozhet byt postavlena pod somnenie i udalena Vy mozhete otredaktirovat etu statyu dobaviv ssylki na avtoritetnye istochniki Eta otmetka ustanovlena 7 maya 2021 goda V promyshlennosti bromovodorod poluchayut neposredstvennym vzaimodejstviem prostyh veshestv H 2 Br 2 200 400 C Pt 2 HBr displaystyle ce H2 Br2 gt 200 400 circ text C Pt 2HBr Takzhe bromistyj vodorod poluchaetsya kak pobochnyj produkt pri sinteze bromproizvodnyh organicheskih soedinenij V laboratorii poluchayut gidrolizom tribromida ili pentabromida fosfora PBr 3 3 H 2 O H 3 PO 3 3 HBr displaystyle ce PBr3 3 H2O gt H3PO3 3 HBr PBr 5 4 H 2 O H 3 PO 4 5 HBr displaystyle ce PBr5 4 H2O gt H3PO4 5 HBr Vosstanovlenie broma neskolkimi sposobami 3 Br 2 S 4 H 2 O 100 150 C H 2 SO 4 6 HBr displaystyle ce 3Br2 S 4H2O gt 100 150 circ text C H2SO4 6HBr Br 2 KNO 2 H 2 O KNO 3 2 HBr displaystyle ce Br2 KNO2 H2O gt KNO3 2 HBr Vytesnenie iz bromidov shelochnyh metallov razbavlennoj kislotoj KBr H 2 SO 4 H 2 O KHSO 4 HBr displaystyle ce KBr H2SO4 gt ce H2O KHSO4 HBr Fizicheskie svojstva PravitV etom razdele ne hvataet ssylok na istochniki informacii Informaciya dolzhna byt proveryaema inache ona mozhet byt postavlena pod somnenie i udalena Vy mozhete otredaktirovat etu statyu dobaviv ssylki na avtoritetnye istochniki Eta otmetka ustanovlena 7 maya 2021 goda Bromistyj vodorod eto bescvetnyj yadovityj gaz s rezkim zapahom silno dymyashij na vozduhe Termicheski ochen ustojchiv Horosho rastvorim v vode 221 g 100 g vody pri 0 C 193 pri 25 130 pri 100 C Vodnyj rastvor obrazuet azeotropnuyu smes s 47 63 HBr kotoraya kipit pri 124 3 C Rastvoryaetsya v etanole obrazuya slabyj elektrolit Pri ohlazhdenii vodnyh rastvorov HBr mozhno poluchit kristallogidraty HBr H2O ustojchiv pri 15 5 3 3 C HBr 2H2O plavitsya pri 11 2 C HBr 4H2O plavitsya pri 55 8 C Chistyj HBr obrazuet kristally ortorombicheskoj singonii prostranstvennaya gruppa F mmm parametry pri 173 C a 0 5640 nm b 0 6063 nm c 0 5555 nm Z 4 Himicheskie svojstva PravitV etom razdele ne hvataet ssylok na istochniki informacii Informaciya dolzhna byt proveryaema inache ona mozhet byt postavlena pod somnenie i udalena Vy mozhete otredaktirovat etu statyu dobaviv ssylki na avtoritetnye istochniki Eta otmetka ustanovlena 7 maya 2021 goda Vodnyj rastvor bromistogo vodoroda obrazuet silnuyu odnoosnovnuyu kislotu HBr H 2 O Br H 3 O p K 9 displaystyle ce HBr H2O lt gt Br H3O quad pK 9 Termicheski HBr ochen ustojchiv pri temperature 1000 C razlagayutsya okolo 0 5 molekul 2 HBr H 2 Br 2 displaystyle ce 2 HBr lt gt H2 Br2 Kak kislota reagiruet s metallami ih oksidami osnovaniyami 2 HBr Mg MgBr 2 H 2 displaystyle ce 2 HBr Mg gt MgBr2 H2 2 HBr CaO CaBr 2 H 2 O displaystyle ce 2 HBr CaO gt CaBr2 H2O 2 HBr Ba OH 2 BaBr 2 2 H 2 O displaystyle ce 2 HBr Ba OH 2 gt BaBr2 2 H2O Yavlyaetsya vosstanovitelem medlenno okislyaetsya na vozduhe iz za chego vodnye rastvory so vremenem okrashivayutsya v buryj cvet 4 HBr O 2 2 Br 2 2 H 2 O displaystyle ce 4 HBr O2 gt 2 Br2 2 H2O Primenenie PravitPrimenyayut dlya prigotovleniya bromidov sinteza razlichnyh organicheskih bromproizvodnyh i dlya reaktivnogo ionnogo travleniya Transportirovka PravitBezvodnyj HBr transportiruyut v ballonah yomkostyu 6 8 i 68 kg pod davleniem 24 atm istochnik ne ukazan 87 dnej Toksichnost Pravit Bromistyj vodorod edkoe vesma toksichnoe veshestvo obladayushee udushayushim dejstviem istochnik ne ukazan 87 dnej Predelno dopustimaya koncentraciya 10 mg m3 porazhayushaya toksodoza 2 4 mg l min istochnik ne ukazan 87 dnej Primechaniya Pravit 1 2 http www cdc gov niosh npg npgd0331 html 1 2 3 Hydrogen bromideLiteratura PravitGOST 2062 77 Kislota bromistovodorodnaya Himicheskaya enciklopediya Redkol Knunyanc I L i dr M Sovetskaya enciklopediya 1988 T 1 623 s Spravochnik himika Redkol Nikolskij B P i dr 3 e izd ispr L Himiya 1966 T 1 1072 s Grinvud N Ernsho A Himiya elementov Binom Laboratoriya znanij 2008 T 2 666 s Neorganicheskaya himiya V 3 t Pod red Yu D Tretyakova M Izd centr Akademiya 2004 T 2 368 s ISBN 5 7695 1436 1 Ahmetov N S Obshaya i neorganicheskaya himiya Ucheb dlya himiko tehnol vuzov 2 e izd pererab i dop M Vyssh shk 1988 640 s il Istochnik https ru wikipedia org w index php title Bromovodorod amp oldid 114071647, Википедия, чтение, книга,
библиотека
, поиск, нажмите,
истории
, книги, статьи, wikipedia, учить, информация, история, секс, порно, скачать, скачать, sex, seks, porn, porno, скачать, бесплатно, скачать бесплатно, mp3, видео, mp4, 3gp, jpg, jpeg, gif, png, картинка, музыка, песня, фильм, игра, игры






















![{displaystyle {ce {H2{}+Br2->[200-400~^{circ }{text{C, Pt}}]2HBr}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f96784f1a8ac79477e910f76d7261b9fa2c6a130)


![{displaystyle {ce {3Br2{}+S{}+4H2O->[100-150~^{circ }{text{C}}]H2SO4{}+6HBr}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d267dd5abcbf222ec3a55b0d8eb63d27065161fe)

![{displaystyle {ce {KBr + H2SO4 ->[{ce {H2O}}] KHSO4 + HBr ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b38beb12efaf4f739545ce3740950d670832f67)






