2018-04-16
Найти температуру $T$ как функцию энтропии $S$ вещества для политропического процесса, при котором теплоемкость вещества равна $C$. Известно, что при температуре $T_{0}$ энтропия вещества равна $S_{0}$. Изобразить примерные графики зависимости $T(S)$ при $C > 0$ и $C < 0$.
Решение:
Мы знаем,
$S — S_{0} = int_{T_{0} }^{T} frac{CdT}{T} = C ln frac{T}{T_{0} }$
предполагая, что $C$ является известной константой.
Тогда $T = T_{0} e^{ frac{S — S_{0} }{C } }$
На рис. 35 изображены кривые изменения действительной энтальпии как функции температуры в зависимости от давления, принятого как независимый параметр. На рис. 36 представлены кривые изменения действительной энтропии как функции температуры в зависимости от давления, также принятого как независимый параметр. Значения энтальпии в качестве независимого [c.185]
В уравнениях (5.4) и (5.5) энтропия представлена как функция температуры и объема. Если из уравнения (5.4) исключить объем, используя уравнение Клапейрона, то можно будет выразить энтропию как функцию температуры и давления. Для этого дифференцируем уравнение Клапейрона ро = ЯТ [c.77]
Мы стремимся выразить энтропию как функцию температуры г, а не У, поскольку функцию а(т) легко определить экспериментально. Образуя дифференциал [c.84]
Известно, что в термодинамике для характеристики теплового состояния системы вводится понятие температуры и других термодинамических функций (энтропия, внутренняя энергия и т. д.) как функций температуры. [c.278]
В гл. 3 мы отмечали, что второе начало термодинамики устанавливает, во-первых, общую закономерность превращения теплоты в работу и, во-вторых, выражает специфические закономерности как обычных, так и необычных систем. Общая закономерность превращения теплоты в работу в обоих случаях систем состоит в том, что при таком превращении в замкнутом круговом процессе часть теплоты непременно отдается рабочим телом другим телам. Этот (первый) элемент компенсации, который в случае обычных систем совпадает со вторым элементом компенсации (изменением термодинамического состояния других тел), приводит к существованию энтропии у равновесной системы (см. 13). Отсюда следует, что второе начало, сформулированное Каратеодори, не изменяется вблизи каждого состояния любой термически однородной системы существуют такие состояния, которые недостижимы из него адиабатным путем. Это означает, что у всякой равновесной системы в состоянии с отрицательной абсолютной температурой (как и в случае обычных систем) существует энтропия как функция ее состояния [c.142]
Соотношение (2.13) определяющее энтропию как функцию состояния тела, было получено исходя из термодинамических особенностей цикла Карно, которые одновременно позволили обосновать и понятие термодинамической температуры. [c.84]
Программа № 4. Программа позволяет вычислить калорические свойства диоксида углерода (энтальпию, энтропию, изобарную теплоемкость) в области перегретого пара по заданным температуре и давлению. Расчет проводится по (5.17), (5.18) и (5.20). Необходимые для этого значения До, кДж/кг, зо, кДж/(кг-К) и Сро, кДж/(кг-К) вводятся в программу в соответствии с (5.21) — (5.23) как функции температуры t, °С [c.158]
Тепловой закон Нернста в формулировке Планка позволяет вычислить абсолютное значение энтропии, если известна теплоемкость как функция температуры. [c.232]
Если принять какую-либо температуру Го за базовую, то отношение давлений р]ро=Ло, называемое ниже относительным давлением, определится как функция температуры независимо от значения энтропии. [c.6]
Условие (4.1) позволяет определить температуру и энтропию как функции давления и объема для любой термодинамической системы, для которой известны уравнения изотерм и адиабат. Мы используем в качестве рабочего вещества для калибровки абсолютной температуры и абсолютной энтропии совершенный газ. Так как для него температура зависит только от РУ, а энтропия от РУ , то, обозначая РУ = х, РУ у = имеем Т = Т х), 3 = 5(у) и [c.19]
С другой стороны, рассматривая внутреннюю энергии и энтропию как функции компонент деформации и температуры, имеем [c.118]
| Рис. 5-6. Поправка не неидеальность для энтропии как функции приведенного давления и приведенной температуры. | 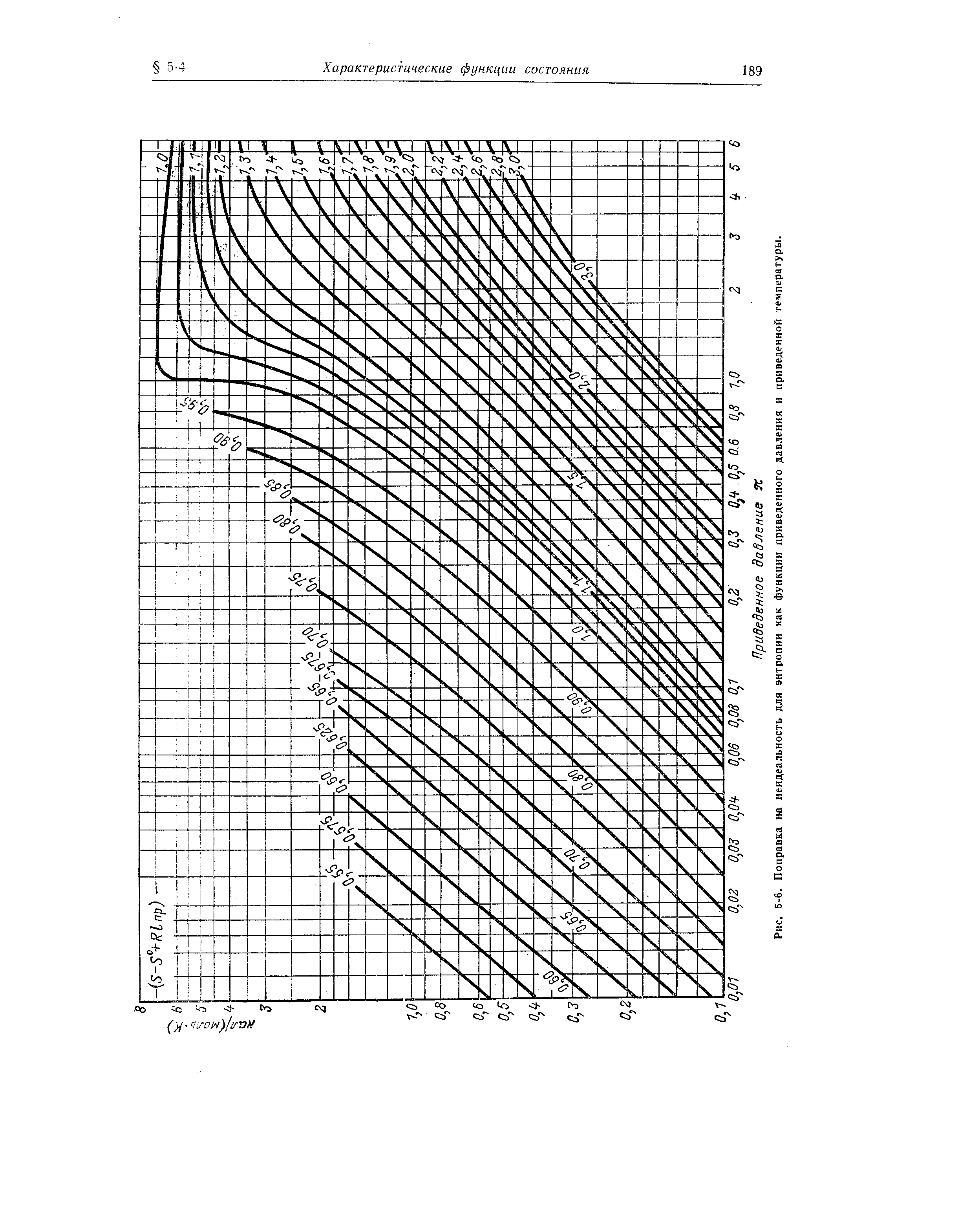 |
Он вычисляется по переменным [8, д] и не равен второму дифференциалу энтропии по переменным [Т, д]. Действительно, если энтропия задается как функция температуры и других переменных по уравнению (22.2), то левая часть неравенства (22.11) должна выглядеть следующим образом [c.114]
На фиг. 23 изображена энтропия газообразного водорода как функция температуры и давления, а на фиг. 24 — энтальпия газообразного водорода как функция давления и энтропии. Отметим, что во втором из этих случаев энтропия обычно рассматривается как независимая переменная (см. гл. 3, 1). [c.85]
Если построить энтропию парамагнитного вещества как функцию температуры при постоянном Н, то в соответствии с третьим законом она будет стремиться при Г -> О к постоянному значению (нулю) при любом Н. Кривые для Н Ф О ж Н = 0 стремятся к одному и тому же пределу при Т О, как показано на фиг. 61. Для не слишком больших Н можно использовать соотношение (6) в решении задачи 20 [c.192]
Дадим теперь формулы остальных механических коэффициентов анизотропного тела для адиабатических и изотермических процессов. Выражение для энтропии можно представить как функцию температуры и напряжений, подставляя (5) в (20), [c.218]
Таким образом, если из эксперимента известна Ср или Су как функция температуры, то этого достаточно для определения абсолютного значения энтропии и ее температурной зависимости. [c.234]
Энтропия и внутренняя энергия идеальной несжимаемой жидкости определяются через теплоемкость с (Г), заданную как функция температуры, по формулам [c.252]
Рассмотрим энтропию 5 как функцию температуры Т и давления р. Составим дифференциал [c.265]
Дадим Х.1 какое-либо постоянное значение и будем рассматривать 2 как переменную величину, а параметры Т , Ра, Р2 P21 Ра как функции переменного %2- Выше было установлено на основании соотношения (6), что трение ускоряет дозвуковой п замедляет сверхзвуковой поток. Тогда нужно считать Хз возрастающим при дозвуковом и убывающим при сверхзвуковом потоке. Поэтому согласно зависимостям (8), (9) и (10) термодинамическая температура, плотность и статическое давление вдоль изолированной трубы под влиянием трения падают в дозвуковом и растут в сверхзвуковом течении. Из равенства (11) следует, что в критическом сечении при Я2 = 1 полное давление Рг имеет минимальное значение ), но тогда из выражения (102) гл. I вытекает, что в критическом сечении энтропия достигает максимального значения. Полное давление и плотность заторможенного газа в соответствии с равенством (11) как в дозвуковом, так и в сверхзвуковом потоке вдоль трубы убывают, и только один параметр — температура торможения — не меняется. [c.183]
Вблизи абсолютного нуля все термодинамические величины, характери-зуюш,ие равновесное состояние тела, перестают зависеть от температуры. Это означает, что частные производные по температуре не только энтропии, как это уже отмечалось ранее, но и всех других термодинамических функций, например,внутренней энергии,энтальпии и др., а также давления и объема при 7 —> о обращаются в нуль. [c.86]
Преобразование Лежандра позволяет получить энтальпию как функцию напряжений и энтропии и свободную энтальпию как функцию напряжений и температуры. Таким образом, потенциалом напряжений для изотермического процесса служит свободная энергия, для адиабатического — внутренняя энергия. Аналогичным способом получаются различные потенциалы деформаций для изотермического и адиабатического случаев. [c.253]
Другой замечательный факт заключается в следующем. В п. 5 указывалось, что в случае, когда штарковское расщепление и магнитное взаимодействие имеют различный порядок величины, кривая эитропип как функции температуры может иметь горизонтальную часть между т п 6. Кривая зависимости S от Т для хромо-калиеиых квасцов действительно имеет такую горизонтальную часть (см., например, фиг. 19), однако она расположена не при iS =i ln2, как следовало бы ожидать, а при значительно более низком значении энтропии. Это, одиако, находится в качественном согласии с данными Блини о теплоемкости, поскольку из рассмотрения фиг. 18 ясно, что кривая А соответствует большему значению эптрошш, чем кривая С. [c.477]
Таким обра.зом, второе начало термодинамики и понятие об удельной энтропии как функции состояния непосредственно вытекает из молекулярно-кинетической природы вещества. При таком понимании второе начало термодинамики приобретает статистический характер и лишается той абсолютной категоричности, которая заложена в формулировке постулата Теплота сама собой переходит лишь ОТ- тела с более высокой температурой к телу с более низкой температурой, но [c.144]
Вычислим тензор напряжений, учитывая изэнтропичность упругой волны. С этой целью используем (13.30), т. е. выражение для энтропии, как функции деформаций и температуры, и положим в нем -=сУо Тогда найдем изменение температуры [c.562]
ЧТО именно увеличение энтропии, связанное с этими колебаниями, и ответственно за переход натрия из низкотемпературной гексагональной плотно упакованной структуры в высокотемпературную объемноцентрированную кубическую структуру ). Чтобы вычислить температуру перехода, необходилю не только рассчитать разность внутренних энергий структур, но и определить их свободные энергии как функции температуры. Ясно, что, если бы такой расчет был выполнен для натрия, его результат плохо согласовывался бы с экспериментом, так как вычисленная разность внутренних энергий структур сильно отличается от той, которую можно получить из экспериментальных данных. [c.493]
Энтропия была определена с помощью основного равспства (2.56), выражающего второе начало для квазистатических процессов, представляющих собой последовательность состояний равновесия. Поэтому энтропия определена этим путем только для равновесного состояния. Поскольку при равновесии состояние системы определяется заданием внешних параметров и температуры (или внешних параметров и энергии), энтропия как функция состояния определена как функция этих величин. Точно так же свободная энергия Р, выражающаяся через энтропию по формуле = Е — TS, пока определена только для состояния равновесия. [c.101]
Для однофазного чистого компонента или гомогенного раствора с огтределенным составом такпе экстенсивные свойства, как объем, внутренняя энергия, энтальпия и энтропия, являются функциями общей массы системы и таких двух интенсивных свойств, как температура и давление. Для однофазного раствора с переменным составом экстенсивные свойства — функции двух интенсивных свойств и массы каждого отдельного компонента. Если G — экстенсивное свойство однофазного раствора, то [c.212]
Если М измеряется как функция Н на ряде кривых постоянной энтропии, то можно вычислить di HdS)n как функцию Н и S. Согласно (9.9), интегрирование этой величины вдоль изоэнтроны дает разность значений температуры для любых двух точек данной изоэнтропы. Наиболее очевидное применение этого метода, предложенное Джиоком [50, 51], заключается D том, чтобы распространить интегрирование на всю область размагничивания от начального ноля до ноля, равного нулю. Это сразу же дает разность между начальной и конечной температурами. К сожалению, такая операция непригодна ири более низких температурах, поскольку небольшая относи-т( льная погрешность в начальной температуре может привести к неудовлетворительной точности конечной температуры. Это возражение не относится к методу, основанному на определении Кельвина, ири котором находятся не разности, а отношения температур [см. (10.1)]. Другим источником погрешностей служит большое число графических дифференцирований и интегрирований, которые необходимо выполнить при расчетах. [c.442]
При более сильных полях кривые приближаются к прямым линиям и могут быть легко экстраполированы к начальным температурам и полям размагничивания. Для более высоких значений энтропии значения ду/д )н=.ч довольно велики (графики зависимости6 от / обсуждаются ниже см. п. 57 и 58) температура Т сильно зависит от поля. В случае калиевых квасцов между и S = Q,1R наблюдается область, в которой у в поле, равном нулю, является практически линейной функцией S. В этой области изменение температуры с полем почти не зависит от энтропии, как это следует из данных табл. 23. В случае метиламиповых квасцов такой области не наблюдается (ср. фиг. 44 и 51). Для этой соли кривые зависимости АТ от // в полях порядка 300 эрстед при значениях энтропии, меньших 0,8 /if, обнаруживают обращенную вниз вогнутость. В случае калиевых квасцов это явление не наблюдалось вплоть до = 0,5/ . Указанное обстоятельство связано с близостью максимума восприимчивости (см. п. 28), который в случае метнламмониевых квасцов находится при значениях энтропии, намного более высоких, чем в случае калиевых квасцов (см. п. 35). [c.512]
Из рассмотрения фиг. 82 можно заключить, что в поле напряженностью 13 эрстед /ц как функция энтропии не обнаруживает максимума. Отсюда следует, что в поле напряженностью 13 эрстед хн является очень удобным термометрическим параметром, ибо если поле поддерживается постоянным, то XII может быть измерено с бсльшей точностью, чем у» или 2. Недавние лейденские измерения абсолютной температуры, о которых говорилось [c.555]
Величина С имеет для каждого черного излучения определенное значение, одно и то же для всех частот. Отсюда следует, что она может быть только функцией температуры и, как мы сейчас покажем, равна l/r. Действительно, пусть при сообщении полости объемом Г=1 см = onst некоторого количества теплоты температура излучения стала T+dT. Тогда энтропия S изменилась на d5 I du [c.359]
На кривой фазового равновесия температуру Т и давление р можно рассматривать также как функции энтропии 5. Разложив вблизи критической точки Г и р в ряд по степеням 5—5 и используя очевидное неравен-ствр 5″ >5 >5, аналогично выражениям (8.14), получим [c.241]
Вывод о существовании энтропии и абсолютной температуры как термодинамических функций состояния любых тел составляет основное содержание второго начала термодинамики (по терминологии проф. Н. И. Белоконя — второго начала термостатики). Математическое выражение в форме равенства 5Q = 5Q + 50 = Тс18 распространяется на любые процессы — обратимые и необратимые. В качестве постулата для вывода этого закона может быть использовано утверждение, что температура есть единственная функция состояния, определяющая направление самопроизвольного теплообмена между телами . [c.48]
Содержание:
- Энтропия
- Принцип существования энтропии
- Принцип возрастания энтропии
- Принцип действия тепловой машины
- Цикл Карно. Максимальный КПД
- Второе начало термодинамики
Энтропия — это физическая величина, используемая для описания термодинамической системы, одна из основных термодинамических величин.
На странице -> решение задач по физике собраны решения задач и заданий с решёнными примерами по всем темам физики.
Энтропия
Энтропия это, в широком смысле, мера хаоса в какой-либо системе. В переводе «энтропия» означает «преобразование».
Энтропия простыми словами — это то, как много информации вам не известно о системе.
В статистической физике энтропия характеризует вероятность осуществления какого-либо макроскопического состояния. Кроме физики, термин широко употребляется в математике: теории информации и математической статистике. В этих областях знания энтропия определяется статистически и называется статистической или информационной энтропией.
В широком смысле, в каком слово часто употребляется в быту, энтропия означает меру сложности, хаотичности или неопределённости системы: чем меньше элементы системы подчинены какому-либо порядку, тем выше энтропия. Величина, противоположная энтропии, именуется негэнтропией или, реже, экстропией.
Принцип существования энтропии
В середине прошлого века было сделано существенное открытие» касающееся обратимых термодинамических процессов. Оказалось, что наряду с внутренней энергией у тела имеется еще одна замечательная функция состояния — энтропия. Также, как и внутренняя энергия, энтропия определяется с точностью до произвольной постоянной. Опыт дает значение разности приращения энтропии. Если тело или система при бесконечно малом переходе из одного состояния в другое при температуре 



определяющаяся, таким образом, одним из двух эквивалентных равенств:
Утверждение о существовании функции, дифференциал которой есть 


Наиболее просто выражаются изменения энтропии при изотермических процессах:


За нуль энтропии может быть принято значение энтропии любого состояния (кипящей воды, плавящегося льда). Однако в некоторых случаях принимают за нуль значение энтропии вещества при абсолютном нуле температуры. Для этого, впрочем, имеются некоторые теоретические основания (теорема Нернста), на которых мы останавливаться не будем.
Приняв 

если нагрев происходит при постоянном давлении. Как видим, чтобы знать энтропию, надо изучить ход теплоемкости с температурой.
Если известно уравнение состояния вещества, то энтропия (с точностью до произвольной постоянной) может быть вычислена весьма просто. По определению

При помощи уравнения газового состояния исключим отсюда давление. Получим: 
Можно также взять от 
Это — выражения для энтропии идеальных газов. Из формул видно, что энтропия возрастает при повышении температуры, а также при увеличении объема газа. Это, разумеется, полностью совпадает с общим утверждением о повышении энтропии при подводе к телу тепла.
Пример. Покажем, что энтропия действительно есть функция состояния системы. Обратимся к примеру на стр. 151 (рис. 79). Путь 1—2—3. Изменение энтропии
Изменение энтропии
Полное изменение энтропии на пути 1—2—3
Видно, что действительно, каким бы путем ни совершался переход газа из состояния 1 в состояние 3, изменение энтропии одно и то же.
Принцип возрастания энтропии
Как уже говорилось, обратимых процессов, строго говоря, не существует, хотя с точностью, доступной опыту, можно осуществить множество процессов, практически неотличимых от обратимых. Имеются, однако, примеры процессов, которые всегда односторонни и уже поэтому никоим образом не могут быть обращены. Так, например, газ может расшириться сам по себе, но не может сжиматься без приложения внешних сил. Тепло может самопроизвольно переходить от горячего тела к холодному и только при затрате работы (например, электроэнергии) может переходить от холодного тела к более нагретому. При трении кинетическая энергия макроскопического движения всегда превращается во внутреннюю энергию, но никогда не происходит самопроизвольный обратный процесс. Необратимость всех остальных процессов в конечном счете связана с тем, что в каждом из них в той или иной степени присутствует один из перечисленных односторонних процессов. В реальных процессах невозможно избежать ни самопроизвольных расширений, ни трения, ни теплового рассеяния.
Нет ли какого-нибудь общего признака у всех перечисленных односторонних процессов? Оказывается, есть: этот признак состоит в том, что во всех односторонних процессах возрастает энтропия.
В случае теплообмена между двумя телами общее (всей системы) изменение энтропии равно
где 

Если 

т. е. при теплообмене общая энтропия системы, в которой произошел теплообмен, возрастает.
Другой случай. Внутри сосуда с газом происходит интенсивное механическое движение (скажем, вертится колесо). Объем не меняется, температура растет, поэтому энтропия изменится на
Наконец, при расширении в пустоту при неизменной температуре прирост энтропии
Итак, во всех односторонних процессах энтропия системы возрастает.
Нетрудно понять, какое значение имеет этот вывод для всех необратимых процессов. Так как каждый необратимый процесс сопровождается односторонними явлениями, идущими с повышением энтропии,.то прирост, энтропии у необратимого процесса будет завышен против того прироста, который имел бы место при обратимом переходе. Пусть 


Если система теплоизолирована, то 
в теплоизолированной системе возможны лишь процессы, идущие с возрастанием энтропии.
Вполне понятно, что энтропия вместе с внутренней энергией являются важнейшими функциями, определяющими термодинамический процесс. Можно сказать, что энтропия является директором-распорядителем процесса, а внутренняя энергия является его бухгалтером: энтропия (определяет направление протекания процесса, энергия «оплачивает расходы» на его проведение.
Если в предыдущие формулы ввести вместо знака 
Эта формула передает содержание второго начала термодинамики. Для замкнутых систем второе начало говорит: энтропия теплоизолированной системы возрастает или остается неизменной.
Целесообразно объединить оба начала термодинамики одной формулой
удобной для рассмотрения всех практических задач термодинамики.
Принцип возрастания энтропии относится к закрытым системам. Если же система общается со средой, другими словами, если речь идет об открытой системе, то ее энтропия может, разумеется, и убывать.
Ниже будет показано, что процессы молекулярного упорядочения связаны с уменьшением энтропии. Живой организм из неупорядоченной системы малых молекул, получаемых в процессах питания и дыхания, конструирует высокоорганизованные постройки — биологические макромолекулы (стр. 595). При этом энтропия организма падает.
Если представить себе замкнутую систему организм+среда, энтропия которой обязана расти, то ясно, что энтропия среды должна возрастать, перекрывая уменьшение энтропии организма.
Возрастание энтропии среды происходит за счет выделений организма.
Если процесс стационарной, то
Можно сказать, что жизнедеятельность организма состоит в пропускании через себя потока энтропии вещества. При этом энтропия вещества, входящего в организм, меньше энтропии, отдаваемой среде,— организм деградирует продукты питания.
Примеры. 1. В примере на стр. 57 мы рассмотрели неупругое столкновение пули с баллистическим маятником и выяснили, что при ударе в системе пуля — маятник исчезает 3920 Дж механической энергии. Это значит, что 

2. Детский резиновый мяч массой 0,3 кг после падения с высоты 2 м подпрыгивает на I м от пола. В этом изотермическом процессе (пусть

Если бы мяч и пол были абсолютно упругими, то энтропия не менялась бы 
3. Рассмотрим необратимый процесс передачи тепла от парового котла к конденсатору. Пусть паровой котел находится при температуре 




Принцип действия тепловой машины
Тепловая машина превращает тепло в работу, иначе говоря, забирает тепло от одних тел и передает его другим телам в форме механической работы. Для того чтобы осуществить это превращение, надо располагать двумя различно нагретыми телами, между которыми возможен теплообмен. Для краткости будем называть более горячее тело нагревателем, а более холодное — холодильником. При наличии таких двух тел процесс превращения тепла в работу рисуется следующим образом: способное расшириться тело (рабочее тело) приводится в контакт с нагревателем. Тепло



Чтобы получить непрерывно действующую тепловую машину, необходимо закончить такт сжатия в той точке, в которой начался такт расширения; короче, процесс должен быть циклическим. Рабочее тело по проведении каждого цикла возвращается в исходное состояние. Закон сохранения энергии требует поэтому, чтобы энергия, полученная от окружающих тел, равнялась энергии, переданной окружающим телам. От среды получено: тепло




Описанный процесс действия тепловой машины является, разумеется, абстрактной схемой. Однако наиболее существенные черты каждого теплового двигателя передаются этой схемой. Рабочим телом является расширяющийся и сжимающийся газ или пар, роль холодильника играет окружающая среда. Нагревателем служит паровой котел или, в двигателях внутреннего сгорания, горючая смесь.
Те же три системы являются необходимыми и для холодильной машины, в которой цикл протекает в обратную сторону. Принцип работы этой машины заключается в следующем: расширение рабочего тела производится тогда, когда оно находится в контакте с холодильником. Этим холодное тело охлаждается еще больше, что и является задачей холодильной машины. Далее, чтобы цикл стал возможным, нужно произвести сжатие рабочего тела и передать тепло, полученное от холодильника. Это выполняется при контакте рабочего тела с нагревателем. Таким образом, более горячее тело нагревается еще больше. «Противоестественный» переход тепла от тела менее нагретого к телу более нагретому «оплачивается» работой. Действительно, при совершении цикла против часовой стрелки равенство энергии, переданной среде, и энергии, отнятой от среды 
индекс 1 относим к части процесса, протекающей при контакте с более горячим телом), имеет следующий смысл: количество тепла, отнятое от системы, должно быть скомпенсировано равным количеством механической работы.
Второе начало термодинамики накладывает некоторое условие на действие тепловой машины. Если предполагать процесс обратимым, то изменение энтропии рабочего тела после прохождения цикла должно равняться нулю. Можно сказать и иначе: изменение энтропии в процессе расширения должно равняться (с обратным знаком) изменению энтропии при сжатии, т. е.
В случае же необратимого процесса энтропия замкнутой системы, состоящей из нагревателя, холодильника и рабочего тела, возрастет и поэтому
(Напоминаем, что 
Цикл Карно. Максимальный КПД
Сейчас мы задаемся целью найти выражение предельно большого коэффициента полезного действия тепловой машины, достижимого для идеальной машины, работающей без потерь на обратимом цикле.
Прежде всего рассмотрим теоретический четырехтактный цикл Карно, изображенный на рис. 81. Цикл Карно состоит из двух изотерм (для температур 


Работа происходит за счет внутренней энергии и температура тела пусть падает до 

Адиабатические процессы в цикле Карно носят вспомогательный характер: они помогают перейти с одной изотермы на другую. В энергетическом балансе эти процессы не участвуют, так как работа адиабатического расширения 

В адиабатическом процессе энтропия системы не меняется. При изотермическом расширении энтропия нагревателя уменьшается на величину 



откуда
К- п. д. цикла определяется температурами холодильника и нагревателя. Чем больше перепад температуры, тем выше к. п. д. машины. Нетрудно видеть, что коэффициент полезного действия цикла Карно дает оптимальное значение к. п. д. Нет лучшего цикла, чем цикл Карно, и в этом смысле он должен являться образцом для конструкторов тепловых машин, они должны стремиться как можно более приблизить реальные циклы к циклу этой идеальной машины.
Доказательство не составит труда. На рис. 82 показан произвольный цикл, вписанный в цикл
Карно. Уменьшение энтропии нагревателя может быть представлено интегралом

так как 





следовательно,
Итак, из всех возможных циклических процессов максимальным к. п. д. обладает цикл Карно.
Формула максимального к. п. д. показывает причину низкого к. п. д. паровых машин. При 
Второе начало термодинамики
Как было указано выше, второе начало термодинамики состоит в утверждении, что энтропия в теплоизолированной системе возрастает. Это утверждение может показаться несколько абстрактным. Кроме того, приведенная формулировка не соответствует историческому развитию идей. Имея в виду огромную, значимость этого закона природы, надо кратко остановиться на других существующих формулировках второго начала термодинамики и показать их эквивалентность приведенной выше.
Исторически второе начало термодинамики вошло в науку в виде постулата Томсона о невозможности создания вечного двигателя второго рода. Вечным двигателем первого рода называют машину, создающую работу «из ничего», т. е. машину, работа которой нарушает первое начало термодинамики. Вечным двигателем второго рода называют такой двигатель, который производит работу при помощи периодически действующей машины за счет одного лишь отнятия теплоты от окружающей среды. Такой двигатель, будь он возможен, был бы практически вечным, так как запас энергии в окружающей среде почти безграничен и охлаждение, скажем, воды океанов на один градус дало бы непредставимо огромную энергию. Масса воды в мировом океане по порядку величины составляет 




Вечный двигатель второго рода — это тепловая машина, работающая с нагревателем, но без холодильника. Такая машина могла бы поработать один такт — газ, находящийся в сосуде с поршнем, мог бы расшириться, но на этом работа двигателя и закончилась бы, так как для продолжения действия машины тепло, полученное газом, необходимо передать холодильнику. Формально невозможность вечного двигателя второго рода видна из формулы максимального к. п. д. При отсутствии теплового перепада 
Невозможно осуществить периодически действующий вечный двигатель, комбинируя изотермическое расширение с адиабатическим процессом сжатия. Такой процесс невозможен, даже если бы удалось его сделать обратимым. При изотермическом расширении рабочего тела энтропия падает. Значит, процесс сжатия должен приводить к возрастанию энтропии. Этого, однако, не может сделать адиабатический процесс, так как он проходит при постоянной энтропии.
Вполне соответствует принятой здесь формулировке второго начала термодинамики также постулат Клаузиуса, который состоит в утверждении о невозможности перехода тепла от менее нагретого тела к более нагретому без компенсации. Процесс, противоречащий постулату Клаузиуса, протекает с уменьшением энтропии; это свойство энтропии было показано с самого начала.
Услуги по физике:
- Заказать физику
- Заказать контрольную работу по физике
- Помощь по физике
Лекции по физике:
- Физические величины и их измерение
- Основные законы механики
- Прямолинейное равномерное движение
- Прямолинейное равнопеременное движение
- Сила
- Масса
- Взаимодействия тел
- Механическая энергия
- Импульс
- Вращение твердого тела
- Криволинейное движение тел
- Колебания
- Колебания и волны
- Механические колебания и волны
- Бегущая волна
- Стоячие волны
- Акустика
- Звук
- Звук и ультразвук
- Движение жидкости и газа
- Молекулярно-кинетическая теория
- Молекулярно-кинетическая теория строения вещества
- Молекулярно — кинетическая теория газообразного состояния вещества
- Теплота и работа
- Температура и теплота
- Термодинамические процессы
- Идеальный газ
- Уравнение состояния идеального газа
- Изменение внутренней энергии
- Переход вещества из жидкого состояния в газообразное и обратно
- Кипение, свойства паров, критическое состояние вещества
- Водяной пар в атмосфере
- Плавление и кристаллизация
- Тепловое расширение тел
- Процессы перехода из одного агрегатного состояния в другое
- Тепловое расширение твердых и жидких тел
- Свойства газов
- Свойства жидкостей
- Свойства твёрдых тел
- Изменение агрегатного состояния вещества
- Тепловые двигатели
- Электрическое поле
- Постоянный ток
- Переменный ток
- Магнитное поле
- Электромагнитное поле
- Электромагнитное излучение
- Электрический заряд (Закон Кулона)
- Электрический ток в металлах
- Электрический ток в электролитах
- Электрический ток в газах и в вакууме
- Электрический ток в полупроводниках
- Электромагнитная индукция
- Работа, мощность и тепловое действие электрического тока
- Термоэлектрические явления
- Распространение электромагнитных волн
- Интерференционные явления
- Рассеяние
- Дифракция рентгеновских лучей на кристалле
- Двойное лучепреломление
- Магнитное поле и электромагнитная индукция
- Электромагнитные колебания и волны
- Природа света
- Распространение света
- Отражение и преломление света
- Оптические приборы и зрение
- Волновые свойства света
- Действия света
- Линзы и получение изображений с помощью линз
- Оптические приборы и глаз
- Фотометрия
- Излучение и спектры
- Квантовые свойства излучения
- Специальная теория относительности в физике
- Теория относительности
- Квантовая теория и природа поля
- Строение и свойства вещества
- Физика атомного ядра
- Строение атома
Свойства энтропии Зависимость энтропии от объема
Рассмотрим,
как изменится энтропия одного моля газа
при изменении объема системы.
Вместо
отношения термодинамических вероятностей
подставим соответствующую зависимость
(3.7) для 1 моля газа:
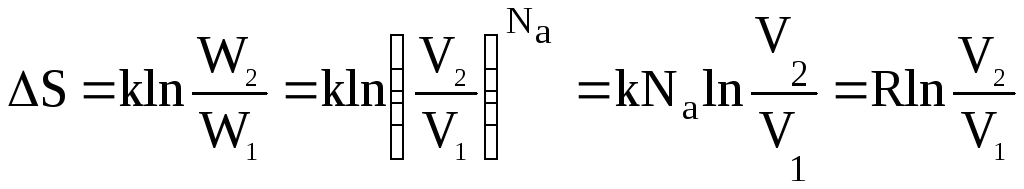
R
= 8,31 Дж/мольК,
следовательно:
Дж/моль
К
(11)
Из
этого уравнения следует, что процессы,
сопровождающиеся увеличением объема
системы при сохранении числа молекул,
участвующих в процессе, протекают с
увеличением энтропии системы.
Зависимость энтропии от давления
Из
уравнения состояния идеального газа
следует, что для 1 моля газа:
.
Подставляя
это выражение в уравнение (3.9), получим
для изотермического (протекающего при
постоянной температуре) процесса:
(12)
При
увеличении давления энтропия системы
уменьшается.
Если
давление выразить в атмосферах,
атмосферное давление обозначить ро
(напомним, что ро
= 1, а энтропию при этом давлении
So,
то получим:
,
или
энтропия
при давлении p
равна:
|
|
(13) |
Следует
обратить внимание, что в уравнении (13)
р
выражено
в абсолютных атмосферах. Если в условиях
задачи давление дается в атмосферах
избыточных, необходимо перевести его
в абсолютные:
рабс.
= ризб.
+1.
Полученная
зависимость (13) характерна только для
газовой фазы, на энтропию конденсированных
(твердых, жидких) систем изменение
давления практически не оказывает
влияние, а влияют такие факторы, как
тип кристаллической решетки, прочность
связей и т.д.
Так,
величины энтропии твердого фосфора
значительно различаются в зависимости
от типа кристаллической решетки («белая»
или «красная» модификация):
Sо298,Р(бел)
= 41,09 Дж/моль·К; Sо298,Р(кр)
= 22,8 Дж/моль·К.
Зависимость энтропии от температуры
С
повышением температуры энтропия
возрастает.
Действительно
температура повышается за счет подвода
теплоты (по мерее увеличения температуры
становится возможным все большее число
состояний, так как молекулы могут
переходить в состояние со все более
высокими значениями энергии, что приводит
к увеличению термодинамической
вероятности),
При
постоянном давлении и небольшом изменении
температуры (СР
принимается
постоянной)
изменение энтропии системы можно
выразить как, (см. уравнение 8):
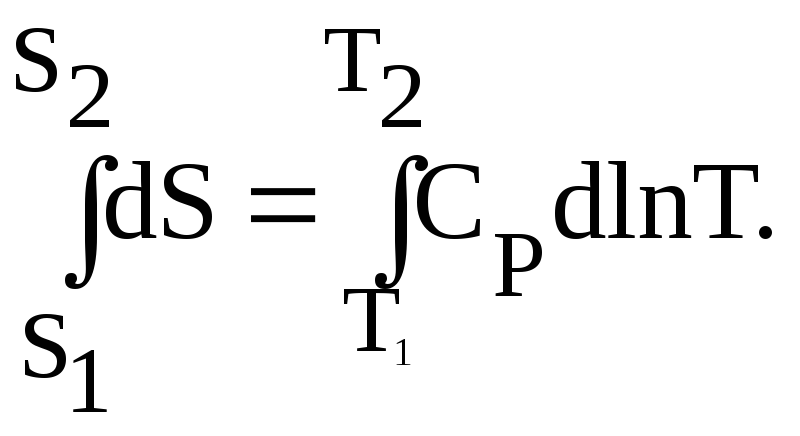
Интегрируя
это уравнение, получаем следующее
выражение:
(14а)
На
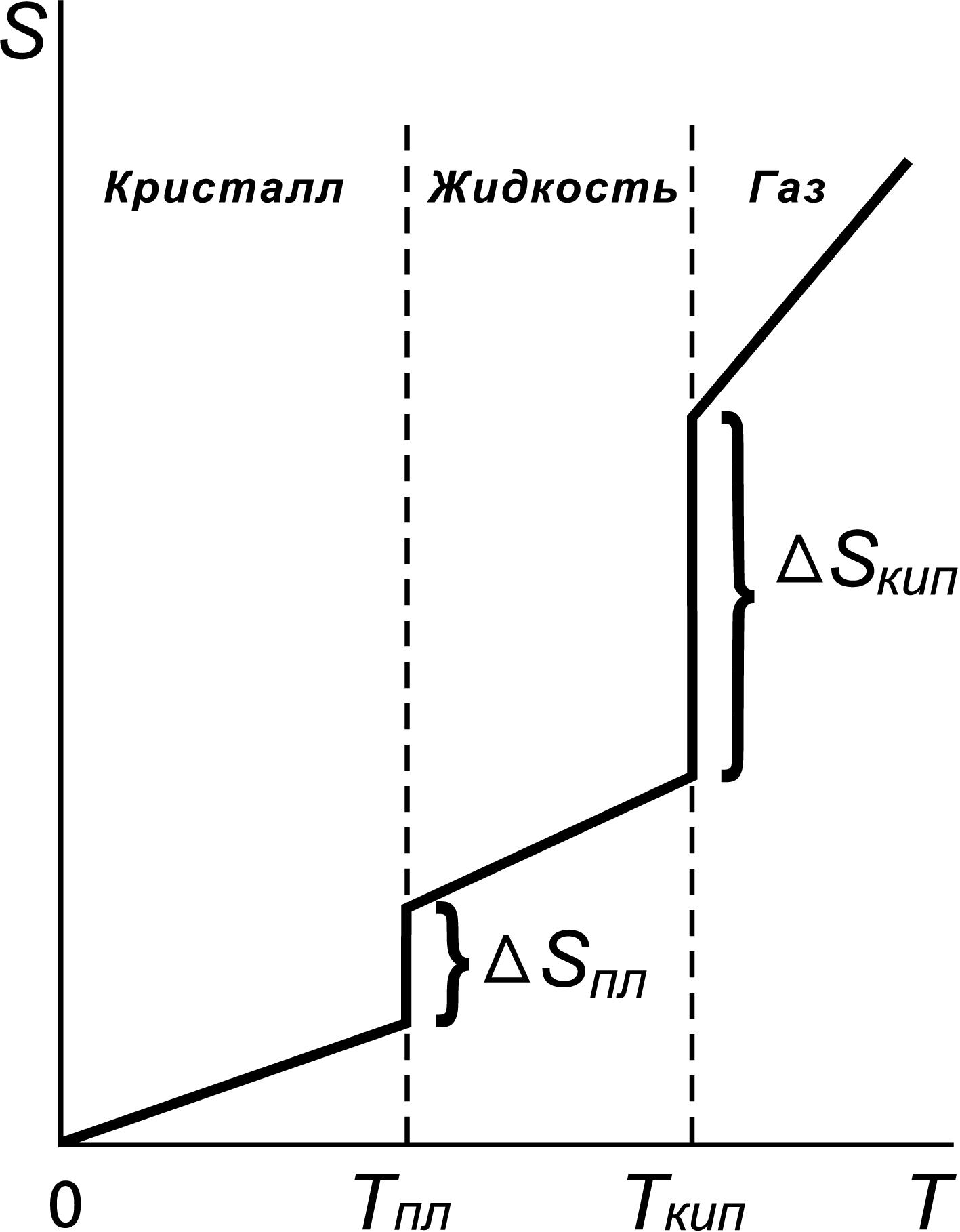
рис. 4. показан характер зависимости
энтропии вещества от температуры. Как
видно из рисунка 4, при фазовом переходе
(ф.п.) вещества (из твердого состояния
в жидкое, из жидкого в газообразное
состояние) энтропия вещества скачкообразно
возрастает, что связано с переходом в
состояние с большей неупорядоченностью.
Изменение
энтропии вещества при любых фазовых
переходах (ф.п.) равно:
|
|
(15) |
Зависимость
энтропии вещества от температуры при
постоянстве фазового состава определяется
уравнением (14а).
В
интервале умеренных температур (300 —
500К) этим изменением при ориентировочных
расчетах часто пренебрегают.
Уравнение
температурной зависимости энтропии 1
моля вещества в пределах одного фазового
состояния:
,
(16)
где
Ср
–
мольная теплоемкость при р = const.
Рис.
4. Зависимость энтропии вещества от
температуры.
Принимая
Ср
= const
в интервале температур Т1
и Т2
получаем
.
(17)
Обратите
внимание, что зависимость на рис.4 выходит
из начала координат. При температуре
равной абсолютному нулю тепловое
движение отсутствует, все атомы в
идеальном кристалле занимают строго
определенные места в пространстве.
Такое состояние системы может быть
реализовано единственным способом,
поэтому при этом W
= 1, а S
= 0. Это третий
закон термодинамики, называемый
также
постулатом Планка.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #




































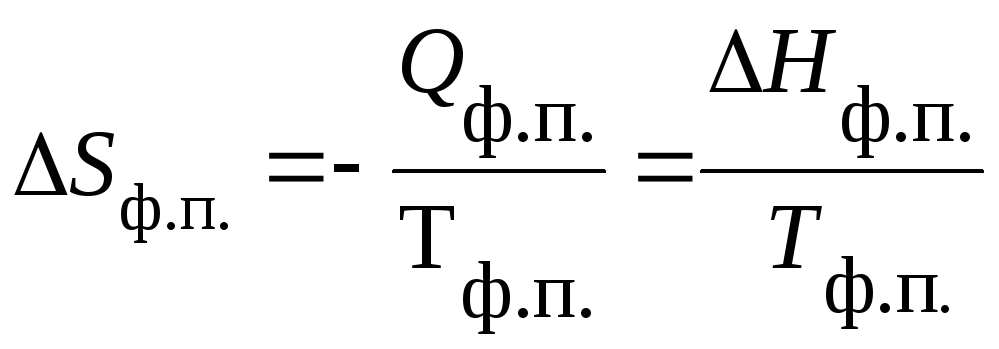 .
.