Загрузить PDF
Загрузить PDF
В атомах одного и того же элемента число протонов неизменно, в то время как число нейтронов может меняться. Зная, сколько нейтронов содержится в конкретном атоме, вы сможете определить, является ли он обычным атомом или изотопом, который будет иметь меньшее или большее количество нейтронов.[1]
Определить количество нейтронов в атоме — довольно просто. Все, что вам нужно сделать для расчета количества нейтронов в атоме или изотопе, — это следовать нашим инструкциям и держать под рукой периодическую таблицу.
-
1
Найдите элемент в периодической таблице. Для примера мы будем рассматривать осмий (Os), который находится в шестом периоде (шестой ряд сверху).
-
2
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер — это количество протонов в одном атоме этого элемента. Для осмия это число 76, то есть в одном атоме осмия содержится 76 протонов.
- Число протонов неизменно, именно оно и делает элемент элементом.
-
3
Найдите атомную массу элемента. Это число обычно находится под символом элемента. Обратите внимание, что в варианте периодической системы в нашем примере атомная масса не приведена (это не всегда так; во многих вариантах периодической системы атомная масса указана). Атомная масса осмия — 190,23.
-
4
Округлите атомную массу до ближайшего целого числа. В нашем примере 190,23 округляется до 190.
- Атомная масса — среднее число изотопов конкретного элемента, обычно она не выражается целым числом.
-
5
Вычтите атомный номер из атомной массы. Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. Цифры после десятичной запятой относятся к очень малой массе электронов в атоме. В нашем примере: 190 (атомный вес) — 76 (число протонов) = 114 (число нейтронов).
-
6
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
-
N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
Реклама
-
N = M – n
-
1
Найдите элемент в периодической таблице. В качестве примера мы будем рассматривать изотоп углерода 14С. Поскольку неизотопный углерод 14С есть просто углерод С, найдите углерод в периодической таблице (второй период или второй ряд сверху).
-
2
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер – это количество протонов в одном атоме этого элемента. Углерод находится под номером 6, то есть один атом углерода имеет шесть протонов.
-
3
Найдите атомную массу. В случае изотопов делать это очень просто, так как они названы в соответствии с их атомной массой. В нашем случае у углерода 14С атомная масса равна 14. Теперь мы знаем атомную массу изотопа; последующий процесс расчета такой же, как и для определения числа нейтронов в атомах (не изотопах).
-
4
Вычтите атомный номер из атомной массы. Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. В нашем примере: 14 (атомная масса) — 6 (число протонов) = 8 (число нейтронов).
-
5
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
-
N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
Реклама
-
N = M – n
Советы
- Протоны и нейтроны составляют практически абсолютную массу элементов, в то время как электроны и прочие частицы составляют крайне незначительную массу (эта масса стремится к нулю). Так как один протон имеет примерно ту же массу, что и один нейтрон, а атомное число представляет собой число протонов, то можно просто вычесть число протонов от общей массы.
- Осмий — металл в твердом состоянии при комнатной температуре, получил свое название от греческого слова «osme» — запах.
- Если вы не уверены, что значит какое-то число в периодической таблице, запомните: таблица, как правило, строится вокруг атомного номера (то есть числа протонов), который начинается с 1 (водород) и растет на одну единицу слева направо, заканчиваясь на 118 (Оганесон). Это потому, что число протонов в атоме определяет сам элемент и такое число — наиболее легкий способ систематизации элементов (например, атом с 2 протонами — всегда гелий, так же, как и атом с 79 протонами — всегда золото).
Реклама
Об этой статье
Эту страницу просматривали 193 556 раз.
Была ли эта статья полезной?
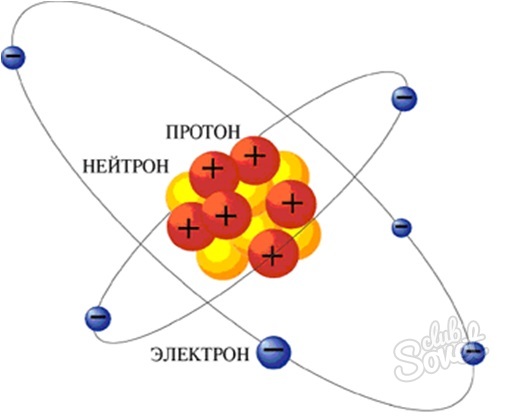
Мы знаем, что масса атома определяется массой ядра. Ядро состоит из протонов и нейтронов, относительные массы которых равны (1). Масса ядра равна сумме масс протонов и нейтронов. Число протонов определяем по порядковому номеру элемента. Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Пример:
фтор — элемент № (9). Его относительная атомная масса равна (19).
В ядре атома фтора — (9) протонов и (19) (–) (9) (=) (10) нейтронов.
Рубидий — элемент № (37). Его относительная атомная масса равна (85).
В ядре атома рубидия — (37) протонов и (85) (–) (37) (=) (48) нейтронов.
Нуклиды
Вид атомов с определённым числом протонов и нейтронов в ядре называется нуклидом.
Нуклид обозначается следующим образом: внизу слева записывается число протонов (Z) (порядковый номер), вверху слева указывается массовое число (A) (сумма чисел протонов и нейтронов) —
RZA
, например:
C612
,
Se3479
.
Для обозначения нуклидов используют и другие способы записи:
углерод — (12),
C
— (12),
C12
;
селен — (79),
Se
— (79),
Se79
.
Изотопы
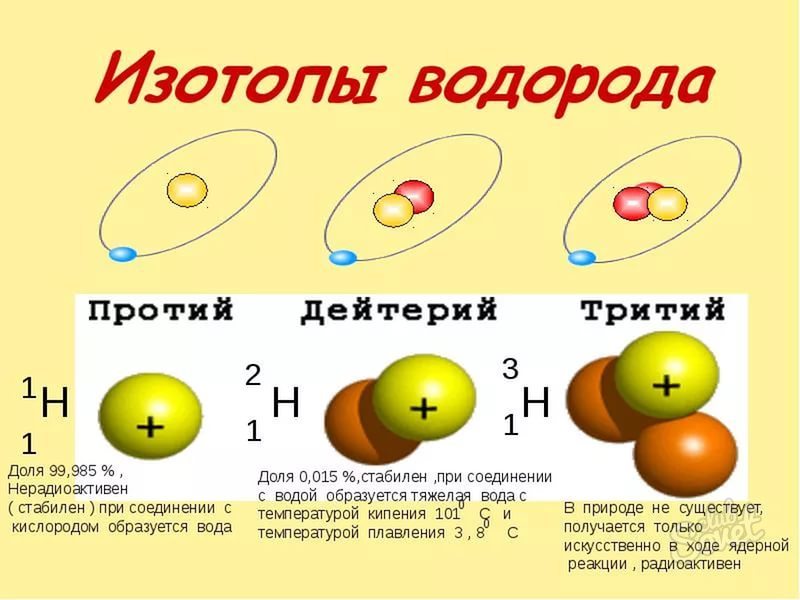
Атомы одного и того же химического элемента могут иметь разные массы. Существуют атомы водорода с массами (1), (2) и (3), атомы хлора с массами (35) и (37) и т. д.
Разновидности атомов одного химического элемента, имеющие разные атомные массы, называют изотопами.
С учётом знаний о строении ядра это определение можно сформулировать по-другому.
Изотопы — разновидности атомов с одинаковым числом протонов в ядре (зарядом ядра), но разным числом нейтронов.
Значит, изотопы отличаются только числом нейтронов.
Рис. (1). Изотопы водорода
Протоны определяют свойства атома, то есть придают ему индивидуальность. А нейтроны не влияют на свойства атома, а отражаются на его массе. Поэтому все изотопы одного и того же элемента химически неотличимы.
Химический элемент — это вид атомов с определённым зарядом ядра.
Относительная атомная масса элемента
Большинство химических элементов существуют в виде смеси изотопов. Приведённая в Периодической таблице относительная атомная масса элемента — это средняя величина атомных масс всех его изотопов.
Пример:
определим относительную атомную массу хлора. (25) % его атомов — это атомы с массой (37), а (75) % — с массой (35). Найдём среднее значение:
·25+35
·75)100
= 35,5.
Источники:
Рис. 1. Изотопы водорода © ЯКласс
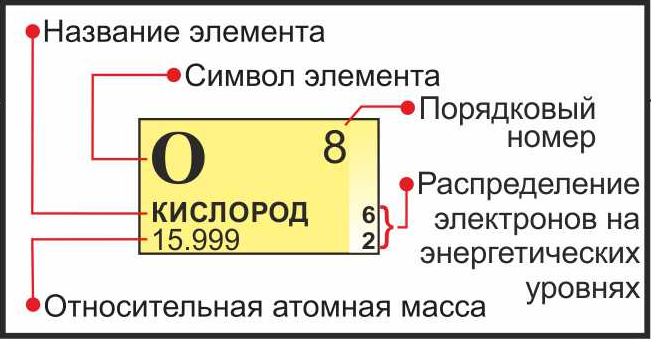
Химический элемент
Химический элемент — совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов
в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.

Изучая подобную карточку химического элемента, можно узнать о нем многое:
- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего
уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную
конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов
равно числу электронов.

Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
27 — 13 = 14
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия,
кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Изотопы (греч. isos — одинаковый + topos — место) — общее название разновидностей одного и того же химического элемента,
имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы — это самые распространенные
на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.

В таблице Д.И. Менделеева представлен самый распространенный из трех — протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У
дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы — атомы одного и того же химического элемента, различающиеся числом нейтронов.
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который
включен в таблицу Д.И. Менделеева.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Как найти нейтроны
Под запросом “Как найти нейтроны” понимается метод поиска числа нейтронов в атоме. Нейтрон – это тяжелая частица, которая не имеет электрического заряда и вместе с протоном составляет атомное ядро элемента. Число нейтронов в атоме определяется с помощью таблицы Менделеева.
1
Как найти нейтроны – ищем число нейтронов в атомах
- Берем таблицу Менделеева и находим нужный элемент.
- Как вы знаете, химические элементы расположены не случайным образом. Порядковый номер элемента соответствует числу протонов, находящихся в одном атоме элемента – атомному номеру. Вот он нам и нужен. Это самое крупное число в ячейке, его нетрудно обнаружить, так как элементы следуют друг за другом практически по порядку (по возрастанию).
- Запоминаем атомный номер.
- Находим массу атома. Это значение также располагается в ячейке элемента периодической системы, чье количество нейтронов мы ищем. Как правило, масса записана более мелким шрифтом, чем номер атома, в виде десятичной дроби. У более сложных элементов заключена в квадратные скобки.
- Для расчетов атомную массу округляем до целого числа.
- Так как ядро атома состоит из нейтронов и протонов, то путем вычитания из массы атома протонов (атомного номера), мы получим величину содержания нейтронов в атоме данного элемента.
2
Как найти нейтроны – пример
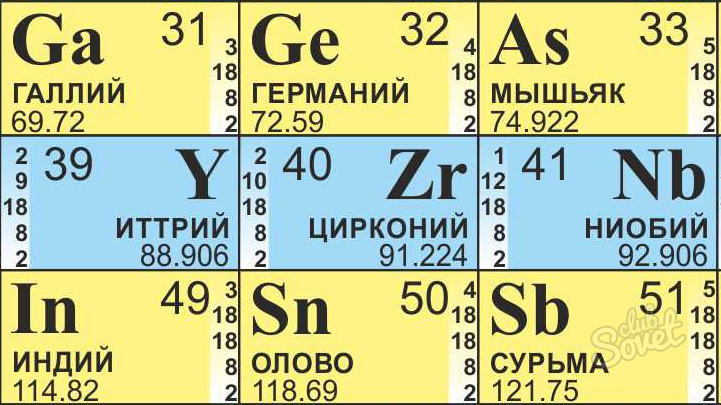
- Например, нам нужно найти, сколько нейтронов находится в атоме Циркония.
- Будем использовать формулу: N = M – n, где:
М – атомная масса, n – атомный номер (число протонов), N – число нейтронов.
- Находим Цирконий в таблице Менделеева, для химических расчетов она всегда должна быть под рукой.
- Его атомная масса равна 91,22, округляем до 91.
- Атомный номер равен 40.
- Получаем, что в атоме Циркония находится 51 (N = 91 – 40) нейтрон.
3
Как найти нейтроны – находим сколько нейтронов у изотопов
- Изотопы – это разновидности одного и того же элемента, но имеющие различную массу атомов. Но атомный номер, который мы научились искать выше, у них совпадает.
- Нужно знать, что все изотопы определенного элемента помещаются в одну ячейку в таблице Менделеева.
- Раз атомный номер у изотопов одного и того же элемента совпадает, значит нам нужно лишь найти атомную массу для расчета величины нейтронов.
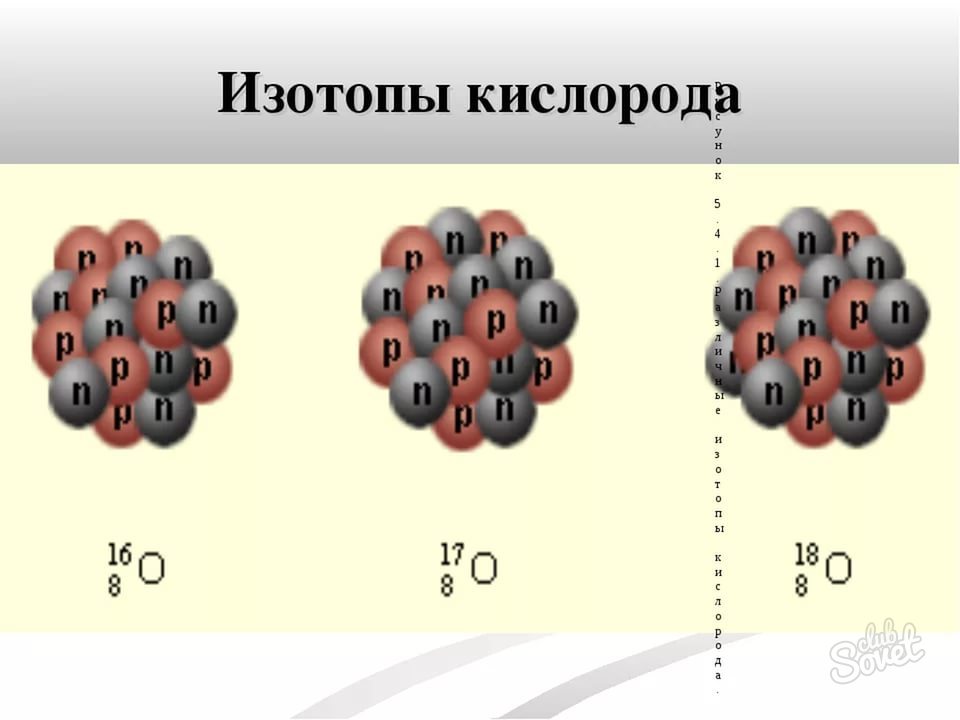
- Атомную массу изотопа найти очень просто – она заключена в самом названии изотопа. Например, О-16, О-17, О-18 – изотопы кислорода с атомной массой 16, 17 и 18 соответственно. Иногда атомную массу записывают как верхний индекс слева от символа хим. элемента.
- Таким образом, нам известны все составляющие для формулы. Нам не составит труда вычислить, какое количество нейтронов находится в изотопе.
4
Как найти нейтроны – пример, изотоп О-17
- Атомный номер всех изотопов кислорода, как и самого элемента равен 8.
- Атомная масса указана в названии изотопа – она равна 17.
- Вычисляем по формуле N = M – n, что количество нейтронов в атоме изотопа О-17 равно 9 (17 – 8).
Теперь вы знаете, как рассчитать число нейтронов в атоме любого элемента и изотопа. Конечно, для расчетов вам всегда понадобится иметь под рукой периодическую таблицу Менделеева.
Download Article
Download Article
Although all atoms of the same element contain the same number of protons, their number of neutrons can vary. Knowing how many neutrons are in a particular atom can help you determine if it’s a regular atom of that element or an isotope, which will have either extra or fewer neutrons.[1]
Determining the number of neutrons in an atom is fairly simple and doesn’t even require any experimentation. To calculate the number of neutrons in a regular atom or an isotope, all you need to do is follow these instructions with a periodic table in hand.
-
1
Locate the element on the periodic table. For this example, we’ll look at osmium (Os), which is in the sixth row down.[2]
-
2
Find the element’s atomic number. This tends to be the most visible number pertaining to a given element and usually sits above the element symbol, either in the middle of the box or in the upper left corner. (On the chart we’re using, in fact, no other numbers are listed.) The atomic number is the number of protons in a single atom of that element.[3]
Os is number 76, meaning one atom of osmium has 76 protons.- The proton number never changes in an element; it’s basically what makes that element that element.[4]
Advertisement
- The proton number never changes in an element; it’s basically what makes that element that element.[4]
-
3
Find the element’s atomic weight. This number is usually found beneath the atomic symbol. Note that the chart in this example is based solely on atomic number and doesn’t list the atomic weight. This won’t always usually be the case. Osmium has an atomic weight of 190.23.[5]
-
4
Round off the atomic weight to the nearest whole number to find the atomic mass.[6]
In our example, 190.23 would be rounded to 190, resulting in an atomic mass of 190 for osmium.- The atomic weight is an average of the isotopes of the element, so that’s why it’s not usually a whole number.[7]
- The atomic weight is an average of the isotopes of the element, so that’s why it’s not usually a whole number.[7]
-
5
Subtract the atomic number from the atomic mass. Since the vast majority of an atom’s mass is made up of its protons and neutrons, subtracting the number of protons (i.e. the atomic number) from the atomic mass will give you the calculated number of neutrons in the atom. The numbers after the decimal point represent the usually very small mass of the electrons in the atom. In our example, this is: 190 (atomic weight) – 76 (number of protons) = 114 (number of neutrons).[8]
-
6
Remember the formula. To find the number of neutrons in the future, simply use this formula:[9]
-
N = M – n
- N = number of Neutrons
- M = atomic Mass
- n = atomic number
-
N = M – n
Advertisement
-
1
Locate the element on the periodic table. As an example, we’ll look at the carbon-14 isotope. Since the non-isotopic form of carbon-14 is simply carbon (C), find carbon on the periodic table (in the second row down).[10]
-
2
Find the element’s atomic number. This tends to be the most visible number pertaining to a given element and usually sits above the element symbol. (On our example chart, in fact, no other numbers are listed.) The atomic number is the number of protons in a single atom of that element.[11]
C is number 6, meaning one atom of carbon has 6 protons. -
3
Find the atomic mass. This is incredibly easy with isotopes, as they are named according to their atomic mass. Carbon-14, for example, has an atomic mass of 14. Once you find the atomic mass of the isotope, the process is the same as it is for finding the number of neutrons in a regular atom.[12]
-
4
Subtract the atomic number from the atomic mass. Since the vast majority of an atom’s mass is found its protons and neutrons, subtracting the number of protons (i.e. the atomic number) from the atomic mass will give you the calculated number of neutrons in the atom. In our example, this is: 14 (atomic mass) – 6 (number of protons) = 8 (number of neutrons).
-
5
Remember the formula. To find the number of neutrons in the future, simply use this formula:[13]
-
N = M – n
- N = number of Neutrons
- M = atomic Mass
- n = atomic number
-
N = M – n
Advertisement
Add New Question
-
Question
How do you find the number of electrons, neutrons and protons?
Bess Ruff is a Geography PhD student at Florida State University. She received her MA in Environmental Science and Management from the University of California, Santa Barbara in 2016. She has conducted survey work for marine spatial planning projects in the Caribbean and provided research support as a graduate fellow for the Sustainable Fisheries Group.
Environmental Scientist
Expert Answer
Support wikiHow by
unlocking this expert answer.Fortunately, there’s a WikiHow article that can help you! It’s called Find the Number of Protons, Neutrons, and Electrons. While the answer section here doesn’t allow links, you can search for it in the search box at the top of the page using this title.
-
Question
How many neutrons are in oxygen?
Atomic mass minus the atomic number. Atomic mass of Oxygen is 16, and the atomic number is 8. 16 — 8 = 8.
-
Question
Where can I locate the atomic mass in a modern periodic table?
The modern periodic table has the atomic number on the top of each element’s symbol and the atomic mass right below the symbol.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Protons and neutrons make up almost all of the weight of the elements, whereas electrons and miscellaneous particles represent negligible mass (approaching zero mass). Since one proton has approximately the same weight as one neutron, and the atomic number represents the number of protons, we can simply subtract the number of protons from the total mass.[14]
-
If you’re ever unsure which number is which in a periodic table, just remember that the table is usually designed around the atomic number (i.e. number of protons), which starts at 1 (hydrogen) and ascends one unit at a time from left to right, ending at 118 (oganesson). This is because the number of protons in an atom determines what that atom is, making it the easiest elemental trait to organize by. (Ex. an atom with 2 protons is always helium, just as an atom with 79 protons is always gold.)
Advertisement
References
About This Article
Article SummaryX
To find the number of neutrons in an atom, you just need a periodic table that lists the atomic number as well as the atomic weight of each element. First, locate the elemental symbol for your atom on the periodic table. Then, find the atomic number for the element. It’s usually located somewhere above the element symbol. This number represents the number of protons in the atom. For instance, the atomic number of niobium (Nb) is 41, meaning that a niobium atom has 41 protons. Next, find the atomic weight of the element, which is usually underneath the element symbol. Round up the atomic weight to the nearest whole number. Niobium has an atomic weight of 92.906, so you would round it up to 93. Finally, subtract the number of protons from the rounded up atomic weight to find the number of neutrons in the atom. In the case of niobium, 93 minus 41 is 52, which means that a niobium atom has 52 neutrons. To find out how to calculate the number of neutrons in an isotope, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 1,161,633 times.
Reader Success Stories
-
«I didn’t know what atomic mass was, and I didn’t know that we had to round it off. So it really helped.…» more