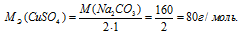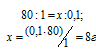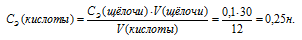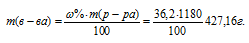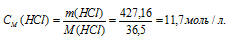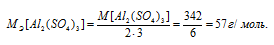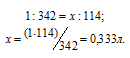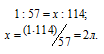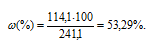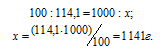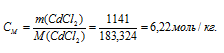Вопрос от #37966
1193 дня назад
Какой объем раствора CuSO4 с массовой долей ω2(CuSO4)=0,54 и
плотностью ρ2=1,3 г/мл можно приготовить из 120 мл раствора с массовой
долей ω1(CuSO4) = 42 % (ρ1 = 1,36 г/мл)?
SashaB11
6 лет назад
Светило науки — 757 ответов — 3106 раз оказано помощи
Мне удобно искать через молярную конц. Cm = Cn÷z. z(CuSO4) = 2. Cn = 0,1÷2 = 0,05 М.
Дано:
См = 0,05 моль/л
m(CuSO4) = 8 г
Найти:
Vр-ра
Решение:
Vp-pa = n(CuSO4)÷Cm
n(CuSO4) = m÷Mr
Mr(CuSO4) = 63,5+32+64 = 159,5 г/моль
n(CuSO4) = 8÷159,5 = 0,05 моль
Vp-pa = 0,05÷0,05 = 1 л
Ответ: Vр-ра = 1л
(2 оценки)
Приготовление раствора медного купороса
Вычислить массу медного купороса (CuSO4 ∙ 5H2O) и воды (H2O), необходимых для приготовления 640 грамм раствора с массовой долей сульфата меди (II) (CuSO4) 10%.
Решение задачи
Найдем, какая масса сульфата меди (II) содержится в 640 г 10-процентного раствора по формуле:
Если раствор 10-процентный, то массовая доля сульфата меди (II) (CuSO4) в нем 0,1.
Получаем:
m (CuSO4) = 640 ∙ 0,1 = 64 (г).
Рассчитаем молярные массы сульфата меди (II) (CuSO4) и медного купороса (CuSO4 ∙ 5H2O):
M (CuSO4) = 160 (г/моль).
M (CuSO4 ∙ 5H2O) = 160 + 5 ∙ 18 = 250 (г/моль).
Учитывая, что в 1 моль медного купороса (CuSO4 ∙ 5H2O) содержится 1 моль сульфата меди (II) (CuSO4)и что молярные массы медного купороса (CuSO4 ∙ 5H2O) и сульфата меди (II) (CuSO4) соответственно равны 250 и 160 г/моль, вычислим массы данных веществ по формуле, устанавливающей связь между массой и химическим количеством вещества:
Получаем:
m (CuSO4) = 160 (г).
m (CuSO4 ∙ 5H2O) = 250 (г).
Найдем, какое количество (в г) кристаллогидрата (медного купороса (CuSO4 ∙ 5H2O)) содержит 64 г сульфата меди (II) (CuSO4). Составим пропорцию:
в 250 г CuSO4 ∙ 5H2O содержится 160 г
в г CuSO4 ∙ 5H2O содержится 64 г CuSO4
Откуда:
Таким образом, масса медного купороса (CuSO4 ∙ 5H2O), которую необходимо взять для приготовления заданного раствора, равна 100 г.
Вычислим массу воды, которую нужно взять для приготовления заданного раствора, по формуле:
m (H2O) = 640 – 100 = 540 (г).
Ответ: масса медного купороса равна 100 грамм, масса воды равна 540 грамм.
-
Жануся
3 сентября, 02:03
0
Нормальная концентрация: кол-во грамм-эквивалентов вещества содержащееся в 1 литре раствора. Найдем грамм-эквивалент CuSO4:Э (CuSO4) = M (CuSO4) / (колич. катионов меди*заряд катиона меди) = = 160/2 = 80 г. Итак по определению: 0,1 = 8 / (80*х), где х — искомый объем в литрах. х = 1 литр Ответ: 1 л.
- Комментировать
- Жалоба
- Ссылка
Найди верный ответ на вопрос ✅ «В каком объеме 0,1 н раствора содержится 8 г сульфата меди? …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Определение концентрации веществ в растворах | Нормальность вещества
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:
где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12 мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) . V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) — нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) — объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:
где

Тогда
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:
где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:
где

Тогда
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
Теперь рассчитаем моляльность раствора:
Ответ: 53,3%; 6,22 моль/кг.