Какова масса атома азота (в граммах)?
Решение задачи
Запишем формулу расчета массы атома азота:
где:
m (N) — масса атома азота;
Ar (N) – относительная атомная масса химического элемента азота;
1,66 ⋅ 10-24 г – абсолютная масса атомной единицы массы.
Атомная единица массы (а.е.м.) – 1/12 части массы атома углерода 12C принятая за единицу.
Учитывая, что относительная атомная масса элемента азота равна 14, найдем по формуле массу атома азота:
m (N) = 14 ⋅ 1,66 ⋅ 10-24 г = 23,24 ⋅ 10-24 (г).
Относительная атомная масса химического элемента (Ar) – число, показывающее во сколько раз данный атом тяжелее углерода 1/12 части атома 12C.
Ответ:
масса атома азота равна 23,24 ⋅ 10-24 грамм.
Азот и его характеристики
Общая характеристика азота
Большая часть азота находится в свободном состоянии. Свободный азот является главной составной частью воздуха, который содержит 78,2% (об.) азота. Неорганические соединения азота не встречаются в природе в больших количествах, если не считать натриевую селитру NaNO3, образующую мощные пласты на побережье Тихого океана в Чили. Почва содержит незначительные количества азота, преимущественно в виде солей азотной кислоты. Но в виде сложных органических соединений – белков – азот входит в состав всех живых организмов.
Общее содержание азота в земной коре (включая гидросферу и атмосферу) составляет 0,04% (масс.).
В виде простого вещества азот – это бесцветный газ, не имеющий запаха и весьма мало растворимый в воде. Он немного легче воздуха: масса 1 л азота равна 1,25 г.
Атомная и молекулярная масса азота
Относительной атомной массой элемента называют отношение массы атома данного элемента к 1/12 массы атома углерода. Относительная атомная масса безразмерна и обозначается Ar (индекс «r» — начальная буква английского слова relative, что в переводе означает «относительный»). Относительная атомная масса атомарного азота равна 14,0064 а.е.м.
Массы молекул, также как массы атомов выражаются в атомных единицах массы. Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Относительной молекулярной массой вещества называют отношение массы молекулы данного вещества к 1/12 массы атома углерода, масса которого равна 12 а.е.м. Известно, что молекула азота двухатомна – N2. Относительная молекулярная масса молекулы азота будет равна:
Mr(N2) = 14,0064× 2 ≈ 28.
Изотопы азота
В природе азот существует в виде двух стабильных изотопов 14N (99,635%) и 15N (0,365%). Их массовые числа равны 14 и 15 соответственно. Ядро атома изотопа азота 14N содержит семь протонов и семь нейтронов, а изотопа 15N – такое же количество протонов и шесть нейтронов.
Существует четырнадцать искусственных изотопов азота с массовыми числами от 10-ти до 13-ти и от 16-ти до 25-ти, из которых наиболее стабильным является изотоп 13Nс периодом полураспада равным 10 минут.
Ионы азота
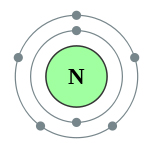
На внешнем энергетическом уровне атома азота имеется пять электронов, которые являются валентными:
1s22s22p3.
Схема строения атома азота представлена ниже:
В результате химического взаимодействия азот может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
N0 –5e → N2+;
N0-4e → N4+;
N0-3e → N3+;
N0-2e → N2+;
N0-1e → N1+;
N0+1e → N1-;
N0+2e → N2-;
N0+3e → N3-.
Молекула и атом азота
Молекула азота состоит из двух атомов – N2. Приведем некоторые свойства, характеризующие атом и молекулу азота:
|
Энергия ионизации атома, эВ |
14,53 |
|
Сродство атома к электрону, эВ |
0,27 |
|
Относительная электроотрицательность |
3,07 |
|
Радиус атома, нм |
0,071 |
|
Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль |
945 |
Примеры решения задач
← Молярная и молекулярная масса
- Относительная молекулярная масса N: 14.0067
- Молярная масса N: 14.0067 г/моль (0.01401 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| N (азот) | 1 | 14.0067 | 14.0067 |
| 14.0067 |
Расчёт молярной и относительной молекулярной массы N
- Mr[N] = Ar[N] = 14.0067 = 14.0067
- Молярная масса (в кг/моль) = Mr[N] : 1000 = 14.0067 : 1000 = 0.01401 кг/моль
Электронная конфигурация атома азота
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
CH6OSi [62.14324]
C6H18N2Si [146.30602]
Калькулятор молекулярной массы

Как определить массу азота
Азот – это элемент с атомным номером 7 в периодической системе химических элементов, которая была открыта Д. И. Менделеевым. Обозначается азот символом N и имеет формулу N2. В нормальных условиях азот – это двухатомный газ, не имеющий цвета, запаха и вкуса. Именно из этого элемента на три четверти состоит наша земная атмосфера.
Инструкция
На сегодняшний день азот широко применяется в различного рода производстве. Так, соединения, содержащие этот элемент, используются при создании красителей, взрывчатых веществ, медикаментов и другой химической индустрии.
Газообразный азот обладает отличными свойствами, которые препятствуют гниению, разложению, окислению материалов. Его используют для продувки различных трубопроводов, для заполнения камер шин автомобилей и летательных аппаратов. Помимо этого азот применяется для изготовления аммиака, специальных азотных удобрений, в коксовом производстве и т.д.
Как найти массу азота знают, конечно же, только специалисты химики и физики, а формулы, приведенные чуть ниже, позволят вычесть и узнать массу этого вещества даже самым неопытным ученикам или студентам.
Итак, известно, что молекула азота имеет формулу N2, атомная масса или так называемая молярная масса равна 14,00674 а. е. м. (г/моль), а, следовательно, малярная масса молекулы азота будет равняться 14,00674 × 2 = 28,01348, округлите и получите 28.
Если необходимо определить массу молекулы азота в килограммах, то это можно сделать следующим способом: 28×1 а. е. м. = 28 × 1,6605402 (10) × 10 − 27 кг = 46,5 × 10−27 кг = 438.Определение массы азота позволит в дальнейшем без труда высчитывать формулы, содержащие массу молекулы азота, а так же находить необходимые компоненты, которые, к примеру, в химической или физической задаче неизвестны.
Видео по теме
Обратите внимание
В промышленности азот используют главным образом для получения аммиака, а также применяют для обеспечения инертной среды в различных химических процессах, часто на металлургических производствах при перекачке горючих жидкостей. Жидкий азот широко используют как хладагент, благодаря «замораживающим» свойствам его активно применяют в медицине, особенно в косметологии.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
| Группа | 15 | Температура плавления | -210,0 ° С, -346,0 ° F, 63,2 К |
| Период | 2 | Точка кипения | -195,795 ° С, -320,431 ° F, 77,355 К |
| Блокировать | п | Плотность (г см -3 ) | 0,001145 |
| Атомный номер | 7 | Относительная атомная масса | 14.007 |
| Состояние при 20 ° C | Газ | Ключевые изотопы | 14 с.ш. |
| Электронная конфигурация | [Он] 2с 2 2п 3 | Количество CAS | 7727-37-9 |
Использование и свойства элемента Азот
Объяснение изображения
Символ снопа пшеницы и молния отражают важность азота для живых существ. Азот важен для роста растений и может быть «зафиксирован» молнией или добавлен в почву в виде удобрений.
Внешность
Бесцветный газ без запаха.
Использует
Азот важен для химической промышленности. Из него делают удобрения, азотную кислоту, нейлон, красители и взрывчатые вещества. Чтобы получить эти продукты, азот сначала должен прореагировать с водородом с образованием аммиака. Это делается с помощью процесса Габера. Таким образом ежегодно производится 150 миллионов тонн аммиака.Газообразный азот также используется для создания инертной атмосферы. Его используют таким образом для консервирования продуктов, а в электронной промышленности при производстве транзисторов и диодов. Большое количество азота используется при отжиге нержавеющей стали и других сталеплавильных изделий. Отжиг – это термическая обработка, облегчающая обработку стали.Жидкий азот часто используется в качестве хладагента. Он используется для хранения спермы, яйцеклеток и других клеток для медицинских исследований и репродуктивных технологий. Он также используется для быстрой заморозки продуктов, помогая им сохранять влажность, цвет, вкус и текстуру.
Биологическая роль
Азот естественным образом циркулирует в живых организмах через «азотный цикл». Он усваивается зелеными растениями и водорослями в виде нитратов и используется для создания оснований, необходимых для построения ДНК, РНК и всех аминокислот. Аминокислоты – это строительные блоки белков.Животные получают азот, потребляя другие живые существа. Они переваривают белки и ДНК на составляющие их основания и аминокислоты, преобразовывая их для собственного использования.Микробы в почве превращают азотные соединения обратно в нитраты для повторного использования растениями. Запасы нитратов также пополняются азотфиксирующими бактериями, которые «фиксируют» азот непосредственно из атмосферы.Урожайность можно значительно повысить, добавив в почву химические удобрения, производимые из аммиака. При неосторожном использовании удобрения могут вымываться из почвы в реки и озера, вызывая быстрый рост водорослей. Это может блокировать свет, препятствуя фотосинтезу. Растворенный кислород скоро истощается, и река или озеро умирают.
Природное изобилие
Азот составляет 78% воздуха по объему. Его получают перегонкой жидкого воздуха. Ежегодно добывается около 45 миллионов тонн. В виде соединений он содержится во всех живых существах, а, следовательно, также в угле и других ископаемых видах топлива.
История химического элемента Азот
Химические свойства
| Атомный радиус, несвязанный (Å) | 1,55 | Ковалентный радиус (Å) | 0,71 |
| Сродство к электрону (кДж моль -1 ) | Нестабильный | Электроотрицательность (шкала Полинга) | 3,04 |
| Энергия ионизационной (кДж моль -1 ) | 1- й 1402,3282- й 2856.0923- й4578.1564 чт 7475,0575 чт 9444,9696 чт 53266,8357 чт 64360,168 чт- |
Состояния окисления и изотопы Азот
| Общие состояния окисления | 5, 4, 3, 2, -3 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 14 с.ш. | 14.003 | 99,636 | – | – | |
| 15 с.ш. | 15 000 | 0,364 | – | – |
Данные о давлении и температуре
| Удельная теплоемкость (Дж кг −1 K −1 ) | 1040 | Модуль Юнга (ГПа) | Неизвестно | |||||||
| Модуль сдвига (ГПа) | Неизвестно | Объемный модуль (ГПа) | Неизвестно | |||||||
| Давление газа | ||||||||||
| Температура (K) | 400600800100012001400160018002000 г.22002400 | |||||||||
| 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 г. | 2200 | 2400 |
| Давление (Па) | ———– | |||||||||
| – | – | – | – | – | – | – | – | – | – | – |
Связанные энтальпии
| Ковалентная связь Энтальпия (кДж моль -1 ) Найти в N – N 163 N 2 H 4 N = N 418 C 6 H 14 N 2 N≡N 944,7 № 2 C – N 304,6 Общее C = N 615 Общее C≡N 889,5 Общее H – N 390,8 NH 3 | ||
| Ковалентная связь | Энтальпия (кДж моль -1 ) | Найти в |
| N – N | 163 | N 2 H 4 |
| N = N | 418 | C 6 H 14 N 2 |
| N≡N | 944,7 | № 2 |
| C – N | 304,6 | Общее |
| C = N | 615 | Общее |
| C≡N | 889,5 | Общее |
| H – N | 390,8 | NH 3 |
