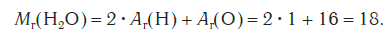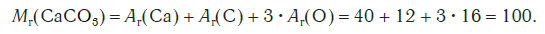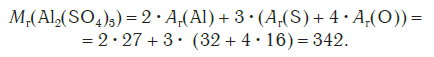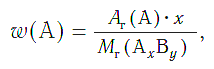- Относительная атомная и молекулярная масса
- Количество вещества. Постоянная Авогадро
- Молярная масса
- Молярный объем
- Задачи
п.1. Относительная атомная и молекулярная масса
Массы атомов и молекул, из которых состоят вещества, очень малы. Поэтому их чаще измеряют не в килограммах, а используют внесистемную единицу – атомную единицу массы.
Атомная единица массы – внесистемная единица, равная 1/12 массы свободного покоящегося атома углерода (^{12}mathrm{C}), находящегося в основном состоянии. $$ 1 text{а. е. м}approx 1,66cdot 10^{-27} text{кг} $$
Относительная атомная масса – это физическая величина, показывающая, во сколько раз масса данного атома больше атомной единицы массы: $$ A_rapprox frac{m_{at}}{1,66cdot 10^{-27}} $$
Относительную атомную массу проще всего найти, пользуясь таблицей Менделеева.
Например:
(A_r(mathrm{H})=1,00797 text{а. е. м}) – относительная атомная масса водорода
(A_r(mathrm{C})=12,01115 text{а. е. м}) – относительная атомная масса углерода
(A_r(mathrm{N})=14,0067 text{а. е. м}) – относительная атомная масса азота
(A_r(mathrm{O})=15,9994 text{а. е. м}) – относительная атомная масса кислорода
На практике при решении учебных задач относительные атомные массы округляют и единицу измерения а.е.м. не пишут.
Например: $$ A_r(mathrm{H})=1, A_r(mathrm{C})=12, A_r(mathrm{N})=14, A_r(mathrm{O})=16 $$
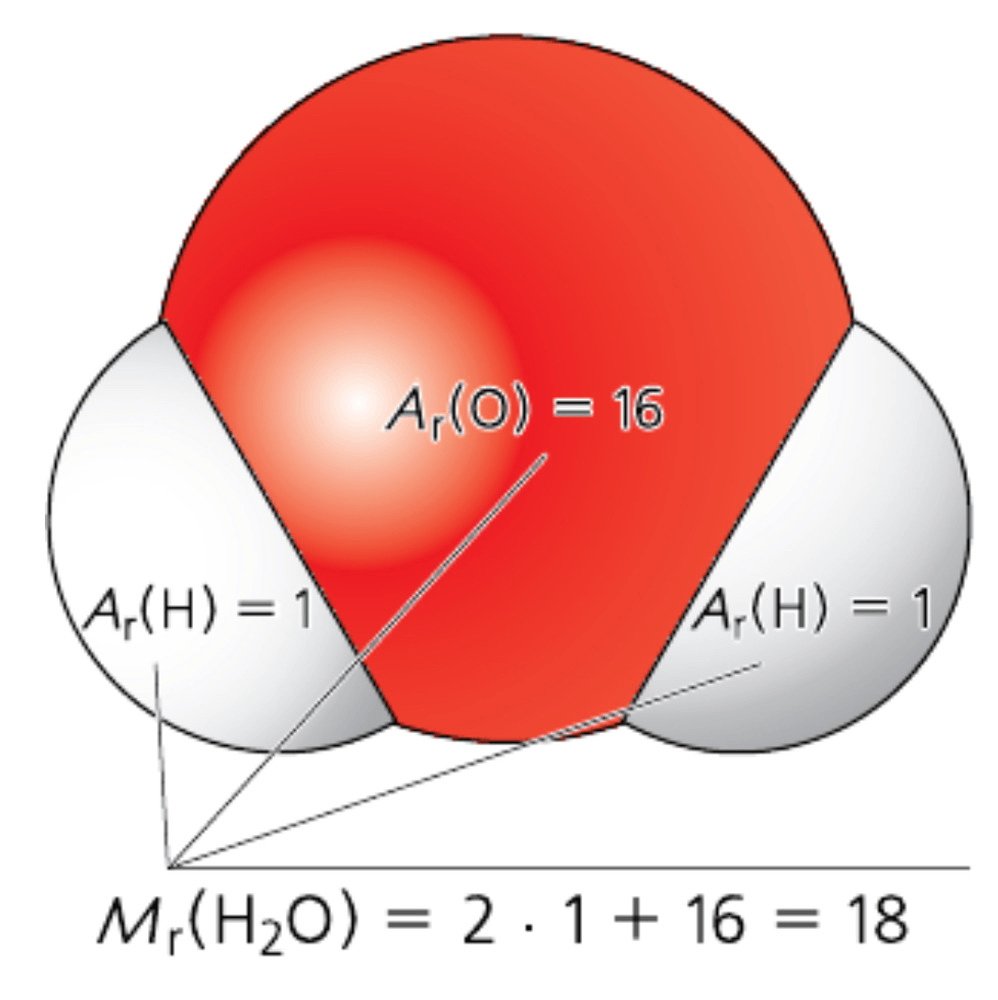
Относительная молекулярная масса вещества – это физическая величина, показывающая, во сколько раз масса одной молекулы данного вещества больше атомной единицы массы: $$ M_rapprox frac{m_{mol}}{1,66cdot 10^{-27}} $$ Относительная молекулярная масса равна сумме относительных атомных масс всех атомов, из которых состоит данное вещество: $$ M_r=sum A_r $$
Например:
Найдем относительную молекулярную массу молекулы воды (mathrm{H_2O}), которая состоит из двух атомов водорода и одного атома кислорода $$ M_r(mathrm{H_2O})=2A_r(mathrm{H})+A_r(mathrm{O})=2cdot 1+16=18 $$
Масса молекулы вещества равна произведению относительной молекулярной массы данного вещества на величину 1 а.е.м., выраженную в килограммах: $$ m_{mol}approx 1,66cdot 10^{-27}cdot M_r (text{кг}) $$
Например:
Масса молекулы водорода $$ m(mathrm{H_2O})=approx 1,66cdot 10^{-27}cdot 18approx 2,99cdot 10^{-26} (text{кг}) $$
п.2. Количество вещества. Постоянная Авогадро
Моль – количество вещества системы, содержащей столько же структурных элементов (атомов, молекул, ионов), сколько содержится атомов в углероде-12 массой 0,012 кг.
В 1 моле любого вещества содержится одинаковое количество частиц $$ N_Aapprox 6,022cdot 10^{23} $$ Число (N_A) называют постоянной Авогадро.
Количество вещества – физическая величина, равная отношению числа однотипных структурных элементов (атомов, молекул, ионов), содержащихся в веществе, к числу Авогадро: $$ nu=frac{N}{N_A} $$ Единицей измерения количества вещества в СИ является моль.
Например:
В 5 молях углерода будет содержаться (N=5cdot N_Aapprox 6,022cdot 10^{23}approx 3,01cdot 10^{24}) атомов углерода. Причём, всё равно, будут ли эти атомы углерода образовывать уголь, графит или алмаз.
Аналогично, в 5 молях воды будет (N=5cdot N_Aapprox 3,01cdot 10^{24}) молекул воды. Причём, независимо от того, в каком агрегатном состоянии находится вода: в виде пара, жидкости или льда.
Т.е., «количество вещества» всегда говорит нам о «количестве частиц», независимо от других параметров.
п.3. Молярная масса
Молярная масса – это масса 1 моля вещества.
Из определения 1 моля вещества и относительной молекулярной массы следует, что молярная масса равна $$ mu=M_rcdot 10^{-3}frac{text{кг}}{text{моль}} $$
Например:
Молярная масса воды $$ mu(mathrm{H_2O})=M_r(mathrm{H_2O})cdot 10^{-3}=18cdot 10^{-3}frac{text{кг}}{text{моль}} $$
Алгоритм определения молярной массы вещества с помощью таблицы Менделеева
Шаг 1. По таблице Менделеева найти относительные атомные массы (A_{ri}) для всех элементов, входящих в молекулу вещества.
Шаг 2. Найти относительную молекулярную массу как сумму всех относительных атомных масс $$ M_r=sum_i A_{ri} $$ Шаг 3. Записать молярную массу в виде $$ mu=M_rcdot 10^{-3}frac{text{кг}}{text{моль}} $$
Например:
Найдем молярную массу этилового спирта begin{gather*} A_r(mathrm{C})=12, A_r(mathrm{H})=1, A_r(mathrm{O})=16\ M_r(mathrm{C_2H_5OH})= 2A_r(mathrm{C})+6A_r(mathrm{H}) +A_r(mathrm{O})=2cdot 12+6cdot 1+16=46\ mu(mathrm{C_2H_5OH})=46cdot 10^{-3}frac{text{кг}}{text{моль}} end{gather*}
п.4. Молярный объем
Молярный объем – это объем 1 моля вещества.
Молярный объем равен отношению молярной массы к плотности вещества: $$ V_{mu}=frac{mu}{rho} $$
Например:
Молярный объем воды begin{gather*} V_{mu}(mathrm{H_2O})=frac{18cdot 10^{-3} text{кг/моль}}{10^3 text{кг/м}^3}=18cdot 10^{-6}frac{text{м}^3}{text{моль}}=18frac{text{cм}^3}{text{моль}}=18frac{text{мл}}{text{моль}} end{gather*} Т.е. 1 моль воды занимает объем 18 мл (столовая ложка).
При нормальных условиях (t=0°C, ρ=1 атм) молярные объемы всех идеальных газов одинаковы и равны: $$ V_{mu text{газ}}=22,4frac{text{л}}{text{моль}} $$
Это свойство газов часто используется при изучении различных веществ и явлений в физике и химии.
п.5. Задачи
Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы (mathrm{S_8}) содержится в этом кристалле? (Ответ округлите до двух значащих цифр).
Дано:
(m=16 text{г}=16cdot 10^{-3} text{кг})
(A_r=32)
(N_A=6,022cdot 10^{23})
__________________
(N-?)
Относительная молекулярная масса одной молекулы $$ M_r=8cdot A_r=8cdot 32=256 $$ Молярная масса $$ mu=256cdot 10^{-3}frac{text{кг}}{text{моль}} $$ Количество вещества в кристалле серы: $$ nu=frac{N}{N_A}=frac{m}{mu} $$ Количество молекул в кристалле серы: $$ N=frac{m}{mu}N_A $$ $$ N=frac{1,6cdot 10^{-3}}{256cdot 10^{-3}}cdot 6,022cdot 10^{23}approx 3,8cdot 10^{22} $$ Ответ: (3,8cdot 10^{22})
Задача 2*. В кислородном генераторе на космическом корабле было получено 1,6 кг кислорода (mathrm{O_2}). Одному космонавту по норме требуется 600 литров кислорода в сутки. Считая условия для газа приблизительно нормальными, определите, на сколько часов космонавту хватит полученного кислорода.
Дано:
(m=1,6 text{кг})
(V_t=600frac{text{л}}{text{сут}}=25frac{text{л}}{text{ч}})
(A_r=16)
(V_{mu}=22,4frac{text{л}}{text{моль}})
__________________
(t-?)
Относительная молекулярная масса молекулы кислорода $$ M_r=2cdot A_r=32 $$ Молярная масса кислорода $$ mu=32cdot 10^{-3}frac{text{кг}}{text{моль}} $$ Количество вещества в полученном кислороде $$ nu=frac{m}{nu}=frac{V}{V_{mu}} $$ Объем полученного кислорода $$ V=frac{m}{mu}=V_{mu} $$ Количество часов для дыхания одного человека begin{gather*} t=frac{V}{V_t}=frac{m}{mu}frac{V_{mu}}{V_t}\[6pt] t=frac{1,6 text{кг}}{32cdot 10^{-3} text{кг/моль}}cdot frac{22,4 text{л/моль}}{25 text{л/ч}}=44,8 text{ч} end{gather*} Ответ: 44,8 ч.
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер
[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Если
посмотреть в периодическую таблицу Д. И. Менделеева, то можно заметить, что все
элементы в ней расположены в клетках. В таких клетках изображён знак
химического элемента, его название. Вверху клетки указан порядковый, или
атомный, номер. Над символом элемента – его название.
Например,
рассмотрим клетку, где расположен элемент сера. Здесь указано название
элемента, его символ. Вверху стоит число 16. А что же обозначает нижнее число
32,064?
Это
число называется относительной атомной массой. Как известно, важным
свойством атомов является их масса, она выражается в граммах, киллограммах, миллиграммах.
Ещё в девятнадцатом веке, когда все учёные наконец-то приняли
атомно- молекулярное учение (то есть было доказано, что вещества состоят
из молекул и атомов), были рассчитаны атомные массы химических элементов.
Эти массы оказались очень маленькими. Это и понятно, ведь атомы
настолько малы, что их не увидишь даже в самые мощные микроскопы.
Для
удобства массы атомов химических элементов сравнивают с массой атома самого
лёгкого химического элемента – водорода. Масса атома водорода равна 1. Поэтому
можно сказать, что масса атома серы в 32 раза больше массы атома водорода.
То
есть относительная атомная масса – это величина, которая показывает, во
сколько раз масса атома данного химического элемента больше массы атома
водорода.
Относительную
атомную массу обозначают символом Ar, где буква r – это первая буква английского слова
relative,
что означает «относительный».
Все
значения относительных атомных масс округляют до целого значения по всем
правилам округления. Единственным исключением является элемент хлор, у которого
относительная атомная масса равна 35,5. Так, относительная атомная масса
кислорода – 16, азота – 14, углерода – 12, железа – 56, меди – 64, фтора – 19,
алюминия – 27, цинка – 65, фосфора – 31, брома – 80.
Как
вы могли заметить, относительная атомная масса является безразмерной
величиной.
Как
и атомы, молекулы обладают массой. Для того, чтобы найти их массу, нужно
сложить массы всех атомов, которые входят в состав молекулы.
То
есть относительная молекулярная масса – это сумма относительных атомных
масс атомов, входящих в состав молекул.
Например,
определим относительную молекулярную массу воды – Н2О. Для этого
относительную атомную массу водорода умножаем на 2, так как в молекуле 2 атома
водорода, на что нам указывает индекс. Затем складываем относительную атомную
массу водорода с относительной атомной массой кислорода. Подставляем значения и
получаем результат – 18.
Mr
(H2O) = Ar (H) · 2 + Ar (O) = 1 · 2 + 16 = 18
Понятие
«относительная молекулярная масса» справедливо только для веществ молекулярного
строения, если же вещество состоит из атомов или ионов, тогда вместо
относительной молекулярной массы говорят об относительной формульной массе.
Определим
относительную молекулярную массу углекислого газа – СО2. Для этого
относительную атомную массу углерода складываем с относительной атомной массой
кислорода, умноженной на два, так как в молекуле 2 атома кислорода. Подставляем
значения относительных атомных масс: 12 складываем с 32 и получаем 44.
Mr
(CO2)
= Ar
(C)
+ Ar
(O)
· 2 = 12 + 16 · 2 = 44
Найдём
относительную формульную массу NaNO3.
Для этого относительную атомную массу натрия складываем с относительной атомной
массой азота и относительной атомной массой кислорода, умноженной на три.
Подставляем значения относительных атомных масс и получаем 85.
Mr
(NaNO3)
= Ar
(Na)
+ Ar
(N)
+ Ar
(O)
· 3 = 23 + 14 + 16 · 3 = 85
Масса атома обозначается символом
ma
и может выражаться в единицах массы: килограммах или граммах.
Массы атомов малы. Так, масса атома водорода равна
ma(H)=1,67⋅10−24г
, а масса атома углерода —
ma(C)=19,94⋅10−24г
. Использовать такие числа неудобно, поэтому в химии применяется относительная атомная масса
Ar
.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
В качестве атомной единицы массы (а. е. м.) выбрана (1/12) часть массы атома углерода. Эта единица обозначается буквой (u) (от английского «unit» — единица):
.
Относительная атомная масса — безразмерная величина, которая показывает, во сколько раз масса атома больше атомной единицы массы.
Относительные атомные массы химических элементов приведены в Периодической таблице. В расчётах обычно используют их значения, округлённые до целых.
Пример:
в Периодической таблице приведено значение относительной атомной массы магния — (24,305). Округлённое значение — (24). Значение атомной массы углерода — (12,011), а её округлённое значение — (12).
Исключение — относительная атомная масса хлора:
Ar(Cl)=
(35,5).
Значения относительных атомных масс некоторых элементов
| Элемент | H | He | Li | C | N | O | F | Ne | Na | Mg | Al | P | S | Cl | Ar | Ca | Fe | Cu | Zn |
|
Ar |
1 |
4 |
7 |
12 |
14 |
16 |
19 |
20 |
23 |
24 |
27 |
31 |
32 |
35,5 |
40 |
40 |
56 |
64 |
65 |
Относительная молекулярная масса
Mr
— это отношение массы молекулы или формульной единицы к атомной единице массы.
,
Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.
Пример:
относительная молекулярная масса углекислого газа:
.
Относительная молекулярная масса фосфата натрия:
.
Относительная молекулярная масса сульфата алюминия:
.
Что такое относительная молекулярная масса? Как она рассчитывается?
reshalka.com
ГДЗ учебник по химии 7 класс Габриелян. §10. Вопросы. Номер №2
Решение
Относительная молекулярная масса − это отношение массы молекулы или формульной единицы к атомной единице массы.
Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.
Рис. 68. Расчёт относительной молекулярной массы воды