По мне, так этот тип заданий один из простых. Тут даже думать особо не надо. Просто механическая работа с вычислениями.
Но многих учеников пугает этот тип заданий. «Незнакомыми» словами, сложными какими-то формулами.
А тут даже задачу читать не надо.
Сначала находим в задаче формулу. Выписываем её:
P•V = ν•R•T
А далее подставляем вместо букв цифры (ищем в задаче)
4986 • 0,7 = ν • 8,31 • 300
Получили уравнение в котором неизвестно ν, его то и надо найти
ν = 4986 • 0,7 / (8,31 • 300) (сократим на 3
ν = 1662 • 7 / 8310 (тут чудным образом 8310 делится на 1662 и будет 5, поэтому сократим на 1662)
ν = 7 / 5 = 14 / 10 = 1,4
Ответ: 1,4
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) — формула, устанавливающая зависимость между давлением, объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
pV = $frac{m}{M}R cdot T$ , где
p — давление [Па],
V — объём [м3],
R — универсальная газовая постоянная 8,31 [Дж/моль∙К],
T — абсолютная температура [K].
Количество вещества — физическая величина, характеризующая количество атомов или молекул, содержащихся веществе. Единица измерения количества вещества —моль.
υ = $frac{m}{M}$ , где
υ ― количество вещества [моль],
m — масса [кг],
M — молярная масса [кг/моль].
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.
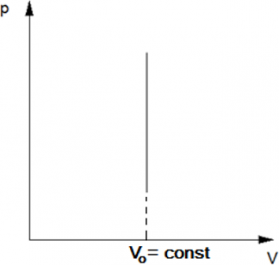
Изохорический процесс — термодинамический процесс, который происходит при постоянном объёме. Следовательно, объем V не изменяется, и значение давления прямолинейно зависит от температуры.
Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма, например, в запаянном сосуде.
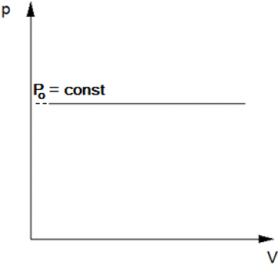
Изобарический процесс — термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа. Следовательно, давление р не изменяется, и значение объёма прямолинейно зависит от температуры.
Простейшим примером изобарического процесса может служить нагревание воды в открытом сосуде.
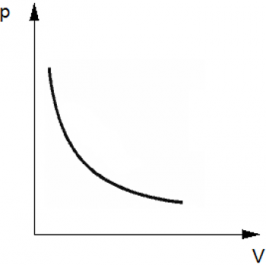
Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре. Следовательно, температура Т не меняется, и значение давления обратно пропорционально объему(гипербола).
p = $frac{vRT}{V}$ = $frac{const}{V}$ .
График имеет вид гиперболы, поскольку давление обратно пропорционально объему при постоянной температуре.
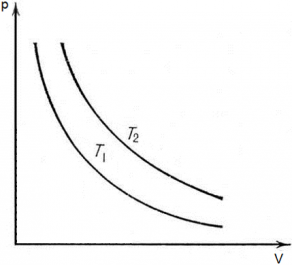
Рассмотрим две изотермы с одинаковой массой, но разной температурой на pV диаграмме (T1 < T2).
Изотерма с температурой Т2 будет располагаться на диаграмме pV выше, чем изотерма с температурой Т1, как следствие закона pV = vRT. Так как при большем значение температуры значение коэффициента перед V в уравнении p = $frac{vRT}{V}$ будет больше (vRT2 ˃ vRT1), следовательно, гипербола будет выше.
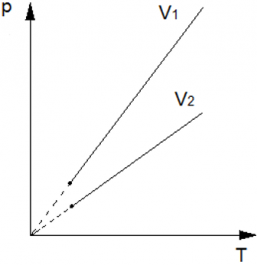
Теперь рассмотрим две изохоры одной массы, но разного объёма (V2 > V1) на pT диаграмме. Изохора с V1 будет выше V2, аналогично, как следствие закона pV = vRT. Так как при большем значении объема, коэффициент при Т будет меньше $big( frac{vR}{V_2} < frac{vR}{V_1} big)$ , а следовательно и прямая на диаграмме pT, будет ниже.
to continue to Google Sites
Not your computer? Use Guest mode to sign in privately. Learn more
Задание 5160
Закон Менделеева–Клапейрона можно записать в виде $$PV=vRT$$, где P — давление (в паскалях), V — объём (в м3), ν — количество вещества (в молях), T — температура (в градусах Кельвина), а R — универсальная газовая постоянная, равная 8,31 Дж/(К моль). Пользуясь этой формулой, найдите количество вещества ν (в молях), если T=700 К, P=20941,2 Па, V=9,5 м3.
Ответ: 34,2
Скрыть
$$v=frac{PV}{RT}$$; $$v=frac{20941,2cdot9,5}{8,31cdot700}=frac{209412cdot95}{831cdot700}=$$ $$frac{252cdot95}{700}=frac{3420}{100}=34,2$$