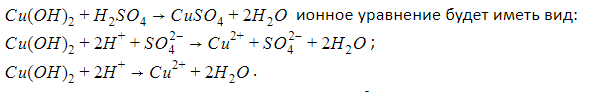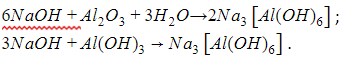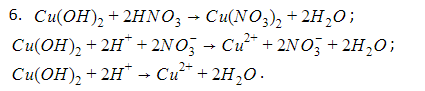Щелочи: определение, химические свойства, методы получения
Материал по химии
Оглавление
- Как связаны щелочи с основаниями?
- Чем отличаются щёлочи от остальных оснований?
- Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
- Физические свойства щелочей
- Химические свойства щелочей
- Получение щелочей
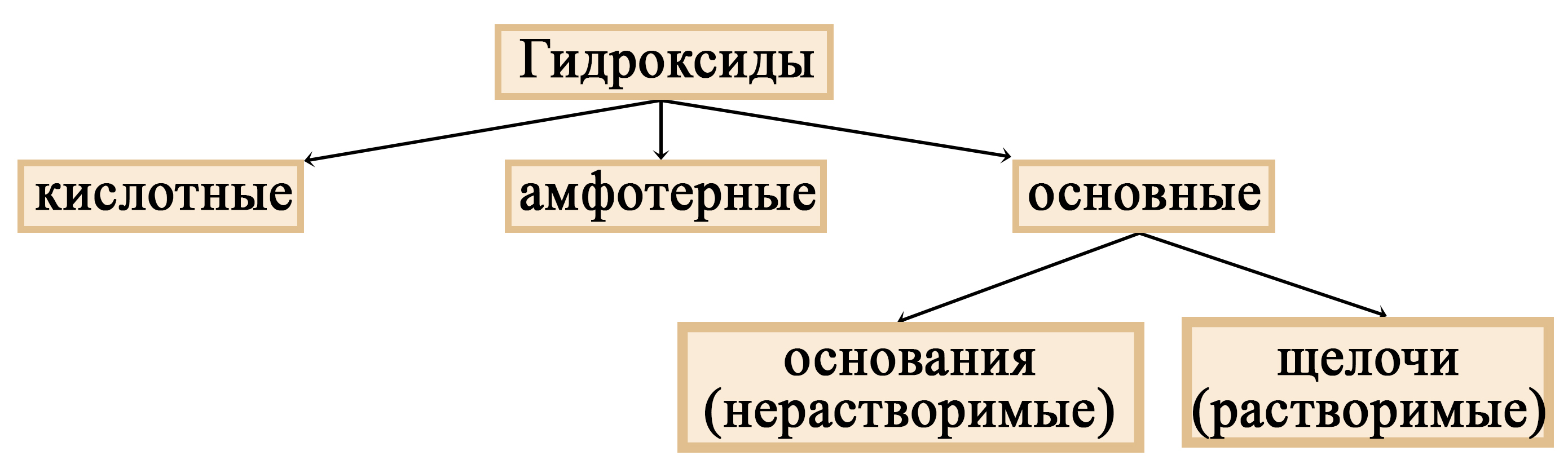
Как связаны щелочи с основаниями?
Щелочи – это небольшая группа неорганических веществ, относящихся к основным гидроксидам или основаниям. Для начала разберемся, какие вещества можно называть основаниями. Основания – это вещества, содержащие гидроксо-группу (‒OH), которая в неорганической химии (в случае с основаниями) пишется в конце молекулы, например: NaOH, Fe(OH)2, Ba(OH)2, но это определение не точное, ведь Fe(OH)3 и Zn(OH)2 имеют сходную формулу, однако, основаниями не являются. Точнее будет сказать, что основания – это гидроксиды, в которых металл находится в степени окисления «+1» или «+2» (кроме цинка и бериллия, образующих в степени окисления «+2» амфотерные оксиды и гидроксиды).
Таблица 1. – Основания и амфотерные гидроксиды
|
Это основания: |
Это НЕ основания: |
|
NaOH KOH Mg(OH)2 Ca(OH)2 Fe(OH)2 |
Al(OH)3 Fe(OH)3 Cr(OH)3 Zn(OH)2 Be(OH)2 |
|
Потому что содержат металл в степени окисления «+1» или «+2» |
Так как в этой группе есть гидроксиды, имеющие металл в степени окисления «+3», и два исключения — Zn(OH)2 и Be(OH)2. Все приведенные выше вещества являются амфотерными гидроксидами, а не основаниями |
Подробнее об отличиях понятий «гидроксиды» и «основания» можно прочитать в статье «Классификация гидроксидов и оснований»
Кроме отличий в степени окисления, основания и амфотерные гидроксиды отличаются так же по реакционной способности. Так, амфотерные гидроксиды могут реагировать как с кислотами, так и с основаниями, а основания могут реагировать с кислотами, но не могут реагировать с другими основаниями. Подробнее о химических свойствах амфотерных гидроксидов можно прочитать в статье «Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей»
Чем отличаются щёлочи от остальных оснований?
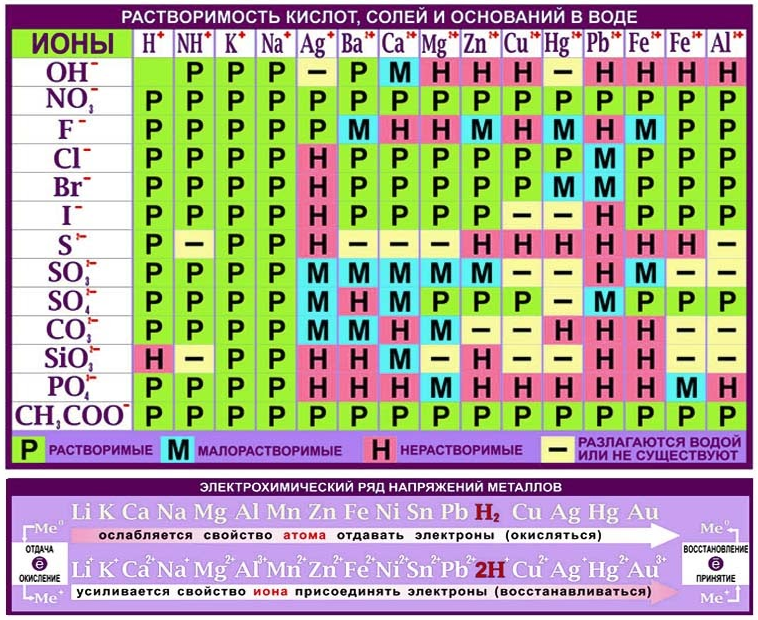
Основания можно разделить на две группы: растворимые и нерастворимые. Растворимые иначе называют щелочами. То есть щелочи – это растворимые основания (растворимые основные гидроксиды).
Таблица 2. – Основания и щёлочи
|
Щелочи (растворимые основания) |
Остальные основания (нерастворимые основания) |
|
NaOH KOH Ba(OH)2 |
Mg(OH)2 Fe(OH)2 Ni(OH)2 |
Место щелочей в классификации гидроксидов
Щелочи – растворимые основания
Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
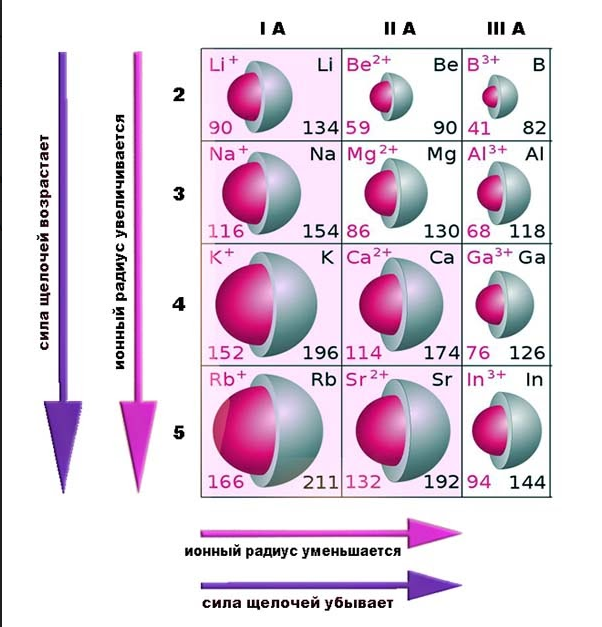
В состав щелочей входят металлы IА-группы Периодической Системы Д. И. Менделеева, а также кальций, стронций и барий.
Полный список щелочей:
NaOH – гидроксид натрия, едкий натр, гидроокись натрия, каустическая сода
KOH – гидроксид натрия, едкое кали, гидроокись калия
LiOH – гидроксид лития, гидроокись лития
CsOH – гидроксид цезия, гидроокись цезия
FrOH – гидроксид франция, гидроокись франция
RbOH – гидроксид рубидия, гидроокись рубидия
Ba(OH)2 – гидроксид бария, едкий барий, баритовая вода
Ca(OH)2 – гидроксид кальция, гашеная известь, известковое молоко, известковая вода.
Sr(OH)2 – гидроксид стронция
Остальные основания считаем нерастворимыми (кроме аммиака, образующего гидрат аммония, являющегося хоть и растворимым, но нестойким соединением). Гидроксид аммония, образующийся при пропускании аммиака через воду, можно представить в виде формулы NH4OH (лучше NH3·H2O – гидрат аммония) является растворимым (раствор называют нашатырным спиртом), однако щелочью это вещество не является.
Гидроксид лития и гидроксид кальция растворяются не так хорошо, как другие основания, но все равно считаются щелочами.
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ga(OH)3
- RbOH
- Cr(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Галлий, в представленном гидроксиде, имеет степень окисления +3, поэтому он относится к группе амфотерных гидроксидов. Гидроксид рубидия – щелочь, так как рубидий – элемент IА-группы. Гидроксид хрома – нерастворимое основание, так как хром в степени окисления +2 не является амфотерным, и не относится к щелочным или щелочноземельным металлам, поэтому не может образовать щелочь.
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Sr(OH)2
- Zn(OH)2
- Fe(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Стронций является щелочноземельным металлом (металлы IIА-группы, кроме магния и бериллия, образуют растворимые гидроксиды), поэтому образует щелочь. Гидроксид цинка вместе с гидроксидом бериллия входят в группу исключений и, несмотря на вторую валентность, образуют амфотерные гидроксиды. Гидроксид железа нерастворим и не входит в группу амфотерных веществ, он является нерастворимым основанием.
Щёлочи, являясь сильными основаниями, диссоциируют в воде очень быстро, тогда как нерастворимые основания диссоциируют медленно, ступенчато:
|
Диссоциация щелочей |
Диссоциация слабых оснований |
|
Ca(OH)2 = Ca2+ + 2OH‒ |
Fe(OH)2 = FeOH+ + OH‒ (I ступень) FeOH+ = Fe2+ + OH‒(II ступень) |
|
Диссоциация настолько быстрая, что ступенчатостью процесса можно пренебречь |
Диссоциация очень медленная, быстрее идет по первой ступени, по второй ступени практически не идёт |
Физические свойства щелочей
Гидроксиды щелочных металлов (металлов IА-группы) – твердые бесцветные кристаллические вещества. Как уже было описано выше, большинство из них очень хорошо растворимы в воде. Гидроксиды щелочноземельных металлов хуже растворяются в воде.
Химические свойства щелочей
Основные свойства гидроксидов в Периодической системе возрастают справа налево и сверху вниз. Поэтому все щелочи, образованные металлами IА-группы сильнее щелочей, образованных металлами IIА-группы.
Щелочи окрашивают фенолфталеин в малиновый цвет.
Твёрдые щелочи и их концентрированные растворы разъедают живые ткани, поэтому работать с ними нужно в перчатках, а при растирании твёрдой щелочи в ступке необходимо надевать очки.
- Щелочи реагируют с кислотными оксидами, образуя либо соль и воду, либо кислую соль:
Щелочь + кислотный оксид = соль + вода
Щелочь + кислотный оксид = кислая соль
Рассмотрим эти реакции на примере образования карбонатов и гидрокарбонатов.
Для щелочей, содержащих одновалентный катион (катион в степени окисления «+1») справедлива общая схема реакции:
2MeOH + CO2 = Me2CO3 + H2O
Или
MeOH + CO2 = MeHCO3
Например:
2NaOH + CO2 = Na2CO3 + H2O
NaOH + CO2 = NaHCO3
2KOH + CO2 = K2CO3 + H2O
KOH + CO2 = KHCO3
Для щелочей, содержащих двухвалентный металл (катион в степени окисления «+2») справедлива общая схема реакции:
Me(OH)2 + CO2 = MeCO3 + H2O
Или
Me(OH)2 + 2CO2 = Me(HCO3)2
Например:
Ca(OH)2 + CO2 = CaCO3 + H2O
Ca(OH)2 + 2CO2 = Ca(HCO3)2
Ba(OH)2 + CO2 = BaCO3 + H2O
Ba(OH)2 + 2CO2 = Ba(HCO3)2
Образование кислых и средних солей
Щелочи с кислотными оксидами
Щелочи при плавлении разрушают стекло и фарфор, основным компонентом которых является кислотный оксид SiO2:
2NaOH(тв) + SiO2(тв) = Na2SiO3(тв) + H2O(г)
Некоторые оксиды диспропорционируют в щелочах (участвуют в реакции самоокисления-самовосстановления). К таким оксидам относят оксид азота IV, который в щелочах превращается одновременно и в нитрит-ион (NO2‒), и нитрат-ион (NO3‒):
2KOH + 2NO2 = KNO2 + KNO3 + H2O
2Ca(OH)2 + 4NO2 = Ca(NO2)2 + Ca(NO3)2 + 2H2O
Для того, чтобы получить только нитрат-ион необходимо присутствие кислорода:
4KOH + 4NO2 + O2 = 4KNO3 + 2H2O
2Ca(OH)2 + 4NO2 + O2 = 2Ca(NO3)2 + 2H2O
О других свойствах кислотных оксидов можно прочитать в статье «Свойства кислотных оксидов»
- Щелочи реагируют с кислотами. Притом, если кислота одноосновная, то образуется только средняя соль, если кислота многоосновная, то может образоваться как средняя, так и кислая соль.
Узнать, как определить тип кислоты можно в статье «Классификация кислот»
А) щелочь + одноосновная кислота = соль + вода
NaOH + HClO3 = NaClO3 + H2O
LiOH + HNO3 = LiNO3 + H2O
KOH + HI = KI + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Ba(OH)2 + 2HClO4 = Ba(ClO4)2 + 2H2O
Sr(OH)2 + HPO3 = Sr(PO3)2 + H2O
Б) щелочь + двухосновная кислота = соль + вода
Щелочь + двухосновная кислота = кислая соль + вода
2NaOH + H2SO4 = Na2SO4 + 2H2O
NaOH + H2SO4 = NaHSO4 + H2O
Ba(OH)2 + H2S = BaS + 2H2O
Ba(OH)2 + 2H2S = Ba(HS)2 + 2H2O
Для получения кислой соли необходим недостаток щелочи (избыток кислоты).
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Sr(OH)2 + SO2 =
- Sr(OH)2 +2SO2 =
- Sr(OH)2 + H2SO4 =
- Sr(OH)2 + 2H2SO4 =
- SrSO4 + 2H2O
- SrSO3 + H2O
- SrSO4 + H2O
- Sr(HSO4)2 + 2H2O
- Sr(HSO3)2 + H2O
- Sr(HSO3)2
- В отличие от нерастворимых оснований, щелочи реагируют с растворимыми солями. Условия типичны для обменных реакций (в продуктах должен появиться газ или осадок):
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
LiOH + NH4Cl = LiCl + NH3↑ + H2O
2KOH + Fe(NO3)2 = 2KNO3 + Fe(OH)2↓
Ca(OH)2 + 2NaF = CaF2↓ + 2NaOH
Ba(OH)2 + K2SO4 = BaSO4↓ + 2KOH
Sr(OH)2 + Na2SiO3 = SrSiO3↓ + 2NaOH
Попробуйте решить задание ЕГЭ:
Из предложенного перечня веществ выберете три вещества, с которыми гидроксид натрия (р-р) не реагирует:
- LiCl
- NH4Br
- CrSO4
- PbSO4
- KNO3
- CuSO4
Комментарий к заданию: помните, что исходная соль должна быть растворимой, а одно из полученных веществ – газ или осадок.
- Щелочи реагируют с кислыми солями с образованием средних солей:
NaHSO3 + NaOH = Na2SO3 + H2O
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
- Твёрдые щелочи реагируют с амфотерными оксидами и гидроксидами при сплавлении, при этом образуется средняя соль, в катион которой входит щелочной или щелочноземельный металл, а в анион – амфотерный металл:
2NaOH + Al2O3 = 2NaAlO2 + H2O
2NaOH + ZnO = Na2ZnO2 + H2O
Ca(OH)2 + Al2O3 = Ca(AlO2)2 + H2O
Ca(OH)2 + ZnO = CaZnO2 + H2O
Из предложенного перечня веществ выберете три вещества, с которыми реагирует гидроксид калия:
- P2O5
- Cr2O3
- NiO
- FeO
- CaO
- ZnO
Комментарий к заданию: Не забывайте, что щелочи реагируют не только с амфотерными, но и с кислотными оксидами.
О том, как амфотерные оксиды реагируют с щелочами и другими веществами, а также о том, как можно прочитать в статье «Амфотерные оксиды»
NaOH + Al(OH)3 = NaAlO2 + 2H2O
NaOH + Zn(OH)2 = Na2ZnO2 + H2O
Ca(OH)2 + 2Al(OH)3 = Ca(AlO2)2 + 4H2O
Ca(OH)2 + Zn(OH)2 = CaZnO2 + 2H2O
Подробнее о свойствах амфотерных гидроксидов можно прочитать в этой статье
- Концентрированные растворы щелочей растворяют амфотерные оксиды и гидроксиды с образованием комплексных солей:
2KOH + Fe2O3 + 3H2O = 2K[Fe(OH)4]
2KOH + BeO + H2O = K2[Be(OH)4]
Ba(OH)2 + Fe2O3 + 3H2O = Ba[Fe(OH)4]2
Ba(OH)2 + BeO + H2O = Ba[Be(OH)4]
KOH + Fe(OH)3 = K[Fe(OH)4]
2KOH + Be(OH)2 = K2[Be(OH)4]
Ba(OH)2 + 2Fe(OH)3 = Ba[Fe(OH)4]2
Ba(OH)2 + Be(OH)2 = Ba[Be(OH)4]
- Концентрированные щелочи вступают в реакции с некоторыми металлами (Al, Be, Zn) с образованием комплексной соли и выделением водорода:
2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2↑
2NaOH + Be + 2H2O = Na2[Be(OH)4] + H2↑
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2↑
Ba(OH)2 + 2Al + 6H2O = Ba[Al(OH)4]2 + 3H2↑
Ba(OH)2 + Zn + 2H2O = Ba[Zn(OH)4] + H2↑
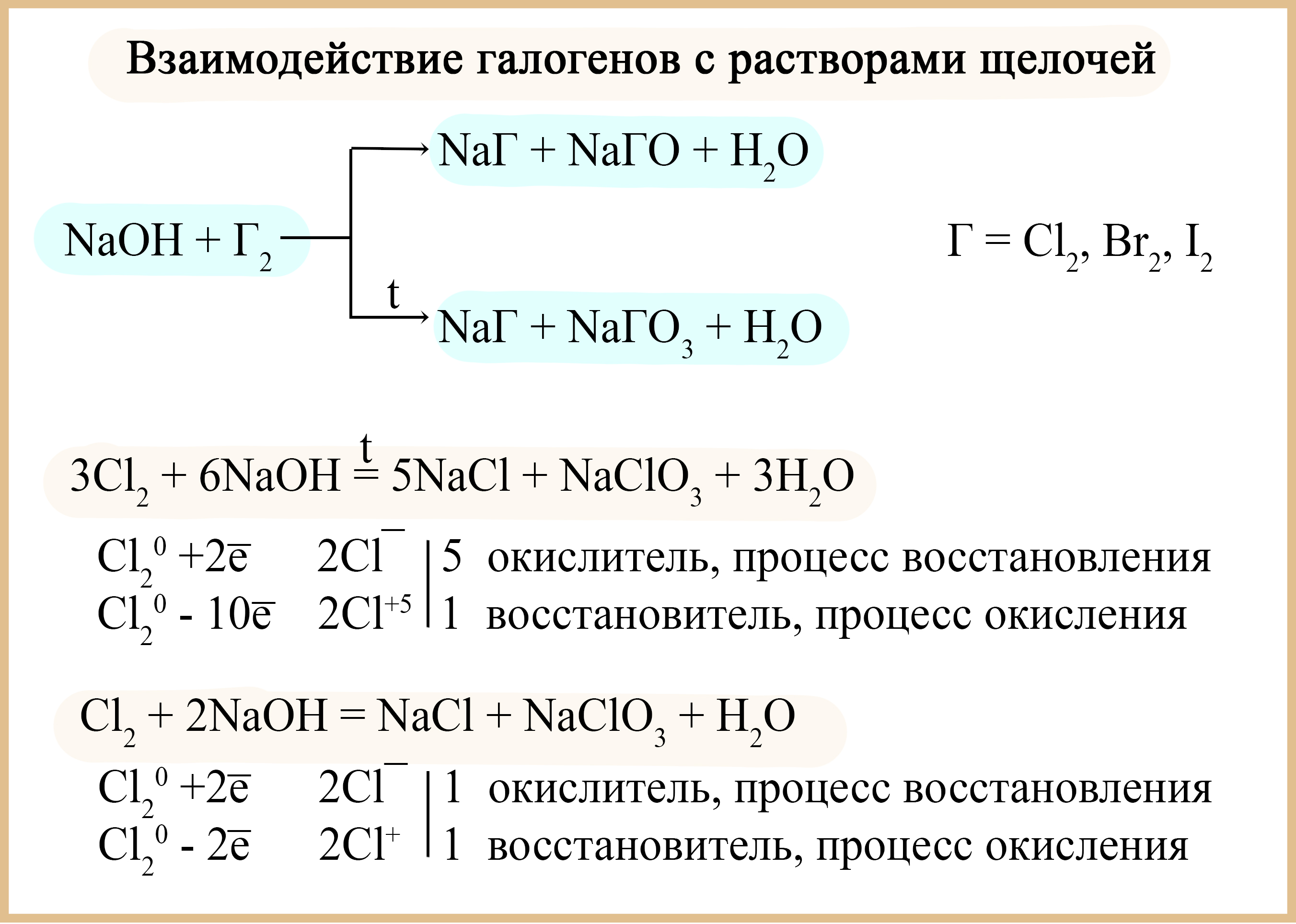
- Хлор, бром, йод диспропорционируют в щелочах, продукты реакции зависят от температуры, при которой происходит реакция:
Cl2 + 2NaOH(холодный) = NaCl + NaClO +H2O
3Cl2 + 6NaOH(горячий) = 5NaCl + NaClO3 + 3H2O
Реакция хлора с гидроксидом натрия
Диспропорционирование галогенов в щелочах
- Фосфор, сера также самоокисляются-самовосстанавливаются в щелочах:
P4 + 3NaOH + 3H2O = 3NaH2PO2 + PH3
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
- Кремний реагирует с щелочами в качестве восстановителя:
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Получение щелочей
- Щелочи можно получить из гидридов, нитридов, фосфидов, карбидов:
LiH + H2O = LiOH + H2↑
CaH2 + 2H2O = Ca(OH)2 + 2H2↑
Na3N + 3H2O = 3NaOH + NH3↑
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
K3P + 3H2O = 3KOH + PH3↑
Ba3P2 + 6H2O = 3Ba(OH)2 + 2PH3↑
Na4C + 4H2O = 4NaOH + CH4↑
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
- При растворении оксида щелочного или щелочноземельного металла в воде образуется раствор щелочи:
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
Реакции идут с выделением большого количества теплоты, то есть являются экзотермическими.
- Щелочи можно получить растворением пероксидов в воде (характерно для получения гидроксида натрия, гидроксида калия и гидроксида бария):
Na2O2 + 2H2O = H2O2 + 2NaOH
BaO2 + 2H2O = H2O2 + Ba(OH)2
- Раствор щелочи получают при растворении щелочного или щелочноземельного металла в воде:
2K + 2H2O = 2KOH + H2↑
Sr + 2H2O = Sr(OH)2 + H2↑
- Растворы щелочей можно получить обменными реакциями:
Li2SO4 + Ba(OH)2 = 2LiOH + BaSO4↓
K2SO4 + Sr(OH)2 = 2KOH + SrSO4↓
- Раствор щелочи можно получить электролизом раствора соли, содержащей катион щелочного или щелочноземельного металла и бескислородный анион, например раствор гидроксида калия получают электролизом раствора хлорида калия:
KCl + H2O = KOH + H20↑ + Cl20↑
Катод: 2H2O + 2ē = H20↑ + 2OH‒
Анод: 2Cl‒ ‒2ē = Cl20
Электролизом расплава соли, содержащей щелочной металл, щелочь получить нельзя. Этим способом получают сам щелочной металл.
Основания (гидроксиды) — это сложные вещества, которые состоят из катиона металла и гидроксильной группы (OH).
Общая формула оснований: Me(OH)n, где Me — химический символ металла, n — индекс, который зависит от степени окисления металла.
Примеры оснований: NaOH, Ba(OH)2, Fe(OH)2.
Названия оснований
Названия гидроксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «гидроксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если второй элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оснований:
Ni(OH)2 — гидроксид никеля (II);
Al(OH)3 — гидроксид алюминия.
У некоторых оснований существуют и тривиальные названия. Собрали их в таблице.
Тривиальные названия некоторых оснований
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Классификация оснований
По растворимости в воде
В зависимости от растворимости в воде выделяют:
-
щелочи. Эти основания растворимы в воде: NaOH, KOH, Ba(OH)2 и другие. Ca(OH)2, хотя малорастворим, тоже относится к щелочам из-за своей едкости;
-
нерастворимые основания. К таким основаниям относятся Fe(OH)2, Cu(OH)2 и другие;
-
амфотерные гидроксиды. К амфотерным относятся те основания, которые образованы металлами со степенью окисления +3 или +4. Эти основания отличаются тем, что проявляют как основные свойства, так и кислотные.
Также есть основания, которые относятся к амфотерным, но образованы металлом с иной степенью окисления: Zn(OH)2, Pb(OH)2, Sn(OH)2, Be(OH)2.
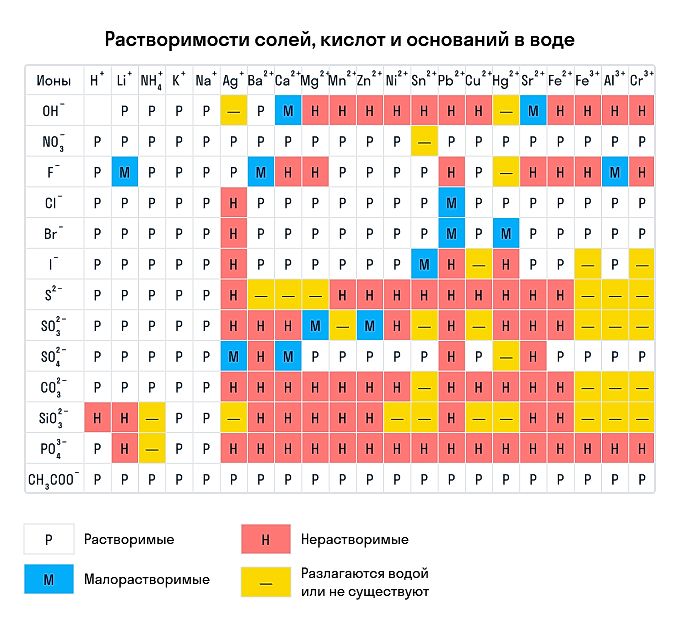
Напомним, что растворимость мы проверяем по таблице растворимости кислот и оснований в воде.
По числу гидроксогрупп
В зависимости от количества гидроксильных групп, способных замещаться на кислотный остаток, выделяют следующие виды оснований:
-
однокислотные: KOH, NaOH;
- двухкислотные: Fe(OH)2, Ba(OH)2;
-
трехкислотные: Al(OH)3, Fe(OH)3.
Физические свойства оснований
Основания при обычных условиях — это твердые кристаллические вещества без запаха, нелетучие, чаще всего белого цвета. В таблице приведены основания, которые имеют иную окраску.
Химические свойства оснований
Растворы щелочей изменяют окраску индикатора
Гидроксид-ионы, которые содержатся в растворе щелочи, взаимодействуют с индикатором, образуя новые соединения. Признак реакции — окраска раствора.
Взаимодействие с кислотными оксидами
Щелочи вступают в реакцию с любыми кислотными оксидами. Нерастворимые основания взаимодействуют только с кислотными оксидами, которые соответствуют сильным кислотам.
Кислотный оксид + основание = соль + вода
Например: N2O5 + 2NaOH = 2NaNO3 + H2O
Взаимодействие с кислотами
Щелочи вступают в реакцию со всеми кислотами. Нерастворимые основания могут взаимодействовать только с сильными кислотами.
Основание + кислота = соль + вода
Например: Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Взаимодействие основания с кислотой называют реакцией нейтрализации — это частный случай реакции обмена.
Взаимодействие с солями
Основания взаимодействуют с растворимыми солями по обменному механизму. В результате такой реакции должен выделиться осадок или газ (CO2, SO2, NH3).
Основание + соль = другое основание + другая соль
Например: KOH + MgSO4 = Mg(OH)2↓ + K2SO4
Термическое разложение
При нагревании нерастворимые основания разлагаются на соответствующий оксид (степень окисления металла остается неизменной) и воду.
Нерастворимое основание
оксид металла + вода
Взаимодействие амфотерных гидроксидов со щелочами
Продукты реакции зависят от условий ее проведения.
-
При сплавлении двух оснований:
Амфотерный гидроксид (тв) + щелочь (тв) = средняя соль + вода
Например: Al(OH)3 + KOH = KAlO2 + 2H2O
-
Если реакция проводится в растворе:
Амфотерный гидроксид (р-р) + щелочь (р-р) = комплексная соль
Например: Al(OH)3 + KOH = K[Al(OH)4]
Получение оснований
Взаимодействие металла с водой
Активные металлы (металлы групп IA и IIA, кроме Be и Mg) активно взаимодействуют с водой при обычных условиях с образованием щелочей.
Нерастворимые основания данным способом получить невозможно, за исключением Mg(OH)2.
Металл + вода = гидроксид металла + водород
Например: Na + H2O = NaOH + H2↑
Гидроксид магния можно получить данным способом, но только при нагревании:
Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
Этим способом получают только растворимые в воде основания.
Оксид металла + вода = щелочь
Например: CaO + H2O = Ca(OH)2
Электролиз
Гидроксид натрия и калия в промышленности получают с помощью электролиза — через раствор хлорида калия проводят постоянный электрический ток:
KCl + H2O = KOH + H2↑ + Cl2↑
Электролиз хлорида натрия протекает по аналогичной схеме.
Получение нерастворимых оснований при взаимодействии соли со щелочью
Растворимая соль + щелочь = нерастворимое основание + другая соль
Например: Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3
Вопросы для самопроверки
-
Вспомните определение оснований и приведите 2 примера этих веществ.
-
Какие виды оснований существуют? Чем они отличаются?
-
К какому виду оснований относится Zn(OH)2?
-
Взаимодействуют ли основания с основными оксидами? Приведите примеры веществ, с которыми основания вступают в реакцию.
-
Можно ли получить гидроксид алюминия с помощью взаимодействия алюминия с водой?
Основания и другие темы по химии изучать интереснее, когда понимаешь, как применять знания в реальной жизни. На онлайн-курсах по химии в Skysmart преподаватели приводят яркие примеры: от процессов в природе до использования химических реакций в промышленности. Приходите учиться — вводный урок бесплатный!
Содержание
- 1 Определение. Структура и формула основания
- 2 Номенклатура
- 3 Классификация
- 3.1 Щелочи
- 4 Свойства
- 4.1 Химические свойства
- 5 Получение
- 6 Применение
- 6.1 Задания
- 6.2 Ответы
Основания в химии – совокупность соединений с характерной способностью к взаимодействию с кислотами, в результате которого происходит образование солей. Основания связаны с основными оксидами.
Определение. Структура и формула основания
Основания (основные гидроксиды) – соединения, образуемые связью между положительно заряженным ионом металла и высокореакционной гидроксильной группой – анионом OH-. В зависимости от валентности металла его ион может присоединять одну или несколько гидроксогрупп.
В составе основания катион металла и протон H+, входящий в гидроксогруппу, взаимно отталкиваются. Их удерживает притяжение к отрицательному иону кислорода O2-, причем протон расположен ближе и притягивается сильнее. Связь с металлом менее прочна, и ее величина определяется радиусом металлического иона.
Общий вид формулы основного гидроксида — MeOHn. Для определения величины n – количества гидроксогрупп, присоединяющихся к металлу, необходимо знать его степень окисления :
| натрий Na+ | n=1 | NaOH |
| железо(II) Fe2+ | n=2 | FeOH2 |
| железо(III) Fe3+ | n=3 | FeOH3 |
В качестве основания может рассматриваться гидрат аммиака () в водном растворе, в этом случае формула данного соединения записывается как NH4OH.
Номенклатура
Наименования оснований строятся по правилу: «гидроксид + название металла». Если степень окисления металла непостоянна, в названии указывается его валентность: гидроксид железа(III).
Некоторые основания имеют, помимо систематических, тривиальные (традиционные и технические) названия:
|
Основание |
Тривиальное название |
| гидроксид натрия NaOH | едкий натр; каустик (техн.) |
| гидроксид калия KOH | едкое кали; калиевый щелок |
| гидрат аммиака NH4OH (в растворе – гидроксид аммония) | аммиачная вода |
| гидроксид кальция Ca (OH2) | гашеная известь; пушонка |
| гидроксид бария Ba (OH2) (в растворе) | баритовая вода |
Классификация
Основания подразделяются по следующим признакам:
Растворимость в воде:
- растворимые – гидроксиды щелочных и щелочноземельных металлов, тяжелого металла таллия(I) TlOH, а также гидроксид аммония;
- нерастворимые.
Кислотность – количество n соединенных с металлом гидроксид-ионов OH-: одно-, двух-, трехкислотные.
Сила – способность к диссоциации, то есть отдаче гидроксид-ионов:
- сильные (все растворимые, за исключением гидроксида аммония, и малорастворимые гидроксиды щелочноземельных металлов кальция Ca(OH2) и стронция Sr(OH2);
- слабые (нерастворимые в воде основания и гидроксид аммония NH4OH).
Щелочи
К щелочам относят сильные основания, растворимые в воде. В отношении гидроксидов кальция и стронция понятие «щелочь» применяется к растворенной части:
Формула щелочи имеет вид ROH либо ROH2 в зависимости от степени окисления образующего ее металла R. Трехосновных щелочей не существует. В таблице представлены щелочи, образованные металлами разных групп периодической таблицы:
|
Металлы |
Гидроксиды |
Щелочные (I A):
|
«Едкие щелочи»:
LiOH NaOH KOH RbOH CsOH |
Щелочноземельные (II A):
|
Ca(OH2)
Sr(OH2) Ba(OH2) Ra(OH2) |
III A:
|
TlOH |
Чем больше радиус металлического катиона и чем меньше его заряд (степень окисления), тем слабее связь с гидроксогруппой OH- и, следовательно, тем сильнее основание. Наиболее сильные щелочи в химии – это гидроксиды цезия и радия: у этих металлов самые крупные ионы. Соответственно слабейшая из щелочей – гидроксид лития.
Свойства
В стандартных условиях основания – твердые вещества с кристаллическим строением, различных оттенков (чаще белые или бесцветные), без запаха. Едкие щелочи в твердом состоянии чрезвычайно гигроскопичны. Расплавы и растворы щелочей являются электролитами.
Водные растворы щелочей – мылкие жидкости, вызывающие изменение цвета индикаторов:
- лакмус: фиолетовый → синий;
- фенолфталеин: бесцветный → малиновый;
- метилоранж: оранжевый → желтый;
- универсальный: оранжевый → синий.
Концентрированные щелочные растворы опасны в обращении. При работе с ними необходимо использовать средства защиты и соблюдать технику безопасности. Едкие щелочи растворяются не только в воде, но также в метаноле и этаноле.
Химические свойства
1. В растворах и расплавах сильные основания диссоциируют:
Гидроксид аммония – неустойчивое соединение и самопроизвольно разлагается на аммиак и воду:
2. Взаимодействие с кислотами
Реакции нейтрализации между щелочью и кислотой, продуктами которых являются соль и вода:
Ионное уравнение: ; сокращенное
.
Слабое основание не диссоциирует, поэтому для реакции
- Реакция протекает не до конца при избытке одного из реагентов:
– образуется основная соль сульфат гидроксомеди(II);
– образуется кислая соль дигидрофосфат натрия.
Если оба реагента слабые, реакция не идет.
3. Взаимодействие с оксидами и гидроксидами
- Между щелочью и кислотным оксидом с образованием соли и воды:
- Между щелочным расплавом и амфотерным оксидом либо гидроксидом:
- Между раствором щелочи и амфотерным оксидом (гидроксидом):
В реакциях этого типа образуется комплексная соль (здесь – гексагидроксоалюминат натрия).
Нерастворимые основания принадлежат к амфотерным гидроксидам: по отношению к сильным основаниям они обладают кислотными свойствами.
4. Между щелочью и растворимой солью протекает реакция обмена, если хотя бы один из продуктов выпадает в осадок:
Ионное уравнение: ; сокращенное –
.
5. Участие в окислительно-восстановительных реакциях с металлами, не образующими основных оксидов (Be, Al, Zn, Sn), и с некоторыми неметаллами:
6. Разложение на оксид и воду при нагревании нерастворимых и малорастворимых оснований:
.
Легкорастворимые щелочи устойчивы к нагреванию, за исключением гидроксида лития.
Получение
Это интересно:
Масса молекул. Количество вещества и моль
О химических элементах и атомах
Применение
Физико-химические свойства оснований сделали их незаменимыми веществами во всех отраслях, использующих химические технологии:
- в добыче полезных ископаемых и металлургии;
- в производстве потребительских товаров, косметической, пищевой и фармацевтической продукции;
- в производстве красителей, бытовой химии и удобрений;
- в топливной и химической промышленности;
- в строительстве и многих других областях.
Наиболее широко применяются щелочи, но и нерастворимые основания используются в производстве полимеров, в очистных сооружениях, в медицине, в электротехнике.
Задания
1. Какое соединение в ряду KOH, Ra(OH2), BeO, P2O5, HBrO3, Al(OH3) является:
-
- амфотерным оксидом;
- едкой щелочью;
- кислотным оксидом;
- нерастворимым основанием;
- гидроксидом щелочноземельного металла?
2. Какое основание в каждой из пар является более сильным?
-
- Ca(OH)2 или Mg(OH)2;
- Ba(OH)2 или Ca(OH)2;
- Ra(OH)2 или CsOH;
- Sr(OH0)2 или Al(OH)3;
- KOH или LiOH.
3. Какие соединения образуются в результате реакции Zn(OH)2+H2SO4? Напишите ее молекулярное и ионное уравнения.
4. Какие соединения являются продуктом реакции между гидроксидом натрия и оксидом азота(V)? Напишите уравнения в молекулярной и ионной форме.
5. Какое основание можно получить, используя реакцию между гидроксидом калия и сульфатом магния? Запишите ее уравнения.
6. Составьте молекулярные и ионные уравнения реакций, позволяющих осуществить превращения .
Ответы
Методическая
разработка:
«Алгоритм
составления названий и формул оснований (гидроксидов)»
При изучении химии в 8 классе учащиеся
сталкиваются с затруднениями в названии химических веществ и составления формул
химических соединений. Для лучшего усвоения данного материала им помогут
«Алгоритмы» — краткая запись последовательности действий.
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ ОСНОВАНИЙ.
Основания — сложные химические вещества ,
состоящие из ионов металла связанных с гидроксогруппой (-ОН)
При названии оснований необходимо соблюдать
данную последовательность действий:
1. Дается
название последней части вещества – гидроксид.
2. Называется
металл, который связан с гидроксогруппой (-ОН), в родительном падеже (записан
перед гидроксогруппой).
3. Если
заряд металла переменный, в скобках указывается валентность металла.
Запомните: количество
гидроксогрупп равно заряду и валентности металла.
ПРИМЕР:
Fe( OH)2
гидроксид железа (ii)
Al(OH)3
гидроксид алюминия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ ОСНОВАНИЙ.
1.
Записываются символы металла и гидроксогруппы
(-ОН).
2.
Указывается заряд металла.
3.
Записывается индекс для гидроксогруппы. Если
заряд металла больше 1, гидроксогруппу заключают в скобки. Индекс указывается
за скобками.
ПРИМЕР:
Гидроксид
алюминия гидроксид меди (II)
1. Al OH
1.
Cu
OH
2. 3+
2.
2+
Al OH
Cu OH
3. Al
(OH)3
3. Cu
(OH)2