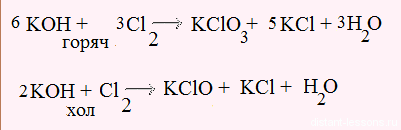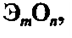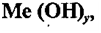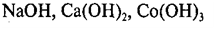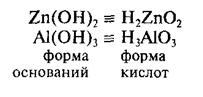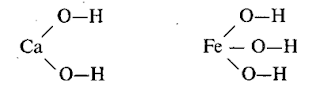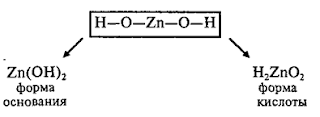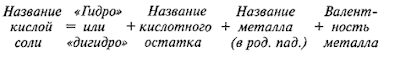План урока:
Оксиды
Кислоты
Основания
Соли
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.
Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.
Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.
Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.
Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.
Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.
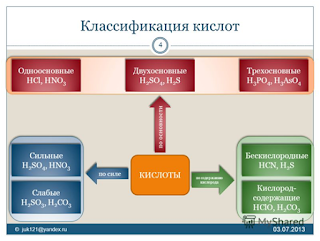
Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.
Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
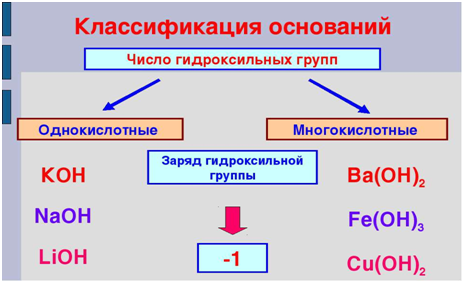
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.
Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции — соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.
Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.
Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.
Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.
В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.
Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.
Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.
Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы — ОН.
Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.
Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.
Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
Na + OH →NaOH или H2 + SO4→ H2SO4
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.
Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.
Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.
Соли
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.
Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.
Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.
Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.
Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.
Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.
Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.
Источник
Теперь необходимо справиться с задачей дать название этому типу солей.
Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN−, равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.
Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.
В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.
Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли.
Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В
этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении
химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты
(в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются
исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными
оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3,
Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и
кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что
СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2,
SO3, P2O5, N2O3, NO2, N2O5, SiO2,
MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять
степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой,
так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)

Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования.
К таким оксидам относят:
- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей.
Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов.
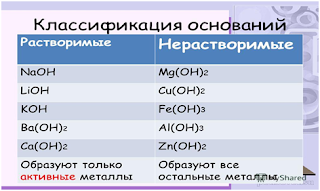
Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.

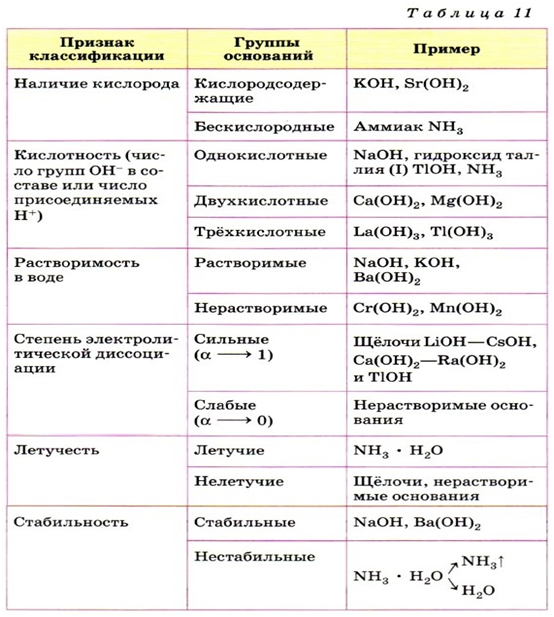
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания
способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет.
Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH,
которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли
и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких
температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации
кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию
с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз.
В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не
обманешь 
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными
гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается
металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат
лития, дигидрофосфат и гидрофосфат натрия) - Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4]
(тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)

Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в
избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода),
то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Классы неорганических соединений
04-Окт-2012 | комментариев 10 | Лолита Окольнова
Классы неорганических соединений
Это очень важная тема в неорганической химии и в учебниках, и в интернете, но здесь я хочу показать именно практическое применение классификации. Так что, давайте разбираться!
Основные классы неорганических соединений:
простые вещества;
сложные вещества:
- оксиды;
- основания;
- кислоты;
- соли
Давайте сразу разберем эту схему на примерах:
У нас есть простые вещества:
- металлы: Na, например
- неметаллы: S
При взаимодействии с кислородом (O2) образуются оксиды:
- из металлов образуются основные оксиды: 4Na + O2 = 2Na2O
- из переходных элементов (диагональ о Be к At) — амфотерные оксиды — Al2O3
- из неметаллов образуются кислотные оксиды — SO2
- также из неметаллов образуются несолеобразующие оксиды: 2С + O2 = 2CO
Названия оксидов очень логичны — из основных оксидов образуются основания — соединения с- OH — группой:
Na2O + H2O = NaOH
( Me(OH)x — общая формула. Х= степени окисления металла. Заряд группы -OH= -1)
Систематическое названия — гидроксиды;
Растворимые основания называются щелочи.
Кислотные оксиды при взаимодействии с водой дают кислоты — соединения, у которых в начале молекулы стоит Н — водород: SO2 + H2O = H2SO3
(Когда пишите уравнения взаимодействия, то просто складываете атомы: сначала H, потом неметалл, потом кислород)
Кислоты и основания при взаимодействии друг с другом дают соли: 2NaOH + H2SO3 = Na2SO3 + 2H2O
Эта реакция называется реакцией нейтрализации, т.к. кислота и щелочь дают соль и воду — «нейтрализуется» действие каждого из реагентов.
Амфотерные оксиды и несолеобразующие лучше разобрать отдельно… у них своя запутанная история 🙂
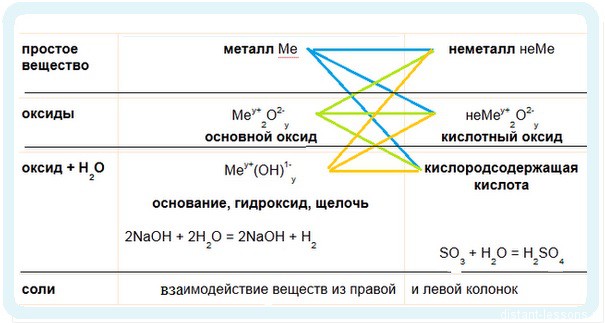
Есть еще одна довольно удобная табличка по взаимодействиям основных классов неорганических соединений:
Правый столбец — все, что относится к металлам и их соединениям.
Левый столбец — неметаллы и их соединения.
ВНУТРИ СТОЛБЦА РЕАКЦИИ НЕ ИДУТ!
(есть некоторые исключения — например, реакции оксидов и металлов d-элементов)
Т.е. основной оксид с основанием взаимодействовать не будет: Na2O + NaOH —> реакция не идет
кислота с кислотным оксидом взаимодействовать не будут: SO2 + H2SO3 —> реакция не идет
ВЕЩЕСТВА ИЗ РАЗНЫХ СТОЛБЦОВ РЕАГИРУЮТ МЕЖДУ СОБОЙ
Давайте эти реакции разберем подробнее…
1. Идем по синим стрелочкам
1. Металл + неметалл = соль:
2Na+ Cl2 = 2NaCl — хлорид натрия
2Na + S = Na2S — сульфид натрия
2. металл + кислотный оксид = оксид металла + неметалл/несолеобразующий оксид:
2Na + CO2 = Na2O + CO
Na + SO2 = Na2O + S
здесь суть в том, что металл окисляется кислородом кислотного оксида, а оксид, соответственно, восстанавливается металлом.
3. металл + кислота = соль + …
Здесь нам понадобится ряд активности металлов.
- Если металл стоит ДО ВОДОРОДА Н, то он вытесняет водород из кислот: 2Na + 2HCl =2 NaCl + H2
- Если металл стоит ПОСЛЕ ВОДОРОДА, то реакция идет без выделения H2: Сu + 4HNO3 = Cu(NO3)2 + NO2 +2 H2O
4. металл + соль = другая соль + другой металл
И опят нам нужен ряд активности металлов. Только предыдущий металл может вытеснить последующий из его соли:
2Na + MgCl2 = 2NaCl + Mg
Na + CaCl2 —> реакция не идет!
2. Идем по зеленым стрелочкам
1. Основной оксид + неметалл = металл/ оксид с меньшей степенью окисления + кислотный оксид/ несолеобразующий оксид
Na2O + S = 2Na + SO2
Fe2O3 + C = 2FeO + CO
здесь идет окислительно-восстановительный процесс — неметалл восстанавливает основной оксид, сам при этом окисляется
2. Основной оксид + кислотный оксид = соль
Na2O + SO2 = Na2SO3 — сульфит натрия (просто «складываем» количество атомов 🙂 )
3. Основной оксид + соль —> реакция не идет
3. Идем по желтым стрелочкам
1. основание + неметалл =…
Обычно такие реакции не идут. Исключение составляет NaOH и Cl2:
2. основание + кислотный оксид = соль
2NaOH + SO2 = Na2SO3 + H2O
3. основание + кислота = соль — РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ
NaOH + HCl = NaCl + H2O
4. основание + соль —> реакция идет, если образуется газ, осадок или малодиссоциирующее вещество
Как видите, в большинстве случаев реакции между веществами из двух столбцов приводят к образованию соли. Ну а исключения надо отдельно все разобрать, а некоторые выучить.
в ЕГЭ это задания:
- А7 — классификация органических и неорганических веществ.
- А8 — свойства простых веществ.
- А9 — химические свойства оксидов.
- А10 — свойства оснований и кислот.
- А11 — химические свойства солей.
- А12 — взаимосвязь неорганических соединений.
в ГИА (ОГЭ) по химии:
- А9 — Химические свойства простых веществ: металлов и неметаллов
- А10 — Химические свойства оксидов: основных, амфотерных, кислотных
- А11 — Свойства оснований и кислот
- А12 — Химические свойства солей (средних)
[TESTME 13]
Категории:
|
Обсуждение: «Классы неорганических соединений»
(Правила комментирования)
Эта информация доступна зарегистрированным пользователям
Вы уже неоднократно встречались с различными типами соединений.
На этом уроке мы приведём эти знания в единую систему.
Среди неорганических химических соединений выделяют 4 основных класса:
- оксиды
- основания
- кислоты
- соли
Отнесение вещества к определенному классу происходит на основании его состава и химических свойств.
Конечно, каждое вещество обладает своими уникальными свойствами, но на этом уроке мы рассмотрим те их свойства, на основании которых вещества разделяют на классы.
Оксиды – это соединения двух элементов, один из которых – кислород.
Все химические элементы могут образовывать оксиды.
Некоторые химические элементы могут образовывать несколько оксидов, проявляя в них разные степени окисления.
При этом образуются совершенно непохожие друг на друга вещества.
Например, азот (N) образует пять оксидов:
|
Химическая формула |
Валентность азота в веществе |
Краткое описание вещества |
|
N2O |
I |
Бесцветный газ со сладковатым привкусом. «Веселящий газ». Слаботоксичен. Используется в медицине для наркоза. |
|
NO |
II |
Бесцветный газ без запаха. Токсичен – вызывает удушье. |
|
N2O3 |
III |
Синяя жидкость. «Азотистый ангидрид». Токсичен – вызывает ожоги кожи. Применяется в лабораторных условиях для получения азотной кислоты. |
|
NO2 |
IV |
Бурый газ с резким запахом. «Лисий хвост». Токсичен – вызывает удушье и ожог легких. Применяется как окислитель ракетного топлива, а также в промышленности при получении азотной кислоты. |
|
N2O5 |
V |
Бесцветные кристаллы. «Азотный ангидрид». Токсичен. Взрывоопасен. |
Эта информация доступна зарегистрированным пользователям
При нормальных условиях оксиды могут быть:
- газами
- жидкостью
- твёрдым веществом
|
Химическая формула |
Систематическое и тривиальное название |
Внешний вид |
Применение |
|
H2O |
Оксид водорода Вода |
Бесцветная жидкость без вкуса |
Везде! |
|
B2O3 |
Оксид бора Борный ангидрид |
Бесцветные кристаллы с горьким вкусом |
Флюс в металлургии |
|
CO2 |
Оксид углерода (IV) Углекислый газ |
Бесцветный газ без запаха |
Наполнитель в пищевой промышленности |
|
N2O |
Оксид азота (I) Веселящий газ |
Бесцветный газ со сладковатым привкусом |
Наркоз в медицине |
|
Al2O3 |
Оксид алюминия Корунд |
Бесцветные кристаллы |
Изготовление керамики |
Оксиды разделяют на три группы:
- Кислотные (оксиды неметаллов). Кислотным оксидам соответствуют кислоты.
- Основные (оксиды металлов). Основным оксидам соответствуют основания.
- Амфотерные (оксиды переходных металлов), которые занимают примерно середину периодической таблицы элементов Менделеева.
Амфотерные оксиды обычно нерастворимы в воде, а растворимы в кислотах или в основаниях. В химических реакциях с кислотами они ведут себя как основные оксиды, а в реакциях с основаниями как кислотные.
Разделение основано на том, вещество какого типа способен образовывать данный оксид:
- кислоту
- основание
- кислоту и основание
Эта информация доступна зарегистрированным пользователям
Оксид водорода (H2O) или воду не относят ни к одному из этих типов, так как вода является основой жизни на Земле.
Оксиды легко вступают в реакцию с водой.
При этом получаются
- кислоты SO3 + H2O → H2SO4
- основания 2Na + 2H2O → 2 NaOH + H2↑
Кислоты и основания также называют гидроксидами.
Это слово состоит из двух корней: гидро («вода») + оксид.
Эта информация доступна зарегистрированным пользователям
Основание — сложное вещество, которое состоит из атома металла или иона аммония (NH4+) и гидроксогруппы (-OH)
Пример оснований:
Ca(OH)2 гидроксид кальция
NH4OH гидроксид аммония
Основания образуются при реакции основного оксида с водой
Na2O + H2O= 2NaOH
Не все оксиды реагируют с водой!
Из оксида кальция образуется гидроксид кальция:
Эта информация доступна зарегистрированным пользователям
Основания бывают
- растворимые в воде
- нерастворимые в воде
Из за этого их свойства различаются.
Растворимые в воде основания называют щёлочи.
Щёлочи образуют металлы I и II групп периодической системы элементов и некоторые другие металлы.
Слово «щёлочь» происходит от древнего слова «selok», обозначающего «стирать», потому что щёлочи с древних времён использовали в стирке: они хорошо растворяют белки, жиры и песок.
Например, гидроксид натрия (NaOH) вы можете найти в составе средств для прочистки труб.
Щелочи известны с давних времен.
Поэтому для них характерны и исторически сложившиеся (тривиальные) названия:
КОН – едкое кали
NaOH – едкий натр
Са(ОН)2 – в твёрдом виде называется гашеная известь, раствор — известковая вода
Ва(ОН)2 – баритовая вода.
Основные свойства гидроксидов увеличиваются сверху вниз: гидроксид цезия CsOH намного более едкий, чем гидроксид натрия NaOH, но не находит широкого применения из-за малой распространенности цезия в природе.
Основания находят широкое применение в быту и в промышленности.
Эта информация доступна зарегистрированным пользователям
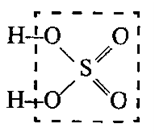
Кислота – это сложное вещество, в молекуле которого имеется атом водорода и кислотный остаток.
Пример: серная кислота H2SO4
Ее состав можно написать так H+(HSO4)—
Видим, что она состоит из атома водорода H+ и кислотного остатка (HSO4)— . Значит, это соединение — кислота!
Кислоты могут образовываться реакцией кислотных оксидов с водой.
SO3 + H2O → H2SO4
Так образуется серная кислота H2SO4
Иначе H2SO4 можно записать в виде гидроксида SO2(OH)2
Кроме этих веществ кислотами в химии также называют множество органических кислот.
Органические кислоты – это те, которые образуются в живых организмах (например, муравьиная, уксусная, лимонная, щавелевая, яблочная, винная).
Их подробно изучает отдельная область химии – органическая химия.
Эта информация доступна зарегистрированным пользователям
Общие признаки кислот- это сложные вещества, а в их составе всегда есть водород.
Все кислоты в разной степени — это едкие вещества.
Карбонаты являются очень неустойчивыми в кислотах – разлагаются с выделением углекислого газа:
Эта информация доступна зарегистрированным пользователям
Алхимики часто использовали «царскую водку» – смесь азотной и соляной кислот.
При их смешивании происходит химическая реакция:
Эта информация доступна зарегистрированным пользователям
Образующийся нитрозилхлорид – очень агрессивное вещество, оно даже реагирует с металлами, не растворяющимися в чистых кислотах: золотом, платиной и палладием.
Поэтому «царская водка» – одно из самых агрессивных химических веществ.
В лаборатории её обычно используют для очистки химической посуды от сильных загрязнений.
Кислота внутри нас.
Газ хлороводород, растворенный в воде, называют соляной кислотой.
Желудочный сок животных и человека содержит соляную кислоту HCl.
Вы могли встретиться уже с этим названием, поскольку соляная кислота свободно продаётся в хозяйственных магазинах.
Она используется в быту как чистящее средство.
Кислоты применяются:
- в быту
- в лаборатории
- в технике
- в промышленности в качестве исходных веществ для получения каких-либо других или в качестве промежуточных в ходе химических производств, также они могут являться конечным результатом производства.
Эта информация доступна зарегистрированным пользователям
Внимание! Сaution! Achtung! Attenzione! 注意力
При работе с кислотами следует помнить, что это едкие вещества, и соблюдать осторожность!
Не допускать попадания кислот на кожу, а особенно на слизистые оболочки – глаза, рот!
При попадании кислоты на кожу или в глаза следует промыть большим количеством проточной воды!
Эта информация доступна зарегистрированным пользователям
В результате многих химических реакций образуются сложные вещества, относящиеся к классу солей.
Солями называют вещества, которые состоят из атомов металла и кислотного остатка.
Кислотный остаток – та часть кислоты, которая при реакции с металлом присоединяется к нему.
Формулы солей составляют на основании учета валентности металла и кислотного остатка.
При этом каждой кислоте соответствует собственное название её кислотного остатка. Так же называется и соль (с прибавлением названия металла).
Несколько примеров с солями разных кислот приведено в таблице:
|
Кислота и её формула |
Название кислотного остатка |
Соли |
|
Угольная H2CO3 |
Карбонат |
CaCO3 – карбонат кальция (мел, жемчуг, мрамор) NaHCO3 – гидрокарбонат натрия (пищевая сода) Na2CO3 – карбонат натрия (кальцинированная сода) K2CO3 – карбонат калия (поташ) |
|
Азотная HNO3 |
Нитрат |
KNO3 – нитрат калия (чилийская селитра) NaNO3 – нитрат натрия (натриевая селитра) AgNO3 – нитрат серебра (ляпис) |
|
Плавиковая HF |
Фторид |
CaF2 – фторид кальция (плавиковый шпат) UF6 – фторид урана (применяется для обогащения урана) LiF – фторид лития (компонент оптических линз) |
|
Кремниевая H2SiO3 |
Силикат |
K2SiO3 – силикат калия (удобрение) Na2SiO3 – силикат натрия (производство стекла) |
|
Серная H2SO4 |
Сульфат |
K2SO4 – сульфат калия (удобрение) MgSO4 – сульфат магния (магнезия) CaSO4 – сульфат кальция (гипс) CuSO4 – сульфат меди (медный купорос) |
|
Соляная HCl |
Хлорид |
NaCl – хлорид натрия (поваренная соль) HgCl2 – хлорид ртути (II), сулема (дезинфекция) Hg2Cl2 – хлорид ртути (I), каломель (дезинфекция) |
В таблице приведена лишь очень малая часть солей.
Большинство неорганических соединений представляют собой именно соли.
В первой строке таблицы вы наверняка, кроме карбоната, заметили гидрокарбонат.
NaHCO3 – гидрокарбонат натрия (пищевая сода)
Это соль неполного замещения.
Такие соли образуются в тех случаях, когда молекула кислоты содержит несколько атомов водорода, но не все из них замещаются на металл.
При этом к названию соли добавляется приставка «гидро-», что обозначает наличие водорода (Н).
Эта информация доступна зарегистрированным пользователям
Соли могут образовываться в результате нескольких типов реакций:
- металла и неметалла 2Na + Cl2 = 2NaCl
- металла с кислотой Zn + 2HCl = ZnCl2 + H2
- металла с солью менее активного металла Fe + CuSO4 = FeSO4 + Cu
- основного и кислотного оксида MgO + CO2= MgCO3
- основного оксида и кислотой CuO + H2SO4= CuSO4 + H2O
- основания и кислотой Ca(OH)2 + 2HCl= CaCl2 + 2H2O
- основания и раствора соли Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4
- основания и кислотного оксида Ba(OH)2 + CO2 = BaCO3 + H2O
- обмен между двумя солями 2Na3PO4 + 3CaCl2 = Ca3(PO4)2 + 6NaCl
- солью и кислотой MgCO3 + 2HCl = MgCl2 + H2O + CO2
Реакции обмена проходят до конца только в тех случаях, когда образуется газ или осадок.
Соли также вступают в химические реакции с металлами, но не во всех случаях.
Происходит химическая реакция: железо переходит в раствор, а медь выделяется в чистом виде:
Эта информация доступна зарегистрированным пользователям
Такие реакции возможны только в тех случаях, когда исходный металл более активный, чем металл в составе соли.
Для определения активности металлов по отношению друг к другу химики составили ряд активности металлов:
Эта информация доступна зарегистрированным пользователям
В этом ряду активность металлов ослабевает слева направо.
Видно, что железо находится левее меди, то есть железо – более активный металл, чем медь.
Поэтому такая реакция возможна. А обратная реакция – вытеснение железа медью – невозможна.
А значит, не стоит хранить рядом гвозди и медный купорос!
Эта информация широко используется в технике. Глядя на ряд активности металлов, мы понимаем, что определенные соли и чистые металлы нельзя держать в тесном контакте, иначе между ними начнется химическая реакция.
Эта информация доступна зарегистрированным пользователям
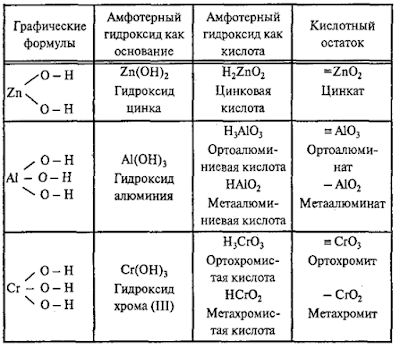
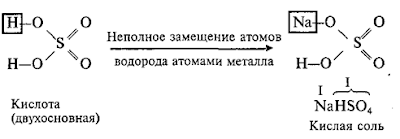
Раздел 1. Классификация неорганических веществ.
Состав, номенклатура и графические формулы оксидов, оснований, кислот и солей
1.1.
Важнейшие классы неорганических веществ
В
настоящее время известно около 400 тысяч различных неорганических веществ. Все неорганические
вещества можно разделить на классы – оксиды, кислоты, основания и соли. Каждый
класс объединяет вещества, сходные по составу и по свойствам.
Все
неорганические вещества делятся на простые
и сложные.
Простые
вещества подразделяются на металлы, неметаллы и инертные газы. Важнейшими
классами сложных неорганических веществ являются: оксиды, основания, кислоты,
амфотерные гидрокисды, соли.
Оксиды – это соединения двух элементов, один из
которых кислород. Общая формула оксидов:
где m – число атомов элемента Э; n – число атомов
кислорода.
Основания – это сложные вещества, молекулы которых
состоят из атома металла и одной или нескольких гидроксидных групп – ОН. Общая
формула оснований:
где
у – число гидроксидных групп, равное
валентности металла Ме.
Примеры
оснований:
Кислоты – это сложные
вещества, содержащие атомы водорода, которые могут замещаться атомами металла.
Общая формула кислот:
где
Ас – кислотный остаток, х – число
атомов водорода, равное валентности кислотного остатка.
Примеры
кислот: НСl, HNO3, H2SO4, H3PO4.
Амфотерные
гидроксиды
– это сложные вещества, которые имеют свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов можно записывать в форме оснований и в
форме кислот.
Примеры
амфотерных гидроксидов:
Соли – это продукты
замещения атомов водорода в молекулах кислот атомами металла или это продукты
замещения гидроксидных групп в молекулах оснований кислотными остатками.
Например:
Состав
нормальных солей выражается общей формулой:
где
х
— число атомов металла; у –
число кислотных остатков.
Примеры
солей: К3РО4, МgSO4, FeCl3.
1.2.
Номенклатура, классификация и графические формулы оксидов
Номенклатура
Называются они просто — «оксид + название элемента»
(см. таблицу). Если валентность химического элемента переменная, то указывается
римской цифрой, заключённой в круглые скобки, после названия химического
элемента.
|
Формула |
Название |
Формула |
Название |
|
CO |
оксид |
Fe2O3 |
оксид |
|
NO |
оксид |
CrO3 |
оксид |
|
Al2O3 |
оксид |
ZnO |
оксид |
|
N2O5 |
оксид |
Mn2O7 |
оксид |
Классификация
оксидов
Все оксиды можно разделить на две группы:
солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или
безразличные.
1). Основные
оксиды – это оксиды, которым соответствуют основания. К основным
оксидам относятся оксиды металлов 1
и 2 групп, а также металлов побочных подгрупп с
валентностью I и II (кроме ZnO — оксид цинка и BeO – оксид берилия):
2). Кислотные
оксиды – это оксиды, которым соответствуют кислоты. К кислотным
оксидам относятся оксиды неметаллов (кроме
несолеобразующих – безразличных), а также оксиды металлов побочных
подгрупп с валентностью от V до VII (Например, CrO3-оксид
хрома (VI), Mn 2O7 — оксид марганца (VII)):
3). Амфотерные оксиды –
это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды
металлов главных и побочных подгрупп с
валентностью III, иногдаIV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3, Cr2O3).
4). Несолеобразующие
оксиды – это оксиды безразличные к кислотам и основаниям. К ним
относятся оксиды неметаллов с валентностью I и II (Например, N2O, NO, CO).
Вывод: характер
свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
CrO (II — основный);
Cr 2O3 (III — амфотерный);
CrO3 (VII — кислотный).
Классификация
оксидов
(по растворимости в воде)
|
Кислотные оксиды |
Основные оксиды |
Амфотерные оксиды |
|
Растворимы в воде. Исключение –SiO2 (не растворим |
В воде растворяются (это металлы I «А» и II «А» групп, исключение Be ,Mg) |
С водой не В воде не растворимы |
Графические
формулы
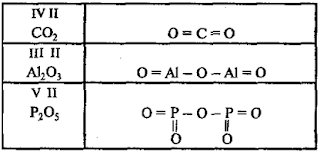
В
оксидах атомы кислорода связаны только с атомами другого элемента и не связаны
друг с другом. Например:
1.3.
Номенклатура, классификация и графические формулы оснований
Номенклатура
По номенклатуре основания называют гидроксидами. Если
валентность химического элемента переменная, то указывается римской цифрой,
заключённой в круглые скобки, после названия химического элемента:
|
Формула |
Название |
Формула |
Название |
|
LiOH |
гидроксид |
Ca(OH)2 |
гидроксид |
|
NaOH |
гидроксид |
Cu(OH)2 |
гидроксид |
|
KOH |
гидроксид |
Fe(OH)3 |
гидроксид |
Классификация оснований
Графические
формулы
В молекуле
основания атом металла соединяется с атомами кислорода гидроксидных групп.
Например:
1.4.
Номенклатура, классификация и графические формулы кислот.
Понятие об амфотерных гидроксидах
Номенклатура
Названия кислородных
кислот образуются от названия элемента с прибавлением окончаний -ная, -вая, если степень окисления его соответствует номеру группы короткой формы Периодической
системы, и слова «кислота». По мере понижения
степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Например,
HCl+7O4 – хлорная кислота,
HCl+5O3 – хлорноватая кислота,
HCl+3O2 – хлористая кислота,
HCl+1O – хлорноватистая кислота.
Если элемент в одной и
той же степени окисления образует несколько кислородсодержащих кислот, то к
названию кислоты с меньшим содержанием кислородных атомов добавляется приставка мета-, при наибольшем числе – приставка орто-.
Например,
HBO2 – метаборная кислота, H3BO3 – ортоборная кислота; HPO3 – метафосфорная кислота, H3PO4 – ортофосфорная кислота.
Названия бескислородных
кислот образуются от названия элемента с окончанием на —о и прибавлением слова «водородная».
Например, HF – фтороводородная; HCl – хлороводородная, H2S – сероводородная.
Помимо этих названий, в
русском языке применяются традиционные названия для некоторых важных и часто
применяемых соединений.
Например, HСl – соляная кислота;
HF – плавиковая кислота;
HCN – синильная кислота и др.
Классификация кислот
Графические
формулы
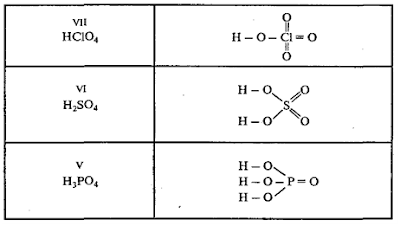
В
оксокислотах атомы водорода связаны с атомами кислорода, но не с атомами
кислотообразующего элемента. Например:
В
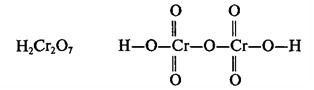
оксокислотах, молекулы которых содержат 2 и более атомов кислотообразующего
элемента, эти атомы соединяются через атомы кислорода. Например:
Амфотерные гидроксиды
Молекулярная
формула любого амфотерного гидроксида может быть записана в форме основания и в
форме кислоты:
Каждому
амфотерному гидроксиду можно дать название как основанию и как кислоте:
1.5.
Номенклатура, классификация и графические формулы солей
Номенклатура
Названия солей
для средней
соли —
название кислотного
остатка + название металла + указываем валентность для металла с переменной
валентностью
Na2SO4— сульфат натрия,
CuSO4—
сульфат меди (II)
для кислой соли
–
«гидро» или
«дигидро» + название кислотного остатка + название металла +
указываем валентность для металла с переменной валентностью
NaHSO4 –
гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
для основной соли –
«гидроксо» + название кислотного остатка + название
металла + указываем валентность для металла с переменной валентностью
Mg(OH)Cl — гидроксохлорид магния
Классификация солей
Нормальные (средние) соли
Нормальные
(средние) соли – это продукты полного замещения атомов водорода в молекуле
кислоты атомами металла, или продукты полного замещениягидроксидных групп в
молекуле основания кислотными остатками. Например:
Графические
формулы
При
составлении графических формул нормальных солей следует в графических формулах
соответствующих кислот замещать атомы водорода атомами металла с учетом
валентности металла.
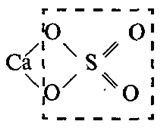
Составим
графическую формулу сульфата кальция СаSO4. Эта соль
содержит кислотный остаток серной кислоты Н2SO4:
Валентность
Са равна двум, поэтому один атом кальция замещает два атома водорода:
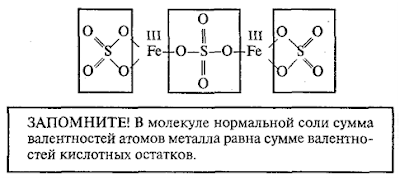
Составим
графическую формулу сульфата железа (III) Fe2(SO4)3.
Одна молекула этой соли содержит 3 кислотных остатка серной кислоты; один атом
трехвалентного железа замещает 3 атома водорода:
Кислые соли
Кислые
соли – это продукты неполного замещения атомов водорода в молекулах
многоосновных кислот атомами металла.
Например:
Двухосновная
кислота с любым металлом образует одну нормальную и одну кислую соль.
Трехосновная кислота с любым металлом образует одну нормальную и две кислые
соли.
Молекулы
кислых солей содержат атомы водорода, латинское название которого
«гидрогениум»:
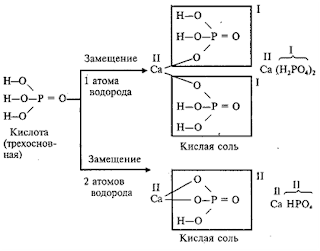
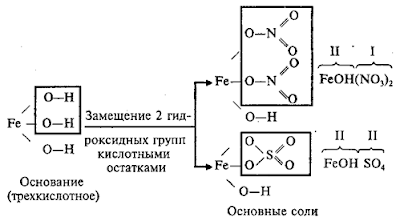
Основные соли
Основные
соли – это продукты неполного замещения гидроксидных групп в молекулах
многокислотных оснований кислотными остатками. Например:
Двухкислотное
основание образует одну нормальную и одну основную соль с данным кислотным
остатком.
Трехкислотное
основание образует одну нормальную и две основные соли с данным кислотным
остатком.
Молекулы
основных солей содержат гидроксидные группы:
УПРАЖНЕНИЯ
1.
Классифицируйте
следующие кислоты по основности и по содержанию атомов кислорода: Н3РО4, НNO2, H2S,
HCN, HClO3,
H2CO3,
HF.
Решение:
Одноосновные
кислоты: НNO2, HCN,
HF, HClO3
Двухосновные
кислоты: H2S, H2CO3
Трехосновные
кислоты: Н3РО4
Бескислородные
кислоты: H2S, HCN, HF
Кислородсодержащие
кислоты: Н3РО4, НNO2, HClO3, H2CO3
____________________________________________________________
2.
Классифицируйте
и назовите следующие соли: BaSO4,
(CuOH)2SO4, NaH2PO4, Ca(HS)2, FeOHCl2, AlPO4, MnOHNO3.
Решение:
Нормальные
соли: BaSO4
– сульфат бария, AlPO4
–
фосфат алюминия.
Кислые
соли: NaH2PO4
– дигидрофосфат натрия, Ca(HS)2 – гидросульфид
кальция.
Основные
соли: (CuOH)2SO4 –
гидроксосульфат меди (II),
FeOHCl2
–
гидроксохлорид железа (III),
MnOHNO3
–
гидроксонитрат марганца (II).
____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
2.
Составьте формулы
предложенных веществ:
Оксид калия, оксид серы (VI), гидроксид
магния, гидроксид меди (II), оксид бария, оксид азота (II), оксид цинка,
гидроксид натрия, оксид фосфора (III), оксид углерода (II), оксид
углерода (IV), оксид алюминия.
3.
Классифицируйте соли (средние
(нормальные), кислые, основные):
Na2CO3; K2SO4; AI(OH)CI;
NaHCO3; Ba(NO3)2; Ca(HCO3)2;
K3PO4; Ca(OH)CI; KH2PO4.
4.
Классифицируйте следующие
кислоты по основности и по содержанию атомов кислорода:
HI, H2S, HNO2, HMnO4, H2CO3.
5.
Напишите формулы и названия
оксидов, гидратами которых являются следующие кислоты: H2SiO3, HNO2, H2CrO4, H3PO4, H2MnO4.
6.
Определите валентность
кислотообразующих элементов в следующих кислотах и напишите графические формулы
этих кислот: HClO, H2Cr2O7,
H4P2O7.
7.
Напишите формулы следующих
амфотерных гидроксидов в форме кислот и определите валентность кислотных
остатков в этих кислотах: Cr(OH)3, Sn(OH)2, Pb(OH)2.
8.
Классифицируйте и назовите
следующие соли:
9.
Напишите молекулярные и графические
формулы следующих солей: а) дигидрофосфат натрия; б) сульфат алюминия; в) гидроксосульфат цинка; г) бромид железа (III);
д) перманганат калия.
10.
Напишите молекулярные и графические формулы
нормальных солей, которые могут быть получены в результате замещения в молекуле
амфотерного гидроксида Zn(OH)2: а) гидроксидных групп кислотными остатками
азотной кислоты; б) атомов водорода
атомами натрия. Назовите эти соли.
|
1. К амфотерным |
|
|
1. а) CuO |
2. б) P2O3 |
|
3. в) Cr2O3 |
4. г) CrO3 |
|
2. Среди перечисленных веществ |
|
|
1. а) гидрид магния |
2. б) гидрокарбонат натрия |
|
в) гидроксид |
3. г) гидроксокарбонат меди |
|
3. Какой из элементов может |
|
|
1. а) Стронций |
2. б) марганец |
|
3. в) кальций |
г) магний |
|
4. Оксид серы (VI) взаимодействует с |
|
|
1. а) водой и соляной кислотой; 2. |
3. б) кислородом и оксидом магния |
|
4. в) оксидом кальция и гидроксидом |
5. г) водой и медью |
|
5. Гидроксид железа (III) образуется |
|
|
1. а) оксид железа (II); |
б) оксид |
|
в) растворы |
г) растворы |
|
6. Хлорид железа (II) реагирует с |
|
|
1. а) MgO , HCl |
2. б) Zn , AgNO3 |
|
3. в) HNO3, CO2 |
г) CaO, CO2 |
|
7. В схеме превращений CaCO3 → X1 → X2 + NaCl |
|
|
1. а) CaCO3 |
2. б) CaCl2 |
|
3. в) CaO |
4. г) Ca(OH)2 |
|
8. К основным оксидам относится: |
|
|
1. а) ZnO |
2. б) SiO2 |
|
3. в) BaO |
4. г) l2O3 |
|
9. Высший оксид элемента с |
|
|
1. а) основным |
2. б) кислотным |
|
3. в) амфотерным |
4. г) несолеобразующим |
|
10. Оксид углерода (IV) |
|
|
1. а) водой и оксидом кальция |
2. б) кислородом и оксидом серы (IV) |
|
3. в) сульфатом калия и гидроксидом |
4. г) фосфорной кислотой и водородом |
Ответы:
|
1 |
в |
|
2 |
б |
|
3 |
б |
|
4 |
в |
|
5 |
г |
|
6 |
б |
|
7 |
а |
|
8 |
в |
|
9 |
б |
|
10 |
а |