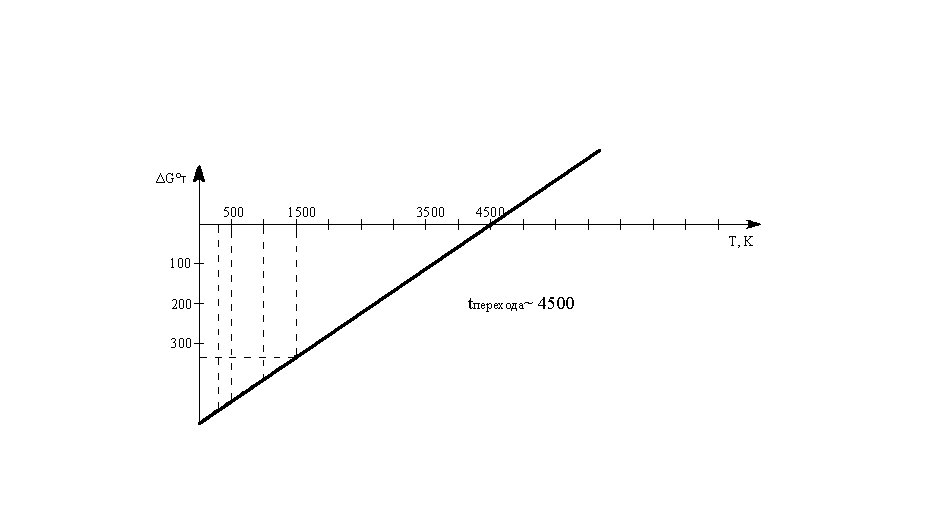В уроке 21 «Теплота образования» из курса «Химия для чайников» рассмотрим что такое теплоты образования и откуда их брать; выясним, какие условия считаются стандартными, а также различия простых и сложных веществ; для закрепления полученных знаний решим пару задач, где используются теплоты образования и закон аддитивности теплот реакций. Будет неплохо, если перед прочтением данного урока, вы изучите материал про изменение энтальпии, а также про теплоты сгорания.
Благодаря закону Гесса (закону аддитивности теплот реакций) нам совсем не нужно считать теплоты всех реакций; достаточно иметь сведения о теплОтах лишь того минимума реакций, из которых можно получить все остальные. Подобный минимум, принятый всеми учеными и инженерами, представляет собой теплоты образования соединений из входящих в них чистых элементов в стандартных состояниях. А что же такое: стандартные состояния?
Стандартное состояние вещества
Для кристаллических и жидких веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25°С (298 К*) и внешнем давлении 1 атмосфера (атм); стандартное состояние газов определяется аналогичным образом, но при парциальном** давлении 1 атм. Вот например, стандартным состоянием углерода считается графит, а не алмаз.
* Кельвин (обозначение «К») – еще один показатель измерения температуры, наряду с Цельсия. Пока вам просто следует запомнить, что 0°С = 273 К, соответственно 1°С = 274 К, -1°С = 272 К, а -273°С = 0 К. Самой низкой температурой считается 0 К и называется абсолютным нулем.
** Парциальное давление — это давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.
Простые и сложные вещества
Все вещества можно разделить на две обширные группы — простые и сложные вещества.
Простые вещества — это вещества, образованные из атомов одного элемента. Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Сложные вещества (химические соединения) — это вещества, образованные атомами разных элементов. Так, оксид меди CuO образован атомами элементов меди Cu и кислорода O, вода H2O — атомами элементов водорода H и кислорода O.
Теперь вы понимаете различия простых веществ от сложных. Так вот, теплота образования простых веществ всегда равна нулю. Это, пожалуйста, запомните.
Стандартные теплоты образования
Вспомним прошлый урок, где мы пытались синтезировать алмаз. Теплоты образования всех веществ, участвующих в этом синтезе таковы:
- C(графит) + 2H2(г.) → CH4(г.) ΔH = -74,8 кДж (1)
- C(графит) → C(алмаз) ΔH = +1,9 кДж (2)
- H2(г.) + ½O2(г.) → H2O(ж.) ΔH = -285,8 кДж (3)
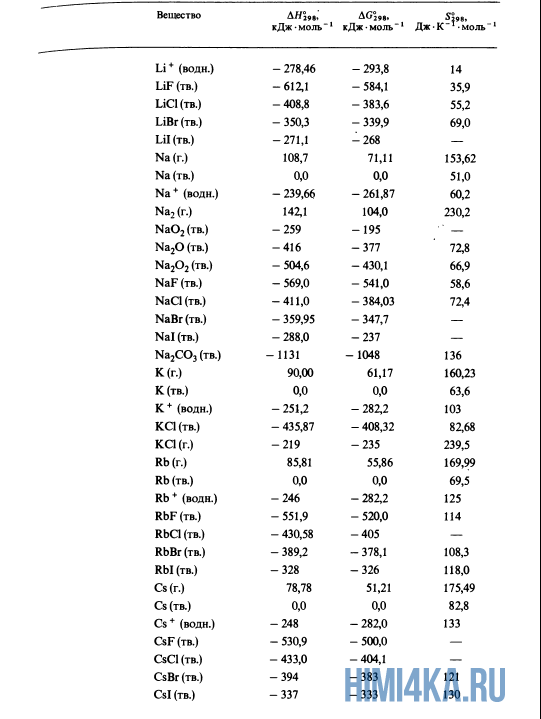
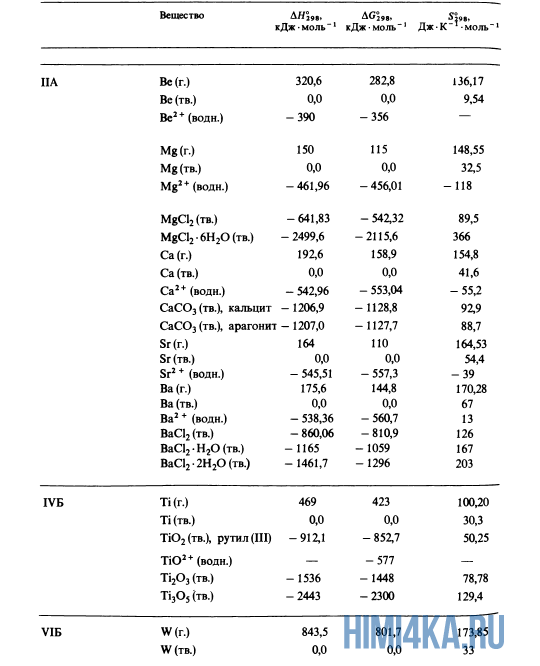
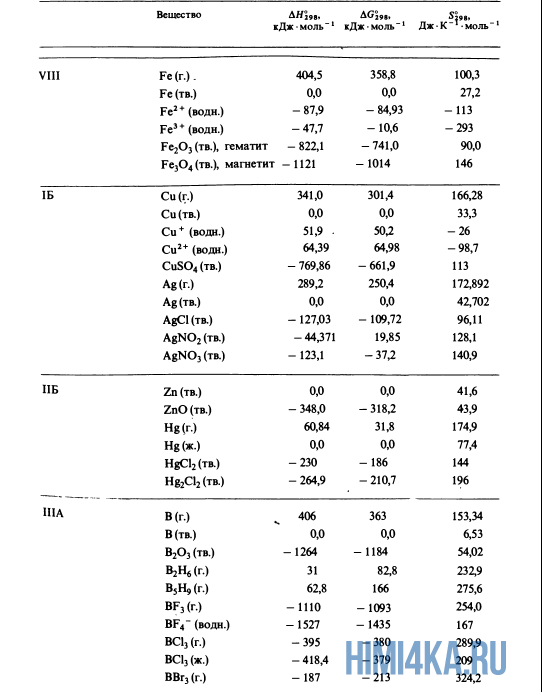
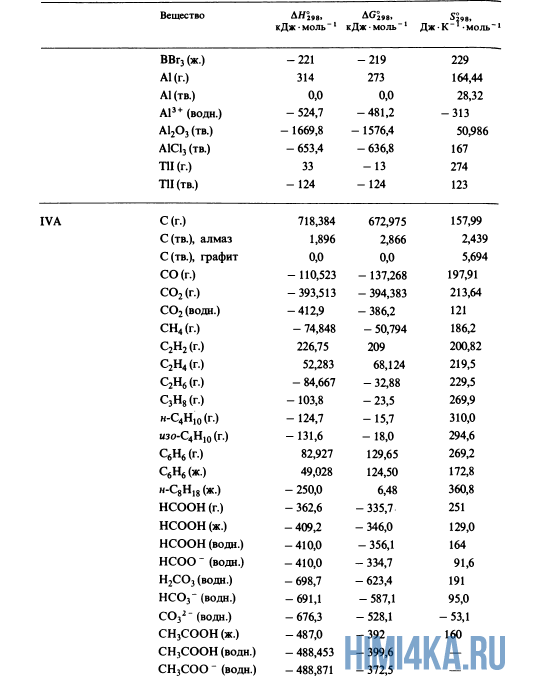
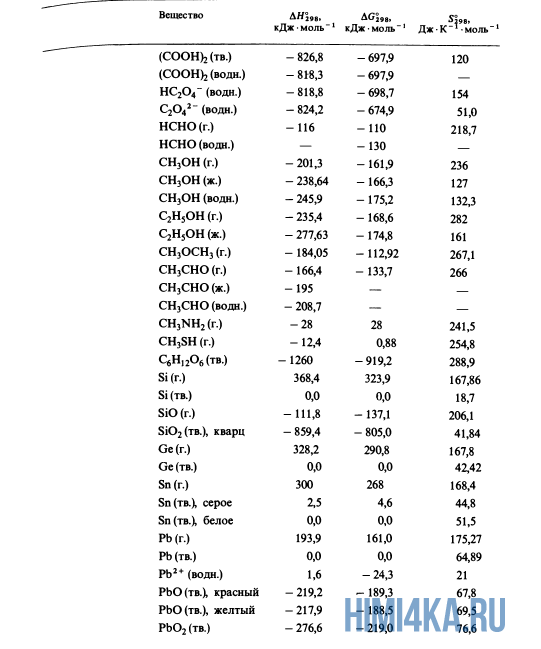
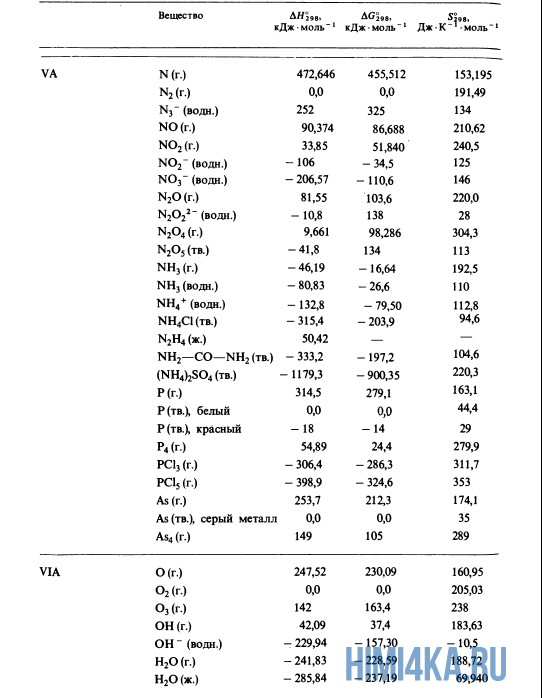
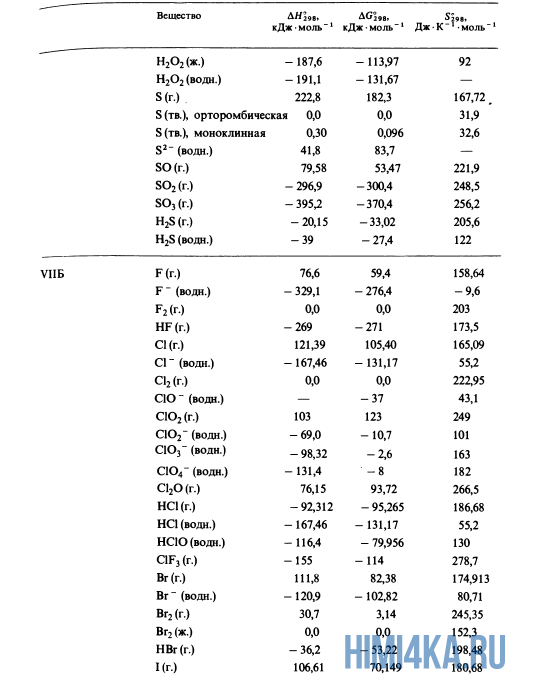
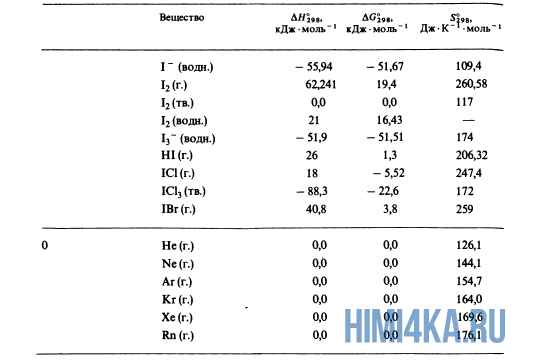
Как уже было отмечено выше, O2 относится к простым веществам, поэтому его теплота образования равна нулю. Таблицы стандартных теплот образования ΔH°298 соединений из чистых элементов приведена ниже под спойлером. В этой таблице нижний индекс 298 обозначает комнатную температуру (298 К = 25°С), а верхний индекс (знак градуса) означает, что реагенты и продукты находятся в своих стандартных состояниях. Однако не обязательно пользоваться записью ΔH°298, достаточно лишь написать ΔH.
Сейчас, на примере старой и доброй реакции (4) получения алмаза путем окисления метана, я покажу вам, как по теплотам образования веществ можно определить теплоту общей реакции. Это уравнение можно получить суммированием уравнения (2) с удвоенным уравнением (3) и обращенным уравнением (1):
- C(графит) → C(алмаз) ΔH = +1,9 кДж (2)
- 2H2(г.) + O2(г.) → 2H2O(ж.) ΔH = -571,6 кДж 2×(3)
- CH4(г.) → C(графит) + 2H2(г.) ΔH = +74,8 кДж -(1)
В итоге получаем:
- CH4(г.) + O2(г.) → C(алмаз) + 2H2O(ж.) ΔH = -494,9 кДж (4)
Теплота реакции вычисляется точно таким же способом, просто из теплот образования продуктов реакции вычитаем теплоты образования реагентов, учитывая все коэффициенты:
- ΔH = (+1,9) + 2(-285,8) — (-74,8) = -494,9 кДж
У кого возник вопрос, почему же мы не вычитаем теплоту образования кислорода, ответ ищите в таблице теплот образования.
Очевидно, что при таких вычислениях следует быть очень внимательным к знакам и коэффициентам. Чтобы не допустить ошибки, настоятельно рекомендую вам выписывать отдельно каждое уравнение с соответствующей теплотой реакции в таком виде, чтобы сумма всех индивидуальных уравнений давала требуемую реакцию. Если все коэффициенты какого-либо уравнения умножены на произвольное число n, на это же число n должна быть умножена соответствующая теплота образования, а если используется обращенное уравнение реакции образования, то следует изменить свой знак перед табличной величиной ΔH. Когда индивидуальные уравнения суммируются для получения требуемой реакции, сумма индивидуальных теплот образования дает искомую теплоту реакции. А теперь закрепим полученные знания примерами.
Пример 1. Чему равна стандартная теплота реакции восстановления оксида трехвалентного железа Fe2O3 углеродом С до железа Fe и моноксида углерода O, протекающей в доменной печи?
Решение:
Запишем уравнение реакции, указав под каждым веществом его стандартную теплоту образования:
- Fe2O3(тв.) + 3C(графит) → 2Fe(тв.) + 3CO(г.)
- -822,1 0,0 0,0 -110,5 ΔH, кДж·моль-1
Стандартная теплота образования простых элементов (С и Fe) по определению равна нулю. Стандартная теплота рассматриваемой реакции равна:
- ΔH° = 2(0,0) + 3(-110,5) — (-822,1) — 3(0,0) = +490,6 кДж
Как видите, изменение энтальпии положительно, а значит реакция эндотермическая (поглощается тепло). Полученный результат согласуется с известным фактом, что при восстановлении железной руды до свободного железа необходимо подводить к реакционной системе большое количество теплоты. Отметим, однако, что 490,6 кДж — это теплота, которая поглощалось бы, если бы реакция проводилась при 298 К, а не при 1800 К, как это происходит в доменной печи. Получается, что наше решение неверно? Нет, оно абсолютно верно, просто тепловой эффект (+490,6 кДж) следует рассматривать как телоту, поглощаемую при нагревании оксида железа (III) и углерода от 298 до 1800 К, последующей реакции между ними и охлаждением снова до комнатной температуры 298 К. Изменение энтальпии, или теплота реакции, зависит только от исходного и конечного состояний участников реакции, а нет от того, остается ли температура постоянной или поднимается до уровня, достигаемого в доменной печи, и затем опускается снова. Важно лишь то, что в конце процесса, как и в его начале, температура имеет значение 298 К. Еще раз повторяю, ибо это очень важный момент: Когда мы ссылаемся на теплоты реакции и утверждаем, что полученные значения относятся к процессу, проводимой «при давлении 1 атм и 298 К», требуется только, чтобы реакция начиналась при этих условиях и продукты были приведены к этим условиям (1 атм и 298 К).
Пример 2. Определите теплоту сгорания жидкого бензола.
Решение:
Запишем полное уравнение реакции с указанием теплот образования всех участвующих в нем веществ:
- 2C6H6(ж.) + 15O2(г.) → 12CO2(г.) + 6H2O(ж.)
- +49 0,0 -393,5 -285,8 ΔH, кДж·моль-1
Теплота этой реакции, как она записана (с 2 молями бензола), равна:
- ΔH = 12(-393,5) + 6(-285,8) — 2(+49,0) — 15(0,0) = -6540 кДж
Следовательно, теплота сгорания 1 моля бензола должна быть равна половине этой величины, т.е. -3270 кДж·моль-1.
Надеюсь урок 21 «Теплота образования» был не скучным. Если у вас возникли вопросы, пишите их в комментарии.
From Wikipedia, the free encyclopedia
In chemistry and thermodynamics, the standard enthalpy of formation or standard heat of formation of a compound is the change of enthalpy during the formation of 1 mole of the substance from its constituent elements in their reference state, with all substances in their standard states. The standard pressure value p⦵ = 105 Pa (= 100 kPa = 1 bar) is recommended by IUPAC, although prior to 1982 the value 1.00 atm (101.325 kPa) was used.[1] There is no standard temperature. Its symbol is ΔfH⦵. The superscript Plimsoll on this symbol indicates that the process has occurred under standard conditions at the specified temperature (usually 25 °C or 298.15 K). Standard states are as follows:
- For a gas: the hypothetical state the gas would assume if it obeyed the ideal gas equation at a pressure of 1 bar
- For a gaseous or solid solute present in a diluted ideal solution: the hypothetical state of concentration of the solute of exactly one mole per liter (1 M) at a pressure of 1 bar extrapolated from infinite dilution
- For a pure substance or a solvent in a condensed state (a liquid or a solid): the standard state is the pure liquid or solid under a pressure of 1 bar
For elements that have multiple allotropes, the reference state usually is chosen to be the form in which the element is most stable under 1 bar of pressure. One exception is phosphorus, for which the most stable form at 1 bar is black phosphorus, but white phosphorus is chosen as the standard reference state for zero enthalpy of formation.[2]
For example, the standard enthalpy of formation of carbon dioxide would be the enthalpy of the following reaction under the above conditions:
All elements are written in their standard states, and one mole of product is formed. This is true for all enthalpies of formation.
The standard enthalpy of formation is measured in units of energy per amount of substance, usually stated in kilojoule per mole (kJ mol−1), but also in kilocalorie per mole, joule per mole or kilocalorie per gram (any combination of these units conforming to the energy per mass or amount guideline).
All elements in their reference states (oxygen gas, solid carbon in the form of graphite, etc.) have a standard enthalpy of formation of zero, as there is no change involved in their formation.
The formation reaction is a constant pressure and constant temperature process. Since the pressure of the standard formation reaction is fixed at 1 bar, the standard formation enthalpy or reaction heat is a function of temperature. For tabulation purposes, standard formation enthalpies are all given at a single temperature: 298 K, represented by the symbol ΔfH⦵
298 K.
Hess’s law[edit]
For many substances, the formation reaction may be considered as the sum of a number of simpler reactions, either real or fictitious. The enthalpy of reaction can then be analyzed by applying Hess’s Law, which states that the sum of the enthalpy changes for a number of individual reaction steps equals the enthalpy change of the overall reaction. This is true because enthalpy is a state function, whose value for an overall process depends only on the initial and final states and not on any intermediate states. Examples are given in the following sections.
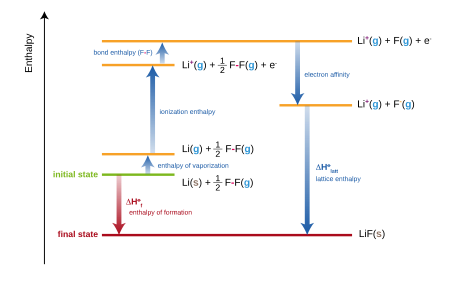
Ionic compounds: Born–Haber cycle[edit]
Standard enthalpy change of formation in Born–Haber diagram for lithium fluoride. ΔHlatt corresponds to UL in the text. The downward arrow «electron affinity» shows the negative quantity –EAF, since EAF is usually defined as positive.
For ionic compounds, the standard enthalpy of formation is equivalent to the sum of several terms included in the Born–Haber cycle. For example, the formation of lithium fluoride,
may be considered as the sum of several steps, each with its own enthalpy (or energy, approximately):
- Hsub, the standard enthalpy of atomization (or sublimation) of solid lithium.
- IELi, the first ionization energy of gaseous lithium.
- B(F–F), the standard enthalpy of atomization (or bond energy) of fluorine gas.
- EAF, the electron affinity of a fluorine atom.
- UL, the lattice energy of lithium fluoride.
The sum of all these enthalpies will give the standard enthalpy of formation (ΔHf) of lithium fluoride:
In practice, the enthalpy of formation of lithium fluoride can be determined experimentally, but the lattice energy cannot be measured directly. The equation is therefore rearranged in order to evaluate the lattice energy:[3]
Organic compounds[edit]
The formation reactions for most organic compounds are hypothetical. For instance, carbon and hydrogen will not directly react to form methane (CH4), so that the standard enthalpy of formation cannot be measured directly. However the standard enthalpy of combustion is readily measurable using bomb calorimetry. The standard enthalpy of formation is then determined using Hess’s law. The combustion of methane:
is equivalent to the sum of the hypothetical decomposition into elements followed by the combustion of the elements to form carbon dioxide (CO2) and water (H2O):
Applying Hess’s law,
Solving for the standard of enthalpy of formation,
The value of 
It is possible to predict heats of formation for simple unstrained organic compounds with the heat of formation group additivity method.
Use in calculation for other reactions[edit]
The standard enthalpy change of any reaction can be calculated from the standard enthalpies of formation of reactants and products using Hess’s law. A given reaction is considered as the decomposition of all reactants into elements in their standard states, followed by the formation of all products. The heat of reaction is then minus the sum of the standard enthalpies of formation of the reactants (each being multiplied by its respective stoichiometric coefficient, ν) plus the sum of the standard enthalpies of formation of the products (each also multiplied by its respective stoichiometric coefficient), as shown in the equation below:[4]
If the standard enthalpy of the products is less than the standard enthalpy of the reactants, the standard enthalpy of reaction is negative. This implies that the reaction is exothermic. The converse is also true; the standard enthalpy of reaction is positive for an endothermic reaction. This calculation has a tacit assumption of ideal solution between reactants and products where the enthalpy of mixing is zero.
For example, for the combustion of methane, 
However 

which is the equation in the previous section for the enthalpy of combustion 
Key concepts for enthalpy calculations[edit]
- When a reaction is reversed, the magnitude of ΔH stays the same, but the sign changes.
- When the balanced equation for a reaction is multiplied by an integer, the corresponding value of ΔH must be multiplied by that integer as well.
- The change in enthalpy for a reaction can be calculated from the enthalpies of formation of the reactants and the products
- Elements in their standard states make no contribution to the enthalpy calculations for the reaction, since the enthalpy of an element in its standard state is zero. Allotropes of an element other than the standard state generally have non-zero standard enthalpies of formation.
Examples: standard enthalpies of formation at 25 °C[edit]
Thermochemical properties of selected substances at 298.15 K and 1 atm
Inorganic substances[edit]
| Species | Phase | Chemical formula | ΔfH⦵ /(kJ/mol) |
|---|---|---|---|
| Aluminium | Solid | Al | 0 |
| Aluminium chloride | Solid | AlCl3 | −705.63 |
| Aluminium oxide | Solid | Al2O3 | −1675.5 |
| Aluminium hydroxide | Solid | Al(OH)3 | −1277 |
| Aluminium sulphate | Solid | Al2(SO4)3 | −3440 |
| Barium chloride | Solid | BaCl2 | −858.6 |
| Barium carbonate | Solid | BaCO3 | −1216 |
| Barium hydroxide | Solid | Ba(OH)2 | −944.7 |
| Barium oxide | Solid | BaO | −548.1 |
| Barium sulfate | Solid | BaSO4 | −1473.3 |
| Beryllium | Solid | Be | 0 |
| Beryllium hydroxide | Solid | Be(OH)2 | −903 |
| Beryllium oxide | Solid | BeO | −609.4 |
| Boron trichloride | Solid | BCl3 | −402.96 |
| Bromine | Liquid | Br2 | 0 |
| Bromide ion | Aqueous | Br− | −121 |
| Bromine | Gas | Br | 111.884 |
| Bromine | Gas | Br2 | 30.91 |
| Bromine trifluoride | Gas | BrF3 | −255.60 |
| Hydrogen bromide | Gas | HBr | −36.29 |
| Cadmium | Solid | Cd | 0 |
| Cadmium oxide | Solid | CdO | −258 |
| Cadmium hydroxide | Solid | Cd(OH)2 | −561 |
| Cadmium sulfide | Solid | CdS | −162 |
| Cadmium sulfate | Solid | CdSO4 | −935 |
| Caesium | Solid | Cs | 0 |
| Caesium | Gas | Cs | 76.50 |
| Caesium | Liquid | Cs | 2.09 |
| Caesium(I) ion | Gas | Cs+ | 457.964 |
| Caesium chloride | Solid | CsCl | −443.04 |
| Calcium | Solid | Ca | 0 |
| Calcium | Gas | Ca | 178.2 |
| Calcium(II) ion | Gas | Ca2+ | 1925.90 |
| Calcium(II) ion | Aqueous | Ca2+ | −542.7 |
| Calcium carbide | Solid | CaC2 | −59.8 |
| Calcium carbonate (Calcite) | Solid | CaCO3 | −1206.9 |
| Calcium chloride | Solid | CaCl2 | −795.8 |
| Calcium chloride | Aqueous | CaCl2 | −877.3 |
| Calcium phosphate | Solid | Ca3(PO4)2 | −4132 |
| Calcium fluoride | Solid | CaF2 | −1219.6 |
| Calcium hydride | Solid | CaH2 | −186.2 |
| Calcium hydroxide | Solid | Ca(OH)2 | −986.09 |
| Calcium hydroxide | Aqueous | Ca(OH)2 | −1002.82 |
| Calcium oxide | Solid | CaO | −635.09 |
| Calcium sulfate | Solid | CaSO4 | −1434.52 |
| Calcium sulfide | Solid | CaS | −482.4 |
| Wollastonite | Solid | CaSiO3 | −1630 |
| Carbon (Graphite) | Solid | C | 0 |
| Carbon (Diamond) | Solid | C | 1.9 |
| Carbon | Gas | C | 716.67 |
| Carbon dioxide | Gas | CO2 | −393.509 |
| Carbon disulfide | Liquid | CS2 | 89.41 |
| Carbon disulfide | Gas | CS2 | 116.7 |
| Carbon monoxide | Gas | CO | −110.525 |
| Carbonyl chloride (Phosgene) | Gas | COCl2 | −218.8 |
| Carbon dioxide (un–ionized) | Aqueous | CO2(aq) | −419.26 |
| Bicarbonate ion | Aqueous | HCO3– | −689.93 |
| Carbonate ion | Aqueous | CO32– | −675.23 |
| Monatomic chlorine | Gas | Cl | 121.7 |
| Chloride ion | Aqueous | Cl− | −167.2 |
| Chlorine | Gas | Cl2 | 0 |
| Chromium | Solid | Cr | 0 |
| Copper | Solid | Cu | 0 |
| Copper(II) oxide | Solid | CuO | −155.2 |
| Copper(II) sulfate | Aqueous | CuSO4 | −769.98 |
| Fluorine | Gas | F2 | 0 |
| Monatomic hydrogen | Gas | H | 218 |
| Hydrogen | Gas | H2 | 0 |
| Water | Gas | H2O | −241.818 |
| Water | Liquid | H2O | −285.8 |
| Hydrogen ion | Aqueous | H+ | 0 |
| Hydroxide ion | Aqueous | OH− | −230 |
| Hydrogen peroxide | Liquid | H2O2 | −187.8 |
| Phosphoric acid | Liquid | H3PO4 | −1288 |
| Hydrogen cyanide | Gas | HCN | 130.5 |
| Hydrogen bromide | Liquid | HBr | −36.3 |
| Hydrogen chloride | Gas | HCl | −92.30 |
| Hydrogen chloride | Aqueous | HCl | −167.2 |
| Hydrogen fluoride | Gas | HF | −273.3 |
| Hydrogen iodide | Gas | HI | 26.5 |
| Iodine | Solid | I2 | 0 |
| Iodine | Gas | I2 | 62.438 |
| Iodine | Aqueous | I2 | 23 |
| Iodide ion | Aqueous | I− | −55 |
| Iron | Solid | Fe | 0 |
| Iron carbide (Cementite) | Solid | Fe3C | 5.4 |
| Iron(II) carbonate (Siderite) | Solid | FeCO3 | −750.6 |
| Iron(III) chloride | Solid | FeCl3 | −399.4 |
| Iron(II) oxide (Wüstite) | Solid | FeO | −272 |
| Iron(II,III) oxide (Magnetite) | Solid | Fe3O4 | −1118.4 |
| Iron(III) oxide (Hematite) | Solid | Fe2O3 | −824.2 |
| Iron(II) sulfate | Solid | FeSO4 | −929 |
| Iron(III) sulfate | Solid | Fe2(SO4)3 | −2583 |
| Iron(II) sulfide | Solid | FeS | −102 |
| Pyrite | Solid | FeS2 | −178 |
| Lead | Solid | Pb | 0 |
| Lead dioxide | Solid | PbO2 | −277 |
| Lead sulfide | Solid | PbS | −100 |
| Lead sulfate | Solid | PbSO4 | −920 |
| Lead(II) nitrate | Solid | Pb(NO3)2 | −452 |
| Lead(II) sulfate | Solid | PbSO4 | −920 |
| Lithium fluoride | Solid | LiF | −616.93 |
| Magnesium | Solid | Mg | 0 |
| Magnesium ion | Aqueous | Mg2+ | −466.85 |
| Magnesium carbonate | Solid | MgCO3 | −1095.797 |
| Magnesium chloride | Solid | MgCl2 | −641.8 |
| Magnesium hydroxide | Solid | Mg(OH)2 | −924.54 |
| Magnesium hydroxide | Aqueous | Mg(OH)2 | −926.8 |
| Magnesium oxide | Solid | MgO | −601.6 |
| Magnesium sulfate | Solid | MgSO4 | −1278.2 |
| Manganese | Solid | Mn | 0 |
| Manganese(II) oxide | Solid | MnO | −384.9 |
| Manganese(IV) oxide | Solid | MnO2 | −519.7 |
| Manganese(III) oxide | Solid | Mn2O3 | −971 |
| Manganese(II,III) oxide | Solid | Mn3O4 | −1387 |
| Permanganate | Aqueous | MnO− 4 |
−543 |
| Mercury(II) oxide (red) | Solid | HgO | −90.83 |
| Mercury sulfide (red, cinnabar) | Solid | HgS | −58.2 |
| Nitrogen | Gas | N2 | 0 |
| Ammonia (ammonium hydroxide) | Aqueous | NH3 (NH4OH) | −80.8 |
| Ammonia | Gas | NH3 | −46.1 |
| Ammonium nitrate | Solid | NH4NO3 | −365.6 |
| Ammonium chloride | Solid | NH4Cl | −314.55 |
| Nitrogen dioxide | Gas | NO2 | 33.2 |
| Hydrazine | Gas | N2H4 | 95.4 |
| Hydrazine | Liquid | N2H4 | 50.6 |
| Nitrous oxide | Gas | N2O | 82.05 |
| Nitric oxide | Gas | NO | 90.29 |
| Dinitrogen tetroxide | Gas | N2O4 | 9.16 |
| Dinitrogen pentoxide | Solid | N2O5 | −43.1 |
| Dinitrogen pentoxide | Gas | N2O5 | 11.3 |
| Nitric acid | Aqueous | HNO3 | −207 |
| Monatomic oxygen | Gas | O | 249 |
| Oxygen | Gas | O2 | 0 |
| Ozone | Gas | O3 | 143 |
| White phosphorus | Solid | P4 | 0 |
| Red phosphorus | Solid | P | −17.4[5] |
| Black phosphorus | Solid | P | −39.3[5] |
| Phosphorus trichloride | Liquid | PCl3 | −319.7 |
| Phosphorus trichloride | Gas | PCl3 | −278 |
| Phosphorus pentachloride | Solid | PCl5 | −440 |
| Phosphorus pentachloride | Gas | PCl5 | −321 |
| Phosphorus pentoxide | Solid | P2O5 | −1505.5[6] |
| Potassium bromide | Solid | KBr | −392.2 |
| Potassium carbonate | Solid | K2CO3 | −1150 |
| Potassium chlorate | Solid | KClO3 | −391.4 |
| Potassium chloride | Solid | KCl | −436.68 |
| Potassium fluoride | Solid | KF | −562.6 |
| Potassium oxide | Solid | K2O | −363 |
| Potassium nitrate | Solid | KNO3 | −494.5 |
| Potassium perchlorate | Solid | KClO4 | −430.12 |
| Silicon | Gas | Si | 368.2 |
| Silicon carbide | Solid | SiC | −74.4,[7] −71.5[8] |
| Silicon tetrachloride | Liquid | SiCl4 | −640.1 |
| Silica (Quartz) | Solid | SiO2 | −910.86 |
| Silver bromide | Solid | AgBr | −99.5 |
| Silver chloride | Solid | AgCl | −127.01 |
| Silver iodide | Solid | AgI | −62.4 |
| Silver oxide | Solid | Ag2O | −31.1 |
| Silver sulfide | Solid | Ag2S | −31.8 |
| Sodium | Solid | Na | 0 |
| Sodium | Gas | Na | 107.5 |
| Sodium bicarbonate | Solid | NaHCO3 | −950.8 |
| Sodium carbonate | Solid | Na2CO3 | −1130.77 |
| Sodium chloride | Aqueous | NaCl | −407.27 |
| Sodium chloride | Solid | NaCl | −411.12 |
| Sodium chloride | Liquid | NaCl | −385.92 |
| Sodium chloride | Gas | NaCl | −181.42 |
| Sodium chlorate | Solid | NaClO3 | −365.4 |
| Sodium fluoride | Solid | NaF | −569.0 |
| Sodium hydroxide | Aqueous | NaOH | −469.15 |
| Sodium hydroxide | Solid | NaOH | −425.93 |
| Sodium hypochlorite | Solid | NaOCl | −347.1 |
| Sodium nitrate | Aqueous | NaNO3 | −446.2 |
| Sodium nitrate | Solid | NaNO3 | −424.8 |
| Sodium oxide | Solid | Na2O | −414.2 |
| Sulfur (monoclinic) | Solid | S8 | 0.3 |
| Sulfur (rhombic) | Solid | S8 | 0 |
| Hydrogen sulfide | Gas | H2S | −20.63 |
| Sulfur dioxide | Gas | SO2 | −296.84 |
| Sulfur trioxide | Gas | SO3 | −395.7 |
| Sulfuric acid | Liquid | H2SO4 | −814 |
| Titanium | Gas | Ti | 468 |
| Titanium tetrachloride | Gas | TiCl4 | −763.2 |
| Titanium tetrachloride | Liquid | TiCl4 | −804.2 |
| Titanium dioxide | Solid | TiO2 | −944.7 |
| Zinc | Gas | Zn | 130.7 |
| Zinc chloride | Solid | ZnCl2 | −415.1 |
| Zinc oxide | Solid | ZnO | −348.0 |
| Zinc sulfate | Solid | ZnSO4 | −980.14 |
Aliphatic hydrocarbons[edit]
| Formula | Name | ΔfH⦵ /(kcal/mol) | ΔfH⦵ /(kJ/mol) |
|---|---|---|---|
| Straight-chain | |||
| CH4 | Methane | −17.9 | −74.9 |
| C2H6 | Ethane | −20.0 | −83.7 |
| C2H4 | Ethylene | 12.5 | 52.5 |
| C2H2 | Acetylene | 54.2 | 226.8 |
| C3H8 | Propane | −25.0 | −104.6 |
| C4H10 | n-Butane | −30.0 | −125.5 |
| C5H12 | n-Pentane | −35.1 | −146.9 |
| C6H14 | n-Hexane | −40.0 | −167.4 |
| C7H16 | n-Heptane | −44.9 | −187.9 |
| C8H18 | n-Octane | −49.8 | −208.4 |
| C9H20 | n-Nonane | −54.8 | −229.3 |
| C10H22 | n-Decane | −59.6 | −249.4 |
| C4 Alkane branched isomers | |||
| C4H10 | Isobutane (methylpropane) | −32.1 | −134.3 |
| C5 Alkane branched isomers | |||
| C5H12 | Neopentane (dimethylpropane) | −40.1 | −167.8 |
| C5H12 | Isopentane (methylbutane) | −36.9 | −154.4 |
| C6 Alkane branched isomers | |||
| C6H14 | 2,2-Dimethylbutane | −44.5 | −186.2 |
| C6H14 | 2,3-Dimethylbutane | −42.5 | −177.8 |
| C6H14 | 2-Methylpentane (isohexane) | −41.8 | −174.9 |
| C6H14 | 3-Methylpentane | −41.1 | −172.0 |
| C7 Alkane branched isomers | |||
| C7H16 | 2,2-Dimethylpentane | −49.2 | −205.9 |
| C7H16 | 2,2,3-Trimethylbutane | −49.0 | −205.0 |
| C7H16 | 3,3-Dimethylpentane | −48.1 | −201.3 |
| C7H16 | 2,3-Dimethylpentane | −47.3 | −197.9 |
| C7H16 | 2,4-Dimethylpentane | −48.2 | −201.7 |
| C7H16 | 2-Methylhexane | −46.5 | −194.6 |
| C7H16 | 3-Methylhexane | −45.7 | −191.2 |
| C7H16 | 3-Ethylpentane | −45.3 | −189.5 |
| C8 Alkane branched isomers | |||
| C8H18 | 2,3-Dimethylhexane | −55.1 | −230.5 |
| C8H18 | 2,2,3,3-Tetramethylbutane | −53.9 | −225.5 |
| C8H18 | 2,2-Dimethylhexane | −53.7 | −224.7 |
| C8H18 | 2,2,4-Trimethylpentane (isooctane) | −53.5 | −223.8 |
| C8H18 | 2,5-Dimethylhexane | −53.2 | −222.6 |
| C8H18 | 2,2,3-Trimethylpentane | −52.6 | −220.1 |
| C8H18 | 3,3-Dimethylhexane | −52.6 | −220.1 |
| C8H18 | 2,4-Dimethylhexane | −52.4 | −219.2 |
| C8H18 | 2,3,4-Trimethylpentane | −51.9 | −217.1 |
| C8H18 | 2,3,3-Trimethylpentane | −51.7 | −216.3 |
| C8H18 | 2-Methylheptane | −51.5 | −215.5 |
| C8H18 | 3-Ethyl-3-Methylpentane | −51.4 | −215.1 |
| C8H18 | 3,4-Dimethylhexane | −50.9 | −213.0 |
| C8H18 | 3-Ethyl-2-Methylpentane | −50.4 | −210.9 |
| C8H18 | 3-Methylheptane | −60.3 | −252.5 |
| C8H18 | 4-Methylheptane | ? | ? |
| C8H18 | 3-Ethylhexane | ? | ? |
| C9 Alkane branched isomers (selected) | |||
| C9H20 | 2,2,4,4-Tetramethylpentane | −57.8 | −241.8 |
| C9H20 | 2,2,3,3-Tetramethylpentane | −56.7 | −237.2 |
| C9H20 | 2,2,3,4-Tetramethylpentane | −56.6 | −236.8 |
| C9H20 | 2,3,3,4-Tetramethylpentane | −56.4 | −236.0 |
| C9H20 | 3,3-Diethylpentane | −55.7 | −233.0 |
Other organic compounds[edit]
| Species | Phase | Chemical formula | ΔfH⦵ /(kJ/mol) |
|---|---|---|---|
| Acetone | Liquid | C3H6O | −248.4 |
| Benzene | Liquid | C6H6 | 48.95 |
| Benzoic acid | Solid | C7H6O2 | −385.2 |
| Carbon tetrachloride | Liquid | CCl4 | −135.4 |
| Carbon tetrachloride | Gas | CCl4 | −95.98 |
| Ethanol | Liquid | C2H5OH | −277.0 |
| Ethanol | Gas | C2H5OH | −235.3 |
| Glucose | Solid | C6H12O6 | −1271 |
| Isopropanol | Gas | C3H7OH | −318.1 |
| Methanol (methyl alcohol) | Liquid | CH3OH | −238.4 |
| Methanol (methyl alcohol) | Gas | CH3OH | −201.0 |
| Methyl linoleate (Biodiesel) | Gas | C19H34O2 | −356.3 |
| Sucrose | Solid | C12H22O11 | −2226.1 |
| Trichloromethane (Chloroform) | Liquid | CHCl3 | −134.47 |
| Trichloromethane (Chloroform) | Gas | CHCl3 | −103.18 |
| Vinyl chloride | Solid | C2H3Cl | −94.12 |
See also[edit]
- Calorimetry
- Thermochemistry
References[edit]
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «standard pressure». doi:10.1351/goldbook.S05921
- ^ Oxtoby, David W; Pat Gillis, H; Campion, Alan (2011). Principles of Modern Chemistry. p. 547. ISBN 978-0-8400-4931-5.
- ^ Moore, Stanitski, and Jurs. Chemistry: The Molecular Science. 3rd edition. 2008. ISBN 0-495-10521-X. pages 320–321.
- ^ «Enthalpies of Reaction». www.science.uwaterloo.ca. Archived from the original on 25 October 2017. Retrieved 2 May 2018.
- ^ a b Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (2nd ed.). Prentice Hall. p. 392. ISBN 978-0-13-039913-7.
- ^ Green, D.W., ed. (2007). Perry’s Chemical Engineers’ Handbook (8th ed.). Mcgraw-Hill. p. 2–191. ISBN 9780071422949.
- ^ Kleykamp, H. (1998). «Gibbs Energy of Formation of SiC: A contribution to the Thermodynamic Stability of the Modifications». Berichte der Bunsengesellschaft für physikalische Chemie. 102 (9): 1231–1234. doi:10.1002/bbpc.19981020928.
- ^ «Silicon Carbide, Alpha (SiC)». March 1967. Retrieved 5 February 2019.
- Zumdahl, Steven (2009). Chemical Principles (6th ed.). Boston. New York: Houghton Mifflin. pp. 384–387. ISBN 978-0-547-19626-8.
External links[edit]
- NIST Chemistry WebBook
ВЫЧИСЛЕНИЕ
СТАНДАРТНЫХ ТЕПЛОТ ОБРАЗОВАНИЯ ВЕЩЕСТВ
И ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
Расчет
стандартной теплоты образования веществ
Пример.
Вычислите стандартную теплоту образования
этана, если известна теплота его сгорания:
ΔНосгор.=
–1560 кДж/моль.
Решение.
Напишем
уравнение реакции таким образом, чтобы
перед
формулой этана стехиометрический
коэффициент был равен
1:
С2Н6
+ 3,5О2
= 2СО2
+ 3Н2О
ΔНообр.
0 2·(–393)·
3·(–286)
ΔНосгор.=
ΔНор.
= (–286)·3.+ (–393)·2 – ΔНообр.
=
–1560 кДж/моль,
ΔНообр.
= 1560 – 286·3 – 393·2 = –84 кДж/моль.
Пример. Определите
стандартную теплоту образования
этилового спирта, если теплоты сгорания
углерода, водорода и этилового спирта
соответственно равны:
–393,51; –285,84; –1366,91
кДж/моль.
Решение.
Стандартная
теплота образования вещества равна
теплоте реакции образования одного
моля этого вещества из простых веществ
при стандартных условиях.
Образование
этилового спирта из простых веществ
можно представить так: 2С + 3Н2
+ 1/2О2
= С2Н5ОН.
Углерод сгорает до СО2,
водород – до Н2О,
а этиловый спирт–до СО2
и Н2О.
Следовательно, для определения стандартной
теплоты образования C2H5ОH
составим следующий цикл Гесса:
1. 2С
+ 2О2
= 2СО2
–393,51·2
2. 3Н2+
3/2О2
= 3Н2О
–285,84·3
3.
2СО2+
ЗН2О
= С2Н5ОН
+ 3О2
+1366,91
(1) + (2) + (3)
2С +
3Н2
+ 1/2О2
= С2Н5ОН
–277,6 кДж/моль
–393,51·2 –285,84·3 +
1366,91 = –277,6
Стандартная теплота
образования этилового спирта равна:
ΔНо298
= –277,6
кДж/моль.
Расчет теплового
эффекта реакции по стандартным теплотам
образования реагирующих веществ
Пример. Определите
количество теплоты, выделяющееся при
гашении
100 кг
извести водой, если стандартные теплоты
образования реагирующих веществ равны
(кДж/моль): ΔНо
(СаО(к))=
–635,1; ΔНо
(Са(ОН)2(к))=
–986,2;
ΔНо
(Н2О(ж))
=
–285,84.
Решение.
Реакция
гашения извести: СaO
+ H2О
= Са(ОН)2.
Тепловой эффект реакции равен
∆Hºp
=
Σ∆Hºобр.(прод.)
– Σ∆Hºобр.(исх..)
ΔНор.
= ΔНо
(Са(ОН)2(к))
–[ΔНо
(СаО(к))+
ΔНо
(Н2О(ж))]
= –986,2+635,1 +285,84 =
–65,3 кДж/моль.
Тепловой эффект
реакции рассчитан на 1 моль СаО, т.е. на
56 г СаО. При гашении 100 кг СаО выделяется
тепловая энергия:
56 г СаО —
(–65,3) кДж
100 000
г СаО — х
кДж
х
= (100
000·(–65,3)) /56
= –1,16·105
кДж.
Расчет теплового
эффекта реакции по стандартным теплотам
сгорания реагирующих веществ
Пример. Определите
тепловой эффект реакции синтеза акриловой
кислоты:
+
СО+ Н2О(ж)
→ СН2=СН–СООН(ж),
если стандартные
теплоты сгорания ацетилена, оксида
углерода и акриловой кислоты соответственно
равны (кДж/моль): –1299,63, –282,50 и –1370,0.
Решение.
Из
закона Гесса следует, что тепловой
эффект реакции равен разности между
суммой теплот сгорания исходных веществ
и суммой теплот сгорания продуктов
реакции (ΔНосгор..н2о=0,
так как Н2О
– высший оксид);
∆Hºp
=
Σ∆Hºсгор.(исх.)
– Σ∆Hºсгор.(прод.)
ΔНо
= ΔНосгор.(СН=СН)
+ ΔНосгор.(СО)
– ΔНосгор.
(СН2=СН–СООН(ж))=
–1299,63 – 282,50 + 1370,0
= –212,13 кДж/моль.
ВЫЧИСЛЕНИЕ ИЗМЕНЕНИЯ
ЭНЕРГИИ ГИББСА
Определение
возможности протекания процесса по
величине изменения энергии Гиббса.
Пример. Возможна
ли следующая реакция в стандартных
условиях:
t
SiО2
(к)
+ 2NaОH
(p)
= Na2SiО3
(к)
+ Н2О
(ж)
если
ΔGо(SiО2
(к))
= –803,75 кДж/моль; ΔGо
(Na2SiО3
(к))=
–1427,8 кДж/моль;
ΔGо
(NaОH(p))
= –419,5 кДж/моль; ΔGо
(Н2О
(ж))
= –237,5 кДж/моль?
Можно ли выпаривать
щелочь в стеклянном сосуде?
Решение.
Изменение
энергии Гиббса ΔGо298
реакции
равно:
ΔGо
=
ΣGопрод.
– ΣGоисх.;
ΔGо298
=
(–1427,8 – 237,5) – (–803,75 –419,5·2)=
–22,55 кДж;
ΔGо298
= –22,55
кДж (т. е. ΔG<0),
а следовательно, данная реакция возможна.
Щелочь нельзя выпаривать в стеклянном
сосуде, так как в состав стекла входит
SiО2.
Пример. Вычислить
ΔGо
для реакции 2Н2
(г)+О2
(г) 2Н2О(г).
при 298, 500, 1000, 1500 К.
Зависимостью ΔНо
и
ΔSo
от температуры пренебречь. Построить
график зависимости ΔGо
от
температуры и найти по графику температуру,
ниже которой указанная реакция в
стандартных условиях может протекать
самопроизвольно.
Решение.
Согласно
уравнению ΔG
= ΔН
– TΔS
влияние
температуры на ΔG
определяется
знаком и величиной ΔS.
Если
пренебречь влиянием Т
на
значения ΔН
и ΔS,
то приведённая зависимость ΔG
=ƒ(T)
является уравнением прямой, наклон
которой определяется знаком ΔS.
при ΔS>0
прямая идет вниз, при ΔS<0
– вверх.
Определим
величину ΔН°298
(исходные данные берем из табл.1)
∆Hºp
=
Σ∆Hºобр.(прод.)
– Σ∆Hºобр.(исх..)
ΔН°298
= 2ΔН°обр.(H2O)
– (2ΔН°обр.(H2)
+ 2ΔН°обр.(O2)
= 2ΔН°обр.(H2O)
=
=2(-241,84)
= –483,68 (кДж) (на 2 моля
H2O)
ΔН°обр.(Н2О)
= 0,5(–483,8)
= –241,89 кДж/моль.<0
Следовательно,
реакция экзотермическая.
Определим
изменение энтропии
данной реакции в стандартных условиях
ΔS°298
(исходные
данные берем из табл.1)
ΔSо
=
ΣSопрод.
– ΣSоисх.:
ΔS°298=
2S°298.(H2O)
– [2S°298.(H2)
+ S°
298.(O2)]=
2·188,74
– (2·130.6 +
205) =
–98,6(Дж/
К) = –0,0986(кДж/ К)
< 0, ΔG
=ƒ(T)
прямая
идет вверх.
Определим
изменение энергии Гиббса ΔG°298
в
стандартных условиях (исходные
данные берем из табл.1):
ΔGо
=
ΣGопрод.
– ΣGоисх.;
ΔG°298
=
2ΔG°298.(H2O)
– [2ΔG°298(H2)
– ΔG°298(O2)]
=
2(–228,8)
=
–457,6 кДж.
Отрицательная
величина ΔG°298
свидетельствует
о том, что в стандартных
условиях реакция самопроизвольно
протекает в
прямом направлении.
ΔG°298
=
ΔН°298
–
298·ΔS0298
=
–483,68 – 298·(–0,0986) = –457,6кДж
ΔG°500
=
ΔН°298
–
500·ΔS0298
=
–483,68 – 500·(–0,0986) = –434,38кДж
ΔG°1000
=
ΔН°298
–
1000·ΔS0298
=
–483,68 – 1000·(–0,0986) = –385,08кДж
ΔG°1500
=
ΔН°298
–
1500·ΔS0298
=
–483,68 – I500·(–0,0986) = –335,78 кДж
Построим
график ΔG°Т
=f(Т):
Температура
перехода ~4500
К
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Тепловой эффект процесса
Термохимические уравнения
Закон Гесса
Следствия из закона Гесса
Стандартные термодинамические величины
Стандартные энтальпии образования и сгорания
Примеры решения задач
Задачи для самостоятельного решения
Тепловой эффект процесса
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН < 0, а в эндотермическом процессе (Q < 0) ΔН > 0.
Термохимические уравнения
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Закон Гесса
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
Следствия из закона Гесса
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25оС (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔНо298.
Стандартные энтальпии образования и сгорания
Стандартная энтальпия образования ΔНоf,298 (или ΔНообр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например, ΔНof,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
Н2(г) + ½O2(г) = Н2О(ж)
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔНoсгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Примеры решения задач
Задача 1. Используя справочные термодинамические данные вычислить ΔНo298 реакции:
2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж); ΔНoх.р.,298 = ?
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔНof,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔНoсгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔНох.р. равна:
ΔНох.р.,298 = 2ΔНоf,298(SO2(г)) + 2ΔНоf,298(H2O(ж)) — 2ΔНоf,298(H2S(г)) — 3ΔНоf,298(O2(г)) = 2(- 296,90) + 2(- 285,83) — 2(- 20,60) = — 1124,21 кДж.
В соответствии со вторым следствием закона Гесса получаем:
ΔНох.р.,298 = 2ΔНосгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔНо298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); ΔНо1 = -1531,22 кДж;
2H2O(ж) = O2(г) + 2H2(г); ΔНо2= 571,66 кДж.
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
-
-
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
-
N2(г) + 3H2O(ж) = 2NH3(г) + 3/2O2(г); ΔНо = 765,61 кДж;
-
-
- умножить на 3/2 второе уравнение и соответствующую ему величину δНo , изменив ее знак на противоположный:
-
3/2O2(г) + 3H2(г) = 3H2O(ж); ΔНо = -857,49 кДж;
-
-
- сложить полученные первое и второе уравнения.
-
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Но298 = (- ΔНо1/2) + (- 3/2·ΔНо2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔНоf,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
CuSO4(к) + 5H2O(ж) = CuSO4·5H2O(к)
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔНо1 = ΔНо2 + ΔНох (по закону Гесса). Отсюда получаем:
ΔНох = ΔНо1 – ΔНо2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
CuSO4(к) + (n H2O) = CuSO4(р-р, n H2O); ΔНо1 = – 40,0 кДж; (1)
CuSO4(к) + 5H2O(ж) = CuSO4·5H2O(к); ΔНох = Но2; (2)
CuSO4·5H2O(к) + (n – 5)H2O = CuSO4(р-р, nH2O); ΔНо3 = 10,5 кДж. (3)
По закону Гесса: ΔНо1 = ΔНох+ ΔНо3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔНоf,298(С2Н4(г)) = 2ΔНовозг(С(графит)) + 2ΔНоатом (H2(г)) + ΔНо(С= С) + 4ΔНо(С–Н).
ΔНо(С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
Задачи для самостоятельного решения
1. Составьте уравнение реакции, для которой ΔНо соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
2. Определить ΔНо298 реакции:
CH3CНO(ж) + H2(г) = CH3CH2OH(ж),
если ΔНосгор,298(CH3CНO(ж)) = — 1193,07 кДж/моль; ΔНосгор,298(CH3CH2OH(ж)) = — 1370,68 кДж/моль; ΔНоf,298(Н2О(ж)) = — 285,83 кДж/моль.
10.3. Энтальпии растворения BaCl2(к) и BaCl2·2H2O(к) с образованием раствора хлорида бария (с мольным отношением BaCl2: H2O = 1: 500) соответственно равны –11,18 и 18,74 кДж/моль.
Определить величину ΔНо присоединения воды к BaCl2(к) с образованием BaCl2·2H2O(к).
10.4. Рассчитать энтальпию связи в молекуле NO на основании следующих термохимических уравнений:
N2(г) + O2(г) = 2NO(г); ΔНо298 = +182,52 кДж;
2O(г) = O2(г); ΔНо298 = — 498,34 кДж;
N2(г) = 2N(г); ΔНо298 = +945,42 кДж.
10.5. Вычислить ΔНо298 реакции 2C(г) + 2H2(г) = C2H4(г), используя следующие термохимические уравнения:
С(графит) = С(г) ; ΔНо298 = +716,67 кДж;
С2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г); ΔНо298 = — 1322,94 кДж;
C(графит) + O2(г) = CO2(г); ΔНо298 = — 393,51 кДж;
H2(г) + 1/2O2(г) = H2O(г); ΔНо298 = — 241,81 кДж.
10.6. Определите стандартную энтальпию реакции взаимодействия метана с оксидом углерода (IV), если стандартные энтальпии образования метана, оксида углерода (IV) и оксида углерода (II) при 298 К равны соответственно: -75; -393 и -111 кДж/моль.
7. Определите стандартную энтальпию образования С2Н5ОН(ж), если стандартные энтальпии сгорания углерода, водорода и этанола при 298 К равны соответственно: -393; -286 и -1366 кДж/моль.
8. Вычислите энтальпию химической реакции 4KClO3(к)=KCl(к)+3KClO4(к) по следующим данным:
2KClO3(к)=2KCl(к)+3O2(г); ΔНо298 = — 95 кДж;
4KClO4(к)=KCl(к)+2O2(г); ΔНо298 = 9 кДж/моль.
9. Вычислите среднюю энтальпию связи P-Cl в молекуле PCl5, используя следующие термохимические уравнения:
P(к, бел.)+5/2Cl2(г)=PCl5(г); ΔНо1 = — 374,8 кДж;
P(к, бел.)=P(г); ΔНо2 = — 17,4 кДж;
Cl2(г)=2Cl(г); ΔНо3 = 242,6 кДж.
10. Вычислите среднюю энтальпию связи N-H в молекуле NH3, используя следующие термохимические уравнения:
1/2N2(г)+3/2H2(г)=NH3(г); ΔНо1 = — 46,2 кДж;
N2(г)=2N(г); ΔНо2 = 945,4 кДж;
H2(г)=2H(г); ΔНо3 = 436,0 кДж.
Поговорим о том, что представляет собой теплота образования, а также определим те условия, которые называют стандартными. Для того чтобы разобраться в данном вопросе, выясним отличия между простыми и сложными веществами. Чтобы закрепить понятие «теплота образования», рассмотрим конкретные химические уравнения.
Стандартная энтальпия образования веществ
В реакции взаимодействия углерода с газообразным водородом выделяется 76 кДж энергии. В этом случае данная цифра – это тепловой эффект химической реакции. Но это и теплота образования молекулы метана из простых веществ. «Почему?» — спросите вы. Это объясняется тем, что исходными компонентами были углерод и водород. 76 кДж/моль будет той энергией, которая химиками называется «теплота образования».
Таблицы с данными
В термохимии существуют многочисленные таблицы, в которых указаны теплоты образования различных химических веществ из простых веществ. Например, теплота образования вещества, формула которого CO2, в газообразном состоянии имеет показатель 393,5 кДж/моль.
Практическое значение
Зачем нужны данные величины? Теплота образования — это величина, которая применяется при проведении расчета теплового эффекта любого химического процесса. Для того чтобы проводить подобные расчёты, потребуется применение закона термохимии.
Термохимия
Он является основным законом, который объясняет энергетические процессы, наблюдаемые в процессе осуществления химической реакции. Во время взаимодействия наблюдаются качественные преобразования в реагирующей системе. Одни вещества исчезают, вместо них появляются новые компоненты. Такой процесс сопровождается изменением в системе внутренней энергии, проявляется это в виде работы либо теплоты. Работа, которая связана с расширением, для химических превращений имеет минимальный показатель. Теплота, выделяемая при превращении одного компонента в другое вещество, может быть большой величиной.
Если рассматривать разнообразные превращения, практически для всех наблюдается поглощение либо выделение определенного количества тепла. Для объяснения происходящих явлений был создан специальный раздел – термохимия.
Закон Гесса
Благодаря первому началу термодинамики стало возможным проводить расчет теплового эффекта в зависимости от условий проведения химической реакции. Базируются расчеты на основном законе термохимии, а именно на законе Гесса. Приведем его формулировку: тепловой эффект химического превращения связан с природой, начальным и конечным состоянием вещества, он не связан с путем проведения взаимодействия.
Что следует из данной формулировки? В случае получения определенного продукта нет необходимости применять только один вариант взаимодействия, можно проводить реакцию разнообразными способами. В любом случае, как бы вы ни получали искомое вещество, тепловой эффект процесса будет неизменной величиной. Для его определения нужно суммировать тепловые эффекты всех промежуточных превращений. Благодаря закону Гесса стало возможным выполнение расчетов числовых показателей тепловых эффектов, что невозможно провести в калориметре. К примеру, количественно теплота образования вещества угарного газа вычисляется по закону Гесса, а вот путем обычных опытов определить ее вам не удастся. Именно поэтому так важны специальные термохимические таблицы, в которых внесены цифровые величины для различных веществ, определенные при стандартных условиях
Важные моменты в вычислениях
Учитывая то, что теплота образования — это тепловой эффект реакции, особое значение имеет агрегатное состояние рассматриваемого вещества. Например, при проведении измерений принято считать стандартным состоянием углерода графит, а не алмаз. Также учитывают давление и температуру, то есть те условия, в которых изначально находились реагирующие компоненты. Данные физические величины способны оказывать на взаимодействие существенное влияние, повышают либо понижают величину энергии. Для того чтобы выполнять основные расчеты, в термохимии принято использовать конкретные показатели давления и температуры.
Стандартные условия
Поскольку теплота образования вещества — это определение величины энергетического эффекта именно при стандартных условиях, выделим их отдельно. Температура для расчетов выбирается 298 К (25 градусов по шкале Цельсия), давление – 1 атмосфера. Кроме того, важным моментом, на который стоит обратить внимание, является тот факт, что теплота образования для любых простых веществ равна нулю. Это логично, ведь простые вещества не образуют сами себя, то есть не происходит расходования энергии для их возникновения.
Элементы термохимии
Данный раздел современной химии имеет особое значение, ведь именно здесь проводят важные вычисления, получают конкретные результаты, применяемые в теплоэнергетике. В термохимии существует множество понятий и терминов, которыми важно оперировать, чтобы получать желаемые результаты. Энтальпия (ΔН) свидетельствует о том, что химическое взаимодействие происходило в замкнутой системе, не было влияния на реакцию со стороны других реагентов, постоянным было давление. Такое уточнение позволяет вести речь о точности выполняемых расчетов.
В зависимости от того, какую именно реакцию рассматривают, величина и знак получаемого теплового эффекта могут существенно отличаться. Так, для всех превращений, предполагающих разложение одного сложного вещества на несколько более простых компонентов, предполагается поглощение теплоты. Реакции соединения множества исходных веществ в один, более сложный продукт сопровождаются выделением существенного количества энергии.
Заключение
При решении любой термохимической задачи применяют один и тот же алгоритм действий. Сначала по таблице определяют для каждого исходного компонента, а также для продуктов реакции величину теплоты образования, не забывая об агрегатном состоянии. Далее, вооружившись законом Гесса, составляют уравнение для определения искомой величины.
Особое внимание следует уделять учету стереохимических коэффициентов, имеющихся перед исходными либо конечными веществами в конкретном уравнении. Если в реакции есть простые вещества, то их стандартные теплоты образования равны нулю, то есть такие компоненты не оказывают влияния на получаемый при расчётах результат. Попробуем использовать полученную информацию на конкретной реакции. Если взять в качестве примера процесс образования из оксида железа (Fe3+) чистого металла путем взаимодействия с графитом, то в справочнике можно найти величины стандартной теплоты образования. Для оксида железа (Fe3+) она составит –822,1 кДж/моль, для графита (простого вещества) она равна нулю. В результате реакции образуется угарный газ (CO), для которого данный показатель имеет значение – 110,5 кДж/моль, а для выделяющегося железа теплота образования соответствует нулю. Запись стандартной теплоты образования данного химического взаимодействия характеризуется следующим образом:
ΔНо298 = 3× (–110,5) – (–822,1) = –331,5 + 822,1 = 490,6 кДж.
Анализируя полученный по закону Гесса числовой результат, можно сделать закономерный вывод о том, что данный процесс является эндотермическим превращением, то есть он предполагает затрачивание энергии на реакцию восстановления железа из его трехвалентного оксида.











![{displaystyle Delta _{text{comb}}H^{ominus }({text{CH}}_{4})=[Delta _{text{f}}H^{ominus }({text{CO}}_{2})+2Delta _{text{f}}H^{ominus }({text{H}}_{2}{text{O}})]-Delta _{text{f}}H^{ominus }({text{CH}}_{4}).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/868ef759a6238c57f082b526d2599d6a04ae8c6a)
![{displaystyle Delta _{text{f}}H^{ominus }({text{CH}}_{4})=[Delta _{text{f}}H^{ominus }({text{CO}}_{2})+2Delta _{text{f}}H^{ominus }({text{H}}_{2}{text{O}})]-Delta _{text{comb}}H^{ominus }({text{CH}}_{4}).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eaa4ff8ecbdfc22efc596605a9e9c5b9fc178c70)

![{displaystyle Delta _{text{r}}H^{ominus }=[Delta _{text{f}}H^{ominus }({text{CO}}_{2})+2Delta _{text{f}}H^{ominus }({text{H}}_{2}{text{O}})]-Delta _{text{f}}H^{ominus }({text{CH}}_{4})+2Delta _{text{f}}H^{ominus }({text{O}}_{2})].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d13e59b354921b5d0bcc0e9da48fd3e719de3e74)
![{displaystyle Delta _{text{r}}H^{ominus }=[Delta _{text{f}}H^{ominus }({text{CO}}_{2})+2Delta _{text{f}}H^{ominus }({text{H}}_{2}{text{O}})]-Delta _{text{f}}H^{ominus }({text{CH}}_{4}),}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2bb97407d417f1efde328dead9949da6b6d6d019)