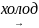1. Положение галогенов в периодической системе химических элементов
2. Электронное строение галогенов
3. Физические свойства и нахождение в природе
4. Соединения галогенов
5. Способы получения галогенов
6. Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с серой
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6.1.5. Взаимодействие с водородом
6.1.6. Взаимодействие с галогенами
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с водой
6.2.2. Взаимодействие с щелочами
6.2.3. Взаимодействие с солями и галогеноводородами
6.2.4. Взаимодействие с восстановителями
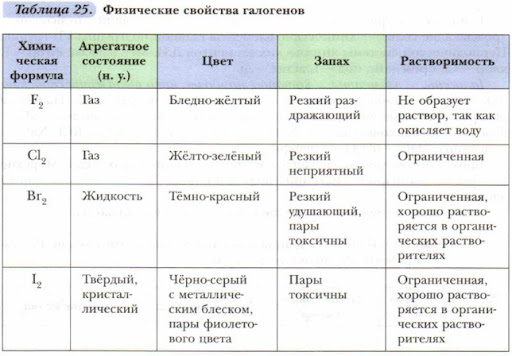
Галогеноводороды
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.2. Диссоциация
3.3. Взаимодействие с солями
3.4. Восстановительные свойства
3.5. Взаимодействие с оксидом кремния (IV)
Соли-галогениды
Способы получения галогенидов
Химические свойства галогенидов
Кислородсодержащие кислоты галогенов
1. Хлорноватистая кислота и ее соли
2. Хлористая кислота и ее соли
3. Хлорноватая кислота и ее соли
4. Хлорная кислота и ее соли
Галогены
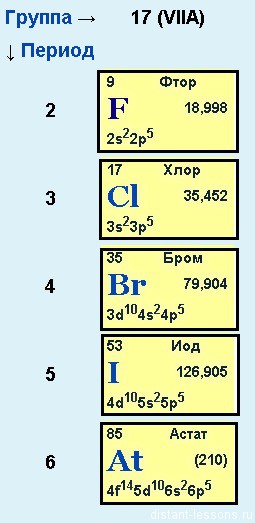
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns2np5.
Например, электронная конфигурация фтора:
Электронная концигурация хлора:
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s22p5 | … 3s23p5 | … 4s24p5 | … 5s25p5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220оС | –101оС | –7оС | 113,5оС |
| Т кипения | –188оС | –34оС | 58оС | 185оС |
Внешний вид галогенов:
Фтор
Хлор
Бром
Йод
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4
Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3
Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO
Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na+ + Cl−
На катоде восстанавливаются ионы натрия:
K(–): Na+ +1e → Na0
На аноде окисляются ионы хлора:
A(+): 2Cl− ̶ 2e → Cl20
Ионное уравнение электролиза расплава хлорида натрия:
2Na+ + 2Cl− → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na+ + Cl−
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH−
На аноде окисляются ионы хлора:
A(+): 2Cl− ̶ 2e → Cl20
Ионное уравнение электролиза раствора хлорида натрия:
2H2O + 2Cl− → H2°↑ + 2OH− + Cl2°↑
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Например, взаимодействием соляной кислоты с оксидом марганца (IV)
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
2KHF2 → 2K + H2 + 2F2
3. Получение брома.
Бром можно получить окислением ионов Br– сильными окислителями.
Например, бромоводород окисляется хлором:
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
Например, оксид марганца (IV):
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O
4. Получение йода.
Йод получают окислением ионов I– сильными окислителями.
Например, хлор окисляет йодид калия:
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Например, оксид марганца (IV) в кислой среде окисляет йодид калия:
2KI + MnO2 + 2H2SO4 → I2 + K2SO4 + MnSO4 + 2H2O
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей. Галогены реагируют с металлами и неметаллами.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
2F2 + O2 → 2OF2
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
2P + 5Cl2 → 2PCl5
2P + 3Cl2 → 2PCl3
2F2 + C → CF4
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например, железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
I2 + Fe → FeI2
Аналогичная ситуация с медью: фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
Cl2 + Cu → 2CuCl2
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример: алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
F2 + H2 → 2HF
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Cl2 + H2 → 2HCl
Бром также реагирует с водородом с образованием бромоводорода:
Br2 + H2 → 2HBr
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
I2 + H2 ↔ 2HI
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например, фтор окисляет хлор, бром и йод:
Cl2 + F2 → 2ClF
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например, хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлороватую кислоту:
Cl2 + 6H2O ↔ 5HCl + HClO3
Фтор реагирует с водой со взрывом:
2F2 + 2H2O → 4HF + O2
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например, хлор реагирует с холодным раствором гидроксидом натрия:
Сl2 + 2NaOH (хол.) → NaCl + NaClO + H2O
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
3Cl2 + 6NaOH (гор.) → 5NaCl + NaClO3 + 3H2O
Еще пример: хлор растворяется в холодном растворе гидроксида кальция:
2Сl2 + 2Са(OH)2(хол.) → СaCl2 + Сa(ClO)2 + 2H2O
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например, хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например, фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl+F–
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
Cl2 + I2 + H2O → HCl + HIO3
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например, хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Cl2 + H2O + Na2SO3 → 2HCl + Na2SO4
Также галогены окисляют пероксиды:
Cl2 + H2O2 → 2HCl + O2
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Например, действием концентрированной серной кислоты на хлорид натрия:
H2SO4(конц.) + NaCl(тверд.) → NaHSO4 + HCl↑
Галогеноводороды получают также прямым взаимодействием простых веществ:
Cl2 + H2 → 2HCl
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства. Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами. Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
Например, хлороводород реагирует с оксидом кальция, оксидом алюминия, гидроксидом натрия, гидроксидом меди (II), гидроксидом цинка (II), аммиаком:
2HCl + CaO → CaCl2 + H2O
6HCl + Al2O3 → 2AlCl3 + 3H2O
HCl + NaOH → NaCl + H2O
2HCl + Cu(OH)2 → CuCl2 + 2H2O
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
HCl + NH3 → NH4Cl
Как типичные минеральные кислоты, водные растворы галогеноводородов реагируют с металлами, расположенными в ряду активности металлов до водорода. При этом образуются соль металла и водород.
Например, соляная кислота растворяет железо. При этом образуется водород и хлорид железа (II):
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют, образуя кислоты. Водный раствор фтороводорода (плавиковая кислота) – слабая кислота:
HF ↔ H+ + F–
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H+ + Cl–
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Например, соляная кислота реагирует с карбонатом кальция:
2HCl + CaCO3 → CaCl2 + 2H2O + CO2
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Галогеноводороды реагируют с галогенами. При этом более активные галогены вытесняют менее активные.
Например, бром вытесняет йод из йодоводорода:
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например: концентрированная соляная кислота окисляется оксидом марганца (IV):
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Например, бромоводород окисляется концентрированной серной кислотой:
2HBr + H2SO4(конц.) → Br2 + SO2 + 2H2O
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
14HBr + K2Cr2O7 → 2KBr + 2CrBr3 + 3Br2 + 7H2O
Или с оксидом марганца (IV):
4HBr + MnO2 → MnBr2 + Br2 + 2H2O
Пероксид водорода также окисляет бромоводород до молекулярного брома:
2HBr + H2O2 → Br2 + 2H2O
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
Например, йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
2HI + Fe2(SO4)3 → 2FeSO4 + I2 + H2SO4
Йодоводород легко окисляется соединениями азота, например, оксидом азота (IV):
2HI + NO2 → I2 + NO + H2O
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
SiO2 + 4HF → SiF4 + 2H2O
SiO2 + 6HF(изб) → H2[SiF6] + H2O
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
1. Галогениды металлов получают при взаимодействии галогенов с металлами. При этом галогены проявляют свойства окислителя.
Например, хлор взаимодействует с магнием и кальцием:
Cl2 + Mg → MgCl2
Cl2 + Ca → CaCl2
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Например, соляная кислота реагирует с железом с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
Например, при взаимодействии оксида кальция и соляной кислоты:
2HCl + CaO → CaCl2 + H2O
Еще пример: взаимодействие оксида алюминия с соляной кислотой:
6HCl + Al2O3 → 2AlCl3 + 3H2O
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
Например, при взаимодействии гидроксида натрия и соляной кислоты:
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
2HCl + Cu(OH)2 → CuCl2 + 2H2O
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
Например, гидрокарбонат натрия реагирует с бромоводородом с образованием бромида натрия:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями, если образуется осадок, газ или вода.
Например, бромиды, йодиды и хлориды реагируют с нитратом серебра с образованием желтого, желтого и белого осадков соответственно.
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
2. Галогениды тяжелых металлов реагируют с более активными металлами. При этом более активные металлы вытесняют менее активные.
Например, магний вытесняет медь из расплава хлорида меди (II):
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Например, натрий не вытесняет цинк из раствора хлорида цинка. Т.к. натрий реагирует с водой, а реакция с хлоридом цинка не идет.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
Например, при электролизе расплава бромида калия на катоде образуется клий, а на аноде – бром:
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
2KBr + 2H2O → H2↑ + 2KOH + Br2↑
4. Галогениды металлов проявляют восстановительные свойства. Хлориды окисляются только сильными окислителями, а вот йодиды уже являются очень сильными восстановителями. В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
Например, бромид калия окисляется концентрированной серной кислотой:
2KBr + 2H2SO4 (конц.) → 4K2SO4 + 4Br2 + SO2 + 2H2O
Еще пример: йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
8KI + 5H2SO4 (конц.) → 4K2SO4 + 4I2 + H2S + 4H2O или
8KI + 9H2SO4 (конц.) → 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
10KI + 8H2SO4 + 2KMnO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2KI + H2SO4 + H2O2 → I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 → I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + H2O → 2CuI + 2K2SO4 + H2SO4
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака.
Например, хлорид серебра (I) растворяется под действием избытка раствора аммиака:
AgCl + NH3 → [Ag(NH3)2]Cl
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
Например, хлорид серебра разлагается под действием ультрафиолета:
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде:
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается:
2HClO → 2HCl + O2
2. Как кислота, хлорноватистая кислота реагирует с сильными основаниями.
Например, с гидроксидом калия:
HClO + KOH → KClO + H2O
3. Ярко выражены окислительные свойства хлорноватистой кислоты за счет атома хлора в степени окисления +1. При взаимодействии с восстановителями хлор, как правило, восстанавливается до степени окисления -1.
Например, хлорноватистая кислота окисляет йодоводород:
HClO + 2HI → HCl + I2 + H2O
Хлорноватистая кислота также окисляет, например, пероксид водорода:
HClO + H2O2 → HCl + H2O + O2
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
Например, соляная кислота реагирует с гипохлоритом натрия:
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Ca(ClO)2 + H2SO4 → CaSO4 + 2HCl + O2
Даже угольная кислота вытесняет гипохлориты:
Ca(ClO)2 + CO2 + H2O → CaCO3 + 2HClO
2. Гипохлориты вступают в обменные реакции с другими солями, если образуется слабый электролит.
Например, гипохлорит кальция реагирует с растворимыми карбонатами:
Ca(ClO)2 + Na2CO3 → CaCO3 + 2NaClO
3. При нагревании гипохлориты разлагаются:
Ca(ClO)2 → CaCl2 + O2
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
2ClO2 + H2O2 → 2HClO2 + O2
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
HClO2 + KOH → KClO2 + H2O
2. При длительном хранении разлагается:
4HClO2 → HCl + HClO3 + 2ClO2 + H2O
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Например, из хлората бария под действием серной кислоты:
Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
HClO3 + KOH → KClO3 + H2O
2. Хлорноватая кислота – сильный окислитель.
Например, хлорноватая кислота окисляет фосфор:
6P + 5HClO3 → 3P2O5 + 5HCl
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
Например, хлорат калия (бертолетова соль) при нагревании разлагается. При этом без катализатора хлорат диспропорционирует:
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример: хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
5KClO3 + 6P → 5KCl + 3P2O5
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Например, из перхлората натрия под действием серной кислоты:
2NaClO4 + H2SO4 → 2HClO4 + Na2SO4
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
HClO4 + KOH → KClO4 + H2O
2. Хлорная кислота – сильный окислитель.
Например, хлорная кислота окисляет углерод:
8HClO4 + 14C → 14CO2 + 4Cl2 + 4H2O
3. При нагревании хлорная кислота разлагается:
4HClO4 → 4ClO2 + 3O2 + 2H2O
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Например, перхлорат калия при нагревании разлагается. При этом хлор окисляет кислород:
KClO4 → KCl + 2O2↑
Еще пример: перхлорат калия окисляет алюминий:
3KClO4 + 8Al → 3KCl + 4Al2O3
Галогены (греч. hals — соль + genes — рождающий) — химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством
других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np5:
- F — 2s22p5
- Cl — 3s23p5
- Br — 4s24p5
- I — 5s25p5
- At — 6s26p5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов
в возбужденном состоянии.

Природные соединения
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CaF2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит

Простые вещества — F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают
электролизом водного раствора хлорида натрия.
NaCl + H2O → (электролиз) NaOH + H2↑ + Cl2↑
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF — был впервые получен фтор.
HF → F2 + H2
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
Cl2 + KBr → Br2 + KCl
Cl2 + KI → I2 + KCl

В лабораторных условиях галогены могут быть получены следующими реакциями.
HCl + MnO2 → MnCl2 + Cl2 + H2O
HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере
фтора самовоспламеняются.
Al + F2 → AlF3
Cu + Cl2 → CuCl2
Na + Br2 → NaBr
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl2 + Si → SiCl4
Cl2 + H2 → HCl (на свету)

F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром — F—)
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод — Br—)
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
H2O + F2 → HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при
нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + NaOH → (t) NaCl + NaClO3 + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KCl + F2 → KF + Cl2
KBr + Cl2 → KCl + Br2
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
Получение
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
H2 + Cl2 → HCl
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
NaCl + H2SO4 → NaHSO4 + HCl↑
CaF2 + H2SO4 → CaSO4 + HF
PBr3 + H2O → HBr↑ + H3PO3
H2S + I2 → S + HI
Химические свойства
- Кислотные свойства
- С солями
- Восстановительные свойства
- Реакция с оксидом кремния
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить
водород из кислоты.
Mg + HBr → MgBr2 + H2↑
Zn + HCl → ZnCl2 + H2↑

Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
Na2O + HCl → NaCl + H2O
ZnO + HI → ZnI2 + H2O
KOH + HCl → KCl + H2O (реакция нейтрализации)

Cr(OH)3 + HCl → CrCl3 + H2O
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
AgNO3 + HCl → AgCl + HNO3
Li2CO3 + HBr → LiBr + H2CO3
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
HI + MnO2 → I2 + MnI2 + H2O
HI + H2SO4 → I2 + H2S + H2O
HI + O2 → H2O + I2
HI + Br2 → HBr + I2
HBr + H2SO4 → Br2 + SO2 + H2O

В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с
плавиковой кислотой.
SiO2 + HF → SiF4 + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства галогенов
30-Окт-2012 | комментариев 6 | Лолита Окольнова
Химические свойства галогенов
или подгруппа фтора
Фтор, хлор, бром, йод и астат
Общее электронное строение:
nS2 np5
И, как всегда, все не так просто, как хотелось бы…
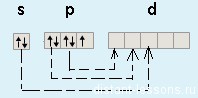
Как уже было замечено в предыдущих лекциях (подгруппа кислорода) у первого элемента — F (фтора) все соответствует общей формуле — на внешнем уровне 7 электронов. А вот у хлора (Cl) — элемента 3-го периода появляется свободная d-орбиталь и возможность распаривать на нее электроны.
Благодаря этой возможности — распаривать электроны p-подуровня на d-подуровень, для всех элементов кроме фтора (!!!) возможны степени окисления +1, +3, +5 и +7.
Итак, выводы:
- Валентность элементов:
- валентность фтора = 1,
- валентность хлора и остальных галогенов — 1,3,5 и 7
- Степени окисления:
- степень окисления фтора = -1 — типичный неметалл, самый сильный неметалл — просто КОРОЛЬ неметаллов — самый верхний в группе и самый левый в периоде.;
- степень окисления хлора и остальных галогенов = -1 (минимальная степень окисления), +1 , +3, +5 и +7 (максимальная степень окисления) в минимальной с.о. элементы будут проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства галогенов
- Фтор — F2 — светло-желтый газ;
- Хлор Cl2 — желто-зеленый газ;
- Бром — Br2 — бурая жидкость;
- Йод — J2 — темно-фиолетовые кристаллы, металлический блеск.
Химические свойства галогенов
Фтор — самый активный неметалл, нет веществ, с которыми он не вступал бы в реакции, он НИКОГДА не проявляет положительные степени окисления. Это КОРОЛЬ неметаллов.
1. Взаимодействие с водородом:
F2 + H2 = 2HF — плавиковая кислота
2. Взаимодействие с металлами:
F2 + 2Li = 2LiF — фторид лития (галогениды)
3. Взаимодействие с неметаллами:
F2 + O2 = OF2 (кислород здесь проявляет с.о. +2)
4.Окислительный свойства:
Сl2 + H2S = S + 2HCl
5. Взаимодействие с водой:
раствор HF — плавиковая кислота
Cl2 + H2O ↔ HCl + HClO — оксокислоты хлора
Не смотря на то, что эти реакции написаны для фтора и хлора, естественно, они применимы и к брому, и к йоду (кроме взаимодействия с кислородом — там придется элементы поменять местами).
Как и во всех других группах, химические свойства соединений галогенов подчиняются законам периодичности:
- сверху вниз в подгруппе восстановительные свойства усиливаются.
- сила кислот сверху вниз увеличивается
- с увеличением степени окисления элемента в оксосоединениях усиливаются окислительные свойства.
Отдельно мы разберем Кислоты хлора — их немало, и их названия, а тем более называния солей, желательно знать наизусть
[TESTME 34]
Категории:
|
Обсуждение: «Химические свойства галогенов»
(Правила комментирования)
Электронная
конфигурация внешнего энергетического
уровня галогенов ns2np5.
Поскольку, до завершения энергетического
уровня галогенам не хватает всего 1-го
электрона, в ОВР они чаще всего проявляют
свойства окислителей. Степени окисления
галогенов: от «-1» до «+7». Единственный
элемент группы галогенов – фтор –
проявляет только одну степень окисления
«-1» и является самым электроотрицательным
элементом. Молекулы галогенов двухатомны:
F2,
Cl2,
Br2,
I2.
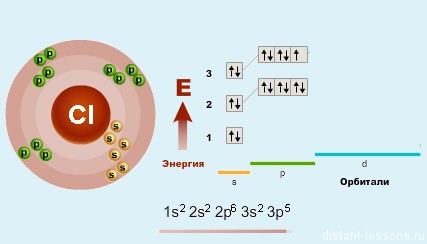
48. Характер химической связи в молекулах галогенов. Их физические и химические свойства
Связь галогенов в
бинарных соединениях с типичными
металлами (щелочными и щелочноземельными)
имеет преимущественно ионный характер.
В бинарных соединениях с неметаллами
галогены образуют преимущественно
ковалентные полярные свзяи.
Фтор – самый
электроотрицательный элемент, проявляет
степень окисления -1. Газ желтого цвета,
при обычных условиях не сжижается, имеет
резкий запах, очень ядовит, не
взаимодействует с He, Ne,
Ar.
Химические свойства:
1) реагирует с водородом
в темноте со взрывом (образуется
плавиковая кислота)
2) с кислородом
F2
+ O2 = 2OF2
3) Вытесняет кислород
из воды и оксида кремния
H2O
+ 2F2
= 4HF + O2
SiO2
+ 2F2
= SiF4
+ O2
3) галогены могут
соединяться между собой, образуя
интергалогениды
Хлор – при
стандартных условиях желто-зеленый газ
с неприятным, удушливым запахом, ядовит.
Раствор хлора в воде называется хлорной
водой.
Химические
свойства:
1) Не реагирует
с благородными газами, O2,
C, N2
2) С большинством
металлов и с остальными неметаллами
реагирует с образованием солей
3) Реагирует с
водой в зависимости от температуры:
Cl2
+ H2O
HCl + HClO
3Cl2
+ 3H2O
5HCl + HClO3
4) Реакция со
щелочами зависит от температуры:
Cl2
+ 2KOH
KCl + KClO + H2O
3Cl2
+ 6KOH
5KCl + KClO3
+ 3H2O
5) Каждый галоген
вытесняет другой нижестоящий галоген
из его солей
2KBr
+ Cl2 = 2KCl
+ Br2
6) Реагирует с
угарным газом с образованием фосгена
(ядовитый газ удушающего действия)
CO
+ Cl2 = COCl2
Бром –
красно-бурая жидкость, имеет вонючий
запах, ядовит, при попадании на кожу
вызывает ожоги
Йод –
черно-серо-фиолетовые кристаллы, легко
возгоняется
2Al
+ 3I2
2AlI3
49. Галогенводороды. Физические и химические свойства
Галогенводороды – это
газы с резким запахом, хорошо растворимые
в воде, водные растворы которых –
кислоты. HF выше 19 градусов
– газ, ниже – жидкость (объясняется
образованием прочных водородных связей).
Химические свойства:
SiO2
+ 4HF = SiF4
+ 2H2O
Соляная кислота реагирует
с:
1) основными и амфотерными оксидами
4HI+MnO2
= I2+MnI2+2H2O
2) щелочами, слабыми и
амфотерными гидроксидами
3) солями, если образуется
осадок, газ или слабый электролит
4) металлами, расположенными
в электрохимическом ряду до водорода

50. Кислородсодержащие соединения галогенов
Все
кислородсодержащие соединения галогенов
получены косвенным путем. Наиболее
устойчивы соли, меньше – оксиды и
кислоты. Для галогенов характерно
образование большого числа оксидов,
отвечающих различным степеням окисления.
Больше всего устойчивых соединений
образует хлор. Из соединений кислорода
с фтором существует только фторид
кислорода OF2. Хлор образует четыре
оксида, степень окисления хлора +1, +3,
+4, +7; бром – один, степень окисления
брома +4, и большое число неустойчивых
оксидов; йод – один, степень окисления
йода +5. Все оксиды неустойчивы, разлагаются
с большим выделением тепла.
Физические
свойства и способы получения некоторых
оксидов галогенов приведены в таблице:
|
Соединение |
Агрегатное |
Температура |
Температура |
Получение |
|
OF2 |
Бесцветный |
-224 |
-145 |
2F2 + 2NaOH = OF2 + 2NaF (при |
|
Cl2O |
Желто-коричневый |
-116 |
2 |
3HgO |
|
ClO2 |
Желтый |
-60 |
10 |
2NaClO3 |
|
Cl2O7 |
Маслянистая |
-90 |
82 |
2HClO4 |
|
Br2O4 |
Бледно-желтые |
Разлагается |
— |
Br2 |
|
I2O5 |
Бесцветные |
400 |
— |
2HIO3 = I2O5 + H2O (при 230°С) |
В кислородсодержащих
соединениях (оксидах, кислотах, солях)
галогены могут проявлять степени
окисления +1, +3, +5, +7. Среди кислородных
соединений галогенов наибольшее значение
имеют кислородные кислоты хлора и их
соли.
Кислородные кислоты
галогенов значительно менее устойчивы,
чем их соли. Среди кислот встречаются
неустойчивые, такие, как НВг02 и Нl2,
или существующие только в растворах
НВгО, НЮ4, НВг04. В ряду НСl
– НВгО – Нl уменьшаются
кислотные свойства и окислительная
активность. Аналогичные тенденции
наблюдаются и в рядах кислородных
кислот, где галогены проявляют степени
окисления +3, +5, +7.
Изменение кислотных и
окислительных свойств кислородсодержащих
кислот галогенов
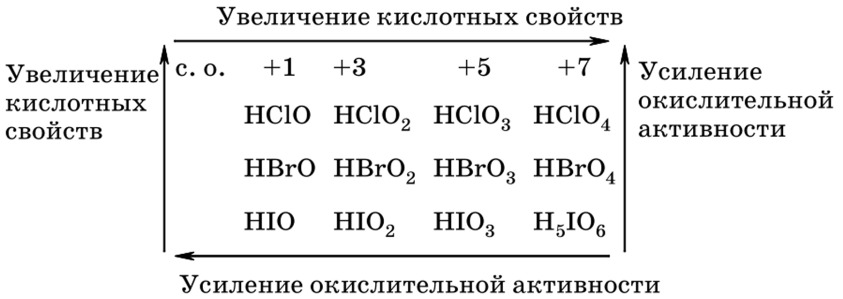
Изменение окислительной
активности солей кислородсодержащих
кислот галогенов происходит аналогично
соответствующим кислотам.
Свойства
НСЮ, НВгО и НЮ — слабые
кислоты, НСЮ4 и НВг04 — сильные
кислоты. Они обладают всеми свойствами
кислот: взаимодействуют с основаниями,
металлами, основными оксидами и др.
Кислородсодержащие
кислоты галогенов сильные окислители,
особенно НСЮ и НСЮ3.
Многие кислородсодержащие
кислоты галогенов и их соли неустойчивы
и разлагаются при комнатной температуре
или при нагревании:

Химические
свойства
-
Кислотные
свойства
Хлорноватистая и хлористая кислоты
относятся к слабым, хлорноватая и хлорная
— к сильным. Кислоты образуют соли в
реакциях c основными оксидами и
основаниями.
HClO + LiOH → LiClO + H2O
HClO3 + NaOH → NaClO3 + H2O
HClO4 + KOH → KClO4 + H2O
-
Разложение
кислот и солей
И кислоты, и их соли разлагаются схожим
образом.
HClO → HCl + O2
HClO2 → ClO2 + HClO3 + HCl + O2
KClO2 → (t) KClO3 + KCl
KClO2 → KCl + O2
KClO3 → KCl + O2
NaClO3 → (t) NaCl + NaClO4
NaClO3 → (кат.) NaCl + O2↑
-
Окислительные
свойства
KI + HClO → KIO3 + HCl
P + HClO3 → P2O5 + HCl
Соли этих кислот образуются в результате
реакции диспропорционирования,
происходящей между щелочью и галогеном.
KOH + Cl2 → KCl + KClO + H2O
KOH + Cl2 → (t) KCl + KClO3 + H2O
Соседние файлы в папке Коллоквиумы и экзамены
- #
- #
- #
- #
- #
- #
1. Химические свойства галогенов и их соединений с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Правило 1.1. Простые вещества
Водный раствор Cl2 окисляет соединения S–2 (H2S и сульфиды) до S+6, восстанавливаясь до степени окисления -1 (так как, находясь в седьмой группе периодической таблицы элементов, принять они могут только один электрон):
4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
4Cl2 + Na2S + 4H2O → Na2SO4 + 8HCl
Br2 и I2 являются более слабыми окислителями и поэтому окисляют сероводород преимущественно до S:
Br2 + H2S → S
Водные растворы Cl2 и Br2 окисляют соединения S+4 до S+6:
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
Br2 + SO2 + 2H2O → H2SO4 + 2HBr
Cl2 и Br2 окисляют аммиак с образованием хлорида и бромида аммония:
3Cl2 + 8NH3 → N2 + 6NH4Cl
3Br2 + 8NH3 → N2 + 6NH4Br
F2, Cl2 и Br2 окисляют пероксид водорода с образованием кислорода:
F2 + H2O2 → O2
Cl2 + H2O2 → O2
Br2 + H2O2 → O2
F2, Cl2 и Br2 окисляют соединения железа, хрома, марганца и др. в промежуточных степенях окисления, преимущественно в щелочной среде:
3F2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KF + 8H2O
3Cl2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KCl + 8H2O
3Br2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KBr + 8H2O
2Br2 + 2CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
3Br2 + 2NaCrO2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O
3Cl2 + 2CrCl3 + 16KOH → 2K2CrO4 + 12KCl + 8H2O
3Br2 + Cr2(SO4)3 + 16NaOH → 2Na2CrO4 + 3Na2SO4 + 6NaBr + 8H2O
3Cl2 + 2K3[Cr(OH)6] + 4KOH → 2K2CrO4 + 6KCl + 8H2O
2Br2 + Mn(NO3)2 + 8NaOH → Na2MnO4 + 4NaBr + 2NaNO3 + 4H2O
F2 + NaBrO3 + 2NaOH → NaBrO4 + 2NaF + H2O
I2 + K2SO3 + 2KOH → K2SO4 + 2KI + H2O
Br2 + 2K2MnO4 → 2KMnO4 + 2KBr
Галогены также окисляют кислоты и кислотные оксиды, в которых неметалл имеет промежуточную степень окисления:
2Cl2 + H3PO2 + 7KOH → K3PO4 + 4KCl + 5H2O
2I2 + As2O3 + 5H2O → 2H3AsO4 + 4HI
F2 + KClO3 + 2NaOH → KClO4 + 2NaF + H2O.
Правило 1.2. Кислородсодержащие кислоты и соли хлора являются сильными окислителями.
При восстановлении любых соединений с положительными степенями окисления галогенов последние восстанавливается по максимуму, до Г– .
Восстановление кислот:
5HClO3 + 6P + 9H2O → 5HCl + 6H3PO4
2HClO3 + 3P2O3 + 9H2O → 2HCl + 6H3PO4
4HClO + PH3 → 4HCl + H3PO4
HClO3 + 6HBr → 3Br2 + HCl + 3H2O
HClO3 + 6HI → 3I2 + HCl + 3H2O.
Восстановление солей:
KClO4 + 8HI → KCl + 4I2 + 4H2O
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
2KClO3 + 3P2O3 → 2KCl + 3P2O5
KClO3 + 3H2O2 → KCl + 3O2 + 3H2O
NaClO3 + 3MnO2 + 6NaOH → 3Na2MnO4 + NaCl + 3H2O.
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
В щелочной среде соединения Fe, Cr и Mn окисляются до ферратов (FeO42–), хроматов (CrO42–) и манганатов (MnO42–), соответственно:
2KClO3 + 3FeSO4 + 12KOH → 2KCl + 3K2FeO4 + 3K2SO4 + 6H2O
KClO3 + 2CrCl3 + 10KOH → 7KCl + 2K2CrO4 + 5H2O
KClO3 + 2Cr(OH)3 + 4NaOH → KCl + 2Na2CrO4 + 5H2O
2KClO3 + 3MnO + 6KOH → 2KCl + 3K2MnO4 + 3H2O
KClO3 + 3MnO2 + 6KOH → KCl + 3K2MnO4 + 3H2O
NaClO3 + Cr2O3 + 2K2CO3 → NaCl + 2K2CrO4 + 2CO2
NaClO3 + Cr2O3 + 4NaOH → NaCl + 2Na2CrO4 + 2H2O.
Правило 1.3. При окислении галогенидов Г– как правило образуются простые вещества (Cl2, Br2 и I2).
Примеры реакций с Cl–, Br–, I– :
16HCl + 2KMnO4 → 5Cl2 + 2KCl + 8H2O + 2MnCl2
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
6HCl + KClO3 → 3Cl2 + KCl + 3H2O
2HCl + KClO → Cl2 + KCl + H2O
HCl + HClO → Cl2 + H2O
4HCl + PbO2 → Cl2 + PbCl2 + 2H2O
4HCl + Ca(ClO)2 → 2Cl2 + CaCl2 + 2H2O
14HI + K2Cr2O7 → 3I2 + 2CrI3 + 2KI + 7H2O
8HI + KClO4 → 4I2 + KCl + 4H2O
6KI + KClO3 + 3H2SO4 → 3I2 + 3K2SO4 + KCl + 3H2O
10KI + 2KMnO4 + 8H2SO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
2KI + MnO2 + 2H2SO4 → I2 + MnSO4 + K2SO4 + 2H2O
10KBr + 2KMnO4 + 8H2SO4 → 5Br2 + 2MnSO4 + 6K2SO4 + 8H2O
Правило 1.4. Только I– окисляется соединениями Fe+3 и Cu+2 :
6HI + 2Fe(OH)3 → I2 + 2FeI2 + 6H2O
6HI + Fe2O3 → I2 + 2FeI2 + 3H2O
6KI + 2FeBr3 → I2 + 2FeI2 + 6KBr
4HI + 2CuCl2 → I2 + 2CuI + 4HCl
4KI + 2CuSO4 → I2 + 2CuI + 2K2SO4
4KI + 2Cu(NO3)2 → I2 + 2CuI + 4KNO3
При взаимодействии HI с соединениями Fe+2 и Cu+1, а также других галогеноводородов с Fe+3 и Cu+2, идут обычные реакции ионного обмена:
HI + Fe(OH)2 → FeI2 + H2O
3HCl + Fe(OH)3 → FeCl3 + 3H2O
Правило 1.5. Ионы I– и Br– могут окисляться кислотами-окислителями:
8HI + H2SO4(к) → 4I2 + H2S
2HBr + H2SO4(к) → Br2 + SO2
8KI + 5H2SO4(к) → 4I2 + H2S
2KBr + 2H2SO4(к) → Br2 + SO2
2KI + 4HNO3(к) → I2 + 2NO2
2KBr + 4HNO3(к) → Br2 + 2NO2