From Wikipedia, the free encyclopedia
In physical chemistry and chemical engineering, extent of reaction is a quantity that measures the extent to which the reaction has proceeded. Often, it refers specifically to the value of the extent of reaction when equilibrium has been reached. It is usually denoted by the Greek letter ξ. The extent of reaction is usually defined so that it has units of amount (moles). It was introduced by the Belgian scientist Théophile de Donder.
Definition[edit]
Consider the reaction
- A ⇌ 2 B + 3 C
Suppose an infinitesimal amount 




The change in the extent of reaction is then defined as[2][3]
where 



The extent of reaction represents the amount of progress made towards equilibrium in a chemical reaction. Considering finite changes instead of infinitesimal changes, one can write the equation for the extent of a reaction as
The extent of a reaction is generally defined as zero at the beginning of the reaction. Thus the change of 
Although in the example above the extent of reaction was positive since the system shifted in the forward direction, this usage implies that in general the extent of reaction can be positive or negative, depending on the direction that the system shifts from its initial composition.[7]
Relations[edit]
The relation between the change in Gibbs reaction energy and Gibbs energy can be defined as the slope of the Gibbs energy plotted against the extent of reaction at constant pressure and temperature.[1]
This formula leads to the Nernst equation when applied to the oxidation-reduction reaction which generates the voltage of a voltaic cell. Analogously, the relation between the change in reaction enthalpy and enthalpy can be defined. For example,[8]
Example[edit]
The extent of reaction is a useful quantity in computations with equilibrium reactions. Consider the reaction
- 2 A ⇌ B + 3 C
where the initial amounts are 
In the above, we note that the stoichiometric number of a reactant is negative. Now when we know the extent, we can rearrange the equation and calculate the equilibrium amounts of B and C.
References[edit]
- ^ a b Atkins, Peter; de Paula, Julio (2006). Physical chemistry (8 ed.). p. 201. ISBN 978-0-7167-8759-4.
- ^ Lisý, Ján Mikuláš; Valko, Ladislav (1979). Príklady a úlohy z fyzikálnej chémie. p. 593.
- ^ Ulický, Ladislav (1983). Chemický náučný slovník. p. 313.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «stoichiometric number, ν«. doi:10.1351/goldbook.S06025
- ^ Canagaratna, Sebastian C. (January 1, 2000). «The Use of Extent of Reaction in Introductory Courses». J. Chem. Educ. 77 (1): 52. doi:10.1021/ed077p52. Retrieved 3 May 2021.
- ^ Hanyak, Jr., Michael E. «Extent of Reaction or Events of Reaction?» (PDF). Department of Chemical Engineering, Bucknell University. 2014. Retrieved 3 May 2021.
- ^ Vandezande, Jonathon E.; Vander Griend, Douglas A.; DeKock, Roger L. (August 23, 2013). «Reaction Extrema: Extent of Reaction in General Chemistry». Journal of Chemical Education. 90 (9): 1177–1179. doi:10.1021/ed400069d. Retrieved 10 July 2021.
- ^ Lisý, Ján Mikuláš; Valko, Ladislav (1979). Príklady a úlohy z fyzikálnej chémie. p. 593.
Написали бы решение сюда, хотя идея то верная использовать в решении Кнест.
Кнест = ([Cu(+)]*[br(-)]^2)/[[CuBr2](-)]
β = 7,76*10^5, Кнест = 1/β, Кнест = 1,289*10^(-6)
По уравнению диссоциации комплекса [CuBr2](-) = Cu(+) + 2Br(-)
Получаем уравнение:
(х*(2х)^2)/0,1=1,289*10^(-6)
Осталось лишь найти х и связать полученный результат со степенью протекания реакции.
Изменено 23 Мая, 2017 в 15:53 пользователем Billman
Определить степень протекания реакции (стр. 279). [c.275]
Можно также определить и степень протекания реакции. Если на горлышко каждой пробирки одеть надувной резиновый шарик, при выделении водорода он увеличится в размерах пропорционально степени протекания реакции. Вы убедитесь в этом, проведя две серии экспериментов. [c.256]
Степень протекания реакции (13.11) также зависит от pH раствора. Таким образом, при титровании в щелочной среде наряду с реакцией (13.8) возможно взаимодействие по схеме (13.11). Неопределенность вклада каждой из этих реакций делает невозможным расчет результатов анализа. Иодометрические титрования рекомендуется поэтому проводить при pH<8,0, а разбавленные (0,01 М) растворы титровать при pH <7,0. При титро- [c.279]
Как величина ЛО связана с самопроизвольным характером процесса, скоростью реакции, степенью протекания реакции, направлением, из которого реакция приближается к равновесию [c.195]
Для отыскания реагентов, эффективных в деполимеризации угля, кроме фенола испытаниям были подвергнуты другие растворители. Полученные результаты сведены в табл. 4. О степени протекания реакции можно судить по выходу угля, перешедшего в раствор (деполимеризация), и по приращению массы испытуемого образца (в %). Для сравнения приведены данные для фенола. Увеличение массы образца не приведено для тех опытов, где продукт выделить не удалось, поскольку из-за нерастворимости используемого растворителя в воде эта операция представляла значительные трудности. В частности, не удалось определить приращение массы исходного образца в опытах с использованием креозотового масла и бензальдегида отрицательные значения степени деполимеризации, приведенные для этих растворителей, указывают, что масса остатка на фильтре превышала массу образца исходного угля, а это свидетельствует о химической реакции между растворителем и углем. [c.318]
Уравнение (11) связывает между собой степень протекания реакции г и величину потока рецикла К, для случая хл =1. [c.129]
Константу скорости реакции третьего порядка можно найти из тангенса угла наклона прямой в координатах [(1/1 —а) t, где а = Р/со —степень протекания реакции (рис. 13). [c.31]
Мы уже указывали, что по величине константы равновесия К можно судить о степени протекания реакции. При очень большом значении К реакция должна быть сильно сдвинута вправо (в сторону продуктов), а при очень низком значении К реак- [c.49]
Различают рассчитанные теоретически и экспериментальные кривые титрования. Теоретический расчет кривых титрования обычно проводится по данным о константе равновесия реакции, протекающей при титровании, и исходным концентрациям реагирующих веществ. Если нормальные концентрации титруемого раствора и титранта одинаковы и для титрования взяли 100,0 мл раствора, то число миллилитров добавленного титранта будет равно степени протекания реакции между титрантом и определяемым веществом (степени оттитрованности). Такие кривые служат главным образом для обоснованного выбора индикатора в данном титровании, который обеспечил бы необходимую точность определения. [c.188]
Соотношения (11.5) — (11.7) показывают, что степень протекания реакции зависит от pH раствора. Влияние кислотности раствора особенно заметно при титровании катионов, образующих сравнительно малоустойчивые комплексы (Мд «, a и др.) их можно оттитровать лишь в щелочной среде. Многие катионы титруются в аммиачном буферном растворе. Катионы, образующие очень устойчивые комплексы, как, например, Ре , могут быть оттитрованы в довольно кислом растворе. [c.236]
Изменение числа молей участника реакции с1п, можно выразить через его стехиометрический коэффициент (V,) и степень протекания реакции т. е. [c.48]
ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА СТЕПЕНЬ ПРОТЕКАНИЯ РЕАКЦИИ [c.476]
Рассмотрим влияние температуры, давления, наличия инертного газа, соотношения между реагентами и степени дисперсности на выход продуктов реакции. Очевидно, любое изменение условий, увеличивающее правую часть (XIV, 13), увеличит и степень протекания реакции. [c.476]
К адиабатным близки процессы, в которых тепловые эффекты велики и теплообмен затруднен (процессы горения, реакции в трубчатых аппаратах, в аппаратах с контактной массой и т, д.). В этом случае степень протекания реакции зависит от конечной температуры. Но значение последней, в свою очередь, определяется тепловым эффектом реакции. Поэтому, в отлнчие от изотермического процесса, расчет выхода здесь сводится к совместному решению уравнения (XIV, 13) и уравнения, связывающего степень протекания реакции со значением конечной температуры (т е. уравнения теплового баланса). Графическое решение заключается в нахождении точки пересечения кривых, отвечающих этим уравнениям (см. схему на рис 183) [c.477]
Следовательно, для реакций, протекающих с уменьшением объема, разбавление инертным газом нежелательно наоборот, при возрастании объема разбавление инертным газом увеличивает теоретическую степень протекания реакции. [c.482]
За исключением ионных гидроксидов, как, например, NaOH, уже содержащих ионы ОН , основания в результате реакции с водой образуют в растворе дополнительные ионы ОН . Сопряженные кислоты сильных оснований не могут быть более сильными, чем Н2О. К числу наиболее распространенных сильных оснований относятся гидроксиды и оксиды щелочных и щелочноземельных металлов. Слабые основания включают HjO, NH3, амины и анионы слабых кислот. Степень протекания реакции слабого основания с водой с образованием ионов ОН и кислоты, сопряженной основанию, определяется константой диссоциации основания (константой основности) К . [c.102]
ТЕОРЕТИЧЕСКАЯ И ПРАКТИЧЕСКАЯ СТЕПЕНИ ПРОТЕКАНИЯ РЕАКЦИИ [c.494]
Поскольку практическая степень протекания реакции зависит от длительности процесса, все факторы, увеличивающие скорость реакции, вместе с этим увеличивают и степень превращения за любой промежуток времени, недостаточный для установления равновесия. Общими факторами, влияющими и на кинетику, и на статику процессов, являются температура, давление и концентрация реагентов. Так, если при повышении температуры величина Ка уменьшается, а скорость реакции возрастает, то без расчета скоростей нельзя предсказать суммарное действие изменения температуры на практическую степень протекания реакции. В присутствии катализатора создается возможность перехода на более высокотемпературный режим, причем температуру в реакционной зоне при прочих равных условиях можно поддерживать тем более высокую, чем активнее катализатор (при том условии, конечно, что повышение температуры не вызовет уменьшения его активности). Кстати говоря, взаимодействию катализатора с реагентами должно отвечать менее отрицательное значение ДС, чем в катализируемом процессе. [c.495]
Степень протекания реакции слева направо определяется константой равновесия. Для реакции [c.166]
Если разность (фо —фвс) лежит в пределах (-0,4)+— (-1-0,4) В, то в стандартных условиях реакция будет протекать в малой степени. Для практического проведения таких реакций отходят от стандартных условий и применяют концентрированные растворы окислителей и восстановителей (при этом берут большой избыток окислителя или восстановителя, а если это возможно, один из реагентов — в виде твердого вещества или газа). В таких случаях потенциал окислителя увеличивается, а потенциал восстановителя уменьшается, что приводит к росту значения (ф8к—Фвс) Кроме того, повышению степени протекания реакции способствует нагревание реакционной смеси. [c.78]
Из уравнения протолиза слабого основания А следует, что [НА ] = [ОН ], а [А] = Сд (в предположении малой степени протекания реакции). Отсюда по заданным значениям и Сд рассчитывают концентрации продуктов протолиза и pH раствора. [c.127]
Известно, что степень протекания реакции слева направо определяется константой (равновесия, так как переход электронов в окислительно-восстановительной реакции происходит лишь до тех пор, пока существует разность потенциалов. Реакция окисления-восстановления переходит в состояние равновесия, когда разность потенциалов становится равной нулю, т. е. в данном состоянии (в состоянии равновесия) потенциалы окислителя и восстановителя становятся одинаковыми, равными. Например, при равновесии для реакции восстановления перманганата калия ионом Ре2+ потенциал окислителя равен потенциалу восстановителя т. е. [c.348]
Молекулярный водород при комнатной температуре химически весьма пассивен. Он реагирует только с фтором. Степень протекания этой реакции сильно зависит от материала сосуда в сосуде из магния она очень мала, в сосуде из железа — значительно больше. Обоснуйте это наблюдение. Какими способами можно увеличить степень протекания реакции в сосуде из магния [c.151]
В соответствии с принципом Ле Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому ее поддерживают в интервале 450-500 °С, достигая 15%-го выхода аммиака. Непрореагировавшие Nj и Н возвращают в реактор и тем самым увеличивают степень протекания реакции. [c.137]
Расчет химических равновесий сводится к нахождению числа зависимых компонентов и, следовательно, к вычислению степени протекания реакции. При этом нужно учитывать следующее 1) если в системе может проходить несколько химических реакций, то сначала каждую из них рассматривают как самостоятельную, затем определяют последовательность протекания реакций и в этой последовательности ведут расчеты (см. гл. 4) 2) правильность расчета проверяют по условию материального баланса 3) расчеты можно проводить с различной степенью точности. В первом приближении концентрациями некоторых веществ пренебрегают. [c.38]
В случае реакций комплексообразования степень маскирования можно характеризовать снижением условной константы равновесия. Так, предложено считать, что мешающий компонент полностью замаскирован, если 1д/С 2. С другой стороны, количественное протекание реакции можно ожидать, если g/ 7. В случае конкурирующих реакций комплексообразования степень протекания реакций маскирования можно оценить коэффициентами избирательности (КИ) и маскирования (КМ) [c.121]
Вообще говоря, можно было бы ожидать, что степень протекания реакции Михаэля так же, как и ее скорость, должна в значительной степени зависеть от кислотности донора и полярности двойной углерод-углеродной связи в акцепторе, Кис- [c.204]
Химические реакции различаются но степени протекания. Одни реакции протекают в данных условиях практически до конца, другие— в очень малой степени. Сравним степень протекания реакции синтеза паров воды из простых веществ и ее разложения на простые вещества при 2000° С и 101,3 кПа. Экспериментально установлено, что при этих условиях из исходной смеси 1 моля Нз и 0,5 молей О а в момент достижения равновесия в системе содержится 0,994 моля Н2О, 0,006 моля Н2 и 0,003моля О2. Такое же соотношение концентрации компонентов возникает при введении в сосуд 1 моля воды. Таким ( бразом, прн 2000° С и 101,3 кПа реакция синтеза паров воды протекает практически до конца, тогда как реакция разложе ния воды протекает в ничтожной степени. [c.177]
Показано, что псевдоравновесные системы можно трактовать как равновесные, если использовать повышенное число компонентов. Конкретизация данной псевдоравновесной системы осуществляется указанием степени протекания реакций, превращающих вспомогательные компоненты в основные. Методика иллюстрирована расчетом зависимости адиабатических тевшератур горшия смесей перхлората аммония с углеродом от количества твердого углерода в продуктах реакции. [c.189]
Выведите расчетную формулу для степени протекания реакции автопротолиза воды ( нго) при известных значениях и Сн,о (см. задачи 7.2 и 7.3). [c.123]
Общая константа устойчивости комплекса [Си Вгз] равна 7,76 10 при 25° С. Рассчитайте степень протекания реакции полного распада этого комплекса (иа и два иона Вг») в его 0,1М растворе, считая реакцию одностадийной (что близко к действительности). По результатам расчета сделайте вывод о том, можно ли считать соединение СиВгз солью. [c.266]
Поскольку реакция включает взаимодействие ароматического углеводорода с протоном, степень протекания реакции может служить непосредственной мерой основности углеводорода. Бензол является слишком слабым донором электронов, чтобы действовать в качестве эффективного ст-о онования, но ксилолы и более вьгсокоалкилированные бензолы при распределении их между н-гептаном и жидким фтористым водородом в присутствии соответствующего количества фтористого бора образуют комплексы, которые переходят в неорганический слой. Так как стабильность а-комплекса изменяется в зависимости от природы, числа и расположения алкильных групп, возможно разделение смеси углеводородов фракционной экстраицией. Если три изомерных ксилола обработать ограниченным количеством фтористого бора в присутствии избытка фтористого водорода, то л1-ксилол, как наиболее сильное основание, извлекается в первую очередь, а п-ксилол — в последнюю. [c.135]
Для того чтобы извлечь пользу из уравнения (2.1.1), необходимо уметь выражать dq и diy через реальные характеристики системы. Сначала обсудим механическую работу и зададимся целью вывести выражение для d-w. Механическая работа включает работу, требуемую для сжатия газов, и работу, которую производят газы при расширеипи. Во многих химических реакциях участвуют или образуются газы, и степень протекания реакции зависит от работы, которую может совершить система. [c.65]
Поскольку степень протекания реакции (3.8) очень мала, относительная акт1шность самой воды ири равновесии будет очень мало отличаться от единицы (<я о а 1), если в качестве стандартного состояния взять [c.227]
Для выбора оптимального режима получения -фенилкоричной кислоты мы провели изучение кинетики ее образования по указанному выше способу. О степени протекания реакции судили по убыли дифенилальдегида в реакционной массе. Для того была разработана методика полярографического определения ди фенилальдегида, которая состоит в следующем. [c.6]
Степень — протекание — реакция
Cтраница 1
Степень протекания реакции (13.11) также зависит от рН раствора. Неопределенность вклада каждой из этих реакций делает невозможным расчет результатов анализа.
[1]
Степень протекания реакции слева направо определяется константой равновесия.
[2]
Степень протекания реакции по механизму одноэлектронного окисления — восстановления зависит от рН среды, причем в одних случаях ей способствуют низкие значения рН, а в других — высокие.
[3]
Степень протекания реакции частично зависит от однородности и формы амальгамы, которую готовят, выливая сплав через нагретое алундовое сито с небольшими отверстиями в колонку высотой 700 мм, заполненную минеральным маслом. Гранулы сушат, взвешивают и перед употреблением промывают бензолом.
[4]
Степень протекания реакции определяется по исчезновению желтой окраски.
[5]
Степень протекания реакции периодически контролируют, проверяя температуру плавления после удаления хлористого водорода в вакууме.
[6]
Степень протекания реакции определяют по уменьшению объема жидкого йодистого метила.
[7]
Степень протекания реакции могла быть измерена количественно разложением избыточного шестифтористого урана водой ( что приводило к образованию фтористого уранила), после чего при помощи окислительно-восстановительного титрования определялось количество присутствующего в растворе четырехфтористого урана. Последний мог образоваться только при реакции шестифтористого урана с частично фторированными примесями, присутствовавшими в образце. Можно полагать, что американскими исследователями накоплен большой опытный материал, относящийся к таким системам; тем не менее опубликованы лишь немногочисленные работы, касающиеся этой области химии фторуглеродов.
[8]
Степень протекания реакции по механизму одноэлектронного окисления — восстановления зависит от рН среды, причем в одних случаях ей способствуют низкие значения рН, а в других — высокие.
[9]
Степень протекания реакции могла быть измерена количественно разложением избыточного шестифтористого урана водой ( что приводило к образованию фтористого уранила), после чего при помощи окислительно-восстановительного титрования определялось количество присутствующего в растворе четырехфтористого урана. Последний мог образоваться только при реакции шестифтористого урана с частично фторированными примесями, присутствовавшими в образце. Можно полагать, что американскими исследователями накоплен большой опытный материал, относящийся к таким системам; тем не менее опубликованы лишь немногочисленные работы, касающиеся этой области химии фторуглеродов.
[10]
Степень протекания реакции (13.11) также зависит от рН раствора. Неопределенность вклада каждой из этих реакций делает невозможным расчет результатов анализа.
[11]
Степень протекания реакции должна зависеть от ряда факторов, в частности от кислотности раствора, диэлектрической проницаемости и сольватирующей способности растворителя.
[12]
Степень протекания реакции обмена между Н2 и бутаном очень сильно зависела от катализатора и его способа применения и была приблизительно пропорциональна степени протекания реакции изомеризации. Наблюдался изотопный эффект, причем обмен происходил гораздо быстрее, если тритий находился в изобутане при первичном атоме углерода, чем тогда, когда тритий находился в составе молекулы водорода.
[13]
Степень протекания реакций переноса иона хлора была подробно изучена спектрофотометрическими методами.
[14]
Приведена степень протекания реакции изотопного обмена, обычно выраженная в процентах прореагировавшего вещества или в числе атомных или молекулярных слоев твердого вещества; при умножении числа атомных слоев на площадь для слоя находят значение, эквивалентное количеству твердого вещества, претерпевающего обмен за указанный промежуток времени. Выражения полный обмен и нет обмена означают, что реакция обмена прошла более чем на 95 % и менее чем на 5 % соответственно.
[15]
Страницы:
1
2
3
4
равновесной
смеси
В
общем случае система в состоянии
химического равновесия представляет
собой равновесную смесь. Количественное
соотношение между веществами в равновесной
смеси определяется константой равновесия,
которая также определяет степень
завершенности реакции. Чем больше K,
тем больше
в равновесной смеси будет веществ,
находящиеся в правой части уравнения
реакции. При K
∞
в равновесной смеси будут только продукты
реакции, следовательно, реакция завершена
полностью.
Степень
завершенности реакции может быть
выражена одной из следующих характеристик:
мерой реакции, степенью превращения и
степенью диссоциации.
Мера реакции
,
(5.22)
где
ni
и Ni
– число молей вещества
i
в равновесной и в исходной смеси перед
реакцией; i
– стехиометрические
коэффициенты. Отсюда число молей i-го
вещества в равновесной смеси:
(5.23)
Степень
превращения представляет собой долю
любого реагента, например, A
(составляющая, находящаяся в левой
стороне уравнения реакции), которая
превращается к моменту достижения
равновесия при данных условиях. Если
степень превращения вещества A
обозначить xA,
то
.
(5.24)
Из
соотношения
,
имеем
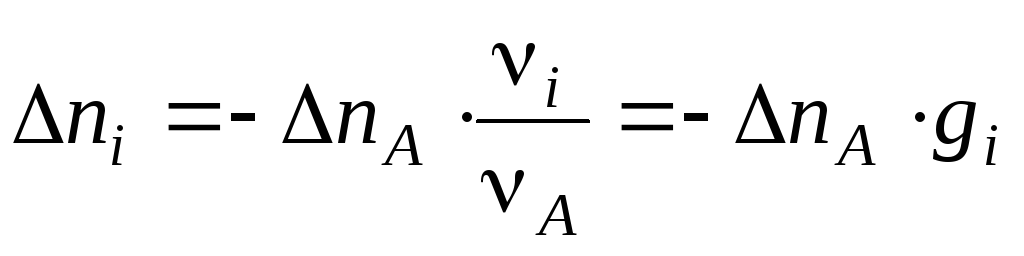
где.
Знак
«минус» свидетельствует о том, что
количество вещества A
уменьшается: nA
0. Если бы
степень превращения рассматривали в
отношении вещества, находящегося в
правой части уравнения реакции (например
D),
то знак был бы положительным, ибо для
этого вещества
nD
0.
Подставляя
ni
в
уравнение (5.23) и учитывая, что nA
0 , запишем
,
(5.25)
где
Степень
диссоциации
представляет собой долю вещества
(например веществаЕ),
которая продиссоциировала к моменту
равновесия:
.
(5.26)
При
реакции диссоциации левая часть уравнения
реакции имеет один член: E
– диссоциирующее вещество. Следовательно,
=хe.
Поэтому по аналогии с (5.25) число молей
любой составляющей i
в равновесной смеси
,
(5.27)
где
.
Величины
,
xA
и α, выражающие степень завершенности
реакции, связаны между собой:
,
(5.28)
(5.29)
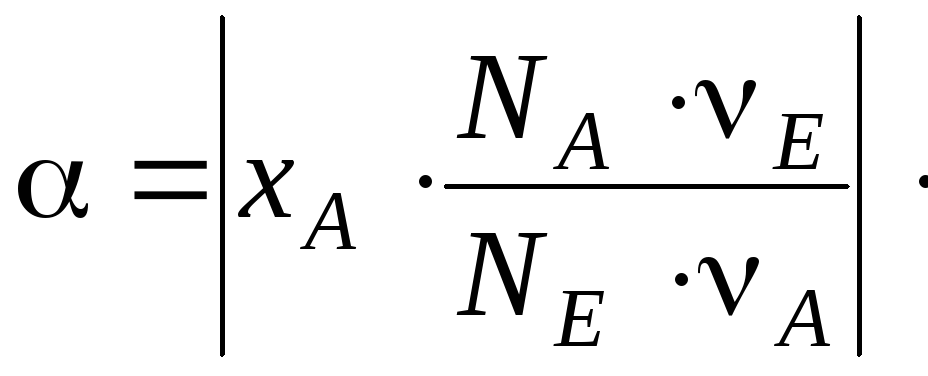
5.7. Термодинамические уравнения процесса протекания
химических
реакций
Величину
изменения изобарного потенциала (энергии
Гиббса) при термодинамически обратимом
протекании химической реакции
,
можно
вычислить по уравнению изотермы:
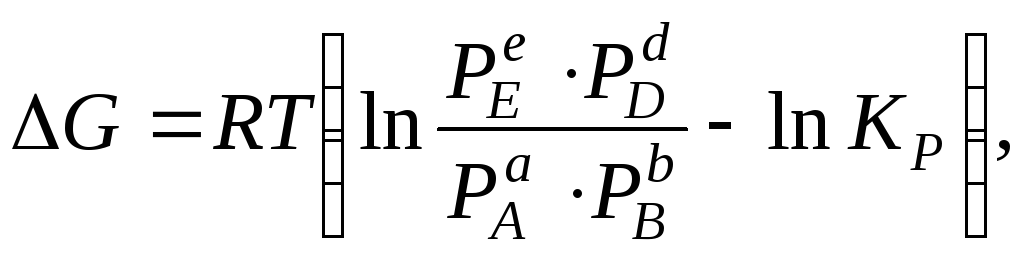
где
P
– величина парциального давления в
неравновесном состоянии.
При
изохорном протекании химической реакции
величина изменения изохорно-изотермического
потенциала (энергии Гельмгольца) также
может быть вычислена по уравнению
изотермы:
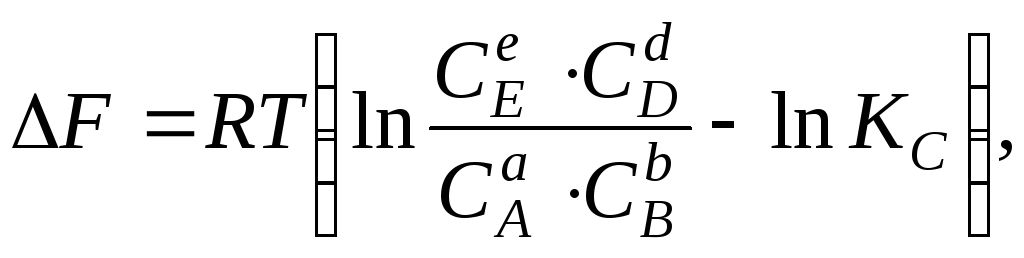
где
С
– концентрация веществ в неравновесном
состоянии.
Если
G
или F
меньше нуля, то реакция самопроизвольно
может протекать в прямом направлении;
если G
или F
больше нуля – в обратном направлении;
если G
или F
равны нулю, система находится в равновесии.
Способность
различных химических реакций к
самопроизвольному их протеканию
сопоставляют друг с другом при стандартных
условиях исходной смеси. За стандартные
принимают условия, когда концентрации
исходных веществ и конечных продуктов
в начале реакции равны 1 кмоль/м3
или
парциальное давление каждого компонента
равно 1 физической атмосфере. В таком
случае уравнения изотермы химической
реакции могут быть представлены в виде:
;
.
(5.33)
Если
парциальные давления и KP
выражать в
Паскалях, то:
или
(5.34)
Изменение
изобарного (или изохорного) потенциала
при протекании химической реакции равно
разности между алгебраическими суммами
G
(или F)
образования конечных продуктов и
начальных веществ:
.
(5.35)
Зная
изменение изобарного или изохорного
потенциала реакции в стандартных
условиях, можно определить константы
равновесия по уравнениям (5.33).
Зависимость
константы химического равновесия от
температуры описывается уравнениями
изобары и изохоры. В дифференциальном
виде эти уравнения можно записать:
и
.
(5.36)
Отсюда
следует, что с повышением температуры
константа равновесия увеличивается в
процессах, сопровождающихся поглощением
теплоты (Q
> 0), т. е.
в эндотермических процессах. В
экзотермических реакциях (т. е. когда
Q
< 0) константа
равновесия при понижении температуры
увеличивается.
В
общем случае влияние на изменение
химического равновесия различных
факторов (главным образом, Т
и Р)
подчиняется принципу смещения равновесия
(принцип Ле-Шателье-Брауна): внешнее
воздействие, выводящее систему из
состояния равновесия, вызывает в системе
процессы, стремящиеся ослабить эффект
этого воздействия.
В
простейшем случае можно принять, что в
небольшом интервале температур величина
теплового эффекта реакции не зависит
от температуры. Тогда получим
(5.37)
где
В –
постоянная интегрирования.
Если
же интегрирование приходится производить
в значительном интервале температур,
то необходимо по закону Кирхгофа вывести
уравнение зависимости теплового эффекта
реакции от температуры, подставить это
уравнение вместо H
или U
в уравнение (5.36) и провести интегрирование.
В результате получается:
;
(5.38)
,
гдеa,
b,
c
– коэффициенты в зависимости теплоемкостей
от температуры (C
= a
+ bT
+ cT
2).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #









