ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
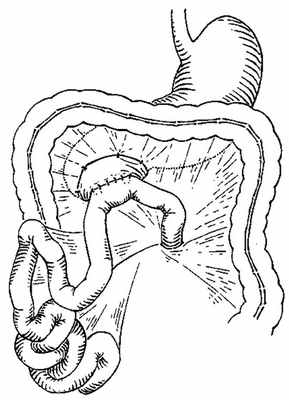
Грыжа Трейтца — это выпячивание внутрибрюшных органов в двенадцатиперстно-тощекишечное углубление (карман Трейтца). Заболевание проявляется периодическими болями в животе через несколько часов после еды, отдающими в поясницу, позвоночник и область эпигастрия; отрыжкой, тошнотой и рвотой, запором. Неприятные ощущения усиливаются в вертикальном положении. Диагностика основывается на клинической картине, данных анамнеза жизни и заболевания, рентгенографии кишечника с барием и КТ брюшной полости. Лечение оперативное. Вмешательство заключается в высвобождении органов, находящихся в грыжевом мешке, и ушивании грыжевых ворот.
- Причины
- Патогенез
- Классификация
- Симптомы грыжи Трейтца
- Осложнения
- Диагностика
- Лечение грыжи Трейтца
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Грыжа Трейтца (парадуоденальная, околодвенадцатиперстная) — внутренняя грыжа живота, которая образуется при выбухании внутренних органов (чаще петель тонкого кишечника) в дуоденально-еюнальный карман. Заболевание названо в честь австрийского патологоанатома Венцеля Трейтца, детально описавшего в середине XIX века анатомическое расположение и симптомы патологического выпячивания. Распространённость заболевания составляет 30-40% от всех случаев внутренних грыж живота. Парадуоденальная грыжа развивается преимущественно в возрасте 20-40 лет. Чаще поражает лиц мужского пола. В связи с трудностями распознавания большинство грыж диагностируется интраоперационно.
Грыжа Трейтца
Причины
Основными предрасполагающими факторами околодвенадцатиперстной грыжи являются внутриутробные аномалии развития органов пищеварения. Заболевание может проявиться вследствие дисплазии соединительной ткани, незавершенного поворота кишечника и связанного с ним отклонения в формировании кармана Трейтца. Во взрослом возрасте причиной грыжи могут послужить самостоятельные и послеоперационные перивисцериты, спаечная болезнь кишечника, в результате которых происходит смещение внутрибрюшных органов. Абдоминальные операции (трансплантация печени, шунтирование желудка, резекция кишечника) могут повлечь за собой дислокацию кишечника и других анатомических структур живота.
Патогенез
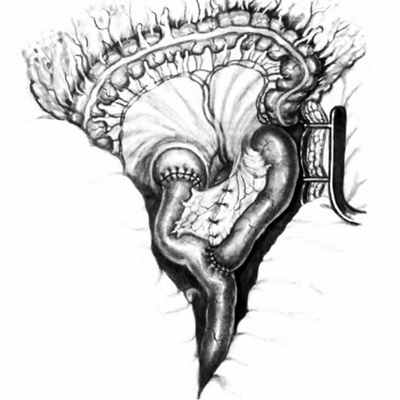
Карман Трейтца формируется на передней поверхности задней брюшной стенки, слева от 2-го поясничного позвонка в области перехода 12-перстной кишки в тощую. Ямка, ограниченная дуоденально-еюнальным изгибом тонкой кишки и брюшинной складкой, образует грыжевые ворота патологического выбухания, имеющие овальную или щелевидную форму. Дно кармана представлено париетальной брюшиной, часть которой при возникновении грыжи Трейтца пролабирует в ретроперитонеальную клетчатку, формируя грыжевой мешок. Грыжевая сумка располагается кзади от поджелудочной железы и может распространяться до селезенки. Грыжевое содержимое представлено в основном петлями тонкого кишечника.
Классификация
Парадуоденальные грыжи могут быть врожденными и приобретенными, неосложненными и ущемленными, иметь большой и малый размер. В зависимости от местоположения относительно позвоночного столба в современной герниологии выделяют два вида грыжевых выпячиваний:
- Левосторонняя грыжа. Встречается в 70-75 % случаев, располагается слева от связки Трейтца позади желудка.
- Правосторонняя грыжа. Находится справа от позвоночника, ниже поперечной ободочной кишки. Для правосторонней грыжи Трейтца характерно смещение двенадцатиперстной кишки вправо, тощей кишки — вправо и кзади.
Симптомы грыжи Трейтца
Клиническая картина заболевания вариабельна, зависит от объема и локализации грыжи. При малых размерах патологического выпячивания симптомы болезни могут отсутствовать. По мере увеличения грыжевого мешка возникают периодические схваткообразные боли в правой или левой половине живота, иррадиирущие в позвоночник, поясницу или эпигастральную область. Неприятные ощущения развиваются через 2-3 часа после приема пищи или на фоне физической нагрузки.
Боли усиливаются в положении стоя и сидя и ослабевают в горизонтальном положении на боку, противоположном локализации грыжи. Пациенты предъявляют жалобы на отрыжку, метеоризм, тошноту и рвоту (редко). Эти симптомы длятся недолго и чаще всего купируются самостоятельно при смене положения тела. Возникают длительные запоры: задержки стула могут составлять 5-7 дней.
Осложнения
Появление резкой приступообразной абдоминальной боли, упорного запора, рвоты свидетельствует об ущемлении грыжи Трейтца. При пальпации брюшной стенки выше пупка определяется мягкое эластичное образование, которое несколько смещается во время дыхания. В результате ущемления кишки возникает острая тонкокишечная непроходимость. Длительное сдавливание приводит вначале к ишемии, а затем и к некрозу части кишечника. Отсутствие экстренных мер влечет за собой развитие перитонита и сепсиса.
Диагностика
Ввиду того, что грыжа Трейтца в большинстве случаев визуально и пальпаторно не определяется, специфическая симптоматика заболевания отсутствует, диагностика парадуоденальной грыжи вызывает трудности. Для установления диагноза необходимо пройти следующие обследования:
- Осмотр хирурга. При визуальном осмотре грыжевое выбухание передней брюшной стенки отсутствует, при пальпации живота можно прощупать только парадуоденальные грыжи больших размеров. Поэтому для более точной диагностики требуется проведение дополнительных исследований.
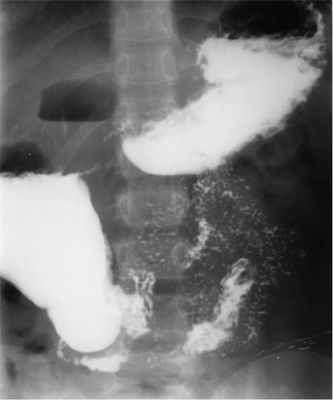
- Рентгенологическое исследование. Рентгенография пассажа бария по тонкому кишечнику помогает увидеть кишечную непроходимость и увеличенные сегменты тонкой кишки, расположенные в кармане Трейтца. При парадуоденальной грыже отмечается смещение 12-перстной кишки вправо, тощей кишки – латерально и кзади. Перед исследованием необходимо исключить перфорацию кишки.
- КТ брюшной полости. Позволяет лучше визуализировать ЖКТ, грыжевой мешок с содержимым.
Дифференциальная диагностика проводится с язвенной болезнью, доброкачественными или злокачественными новообразованиями 12-перстной кишки. Периодические острые боли в животе могут быть ошибочно приняты за обострение панкреатита, холецистита. В этом случае инструментальные методы исследования помогают поставить верный диагноз.
Лечение грыжи Трейтца
Лечение парадуоденальной грыжи хирургическое. При подтверждении диагноза проводят верхнюю срединную лапаротомию. Рассекают грыжевые ворота, высвобождают органы из грыжевого мешка. Затем ушивают щелевидный дефект и производят ревизию брюшной полости. При ущемленной грыже осуществляют удаление грыжевого мешка с частью некротизированной кишки, после чего выполняют ушивание грыжевых ворот. В послеоперационном периоде назначают курс антибиотикотерапии. При наличии осложнений назначают дезинтоксикационную и противовоспалительную терапию.
Прогноз и профилактика
Прогноз заболевания зависит от грамотно проведенной дифференциальной диагностики. При своевременном обнаружении грыжи Трейтца и проведении операции прогноз благоприятный. Ущемление патологического грыжевого выпячивания вызывает ряд серьезных, жизнеугрожающих осложнений. Профилактика направлена на раннее диагностирование грыжи. Рекомендовано при появлении первых симптомов болезни обратиться к гастроэнтерологу или абдоминальному хирургу для проведения дополнительных диагностических исследований.
Вы можете поделиться своей историей болезни, что Вам помогло при лечении грыжи Трейтца.
Источники
- Настоящая статья подготовлена по материалам сайта: https://www.krasotaimedicina.ru/
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
From Wikipedia, the free encyclopedia
| Suspensory muscle of duodenum | |
|---|---|
The duodenum. The suspensory muscle of the duodenum attaches to the duodenojejunal flexure, shown. |
|
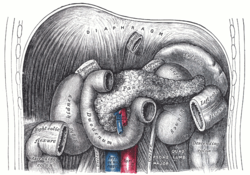
The duodenum and jejunum depicted in situ. The suspensory muscle of the duodenum connects posteriorly to the duodenojejunal flexure, behind the pancreas, shown. |
|
| Details | |
| System | Gastrointestinal |
| Origin | Connective tissue surrounding coeliac artery and superior mesenteric artery |
| Insertion | Third and fourth-parts of duodenum, duodenojejunal flexure |
| Nerve | Coeliac plexus, Superior mesenteric plexus |
| Actions | Facilitates movement of food; embryological role in fixating jejunum during gut rotation |
| Identifiers | |
| Latin | Musculus suspensorius duodeni, ligamentum suspensorium duodeni |
| TA98 | A05.6.02.011 |
| TA2 | 3781 |
| FMA | 20509 |
| Anatomical terms of muscle
[edit on Wikidata] |
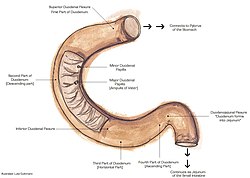
The suspensory muscle of duodenum (also known as the ligament of Treitz)[1] is a thin muscle connecting the junction between the duodenum and jejunum (the small intestine’s first and second parts, respectively), as well as the duodenojejunal flexure to connective tissue surrounding the superior mesenteric and coeliac arteries. The suspensory muscle most often connects to both the third and fourth parts of the duodenum, as well as the duodenojejunal flexure, although the attachment is quite variable.
The suspensory muscle marks the formal division between the duodenum and the jejunum. This division is used to mark the difference between the upper and lower gastrointestinal tracts, which is relevant in clinical medicine as it may determine the source of gastrointestinal bleeding.
The suspensory muscle is derived from mesoderm and plays a role in the embryological rotation of the gut, by offering a point of fixation for the rotating gut. It is also thought to help digestion by widening the angle of the duodenojejunal flexure. Superior mesenteric artery syndrome is a rare abnormality caused by a congenitally short suspensory muscle.
Structure[edit]
The duodenum and the jejunum are the first and second parts of the small intestine, respectively. The suspensory muscle of the duodenum marks their formal division.[2] The suspensory muscle arises from the right crus of the diaphragm as it passes around the esophagus, continues as connective tissue around the stems of the celiac trunk (celiac artery) and superior mesenteric artery, passes behind the pancreas, and enters the upper part of the mesentery, inserting into the junction between the duodenum and jejunum, the duodenojejunal flexure.[3] Here, the muscles are continuous with the muscular layers of the duodenum.[1]
Variation[edit]
Considerable anatomic variation exists, in terms of length and point of attachment.[4] Despite the classical description, the muscle only solely attaches to the duodenojejunal flexure in about 8% of people; it is far more common, 40 to 60% of the time to attach additionally to the third and fourth parts of the duodenum; and 20 to 30% of the time it only attaches to the third and fourth parts. Moreover, separate multiple attachments are not that uncommon.[1]
According to some authors, who use the original description by Treitz, the muscle may be divided into two sections: a ligamentous portion attaching the right crus of diaphragm to the connective tissue surrounding the coeliac artery and superior mesenteric artery; and a lower muscular portion from the connective tissue attaching to the duodenum. The superior portion is also described as the Hilfsmuskel.[3][4] These two parts are now considered anatomically distinct, with the suspensory muscle referring solely to the lower structure attaching at the duodenum.[1][4]
Function[edit]
The ligament contains a slender band of skeletal muscle from the diaphragm and a fibromuscular band of smooth muscle from the horizontal and ascending parts of the duodenum. When it contracts, by virtue of connections to the third and fourth parts of the duodenum, the suspensory muscle of the duodenum widens the angle of the duodenojejunal flexure, allowing movement of the intestinal contents.[1][5]
Embryology[edit]
Embryologically, the suspensory muscle of the duodenum is derived from mesoderm. It plays an important role in the embryological rotation of the small intestine as the superior retention band.[1][3]: 48
Clinical significance[edit]
This ligament is an important anatomical landmark of the duodenojejunal flexure, separating the upper and lower gastrointestinal tracts. For example, bloody vomit or melena, black tarry stools, usually indicate a gastrointestinal bleed from a location in the upper gastrointestinal tract. In contrast, hematochezia, bright red blood or clots in the stool, usually indicates gastrointestinal bleeding from the lower part of the gastrointestinal tract.[6] It is an especially important landmark to note when looking at the bowel for the presence of malrotation of the gut, a syndrome often suspected in young children when they have episodes of recurrent vomiting. Visualising a normal location of the ligament of Treitz in radiological images is critical in ruling out malrotation of the gut in a child; it is abnormally located when malrotation is present.[4]
During a Whipple’s procedure, commonly used to treat pancreatic cancer by removing the pancreas, duodenum, and part of the jejunum, the ligament of Treitz is separated from the duodenum and preserved. When the remaining jejunum is anastamosed with the pylorus of the stomach, it may be passed through the ligament.[7]
Superior mesenteric artery syndrome (SMA) is an extremely rare life-threatening condition that can either be congenital and chronic, or induced and acute. SMA Syndrome is characterised by compression of the duodenum between the abdominal aorta and the superior mesenteric artery, and may—when congenital—result from a short suspensory muscle. One surgical treatment is Strong’s operation, which involves cutting the suspensory muscle, though this is not often carried out.[8]
History[edit]
The suspensory muscle of the duodenum was first named in 1853 by Václav Treitz, as the musculus suspensorius duodeni (in Latin), and described as consisting of a lower muscular portion with a broad base, and an upper tendinous portion blending with connective tissue around the origins of the superior mesenteric and coeliac arteries. It is commonly termed the ligament of Treitz by clinicians and as the suspensory muscle of the duodenum by anatomists. It has also been likened to «a polar ice cap … a structure that many refer to but few have seen.»[1]
Additional images[edit]
-
Depiction of the origin of the suspensory muscle, from the fibres of the right diaphragmatic crus
-
Suspensory muscle of the duodenum or muscle of Treitz seen in a ventral view.
References[edit]
- ^ a b c d e f g Meyers, M. A. (September 1995). «Treitz redux: the ligament of Treitz revisited». Abdominal Imaging. 20 (5): 421–424. doi:10.1007/BF01213262. PMID 7580775. S2CID 4381790.
- ^ David A. Warrell (2005). Oxford textbook of medicine: Sections 18-33. Oxford University Press. ISBN 978-0-19-856978-7. Retrieved 1 July 2010.: 511
- ^ a b c Mitra, S (2006). Anatomy, Combined Edition. Academic Publishers. p. 48. ISBN 81-87504-95-1.
- ^ a b c d Kim, Seuk Ky; Cho, C. D.; Wojtowycz, Andrij R. (25 July 2007). «The ligament of Treitz (the suspensory ligament of the Duodenum): anatomic and radiographic correlation». Abdominal Imaging. 33 (4): 395–397. doi:10.1007/s00261-007-9284-3. PMID 17653583. S2CID 11858260.
- ^ Moore KL, Dalley AF, Agur AMR (2010). Clinically Oriented Anatomy (6th ed.). Lippincott Williams & Wilkins. p. 241. ISBN 978-0-7817-7525-0.
- ^ Vernava, Anthony M.; Moore, Beth A.; Longo, Walter E.; Johnson, Frank E. (July 1997). «Lower gastrointestinal bleeding». Diseases of the Colon & Rectum. 40 (7): 846–858. doi:10.1007/BF02055445. PMID 9221865. S2CID 6971032.
- ^ Gagner, Michel; Palermo, Mariano (28 July 2009). «Laparoscopic Whipple procedure: review of the literature». Journal of Hepato-Biliary-Pancreatic Surgery. 16 (6): 726–730. doi:10.1007/s00534-009-0142-2. PMID 19636494.
- ^ Lee, Tae Hee; Lee, Joon Seong; Jo, Yunju; Park, Kyung Sik; Cheon, Jae Hee; Kim, Yong Sung; Jang, Jae Young; Kang, Young Woo (18 October 2012). «Superior Mesenteric Artery Syndrome: Where Do We Stand Today?». Journal of Gastrointestinal Surgery. 16 (12): 2203–2211. doi:10.1007/s11605-012-2049-5. PMID 23076975. S2CID 40701151.
Грыжа Трейтца (Околодвенадцатиперстная грыжа, Парадуоденальная грыжа)
Грыжа Трейтца — это выпячивание внутрибрюшных органов в двенадцатиперстно-тощекишечное углубление (карман Трейтца). Заболевание проявляется периодическими болями в животе через несколько часов после еды, отдающими в поясницу, позвоночник и область эпигастрия; отрыжкой, тошнотой и рвотой, запором. Неприятные ощущения усиливаются в вертикальном положении. Диагностика основывается на клинической картине, данных анамнеза жизни и заболевания, рентгенографии кишечника с барием и КТ брюшной полости. Лечение оперативное. Вмешательство заключается в высвобождении органов, находящихся в грыжевом мешке, и ушивании грыжевых ворот.
Общие сведения
Грыжа Трейтца (парадуоденальная, околодвенадцатиперстная) — внутренняя грыжа живота, которая образуется при выбухании внутренних органов (чаще петель тонкого кишечника) в дуоденально-еюнальный карман. Заболевание названо в честь австрийского патологоанатома Венцеля Трейтца, детально описавшего в середине XIX века анатомическое расположение и симптомы патологического выпячивания. Распространённость заболевания составляет 30-40% от всех случаев внутренних грыж живота. Парадуоденальная грыжа развивается преимущественно в возрасте 20-40 лет. Чаще поражает лиц мужского пола. В связи с трудностями распознавания большинство грыж диагностируется интраоперационно.
Грыжа Трейтца
Причины
Основными предрасполагающими факторами околодвенадцатиперстной грыжи являются внутриутробные аномалии развития органов пищеварения. Заболевание может проявиться вследствие дисплазии соединительной ткани, незавершенного поворота кишечника и связанного с ним отклонения в формировании кармана Трейтца. Во взрослом возрасте причиной грыжи могут послужить самостоятельные и послеоперационные перивисцериты, спаечная болезнь кишечника, в результате которых происходит смещение внутрибрюшных органов. Абдоминальные операции (трансплантация печени, шунтирование желудка, резекция кишечника) могут повлечь за собой дислокацию кишечника и других анатомических структур живота.
Патогенез
Карман Трейтца формируется на передней поверхности задней брюшной стенки, слева от 2-го поясничного позвонка в области перехода 12-перстной кишки в тощую. Ямка, ограниченная дуоденально-еюнальным изгибом тонкой кишки и брюшинной складкой, образует грыжевые ворота патологического выбухания, имеющие овальную или щелевидную форму. Дно кармана представлено париетальной брюшиной, часть которой при возникновении грыжи Трейтца пролабирует в ретроперитонеальную клетчатку, формируя грыжевой мешок. Грыжевая сумка располагается кзади от поджелудочной железы и может распространяться до селезенки. Грыжевое содержимое представлено в основном петлями тонкого кишечника.
Классификация
Парадуоденальные грыжи могут быть врожденными и приобретенными, неосложненными и ущемленными, иметь большой и малый размер. В зависимости от местоположения относительно позвоночного столба в современной герниологии выделяют два вида грыжевых выпячиваний:
- Левосторонняя грыжа. Встречается в 70-75 % случаев, располагается слева от связки Трейтца позади желудка.
- Правосторонняя грыжа. Находится справа от позвоночника, ниже поперечной ободочной кишки. Для правосторонней грыжи Трейтца характерно смещение двенадцатиперстной кишки вправо, тощей кишки — вправо и кзади.
Симптомы грыжи Трейтца
Клиническая картина заболевания вариабельна, зависит от объема и локализации грыжи. При малых размерах патологического выпячивания симптомы болезни могут отсутствовать. По мере увеличения грыжевого мешка возникают периодические схваткообразные боли в правой или левой половине живота, иррадиирущие в позвоночник, поясницу или эпигастральную область. Неприятные ощущения развиваются через 2-3 часа после приема пищи или на фоне физической нагрузки.
Боли усиливаются в положении стоя и сидя и ослабевают в горизонтальном положении на боку, противоположном локализации грыжи. Пациенты предъявляют жалобы на отрыжку, метеоризм, тошноту и рвоту (редко). Эти симптомы длятся недолго и чаще всего купируются самостоятельно при смене положения тела. Возникают длительные запоры: задержки стула могут составлять 5-7 дней.
Осложнения
Появление резкой приступообразной абдоминальной боли, упорного запора, рвоты свидетельствует об ущемлении грыжи Трейтца. При пальпации брюшной стенки выше пупка определяется мягкое эластичное образование, которое несколько смещается во время дыхания. В результате ущемления кишки возникает острая тонкокишечная непроходимость. Длительное сдавливание приводит вначале к ишемии, а затем и к некрозу части кишечника. Отсутствие экстренных мер влечет за собой развитие перитонита и сепсиса.
Диагностика
Ввиду того, что грыжа Трейтца в большинстве случаев визуально и пальпаторно не определяется, специфическая симптоматика заболевания отсутствует, диагностика парадуоденальной грыжи вызывает трудности. Для установления диагноза необходимо пройти следующие обследования:
- Осмотр хирурга. При визуальном осмотре грыжевое выбухание передней брюшной стенки отсутствует, при пальпации живота можно прощупать только парадуоденальные грыжи больших размеров. Поэтому для более точной диагностики требуется проведение дополнительных исследований.
- Рентгенологическое исследование. Рентгенография пассажа бария по тонкому кишечнику помогает увидеть кишечную непроходимость и увеличенные сегменты тонкой кишки, расположенные в кармане Трейтца. При парадуоденальной грыже отмечается смещение 12-перстной кишки вправо, тощей кишки – латерально и кзади. Перед исследованием необходимо исключить перфорацию кишки.
- КТ брюшной полости. Позволяет лучше визуализировать ЖКТ, грыжевой мешок с содержимым.
Дифференциальная диагностика проводится с язвенной болезнью, доброкачественными или злокачественными новообразованиями 12-перстной кишки. Периодические острые боли в животе могут быть ошибочно приняты за обострение панкреатита, холецистита. В этом случае инструментальные методы исследования помогают поставить верный диагноз.
Лечение грыжи Трейтца
Лечение парадуоденальной грыжи хирургическое. При подтверждении диагноза проводят верхнюю срединную лапаротомию. Рассекают грыжевые ворота, высвобождают органы из грыжевого мешка. Затем ушивают щелевидный дефект и производят ревизию брюшной полости. При ущемленной грыже осуществляют удаление грыжевого мешка с частью некротизированной кишки, после чего выполняют ушивание грыжевых ворот. В послеоперационном периоде назначают курс антибиотикотерапии. При наличии осложнений назначают дезинтоксикационную и противовоспалительную терапию.
Прогноз и профилактика
Прогноз заболевания зависит от грамотно проведенной дифференциальной диагностики. При своевременном обнаружении грыжи Трейтца и проведении операции прогноз благоприятный. Ущемление патологического грыжевого выпячивания вызывает ряд серьезных, жизнеугрожающих осложнений. Профилактика направлена на раннее диагностирование грыжи. Рекомендовано при появлении первых симптомов болезни обратиться к гастроэнтерологу или абдоминальному хирургу для проведения дополнительных диагностических исследований.
Грыжа Трейтца — лечение в Москве
Геморрой является одним из самых распространенных заболеваний человека и наиболее частым колопроктологическим заболеванием в странах Западной цивилизации. Около 140 человек из 1000 взрослого населения имеют те или иные симптомы, связанные с патологическим увеличением геморроидальных узлов. Установлено, что у 70% людей старше 30 лет, обратившихся к колопроктологу, обнаруживаются симптомы геморроя, при этом мужчины и женщины предъявляют вышеобозначенные жалобы одинаково часто. В структуре колопроктологических заболеваний на долю геморроя приходится около 40%.
Cтроение анального канала
Анальный канал считается исключительно сложным анатомическим образованием, так как является одной из немногих в организме человека пограничных структур, образующихся с участием всех трех эмбриональных закладок: энтодермы, мезодермы и эктодермы. Его формирование происходит с 5 по 8 неделю внутриутробного развития. Этот сложный процесс складывается из следующих стадий:
- образование анальной ямки путем погружения эктодермы в сторону задней кишечной трубки;
- углубление анальной ямки навстречу конечному отделу задней кишки;
- образование анальной мембраны, как места соединения анального канала и задней кишки (в последующем — зубчатой линии);
- перфорация анальной мембраны, в результате чего устанавливается связь между прямой кишкой и анальным каналом.
Следует различать «анатомический» и «хирургический» анальный канал (табл. 1).
Таблица 1. Характеристики анатомического и хирургического анального канала
| Признаки | Анатомический анальный канал | Хирургический анальный канал |
| Верхняя граница | Зубчатая линия | Аноректальное кольцо |
| Нижняя граница | Linea anocutanea | Linea anocutanea |
| Протяженность | 1,5 — 3,0 см | 2,0 — 5,0 см |
Анатомический анальный канал располагается от зубчатой линии (linea dentata), известной также как гребешковая линия (linea pectinea), до наружного края заднего прохода — линии Хилтона (linea anocutanea, linea alba). Последняя представляет собой место перехода анодермы в перианальную кожу и имеет характерную бледную окраску.
Хирургический анальный канал располагается между верхней границей мышечного аноректального кольца и наружным краем заднего прохода.
Каркасом анального канала служат два мышечных комплекса:
- гладкомышечный комплекс, являющийся продолжением циркулярного и продольного мышечных слоев стенки прямой кишки;
- поперечно-полосатый мышечный комплекс, состоящий из мышц наружного сфинктера и мышцы, поднимающей задний проход.
Гладкомышечный комплекс составляют внутренний сфинктер длиной 2,5-4 см, имеющий бобовидную форму и утолщающийся книзу, и продольная мышца, которая окружает внутренний сфинктер снаружи, тесно переплетаясь с пуборектальной мышцей в области верхнего края аноректального кольца, и, по мере приближения к перианальной коже дает множество волокон в виде гусиной лапки. Последние, прободая внутренний сфинктер, преобразуются в мышцу, удерживающую внутренние геморроидальные сплетения, получившую название мышцы Трейца или m. submucosae ani. По мере приближения к анодерме и перианальной коже волокна продольной мышцы проходят через подкожную порцию наружного сфинктера и выходят в виде связки, удерживающей внутренние и наружные геморроидальные узлы (связка Паркса), и мышцы, вплетающейся в перианальную кожу, образуя m. corrugator cutis ani, прикрепляя эту часть наружного сфинктера к коже.
Поперечно-полосатый мышечный комплекс представлен двумя компонентами. Первым является наружный сфинктер, состоящий из трех порций — подкожной, поверхностной и глубокой. Подкожная порция имеет вид циркулярной манжеты и крепится к коже. Поверхностная порция начинается от сухожильного центра промежности, прикрепляется к копчику и коже. Наиболее мощная глубокая порция наружного сфинктера имеет вид мышечного цилиндра, внутри которого находится внутренний сфинктер и геморроидальные сплетения, сзади она крепится к копчику, а спереди у женщин — к сжимателю влагалища, а у мужчин — к луковично-пещеристой мышце. Вторым по порядку, но равнозначным скелетно-мышечным компонентом аноректального кольца является пуборектальная мышца, берущая свое начало от лонных костей и огибающая прямую кишку сзади, тесно переплетаясь с волокнами глубокой порции наружного сфинктера и продольной мышцы гладкомышечного комплекса удерживающего аппарата.
Таким образом, верхняя часть мышечного аноректального кольца образуется за счет соединения:
- puborectalis (в составеm. levator ani);
- верхнего края глубокой порции наружного сфинктера;
- верхней трети внутреннего сфинктера.
Хирургический анальный канал включает в себя анатомический анальный канал, а также дистальную часть прямой кишки с внутренними геморроидальными сплетениями, располагающуюся между зубчатой линией и аноректальным мышечным кольцом (рис. 1).
Рисунок 1. Схема анатомических структур анального канала
1 — аноректальное кольцо; 2 — зубчатая линия (linea dentata); 3 — линия Хилтона (linea anocutanea); 4 — анатомический анальный канал; 5 — хирургический анальный канал; 6 — связка Паркса; 7 — наружные геморроидальные сплетения; 8 — анальная железа; 9 — подкожная порция наружного сфинктера; 10 — поверхностная порция наружного сфинктера; 11 — глубокая порция наружного сфинктера; 12 — продольная мышца; 13 — пуборектальная мышца; 14 — мышца, поднимающая задний проход (m. levator ani); 15 — слизистый и подслизистый слои кишечной стенки и анального канала; 16 — внутренние геморроидальные сплетения; 17 — Морганиева заслонка; 18 — Морганиева колонна; 19 — Морганиева крипта; 20 — мышца Трейца
Зубчатая линия служит границей между прямой кишкой и анальным каналом, происходящими из разных зародышевых листков. В соответствии с этим между частями хирургического анального канала, расположенными дистальнее и проксимальнее зубчатой линии, существуют следующие различия (табл. 2):
- кровоснабжение верхней части хирургического анального канала осуществляется из системы верхних и средних геморроидальных сосудов, а иннервация — вегетативной нервной системой, не имеющей болевых рецепторов;
- иннервация зоны ниже зубчатой линии обеспечивается соматическими нервами, а крово- и лимфоток — системой нижних геморроидальных сосудов.
Таблица 2. Сравнительная характеристика верхней и нижней зоны анального канала
| Признаки | Ниже зубчатой линии | Выше зубчатой линии |
| Эмбриологические
зачатки |
Эктодерма | Энтодерма |
| Эпителий | Плоскоклеточный | Цилиндрический |
| Артериальное
кровоснабжение |
Нижняя прямокишечная артерия | Верхняя и средняя прямокишечная артерия |
| Венозный отток | В систему нижней прямокишечной вены | В систему верхней и средней прямокишечной вены |
| Лимфатический
дренаж |
Паховые лимфатические узлы | Мезоректальные подвздошные и запирательные лимфатические узлы |
| Иннервация | Нижний срамной нерв (соматическая нервная система) | Тазовое сплетение (вегетативная нервная система) |
Анальный канал со стороны прямой кишки до зубчатой линии покрыт однорядным цилиндрическим эпителием, а после нее — многослойным плоским неороговевающим эпителием, не имеющим эпидермиса. Последний получил название анодермы. Область перехода цилиндрического эпителия в плоский, располагающаяся над зубчатой линией, занимает около 1,0 см и называется переходной зоной (transitional zone). Ниже уровня анального канала анодерма постепенно переходит в кожу, с расположенными в ней сальными и потовыми железами, не имеющую волосяных луковиц. Эта часть кожного покрова именуется перианальной кожей.
Дистальная часть прямой кишки, непосредственно над зубчатой линией содержит от 8 до 14 продольно расположенных валиков длиной 2-4 см, в основе которых лежат гладкомышечные волокна, сосуды и соединительная ткань. Эти продольные складки получили название Морганиевых колонн (columni Morgagnii). В нижней части они соединены поперечными полулунными складками — Морганиевыми заслонками, образующими таким образом углубления слизистой — Морганиевы крипты, куда открываются протоки трубчатых и трубчато-альвеолярных анальных желез.
Артериальная и венозная системы анального канала
Кровоснабжение прямой кишки осуществляется пятью артериями (табл. 3):
- непарной верхней прямокишечной артерией;
- парной средней прямокишечной артерией;
- парной нижней прямокишечной артерией.
Таблица 3. Артериальное кровоснабжение анального канала
| Название артерии | Берут начало от | Принимают участие в образовании |
| Верхняя прямокишечная артерия | Нижняя брыжеечная артерия | Внутренних геморроидальных сплетений |
| Левая и правая средние прямокишечные артерии | Внутренняя подвздошная или внутренняя срамная артерия | |
| Левая и правая нижние прямокишечные артерии | Внутренние срамные артерии | Наружных геморроидальных сплетений |
Конечными ветвями приносящих артерий являются внутристеночные артерии, имеющие улиткообразную форму и получившие название улитковых артерий. Венозная сеть прямой кишки состоит из трех сплетений (табл. 4):
- подслизистого венозного сплетения;
- подфасциального венозного сплетения;
- подкожного венозного сплетения.
Таблица 4. Строение венозной системы анального канала
| Название | Формируют | Принимают участие в образовании |
| Подслизистое венозное сплетение | Верхние и средние геморроидальные вены | Внутренних геморроидальных сплетений |
| Подфасциальное венозное сплетение | ||
| Подкожное венозное сплетение | Нижние геморроидальные вены | Наружных геморроидальных сплетений |
Начальными ветвями подслизистого и подкожного сплетений являются кавернозные вены, стенки которых состоят из выраженных участков соединительной ткани и мышечных волокон. Благодаря такому строению эти вены обладают способностью к значительному растяжению и кровенаполнению, что обеспечивает герметичное смыкание анального канала. После этого кавернозные вены так же быстро сокращаются для эвакуации крови из их просвета.
Геморроидальные сплетения
Основой геморроидальных узлов являются кавернозные образования, которые в процессе нормального эмбриогенеза закладываются в дистальном отделе прямой кишки выше зубчатой линии (внутренние узлы) и под кожей промежности (наружные узлы).
В 1974 году Л. Л. Капуллером было установлено, что венозные сосуды этой области образуются не в результате слияния посткапилярных венул, а отходят от сравнительно крупного резервуара диаметром от 1 до 5 мм, являющегося кавернозным образованием. Расположенные в подслизистом слое прямой кишки, они образуют не сплошное кольцо по окружности анального канала, а 3-4 отдельных скопления, главные из которых занимают левое боковое, правое заднее и правое переднее положения, соответственно расположению основных геморроидальных узлов на 3, 7 и 11 часах по циферблату (рис. 2).
Доказано, что эти кавернозные сплетения, наполняясь кровью во время акта дефекации, способствуют защите анального канала от механической травмы. После кратковременного опущения во время акта дефекации мышечные (мышца Трейца) и эластические волокна (связка Паркса), составляющие соединительно-тканную основу геморроидальных сплетений, подтягивают их вверх на прежнее место.
Рисунок 2. Схема расположения геморроидальных узлов в анальном канале (положение больного на спине)
1 — проекция linea anocutanea;
2 — проекция аноректального кольца;
3 — левый геморроидальный узел;
4 — правый задний геморроидальный узел;
5 — правый передний геморроидальный узел.
По мнению Wexner и Baig кроме основной функции — обеспечения венозного оттока из области анального канала, геморроидальные сплетения могут выполнять следующие функции:
- поддерживают континенцию;
- обеспечивают защиту сфинктерного аппарата благодаря своеобразному амортизирующему эффекту;
- усиливают механизм смыкания анального канала.
Обновлено: 28.05.2023
Авторы: Т.Д. Звягинцева, И.И. Шаргород, Харьковская медицинская академия последипломного образования
Версия для печати
Хроническая дуоденальная непроходимость (ХДН) играет существенную роль в развитии рефлюкс-гастрита и рефлюкс-эзофагита, хронического дуоденита, холецистита и панкреатита, в связи с чем ее рассматривают как одну из важных проблем гастроэнтерологии.
Моторно-эвакуаторные нарушения двенадцатиперстной кишки (ДПК) при заболеваниях органов гастродуоденальной зоны встречаются в 50–80 % случаев. Они способны выступать как в роли ведущего патогенетического фактора, так и в виде сопутствующих нарушений.
Синдром хронической дуоденальной непроходимости — это клинический симптомокомплекс, обусловленный нарушением моторной и эвакуаторной деятельности ДПК различной этиологии (органической или функциональной природы), который приводит к задержке (стазу) ее содержимого.
Диагностика ХДН затруднена вследствие многообразия клинических проявлений, вовлечения в патологический процесс окружающих двенадцатиперстную кишку органов (желудок, желчный пузырь, желчевыводящие пути, поджелудочная железа, печень и другие), что маскирует клинику самого синдрома ХДН.
Причины возникновения ХДН разделены на 2 группы: органические (механические) и функциональные — встречаются в 6 раз чаще, чем наличие механического препятствия.
Функциональные формы могут быть первичными (расстройства вегетативной иннервации или дистрофические изменения интрамурального нервного аппарата ДПК) и вторичными (отрицательные рефлекторные влияния с патологически измененных органов пищеварения).
Основные механизмы возникновения первичных нарушений моторной функции ДПК:
1. Нарушение функции и структуры гладкомышечных образований ДПК.
2. Разбалансированность внешней симпатической и парасимпатической иннервации ДПК.
3. Нарушение регуляторной функции автономных нервных сплетений ДПК.
Вторичная функциональная ХДН может сопровождать: язвенную болезнь ДПК, атрофический дуоденит, хронический холецистит, хронический панкреатит, микседему, а также быть проявлением постхолецистэктомического синдрома.
Причиной органической ХДН могут быть:
1. Врожденные аномалии ДПК, связки Трейца и поджелудочной железы, которые способствуют стазу в ДПК: мегадуоденум, мобильная (подвижная) ДПК (в норме она фиксирована на всем протяжении), что приводит к сужению просвета ДПК с задержкой дуоденального содержимого; резкое сужение дистальной части ДПК (врожденное), создающее препятствие к ее опорожнению; опущение ДПК; врожденное укорочение и другие аномалии связки Трейца, ведущие к образованию острого угла в области дуоденоеюнального перехода; кольцевидная и аберрантная поджелудочная железа (ПЖ), локализованная в ДПК.
2. Экстрадуоденальные причины синдрома ХДН, которые приводят к сужению просвета ДПК за счет сдавления ее извне.
3. Интрамуральные патологические процессы в стенке ДПК: доброкачественные и злокачественные опухоли ДПК (циркулярный рак, рак большого дуоденального сосочка (БДС), злокачественная лимфома, обструктивная плазмоцитома ДПК как одно из проявлений рецидивирующей множественной миеломы), крупный внутрипросветный дивертикул ДПК, постбульбарный рубцово-язвенный стеноз ДПК как следствие рецидивирующей внелуковичной язвы, болезнь Крона ДПК со стенозированием ее просвета, рубцовый стенозирующий перидуоденит.
4. Редкие причины обтурации ДПК: закупорка крупным желчным камнем, проникшим в ДПК по холецистодуоденальному свищу, закупорка инородным телом (безоаром и др.); обтурация ДПК клубком аскарид.
5. Патологические процессы, возникающие после операции на желудке: спаечный процесс в пилородуоденальной зоне; синдром приводящей петли после резекции желудка и гастроеюностомии; возникновение порочного круга в результате неудачной операции; сочетание спаечного процесса и гастроеюнальной язвы.
Стойкое повышение внутридуоденального давления, независимо от вызвавшей его причины, приводит к нарушению микроциркуляции, ухудшению трофики слизистой оболочки, уменьшению ее регенераторных и защитных свойств, снижению устойчивости слизистой к агрессивным экзогенным и собственным пищеварительным субстанциям, богатым разного рода гидролизами.
Развивается дуоденит, в воспалительно-дегенеративный процесс вовлекаются мышечные жомы сфинктерного аппарата, что приводит к их неспособности выполнять свою замыкательную функцию. Это приводит к нарушению дуоденального пищеварения и повышению осмотического давления в полости кишки.
Клиническая картина ХДН зависит от стадии и причин ее развития, давности заболевания. Основными симптомами в разных сочетаниях являются боли, тошнота, рвота.
Больные отмечают склонность к запорам (редко диарея), может быть «шум плеска» в эпигастральной области после еды, периодически возникает рвота пищей со значительной примесью желчи, которая приносит временное облегчение. Иногда на фоне диспептических явлений возникает симптоматика «дуоденальной мигрени»: внезапные приступообразные односторонние пульсирующие головные боли, вазомоторные расстройства, головокружения, светобоязнь, обильная рвота желчью, диарея.
Перечисленные симптомы сопровождаются общей слабостью, быстрой утомляемостью, снижением трудоспособности, похуданием, бессонницей, иногда субфебрилитетом.
При депрессивном состоянии психики больные предъявляют многочисленные жалобы сенестопатического типа: ощущение распирания, скручивания, жара в эпигастральной области, которые могут распространяться по всему животу и нарастают в связи с приемом пищи, а также при резких колебаниях метеорологических условий, психоэмоциональных нагрузках.
В течении синдрома ХДН различают компенсированную, субкомпенсированную и декомпенсированную стадии.
При компенсированной (или латентной) стадии ХДН повышается внутриполостное давление в ДПК при еще сохраненной замыкательной функции привратника. Постепенно мышечная оболочка ДПК гипертрофируется, транзит пищевого химуса задерживается, что приводит к стазу дуоденального содержимого.
При субкомпенсированной стадии ХДН нарастает гипертензия в ДПК, появляются антиперистальтические сокращения, возникает застой желчи и секрета ПЖ. ДПК постепенно расширяется, истощается ее нервно-мышечный аппарат. В свою очередь, это приводит к расслаблению привратникового жома и забросу дуоденального содержимого в желудок: развивается дуоденогастральный рефлюкс (ДГР). Желудок расширяется, а в результате повреждения его слизистой оболочки желчными кислотами и лизолецитином формируется рефлюкс-гастрит.
В стадии декомпенсации ХДН гипертензия и усиленная перистальтика ДПК сменяются гипотонией и атонией, значительной ее дилатацией, что приводит к развитию порочного круга: содержимое ДПК свободно перемещается через зияющий привратник в желудок и обратно. Длительный стаз в ДПК приводит к инфицированию содержимого и обусловливает развитие хронического дуоденита с прогрессирующей атрофией слизистой оболочки, появлением в ней эрозий и изъязвлений. При понижении тонуса сфинктера Одди возникает рефлюкс застойного дуоденального содержимого в ампулу большого дуоденального соска и далее в общий желчный и панкреатический протоки с развитием хронических холецистита и панкреатита, осложняющих течение ХДН.
Для диагностики ХДН используют рентгенологическое исследование, зондовую релаксационную дуоденографию, фиброгастродуоденоскопию, ультразвуковое исследование органов брюшной полости, рН-метрию, поэтажную манометрию, дуоденодебитометрию, дуоденокинезиграфию.
Рентгенологическое исследование позволяет установить характер механического препятствия, его локализацию, протяженность, стадию синдрома ХДН, нарушение замыкательной функции привратника, наличие и выраженность ДГР.
Релаксационная зондовая дуоденография дает возможность проводить дифференциальную диагностику между функциональным и органическим дуоденостазом, изучить рельеф и пневморельеф слизистой оболочки ДПК.
Эндоскопический метод позволяет определять двигательные нарушения ДПК, недостаточность пилорического жома, наличие гастроэзофагеального (ГЭР) и/или дуоденогастрального рефлюкса. Изучение биоптатов гастродуоденальной слизистой дает возможность устанавливать характер поражения ДПК и желудка.
Исследование двигательной функции ДПК может проводиться как в ходе фракционного дуоденального зондирования, так и путем изучения внутриполостного давления водным манометром Вальдмана.
Для выявления компенсированных форм ХДН проводится манометрия, изучается внутрикишечное давление после нагрузки, которая осуществляется путем введения в ДПК 100 мл теплого физиологического раствора и последующего измерения давления с интервалом в 10, 20 и 30 минут, с последующим изучением кривых манометрического давления в полости ДПК.
В диагностике ХДН используют эндорадиозондирование, радиотелеметрический метод, электромиодуоденографию, динамическое изучение эвакуаторной функции желудка радионуклидным методом — путем приема определенного стандартного объема пищи, меченной триолеатглицерином (131J), непрерывную радиогастродуоденографию, радионуклидные методы.
Поскольку содержимое ДПК при ХДН почти всегда инфицировано, необходимо проводить бактериологическое исследование для выявления патогенной и условно-патогенной микрофлоры и определить ее чувствительность к антибактериальным средствам.
Лечение синдрома ХДН
Если причиной нарушения пассажа химуса по ДПК является механическое препятствие, то лечебные мероприятия сводятся к оперативному вмешательству: дренирование ДПК или выключение последней из пассажа пищевого химуса.
В медикаментозной терапии первичного и вторичного функциональных синдромов ХДН в компенсированной и субкомпенсированной стадии используют лекарственные средства, восстанавливающие двигательную функцию ДПК и желудка, подавляющие бактериальную инфекцию в ДПК и смежных с ней органах.
Наиболее эффективными для нормализации двигательно-эвакуаторной функции желудка и ДПК признаны прокинетики, к числу которых относятся блокаторы допаминовых рецепторов и агонисты 5-НТ4-рецепторов.
Прокинетики оказывают преимущественно стимулирующее влияние на гладкую мускулатуру желудочно-кишечного тракта: повышают тонус и сократительную активность желудка и ДПК, улучшают антродуоденальную координацию, ускоряют эвакуацию желудочного содержимого и тонкокишечный транзит.
В настоящее время рекомендуется использовать селективный прокинетический препарат ІІ поколения с комбинированным механизмом действия — Праймер (итоприда гидрохлорид), который считается препаратом выбора в лечении больных с моторно-эвакуаторными нарушениями желудка и ДПК:
— Праймер является одновременно антагонистом периферических допаминовых D2-рецепторов и блокатором ацетилхолинэстеразы (препарат активирует высвобождение ацетилхолина, препятствует его деградации и таким образом оказывает антихолинэстеразное действие);
— блокирование D2-рецепторов на фоне приема препарата способствует повышению активности аденилатциклазы в миоцитах пищевода, желудка, двенадцатиперстной кишки и уровня цАМФ, что вызывает стимуляцию двигательной активности этих органов;
— оказывает модулирующее влияние на гипоталамо-гипофизарно-адреналовую систему благодаря повышению концентрации гастроинтестинальных гормонов (мотилина, соматостатина) и снижению уровня холецистокинина, адренокортикотропного гормона;
— отсутствие ингибирования системы цитохрома Р450 свидетельствует о минимальной гепатотоксичности препарата;
— усиливает пропульсивную моторику желудка и ускоряет его опорожнение;
— повышает перистальтическую активность тонкой и толстой кишки за счет холиномиметического действия;
— оказывает противорвотный эффект, которой реализуется благодаря взаимодействию с D2-допаминовыми хеморецепторами триггерной зоны;
— не вызывает побочных нежелательных эффектов, присущих прокинетикам, гинекомастии, повышения уровня пролактина и удлинения интервала Q–T на электрокардиограмме.
Итоприд следует рассматривать как идеальный прокинетик, так как этот препарат, единственный из всех существующих классов прокинетических средств, стимулирует контрактильную активность всего пищеварительного тракта (от желудка до кишечника) и обладает максимальной прокинетической активностью среди других прокинетиков.
Проведенные двойные слепые рандомизированные сравнительные исследования в Европе и России показали достоверные преимущества в отношении эффективности и безопасности итоприда гидрохлорида перед цизапридом, метоклопрамидом, мосапридом и домперидоном.
Праймер назначают внутрь по 1 таблетке (50 мг) 3 раза в сутки независимо от приема пищи, суточная доза составляет 150 мг.
В исследовании И.Ю. Пирогова (2010) назначение итоприда в качестве прокинетика в составе комплексной терапии позволило достичь регресса клинической симптоматики при явлениях желудочной и кишечной диспепсии, связанной с нарушением моторики пищевода, желудка и двенадцатиперстной кишки. В данном исследовании в качестве второй исследуемой группы были выбраны пациенты с явлениями дуоденостаза, у которых полное отсутствие жалоб после лечения итопридом наблюдалось в 66 % случаев и в 34 % — уменьшение клинической симптоматики.
Если нет возможности перорального приема, пациенту рекомендовано парентеральное введение прокинетиков (метоклопрамид по 2 мл (10 мг) внутримышечно 3 р/день — 3–4 недели). Такой препарат, как сульпирид (Эглонил), для этих целей назначают гораздо реже из-за выраженного центрального действия, чаще при необходимости использовать амбивалентность его свойств — прокинетика и нейролептика.
Прокинетики эффективны главным образом при функциональных формах синдрома ХДН. Если клинический эффект не достигнут в течение 7–10 дней, то прокинетики следует отменить и продолжить поиски истинной (вероятнее всего, механической) причины дуоденостаза.
Также можно назначить пациенту препарат тримебутин, который способен купировать болевой синдром и в какой-то степени восстановить моторику ДПК. Он модулирует высвобождение желудочно-кишечных пептидов, оказывает позитивный эффект как при гипомоторной, так и при гипермоторной дисфункции желчного пузыря. Препарат назначают в дозе 200 мг 3 раза в день за 30 минут до еды в течение 28 дней.
Среди миотропных спазмолитиков заслуживает внимания мебеверина гидрохлорид, который в 20–40 раз превышает эффект папаверина. С целью нормализации нарушенной двигательно-эвакуаторной функции желудка и ДПК дуспаталин может использоваться в комплексной терапии ХДН. Препарат назначают по 1 капс. (200 мг) 2 раза в день за 15 мин до еды на протяжении 3–4 недель.
Определенную симптоматическую помощь оказывают невсасывающиеся антациды (Фосфалюгель, Альмагель), способные абсорбировать компоненты желчи, попадающие в желудок. Принимают препараты этой группы через 30–40 мин после еды по 1 пакету 3 раза в день и на ночь на протяжении 2–3 недель.
Инфицирование содержимого ДПК при синдроме ХДН может иметь серьезные последствия из-за возможности проникновения инфекции через несостоятельный сфинктер Одди в панкреатический проток и желчные пути и реальной опасности возникновения панкреатита, холецистита, холангита. С целью подавления бактериальной инфекции назначают курсы антибактериальных средств (полусинтетические пенициллины, макролиды, нитрофураны, нитроимидазолы).
При нарушениях микробиоценоза кишечника назначают пробиотики и пребиотики.
Для коррекции процессов нарушенного пищеварения используют полиферментные средства.
Панкреатические ферменты (Креон) ускоряют переваривание пищи в ДПК, приводят к снижению внутридуоденального содержимого, вследствие чего облегчается опорожнение желудка, снимается давление в желчевыводящих и панкреатических протоках.
Доза панкреатического фермента подбирается индивидуально. В большинстве случаев для коррекции нарушенного полостного пищеварения в ДПК у пациентов с хроническим дуоденитом, сопровождающимся вторичной недостаточностью поджелудочной железы, достаточно приема 3 капсул Креона 10 000 в сутки во время еды. При тяжелой экзокринной недостаточности поджелудочной железы Креон назначают в минимальной дозе 25 000–40 000 единиц липазы во время еды.
Показано назначение ингибиторов протонной помпы для профилактики эрозивно-язвенных повреждений гастродуоденальной слизистой, устранения симптомов эзофагита (при дуоденогастроэзофагеальных рефлюксах, обусловленных нарушением гастродуоденальной моторики).
С целью дренирования ДПК используют лечебные дуоденальные зондирования (4–5 на курс через день) без стимуляторов желчевыделения (можно спровоцировать выраженный болевой синдром).
Для стимуляции моторно-эвакуаторной функции ДПК используют физиотерапевтические методы: транскутанную электроимпульсную стимуляцию синусоидальными модулирующими токами низкой частоты; зондовую электростимуляцию моторики ДПК; диадинамические токи; электростимулирующее воздействие на ДПК с помощью специальных электростимуляторов.
При соматизированной депрессии основной группой лекарственных средств являются психотропные препараты, антидепрессанты и нейролептики.
Результаты изучения качества жизни пациентов после комплексного курсового лечения свидетельствуют об улучшении таких параметров, как физическое самочувствие и работоспособность.
Таким образом, коррекция моторно-эвакуаторных нарушений ДПК требует системного и тщательного индивидуализированного подхода к лечению.
Важным условием для эффективной терапии данной патологии является своевременная диагностика дуоденостаза.
Выводы
1. Синдром ХДН имеет хроническое прогрессирующее течение и способен выступать в роли ведущего патогенетического фактора в развитии многих заболеваний желудочно-кишечного тракта.
2. Клиническая картина ХДН зависит от стадии и причин развития, давности и течения заболевания.
3. Препаратом выбора для коррекции моторно-эвакуаторных нарушений ДПК при функциональных формах ХДН является универсальный прокинетик комплексного действия итоприда гидрохлорид (Праймер).
1. Бабак О.Я., Можина Т.Л. Прокінетичні препарати (від метоклопраміду до ітоприду) у клінічній практиці // Сучасна гастроентерол. — 2008. — № 5. — С. 4-11.
2. Звягинцева Т.Д., Мирзоева Л.А., Шаргород И.И. Хроническая дуоденальная непроходимость: Учебное пособие. — Харьков, 2006. — 42 с.
4. Шептулин А.А. Нарушения двигательной функции желудка и современные возможности их патогенетической терапии // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2007. — № 5. — С. 49-54.
5. Пирогова И.Ю., Бастриков О.Ю. Применение Ганатона при желудочной и кишечной диспепсии // Рос. журн. гастроэнтерол., гепатологии, колопроктологии. — 2010. — № 5, т. XX, прил. № 36.
Дуоденальная непроходимость и хирургические методы её лечения
Хроническая дуоденальная непроходимость – не является отдельным заболеванием, это комплекс различных симптомов, которые вызваны различными причинами. При этом причины могут быть как органического характера (какое-либо препятствие: образование), так и функционального характера (спазм стенок).
При развитии хронической дуоденальной непроходимости пищевой комок не может двигаться в другие отделы желудочно-кишечного тракта и остается в двенадцатиперстной кишке.
Существует несколько теорий возникновения данной патологии. Наиболее часто рассматривают анатомо-механическую теорию. Вокруг двенадцатиперстной кишки расположены различные сосуды: артерии и вены. Верхняя брыжеечная артерия окружает нижнюю часть двенадцатиперстной кишки и в некоторых случаях может ее сжимать, что приводит к расширению верхне-лежащих отделов. Кроме того, причиной нарушения проходимости может быть аномальное расположение петли тощей кишки. Так же, поражение блуждающего нерва вследствие прошедших операций может нарушить моторику двенадцатиперстной кишки.
Поми мо анатомической теории существует рефлекторная теория дуоденальной непроходимости за счет постоянных импульсов, которые приводят к реактивным и дегенеративным изменениям в нервном аппарате двенадцатиперстной кишки. Если патологические процессы происходят длительное время, то компенсаторные запасы кишки заканчиваются, и может возникнуть ее полная атония, когда кишка не способна сокращаться.
Существует большое количество различных классификаций дуоденальной непроходимости. Обычно выделяют 4: две функциональных формы – у больных с психической патологией и как результат длительного соматического заболевания, а также две механических формы – при врожденной аномалии и вследствие осложнений соматического заболевания.
Причин для развития дуоденальной непроходимости большое количество, поэтому их принято разделять на несколько подгрупп.
— Причины вне двенадцатиперстной кишки: за счет сдавления сосудами, опухолями и кистами.
— Процессы в самой двенадцатиперстной кишке: опухоли, дивертикулы, болезнь Крона, воспалительные изменения.
— Обтурация просвета инородным телом, паразитами.
— Процессы, которые развиваются после операций в области желудочно-кишечного тракта.
Болезнь может проявить себя не сразу. Если патологические процессы длятся достаточно долго, это может проявляться болями в животе, головными болями, отрыжкой, вздутием живота, рвотой и другими проявлениями.
Хроническая дуоденальная непроходимость может протекать в трех стадиях: компенсированной, субкомпенсированной и декомпенсированной. Для постановки диагноза обычно проводят рентгенологическое исследование органов брюшной полости, где видно усиление перистальтики, увеличение стенки двенадцатиперстной кишки. Кроме того, может наблюдаться задержка контрастного вещества.
Лечение данной патологии является комплексным. Пациент должен соблюдать определенную диету. После стабилизации состояния организма, а также при неэффективности консервативного лечения пациенту проводится хирургическое лечение хронической дуоденальной непроходимости.
Выделяют большое количество различных хирургических методов лечения хронической дуоденальной непроходимости. Принципиально определяют две группы операций: дренирование кишки и исключение кишки из процесса пищеварения.
В первом случае наиболее распространенная операция – операция Стронга. При этой операции происходит рассечение связки Трейтца, что приводит к освобождению двенадцатиперстной кишки. Кроме того, при данной операции выполняют одновременно дуоденоэнтеростомию. Это операция, которая заключается в формировании соединения между двенадцатиперстной кишкой и другим отделом тонкой кишки. При этом дуоденоэнтеростомия имеет множество модификаций. Наилучшие результаты были достигнуты при выполнении операции Грегори-Смирнова и операции Витебского. Из второй группы операции наиболее положительные результаты достигаются при антрумэктомии с наложением гастроэнтероанастомоза. Объем операции определяется сопутствующей патологией, были ли язвы в анамнезе, а также какая часть кишки еще работает.
Хроническая дуоденальная непроходимость является тяжелым заболеванием, которое на ранних сроках требует комплексного лечения, а в случае его неэффективности, производят оперативное вмешательство различного объема.
Для успешного лечения этой сложной патологии требуется точное определение причины, то есть точная диагностика , и высокой квалификации хирург. В клиниках Мюнхена работают ведущие специалисты по лечению данного заболевания, которые обладают большим опытом в лечении хронической дуоденальной непроходимости, в частности, хирургическими методами.
Лечение дуоденальной непроходимости в Израиле
Гастроэнтерологи медицинского центра Топ Ихилов оказывают квалифицированную и оперативную помощь пациентам, страдающим синдромом дуоденальной непроходимости и любым другим расстройством двенадцатиперстной кишки. При этом в клинике применяются самые современные методы диагностики и лечения, доступные только крупным медицинским учреждениям США, Европы и Израиля.
Лечение ХНДП в Израиле
Функциональные формы заболевания лечатся консервативно. Используются:
- Диетотерапия, включающая дробное частое питание, с исключением острой, жареной, жирной и тяжелой пищи, алкоголя, наваристых бульонов и острых приправ;
- Физиотерапия: амплипульс на эпигастральную область, стимуляция кишечника, КВЧ, ультразвук;
- При необходимости медикаментозная терапия (ферменты, противорвотные, пробиотики и т.д.);
- Лечебная гимнастика;
- Психотерапия.
Механические формы лечатся оперативным путем – устраняются препятствия для нормального продвижения кишечного содержимого по двенадцатиперстной кишке.
Диагностика ХНДП в клинике Топ Ихилов
Синдром может проявляться в двух функциональных формах: первичной и вторичной. К возникновению первичной формы приводит нарушение моторики двенадцатиперстной кишки, которое может провоцироваться сбоем контролирующей функции нервной и эндокринной системы, а также поломкой миогенного механизма регуляции непосредственно в мышечной стенке самой кишки, в результате чего миоциты перестают реагировать на растяжение сокращением, как это происходит в норме.
Вторичная форма является осложнением хронически протекающих заболеваний зоны, объединяющей двенадцатиперстную кишку, желчевыводящую систему и поджелудочную железу. К этим заболеваниям относятся:
- Язвенная болезнь;
- Холецистит;
- Панкреатит.
Хроническое нарушение дуоденальной проходимости (ХНДП) – это комплекс следующих клинических симптомов:
- Повышенного давления в двенадцатиперстной кишке;
- Снижения скорости продвижения пищевого комка;
- Задержки транспортировки химуса из двенадцатиперстной кишки в тонкую.
Диагноз ХНДП выставляется на основе жалоб больного, сбора анамнеза, объективного осмотра, результатов клинических анализов и инструментальных методов исследования.
Пациент может предъявлять следующие жалобы:
- Чувство тяжести в желудке, усиливающиеся после приема пищи;
- Постоянные тупые боли в эпигастрии;
- Отрыжка съеденной пищей, тухлым;
- Рвота;
- Изжога;
- Запоры.
При объективном осмотре могут быть отмечены болезненность по ходу кишечника, вздутие живота.
В качестве инструментальных методов обследования используются:
- ФГДС (фиброгастродуоденоскопия);
- УЗИ органов брюшной полости и расположенной в забрюшинном пространстве клетчатки;
- Дуоденография, как релаксационная зондовая с двойным контрастированием, так и беззондовая;
- Дуоденокинезиография – регистрация частоты и силы мышечных сокращений двенадцатиперстной кишки с применением баллонокимографического метода;
- Измерение давления внутри дуоденальной полости (последовательная поэтажная манометрия).
Получить цены в клинике
- 5
- 4
- 3
- 2
- 1
Вниманию пациентов. Важно! Израиль открывает небо. Пациенты с неотложными заболеваниями могут записаться на прием к врачу. Успейте забронировать раннюю дату!
Узнайте стоимость лечения у официального представителя клиники! Оставьте свои контактные данные в форме ниже.
Дуоденальная непроходимость
Эта аномалия является вторым наиболее распространенным типом атрезии желудочно-кишечного (ЖК) тракта. Расчетная частота составляет 1 на 5000─10 000 живорожденных. Атрезия двенадцатиперстной кишки обусловлена нарушением формирования канала двенадцатиперстной кишки у эмбриона. Это расстройство может быть связано с ишемическим событием или генетическими факторами.
Дуоденальная атрезия, в отличие от других кишечных атрезий, обычно ассоциируется с другими врожденными аномалиями, такими как синдром Дауна Синдром Дауна (трисомия 21) Синдром Дауна является аномалией 21-й хромосомы, может проявляться нарушением умственного развития, микроцефалией, небольшим ростом и характерным внешним видом. Диагноз предполагают на основании. Прочитайте дополнительные сведения Vertebral anomalies, Anal аtresia, Cardiovascular malformations, Tracheoesophageal fistula, Esophageal atresia, Renal anomalies, Radial aplasia, Limb anomalies – аномалии позвоночника, атрезия ануса, пороки сердца, трахеопищеводный свищ с атрезией пищевода, аномалии почек, гипоплазия лучевой кости, дефекты конечностей), незавершенный поворот кишечника Мальротация кишечника Мальротация кишечника – аномалия развития кишечника, заключающаяся в неспособности кишечника занять свое нормальное место в брюшной полости во время внутриутробного развития. Диагноз устанавливают. Прочитайте дополнительные сведения , аномалии билиарного тракта и челюстно-лицевые аномалии Обзор врожденных черепно-лицевых аномалий (Overview of Congenital Craniofacial Abnormalities) Врожденные черепно-лицевые аномалии — это группа дефектов, вызванных аномальным ростом и/или развитием мягкотканных структур и/или костей головы и лица. (См.также Введение во врожденные черепно-лицевые. Прочитайте дополнительные сведения .
Диагноз дуоденанльной атрезии может быть заподозрен пренатально при выявлении многоводия и/или расширении кишечника. Пренатальная ультрасонография может обнаружить два газовых пузыря примерно в 50% случаев.
После рождения у детей с атрезией двенадцатиперстной кишки наблюдается многоводие, сложности с кормлением и рвота, возможно, желчью. Диагноз предполагается на основании выявленных симптомов и классического двойного пузыря на рентгенограмме: один пузырь находится в желудке, а другой в проксимальной части двенадцатиперстной кишки; в дистальных отделах кишечника воздух практически отсутствует. Снимки верхних участков желудочно-кишечного тракта позволяют поставить окончательный диагноз, но их должен проводить рентгенолог, у которого есть опыт выполнения данной процедуры у детей, чтобы избежать аспирации. К тому же, данное исследование зачастую не является первостепенным, если нужна срочная операция. Если же операция откладывается (например, потому, что в коррекции нуждаются другие медицинские проблемы, такие как респираторный дистресс-синдром), стоит провести ирригографию для подтверждения, что эффект «двойного пузыря» не связан с мальротацией. При подозрении на это расстройство детям ничего не вводят через рот и устанавливают назогастральный зонд для декомпрессии желудка.
Хирургическое лечение является завершающим этапом терапии.
Стеноз двенадцатиперстной кишки
Эта аномалия встречается реже, чем атрезия двенадцатиперстной кишки, но имеет сходные проявления и требует хирургического вмешательства. Данная патология тоже часто бывает ассоциирована с синдромом Дауна.
Киста общего желчного протока
У детей с кистой общего желчного протока в классическом случае выявляют триаду симптомов: абдоминальную боль (очень тяжело выявить у новорожденных), выбухание правого верхнего квадранта живота и желтуху. Если киста большая, она может также проявляться дуоденальной обструкцией различной степени. У новорожденных может быть холестаз.
Кисту общего желчного протока чаще всего диагностируют с помощью УЗИ. В дальнейшем эти кисты могут быть распознаны при помощи магнитно-резонансной холангиопанкреатографии, эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) или эндоскопического ультразвукового исследования.
Лечение кисты общего жёлчного протока хирургическое и требует полного иссечения кисты по причине высокого риска (20–30%) развития рака из остатков кисты. Наиболее часто проводимой хирургической операцией является гепатикоеюностомия по Ру. Эту процедуру обычно проводят лапароскопически. В некоторых недавних исследованиях отмечается, что результат может быть улучшен с помощью роботизированной хирургии.
Кольцевидная поджелудочная железа
Кольцевидная поджелудочная железа является редкой врожденной аномалией (5–15 случаев на 100 000 живорожденных), часто сопутствующая синдрому Дауна, при которой ткани поджелудочной железы окружают нисходящий отдел двенадцатиперстной кишки, вызывая дуоденальную непроходимость.
Примерно у двух третей страдающих людей протекает бессимптомно. У тех, у кого симптомы развиваются, они преимущественно проявляются в неонатальном периоде, но их обнаружение может быть отсрочено до взрослого периода жизни. Новорожденные рождаются при многоводных родах, у них наблюдаются проблемы при кормлении, а рвота может быть с желью.
На диагноз кольцевидная поджелудочная железа может указывать рентгенограмма брюшной полости, на которой виден такой же эффект двойного пузыря, что и при атрезии двенадцатиперстной кишки. Диагноз может быть заподозрен на основании данных серии снимков верхнего отдела желудочно-кишечного тракта и поставлен при помощи КТ или магниторезонансной холангиопанкреатографии. Детям старшего возраста можно провести ЭРХП.
Лечение кольцевидной поджелудочной железы проводят хирургическим путем: выполняют шунтирование кольцевидной поджелудочной железы с дуоденодуоденостомией, дуоденоеюностомией или гастроеюностомией. Резекции поджелудочной железы нужно избегать из-за возможных осложнений в виде панкреатита и развития свища поджелудочной железы.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Дуоденальная непроходимость
Хроническая дуоденальная непроходимость (ХДН) — клинический симптомокомплекс, обусловленный нарушением моторной и эвакуаторной деятельности двенадцатиперстной кишки (ДПК) различной этиологии и приводящий к задержке (стазу) ее содержимого [3]. Общепризнанной классификации ХДН не создано. Однако этиологические факторы можно условно разделить на две группы — органические и функциональные. Среди последних выделяют первичные и вторичные формы ХДН, возникающие в связи с другими (первичными) заболеваниями органов дуоденохоледохопанкреатической зоны.
Вместе с тем многие исследователи отмечают, что зачастую весьма сложно провести четкую грань между механической и функциональной ХДН вследствие развития порочного круга при первичном механическом или функциональном поражении ДПК. Наиболее изучена и систематизирована этиология органических форм ХДН, так как их по сравнению с функциональными легче диагностировать и они в значительном числе наблюдений требуют хирургического лечения [2, 9, 11, 14].
Механическую форму ХДН разделяют на врожденную и приобретенную. У детей чаще встречаются врожденные заболевания ДПК (мембрана, стеноз), кольцевидная поджелудочная железа и др. [12, 19, 23, 24]. Среди механических причин, вызывающих нарушения моторно-эвакуаторной деятельности ДПК, одно из ведущих мест занимает артериомезентериальная компрессия [10, 13, 20, 25]. Долгое время считали, что у детей это заболевание не встречается. В 80-х годах XX века многие авторы при целенаправленном обследовании детей с постоянными жалобами на боли в верхнем квадранте живота обнаруживали патологические изменения органов гастродуоденальной зоны, причем у части из них эти изменения имели органический характер и выражались в нарушении положения, формы и функции ДПК. Анатомическим субстратом подобного синдрома является образование более острого, чем в норме, угла между аортой и верхней брыжеечной артерией (меньше 45—60°). Дети с подобным синдромом обычно имеют астеническое телосложение, у них выявляется острый эпигастральный угол. Этот синдром почти в 80% наблюдений проявляется у детей старшего возраста (старше 7 лет) [5].
ХДН сама может являться причиной заболеваний органов желудочно-кишечного тракта. Исследования последних лет показали, что нарушения пассажа по ДПК и повышение давления в ней отрицательно влияют на нейтрализующую способность проксимального отдела кишки и могут привести к развитию рефлюкс-гастрита, язвы желудка, панкреатита, желчнокаменной болезни [1, 4, 6, 8, 10].
Ввиду этого необходимо максимально полное обследование больных при подозрении на ХДН. Клиническая картина ХДН разнообразна и зависит от стадии заболевания и причин ее развития. Основными симптомами являются боль, тошнота, рвота. Больные жалуются на дискомфорт, тяжесть в эпигастральной области и правом подреберье после приема пищи.
Для обследования больных с явлениями механической ХДН используют ультразвуковое исследование (УЗИ), рентгеноконтрастное исследование пассажа по желудочно-кишечному тракту, компьютерную томографию (КТ) органов брюшной полости, фиброгастродуоденоскопию (ФГДС) [8, 10, 11, 15, 26].
В настоящее время необходимость оперативного лечения при механической форме ХДН не вызывает сомнений. Основными целями оперативного лечения ХДН должны стать ликвидация застоя содержимого и желчи в ДПК [7]. Операции, применяемые в хирургическом лечении больных с ХДН, условно разделяются на две большие группы: 1) операции с сохранением пассажа пищи по ДПК; 2) операции с выключением ДПК из пассажа пищи. Операции первой группы направлены на дренирование ДПК путем наложения анастомозов или рассечения спаек и связочного аппарата кишки. Операции второй группы в основном комбинированные и сочетают элементы различных методик, но основной их принцип заключается в выключении ДПК из пассажа пищи.
Из арсенала операций, сохраняющих пассаж по ДПК, одной из первых была дуоденоеюностомия, предложенная Albrecht в 1888 г. и впервые выполненная Stavley в 1908 г. Довольно продолжительное время это вмешательство многие хирурги определяли как операцию выбора при ХДН. В настоящее время такая операция нашла широкое применение и стало возможным ее лапароскопическое проведение [16, 17, 18, 21]. В детской хирургии широкое применение нашло использование петли по Ру [22].
Материал и методы
C 2012 по 2013 г. в ДГКБ № 13 им. Н.Ф. Филатова находились под наблюдением 5 детей с явлениями ХДН: 3 мальчика в возрасте 2, 11 и 12 лет (мальчик 11 лет с синдромом Дауна) и 2 девочки в возрасте 15 и 17 лет (девочке 17 лет в 2009 г. выполнена лапароскопическая кардиомиотомия по поводу ахалазии пищевода).
Все дети предъявляли жалобы на периодические боли в животе, вздутие живота, тошноту, рвоту после приема пищи, снижение аппетита. Девочки были астенического телосложения и пониженного питания. У мальчиков был выражен «шум плеска» после еды. У больных отмечались диспепсические явления: отрыжка воздухом или пищей с горьким вкусом, изжога, урчание и переливание в кишках. У 2 детей отмечалась склонность к запорам. Перечисленные симптомы сопровождались общей слабостью, быстрой утомляемостью, снижением трудоспособности, снижением массы тела, бессонницей, иногда субфебрильной температурой тела.
Учитывая разнообразную этиологию ХДН, использовали комплексное обследование: УЗИ, ФГДС, рентгеноконтрастное исследование.
При проведении УЗИ брюшной полости у всех больных выявлено расширение ДПК.
По результатам ФГДС у детей выявлены нарушение проходимости ДПК, гастрит и дуоденогастральный рефлюкс. У мальчиков обнаружено сужение (стеноз) ДПК в нисходящей части.
При выполнении рентгенологического исследования желудочно-кишечного тракта с контрастным веществом определялись расширение ДПК, задержка эвакуации контрастного вещества, маятникообразное движение стенки ДПК и заброс контрастного вещества в желудок (рис. 1).
Рис. 1. Рентгенограмма больного 12 лет. Расширенные ДПК и желудка (снимок через 6 ч после приема контрастного вещества).
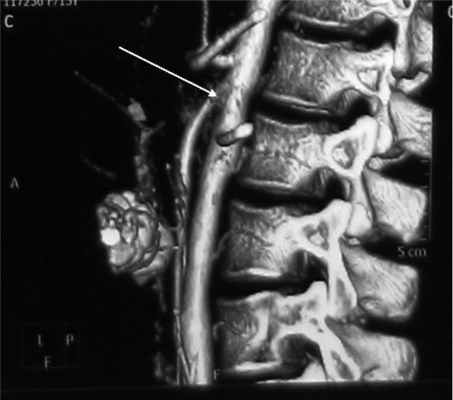
У мальчиков, проходивших это исследование, выявлено значительное расширение не только ДПК, но и желудка. Ввиду этого мы посчитали ясной причину ХДН и от проведения КТ брюшной полости у мальчиков решили воздержаться. У девочек при КТ по совокупности признаков определялась артериомезентериальная компрессия ДПК (рис. 2).
Рис. 2. Компьютерная томограмма больной М., 15 лет. Артериомезентериальная «вилка» (указана стрелкой).
Учитывая наличие механической формы ХДН, детям выполнили лапароскопическое наложение дуоденоеюноанастомоза.
Методика лапароскопического наложения дуоденоеюноанастомоза
При проведении оперативного лечения 1 ребенку выполнена дуоденоеюностомия бок в бок (рис. 3), 4 — дуоденоеюностомия на петле по Ру (рис. 4).
Рис. 3. Схема дуоденоеюноанастомоза бок в бок.
Рис. 4. Схема дуоденоеюностомии на петле по Ру.
Для проведения оперативного вмешательства мы использовали 4 троакара: 1 диаметром 10 мм для оптики устанавливали в параумбиликальной области и 3 диаметром 5 мм для рабочих инструментов — параректально (2) и в эпигастральной области (1).
Первым этапом операции производили мобилизацию ДПК по Кохеру. У мальчиков в нисходящей части ДПК отчетливо визуализировалось место стеноза, после которого располагалась нерасширенная часть ДПК. Следующим этапом операции на расстоянии 25 см от связки Трейтца пересекали петлю тощей кишки для формирования петли по Ру и через сформированное «окно» в брыжейке толстой кишки тощую кишку подводили к ДПК. В одном наблюдении (у мальчика 11 лет) тощую кишку не пересекали, на расстоянии 25 см от связки Трейтца брали петлю кишки и подводили к ДПК для наложения анастомоза бок в бок. При формировании этого вида анастомоза ДПК вскрывали более широко, чем при использовании петли по Ру. У мальчиков по вскрытии просвета ДПК отмечали значительное количество застойного содержимого, в том числе имелись безоары.
При наложении анастомоза мы использовали нити PDS 5/0 и накладывали однорядные швы. В 4 наблюдениях анастомоз наложен узловыми швами и в 1 наблюдении шов был непрерывным.
Интраоперационных осложнений не было, длительность операции варьировала от 90 до 180 мин.
Результаты и обсуждение
После проведения оперативного вмешательства дети находились в отделении реанимации и интенсивной терапии в течение 4 сут, энтеральную нагрузку начинали с 5-х суток. Дети получали парентеральное питание, инфузионную и антибактериальную терапию и были выписаны из стационара на 10—12-е сутки в удовлетворительном состоянии.
Через 6 мес после операции детей госпитализировали для планового обследования. Их состояние было удовлетворительным, жалоб они не предъявляли. Рентгеноконтрастное исследование желудочно-кишечного тракта: пассаж контрастного вещества удовлетворительный, маятникообразные движения не определяются, однако у ребенка 11 лет с синдромом Дауна сохраняется расширение ДПК. Стоит отметить отличный косметический результат после такого сложного оперативного вмешательства (рис. 5).
Рис. 5. Внешний вид передней брюшной стенки через 6 мес после операции.
Таким образом, хроническая дуоденальная непроходимость (ХДН) у детей встречается довольно редко, при диагностике заболевания необходимо уделять внимание клинической картине, которая может быть разнообразной. Несомненна важность всестороннего клинико-инструментального обследования больных с явлениями хронического дуоденостаза для выяснения причины ХДН, ее стадии, наличия патогенетически связанных с ХДН заболеваний. Результаты обследования влияют на выбор оптимальной лечебной тактики у этого контингента больных. Стоит отметить, что при ХДН отсутствует патогномоничная симптоматика, поэтому необходимо проявлять особую настороженность в отношении возможного наличия хронического дуоденостаза. Особенно это касается больных с длительно существующими диспепсическими явлениями, абдоминальными болями, которые имеют наибольшую значимость при наличии ХДН. Основным методом диагностики этого заболевания является рентгеноконтрастное исследование желудочно-кишечного тракта в динамике или рентгеноскопия, при которых достоверно определяется маятникообразное движение контрастного вещества при артериомезентериальной непроходимости.
Выбор характера операции при хронической непроходимости двенадцатиперстной кишки должен быть индивидуальным и строго обоснованным формой заболевания. Механическая форма ХДН требует оперативного лечения. Ввиду развития миниинвазивных технологий операцию целесообразно проводить лапароскопическим способом, что сопровождается хорошими функциональными результатами, благоприятным течением послеоперационного периода и ранней активизацией больных. Способ наложения дуоденоеюноанастомоза зависит от решения хирурга, но, по нашему мнению, более физиологичен анастомоз с использованием петли по Ру.
Читайте также:
- Эозинофилия
- Лимфоциты. Кровяные пластинки. Лимфа.
- Инфекции клебсиелла,энтеробактера и серратии
- Злокачественные кортикостеромы. Андростерома
- Хондромаляция коленной чашечки