Organic chemicals such as alcohol, phenol, and ether are extensively employed in both domestic and industrial settings. Perfumes, sanitizers, and fuels are all examples of these goods, which are used in a number of ways in our daily lives.
What are Ethers?
Ethers are a form of an organic molecule in which a single oxygen atom connects two hydrocarbon groups (alkyl or aryl). It is represented using the R-O-R′ formula.
In the formula, R′, the hydrocarbon group could be the same as or different from R.
Ethers are generated when the hydrogen atom of the hydroxyl group in alcohols is replaced by an alkyl or aryl group.
For example-
The oxygen and carbon in the C-O-C bond are sp3 hybridized. The repulsion of two lone pairs (lp) on the oxygen atom causes the bending form. The presence of bulky groups at both ends of the oxygen atom, as well as the bp-bp repulsion resulting in a C-O-C bond angle of around 111.7, produce a steric barrier.
Classification of Ethers
Ethers are divided into two types based on the groups at R and R’:
- Simple ethers or symmetrical ethers: These ethers have the same alkyl group on both ends of the oxygen atom. For example,
- Mixed ethers or asymmetrical ethers: These ethers are made up of different alkyl groups on both ends of the oxygen atom. For example,
Ethyl Methyl Ether
Methyl Phenyl Ether
Physical Properties of Ethers
The physical characteristics of ethers are as follows:
- Physical State: Other ingredients are odourless volatile liquids, while methoxy methane and methoxy ethane are gases. Lower homologues include colourless, pleasant-smelling, volatile liquids having a characteristic ether odour.
- Polar Nature of Ether: Ethers have a polar character. The difference in electronegativity between the oxygen and carbon atoms is the reason behind this. The oxygen atom pushes the shared pair of electrons closer to itself due to the electronegativity difference, resulting in a partial negative charge on the oxygen atom and a partial positive charge on the carbon atom. Two polar C–O bonds in the ether are inclined at an angle of 111.7 degrees to one another. As a result, the two dipoles do not cancel out, resulting in a net dipole moment. i.e., in ether, the dipole moment (μ) ≠ 0. Ethers are more polar than alkenes but not as polar as alcohols, esters, or amides with similar structures.
- Hydrogen Bonding of Ether: The hydrogen atom is not directly bound to the oxygen atom in ethers. As a result, ethers contain no hydrogen bonds between molecules. Ethers, on the other hand, are only used to accept hydrogen bonds. Hydrogen bonding with water molecules is feasible because oxygen atoms have two lone pairs of electrons.
When compared to linear aliphatic ethers, cyclic ethers such as tetrahydrofuran and 1,4-dioxane are miscible in water due to the more exposed oxygen atom for hydrogen bonding.
- Boiling Point of Ether: Because ethers do not establish intramolecular hydrogen bonds, their boiling temperature is lower than that of isomeric alcohols, but it is closer to that of alkanes of the same mass. Even though both have the same chemical formula C2H6O, the boiling point of methoxy methane (CH3OCH3) is lower than that of ethanol (CH3CH2OH).
- Solubility of Ether: Ethers with up to three carbon atoms are miscible in water. This is because lesser ethers have an easier time forming hydrogen bonds with water molecules. Ethers are made up of two types of molecules: the nonpolar hydrophobic hydrocarbon chain and the polar hydrophilic oxygen end. The solubility of ether in water decreases as the size of the alkyl group increases. This is owing to the hydrocarbon component’s non-polar nature, which inhibits hydrogen bonds with the polar water molecules from forming. Organic solvents such as alcohols, benzene, and acetone are relatively soluble in ethers. Diethyl ether and n-butyl alcohol, for example, are water-soluble to a similar extent. Because ether forms a hydrogen connection with water in the same way as alcohol does.
- Acidity: Water, ethers, and alcohols all have similar oxygen bonds. Because oxygen is more electronegative than carbon, the hydrogens alpha to ethers in simple hydrocarbons is more acidic. They are far less acidic than the alpha to carbonyl groups of hydrogen (such as in ketones or aldehydes).
- Ethers are lighter than water.
Chemical Properties of Ethers
- Ethers are colorless, sweet-smelling, extremely volatile, and combustible liquids. Ethers are only sparsely soluble in water due to H-bonding and hydrophobic alkyl or aryl groups.
- Within themselves, ethers do not have hydrogen bonds. As a result, their boiling points are significantly lower than the boiling points of equivalent alcohols.
- Diethyl ether vapors are employed as an anesthetic because they produce unconsciousness when inhaled.
- Because ethers have a C–O–C bond angle of around 110∘, the dipole moments of two C–O bonds do not cancel out. As a result, ethers are polar, but their polarity is weak (for diethyl ether =1.18D).
- The reactivity of ethers is lower than that of complex functional groups. Active metals, strong bases, and reducing and oxidizing agents have no effect on them. The presence of an alkyl group, a lone pair of electrons on the oxygen atom, and the breakage of the C–O bond give ethers their chemical characteristics.
Reactions Due to Alkyl Group
- Combustion: Ethers are extremely combustible, and when they come into contact with air, they form carbon dioxide and water.
C2H5OC2H5 + 6O2 → 4CO2 + 5H2O
- Halogenation: The alkyl group of ether undergoes a substitution process with chlorine or bromine in the absence of sunlight, resulting in a-halogenated ethers.
All of the hydrogen atoms in ethers are substituted in the presence of sunlight.
Reaction Due to Ethereal Oxygen
- Peroxide Formation: When ether comes into touch with atmospheric oxygen in the presence of sunlight, it interacts with oxygen to generate ether peroxide due to the presence of a lone pair of electrons on the ethereal oxygen. When heated, ether peroxide is highly unstable and explodes violently, causing serious accidents. As a result, boiling an ether sample that has been held for a long time is dangerous.
- Formation of Oxonium Salts: Because ethers can act as weak Lewis bases, they can create oxonium salts when dissolved in cold, strong mineral acids like hydrochloric or sulphuric acid.
Reactions in Aromatic Ethers
- Halogenation: In the benzene ring, phenyl alkyl ethers undergo normal halogenation. Even in the absence of an iron (III) bromide catalyst, anisole conducts bromination with bromine in ethanoic acid. The methoxy group activates the benzene ring, resulting in this reaction. The para isomer is obtained as the main product 90% of the time.
- Friedel-Crafts Reaction: The Friedel-Crafts process includes adding alkyl and acyl groups at ortho and para positions in anisole via reactions with an alkyl halide and an acyl halide in the presence of anhydrous aluminium chloride (a Lewis acid) as a catalyst.
- Nitration: Ortho and para nitro anisole are formed when anisole interacts with strong sulphuric and nitric acids.
Uses of Ethers
- Ether is a solvent for dissolving oil, resin, gasoline, gum, and other materials.
- Due to their practically inert nature and high dissolving power, they are also used as a reaction media for several procedures, such as the synthesis of Grignard reagent, the Wurtz reaction, and so on.
- It also serves as a local anesthetic.
- It’s also used to maintain a cool environment.
Sample Questions
Question 1: What is the classification of ether?
Answer:
Ethers are divided into two categories based on the presence of a hydrocarbon (aryl or alkyl) chain at both ends of the oxygen atom: simple or symmetrical ethers, and mixed or asymmetrical ethers.
- Simple or symmetrical ethers are created when the hydrocarbon (aryl or alkyl) chain present at both ends of the oxygen atom is the same. CH3OCH3 is an example.
- Mixed or asymmetrical ethers are created when the hydrocarbon (aryl or alkyl) chain present at both ends of the oxygen atom is different. -CH3OC2H5 is an example.
Question 2: Why are ethers soluble in water?
Answer:
Two alkyl groups (R–O–R′) are connected to the ends of an oxygen atom in ethers. Because of its high electronegativity, oxygen behaves as a hydrogen-bond acceptor and is soluble in water in the same way that alcohols are.
Question 3: How to convert alcohol into the ether?
Answer:
The production of ethers is caused by the acid catalysed dehydration of primary alcohols. A condensation reaction occurs when two molecules of primary alcohol combine to generate a bigger one while also freeing a tiny molecule of water.
Question 4: Why is ether stored in a bottle containing iron wire?
Answer:
When exposed to sunlight, ether reacts strongly with ambient oxygen, creating peroxide, which explodes when heated, resulting in a major accident.
When ether is held in a bottle with iron wire, oxygen reacts with the iron to generate iron oxide, which prevents ether from becoming peroxide. As a result, ether is stored in a container with iron wire inside.
Question 5: What is diethyl ether used for?
Answer:
- Oils, fats, gums, resins, polymers, and other similar compounds are mostly dissolved in it.
- It performs the function of a refrigerant.
- It is used as a general anaesthetic in surgery.
- Under the brand name Natalite, it is combined with alcohol and used as a fuel alternative.
Question 6: What are the physical properties of ethers?
Answer:
- In an ether molecule, there is a net dipole moment. This is due to the polarity of the C−O bond.
- Ether has a boiling point similar to that of alkanes.
- Ether is miscible with water in the same way as alcohol is.
- In water, ether molecules are miscible.
Question 7: What is Friedel-Crafts Reaction?
Answer:
The Friedel-Crafts procedure involves reacting an alkyl halide and an acyl halide in the presence of anhydrous aluminium chloride (a Lewis acid) to add alkyl and acyl groups at ortho and para positions in anisole.
Last Updated :
28 Apr, 2022
Like Article
Save Article
А это решение можно как то проверить на достоверность, как то перестраховаться?? Вывод т2 меня как то смущает, чтобы уж точно, другу решаю
А что там может смущать?
Можно прикинуть по правилу (не помню кого) — при снижении давления вдвое, температура кипения падает на 10 градусов.
T2 = T1 — 10*lg(P1/P2)/0.301
T2 = 34.5 — 10*lg(760/750)/0.301 = 34.3C
Приближение весьма грубое, ориентировочное.
Скачать полную таблицу температур кипения спиртов
|
Примесь |
Температура кипения, °С |
|
Уксусный альдегид |
20,8 |
|
Муравьиноэтиловый эфир |
54,15 |
|
Уксуснометиловый эфир |
56,0 |
|
Уксусноэтиловый эфир, Этиловый спирт Изопропиловый спирт |
77.05 |
|
Пропиловый спирт |
97,4 |
|
Вода |
100,0 |
|
Ацеталь |
102,9 |
|
Изобутиповый спирт |
108,4 |
|
Изомасляноэтиловый эфир |
110,1 |
|
Бутиловый спирт |
117,0 |
|
Масляноэтиловый эфир |
121,0 |
|
Оптически деятельный амиловый спирт |
128,0 |
|
Изоамиловый спирт |
132,0 |
|
Изовалерьяновый эфир |
134,3 |
|
Амиловый спирт |
137,0 |
|
Уксусноизоамиловый эфир |
137,6 |
|
Фурфурол |
162,0 |
|
Изовалерьяноизоамиловый эфир |
196,0 |
|
Номер фракции |
Название фракции |
Количество для отбора |
Показания для первых 100мл по термометру-спиртометру 223 |
По спиртометру при температуре 20Спервые 100мл |
Примерные показатели перехода на следующую фракцию для калиброванного термометра-спиртометра 223 для ПД-0.057 |
||||||
|
в% |
в мл. |
температура |
крепость |
||||||||
|
начало |
конец |
начало |
конец |
среднее |
температура |
крепость |
|||||
|
1 |
головы |
6,9 |
400 |
78,2 |
82,4 |
92,2 |
82,8 |
87,5 |
86,18 |
||
|
2 |
первое тело |
8,6 |
500 |
84,0 |
84,6 |
79,0 |
78,1 |
78,6 |
78,81 |
83,5 |
80 |
|
3 |
тело |
19,0 |
1100 |
85,7 |
86,2 |
75,5 |
74,5 |
75,0 |
75,48 |
87 |
75 |
|
4 |
ароматное тело |
5,2 |
300 |
91,4 |
92,1 |
60,1 |
57,2 |
58,7 |
59,00 |
91,7 |
60 |
|
5 |
тяжелое тело |
1,7 |
100 |
93,9 |
94,9 |
49,8 |
43,8 |
46,8 |
47,30 |
94,4 |
50 |
|
6 |
хвосты |
1,7 |
100 |
95,6 |
45 |
||||||
|
ИТОГО: |
2500 |
5800 мл. объем заливаемого в куб 30% спирта сырца
Петролейный эфир представляет собой бесцветную жидкость, добываемую 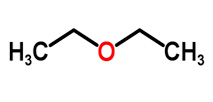
Петролейный эфир великолепно справляется с ролью растворителя смол, масел, жиров и прочих веществ. Является огнеопасным, а при смешении с воздухом образует взрывчатую смесь.
Температура кипения петролейного эфира составляет от 40 до 100 °С в зависимости от вида. Плотность же этого вещества, согласно ГОСТ 3900—47, колеблется в пределах от 0,650 до 0,695 г/куб.см. Срок хранения – 12 месяцев.
Виды
Петролейный эфир бывает двух видов – легкий и тяжелый. Легкий вид эфира образуется при нагреве от 40 до 70 °С, а тяжелый – при нагревании до температуры от 70 до 100 °С.
Сферы применения

— в качестве растворителя (элюента) в таком методе анализа смесей как жидкостная хроматография;
— как растворитель масел, а также жиров или смол;
— как топливо зажигалок и грелок;
— в процессе производства полиэтилена и каучука;
— в качестве экстрактора животных жиров в пищевой промышленности;
— для очистки шерсти в промышленных объемах.
Тяжелый вид данного химиката повсеместно применяется в нефтехимической, фармацевтической и косметологической промышленности. В металлургии и на трубопрокатном производстве он используется для обезжиривания не только поверхностей, но и целых деталей.
Несколько слов о правилах перевозки и хранения
Петролейный эфир, купить который в магазине «ПраймКемикалсГрупп» 
Транспортировка эфира петролейного, как и перевозка многих других химических реактивов, осуществляется исключительно в герметично закрытых резервуарах – канистрах, контейнерах или стеклянных емкостях. При этом емкость стеклянной тары в данном случае не должна превышать полутора литров. Выбор же резервуара для хранения или перевозки зависит лишь от объема петролейного эфира и удобства тары. В промышленных объемах это вещество транспортируется преимущественно в цистернах – по железным или автомобильным дорогам.
План урока:
Строение простых эфиров
Номенклатура простых и сложных эфиров
Изомерия простых и сложных эфиров
Классификация простых и сложных эфиров
Способы получения простых и сложных эфиров
Физические свойства простых и сложных эфиров
Химические свойства простых и сложных эфиров
Применение простых и сложных эфиров
Строение простых эфиров
Для атомов углерода насыщенных простых эфиров характерно состоянии sp3-гибридизации, а в ненасыщенных соединениях – sp2-гибридизации.
Строение молекулы диметилового эфира
Номенклатура эфиров
Если в простых эфирах R и R’ идентичны, то молекула симметрична, а если различны, то молекула несиметрична. Согласно международной номенклатуре названия простых эфиров формируются с помощью суффикса «-овый» и слова «эфир».
Например, симметричная молекула С2Н5-О-С2Н5 называется диэтиловым эфиром.
В несимметричной молекуле радикалы располагаются по алфавиту. Например, молекула СН3-О-С2Н5 называется метилэтиловым эфиром.
Согласно систематической номенклатуре в сложных эфирах в спиртовом радикале суффикс заменяется на «-оат». В названиях сложных эфиров присутствуют название кислотного аниона и спиртового радикала.
Строение сложных эфиров
Например, C2H5-C(O)O-CH3 – метилэтаноат. С2Н5-С(О)О-С2Н5 – этилэтаноат.
Название соединения в тривиальной номенклатуре формируется названием спиртового радикала, слова «эфир» и названием кислоты.
Например, C2H5-C(O)O-CH3 также можно назвать как метиловый эфир этановой кислоты, а С2Н5-С(О)О-С2Н5 — этиловый эфир этановой кислоты.
Изомерия эфиров
Изомерия простых эфиров
Изомерия сложных эфиров
Классификация эфиров
Виды простых эфиров
Простые эфиры классифицируются по строению углеводородного скелета.
Виды сложных эфиров
Сложные эфиры классифицируются на несколько видов.
- Сложные эфиры, образованные низшими карбоновыми кислотами и спиртами
С5Н11-С(О)О-СН3 – метиловый эфир пентановой кислоты
С2Н5-С(О)О-С3Н7 – пропиловый эфир этиловой кислоты
- Сложные эфиры, образованные высшими карбоновыми кислотами и спиртами
СН3-(СН2)14-С(О)О-(СН2)29-СН3 – мирициловый эфир пальмитиновой кислоты (один из компонентов пчелиного воска)
СН3-(СН2)14-С(О)О-(СН2)15-СН3 – цетиловый эфир пальмитиновой кислоты (основной компонент спермацета)
- Жиры
Жиры отличаются от других представителей класса тем, что они образованы от глицерина ОН-СН2-СН(ОН)-СН2-ОН.
Общая формула жиров
Способы получения простых и сложных эфиров
Получение простых эфиров
Простые эфиры не встречаются в природе, но есть множество химических способов получения эфиров.
- Дегидратация между молекулами спиртов
С помощью этого способа получают симметричные молекулы. Реакция дегидратации (отщепления молекулы воды) протекает в присутствии минеральной кислоты и при нагревании.
C5H11-OH + HO-C5H11 → C5H11-O-C5H11 + Н2О
- Реакция Вильямсона (взаимодействие галогенпроизводных с алкоголятами)
С помощью этого метода можно синтезировать несимметричные молекулы.
С2Н5ONa + C3H7Cl → C2H5-O-C3H7 + NaCl
- Окисление алкенов
Данным способом можно получать циклические соединения класса. Для проведения реакции необходимо нагревание и наличие катализатора.
Способ получения сложных эфиров
Реакция этерификации протекает в присутствии минеральной кислоты.
CH3-COOH + C2H5OH → CH3-C(O)O-C2H5 + H2O
Физические свойства простых и сложных эфиров
Физические свойства простых эфиров
Для простых эфиров не характерно твердое состояние. Диметиловый эфир и метилэтиловый эфир – газы, а все остальные представители класса находятся в жидком состоянии. Простые эфиры кипят при более низких температурах, по сравнению со спиртами. Также им характерен приятный и сладкий запах.
Диэтиловый эфир – бесцветная жидкость, кипящая при температуре 35,5˚С. Он малорастворим в воде, но хорошо растворим в этиловом спирте. Температура воспламенения – 9,4˚С. При взаимодействии с воздухом образуется взрывоопасная смесь. Используется как растворитель. Это ядовитое вещество, которое опасно тем, что вызывает привыкание.
Диэтиловый эфир
Диоксан – хороший растворитель, из-за чего его иногда называют «органической водой». Температура кипения – 101˚С. Диоксан токсичен и ядовит.
1,4-диоксан
Простые эфиры не растворимы в воде. Эта особенность связана с неспособностью образовывать водородные связи. Простые эфиры – отличные растворители.
Физические свойства сложных эфиров
Сложные эфиры, образованные от низших карбоновых кислот и спиртов, находятся в жидком состоянии. Они обладают приятными запахами и не растворяются в воде. Приятные цветочные и плодовые запахи обусловлены наличием сложных эфиров.
У сложных эфиров более низкие температуры плавления и кипения, чем у карбоновых кислот. Эта особенность связана с отсутствием межмолекулярных водородных связей.
Сложные эфиры, образованные от высших карбоновых кислот и спиртов – воски. У них отсутствуют запахи. Также они совсем не растворимы в воде, но растворимы в органических растворителях. Воски бывают растительными, животными, ископаемыми и синтетическими.
Соты из пчелиного воска
Растительные воски можно встретить на поверхностях листовых пластин, стеблей, плодов. Они защищают от проникания лишней воды, высыхания, попадания микроорганизмов. Наиболее популярный животный воск – пчелиный. Из него насекомые строят соты. Также животный воск находится на шерсти животных. Он предотвращает попадание избыточной влаги на кожу.
Ланолин (воск шерсти животных)
Представитель ископаемых восков – горный воск, который представляет собой минерал из группы нефтяных битумов. Синтетические воски получают на основе нефтяных и смоляных парафинов и их производных.
Химические реакции простых и сложных эфиров
Химические реакции простых эфиров
- Взаимодействие с йодоводородной (HI) или бромоводородной (HBr) кислотой
Под действием концентрированной кислоты происходит разложение простого эфира.
R-O-R’ + HI →R-OH + R’-I
- Взаимодействие с соляной кислотой (HCl)
В результате данной реакции образуются нестойкие соли оксония.
- Взаимодействие с кислородом (окисление)
При хранении простых эфиров на воздухе образуются перекиси.
CH3-O-CH3 + O2→ CH3-O-O-CH3
Из-за образованных перекисей в процессе перегонки эфира может произойти взрыв, поэтому особенно важно очищать эфиры перед началом работы.
Химические реакции сложных эфиров
Химические реакции сложных эфиров обусловлены нуклеофильной атакой по атому углерода, находящимся в карбонильной группе, и замещением алкоксигруппы.
- Взаимодействие с водой (гидролиз)
При кислотном гидролизе сложный эфир превращается в исходную карбоновую кислоту и спирт. Реакция проходит в присутствии минеральной кислоты.
CH3-C(O)O-C2H5 + H2O → CH3COOH + C2H5OH
При щелочном гидролизе образуются соль карбоновой кислоты и спирт. Данная реакция необратима.
CH3-C(O)O-C2H5 + NaOH→ CH3-C(O)ONa + C2H5OH
Следует обратить внимание на то, что кислотный гидролиз обратим.
- Взаимодействие с водородом (гидрирование, или восстановление)
В процессе гидрирования образуются две молекулы спирта. Реакция идет при наличии катализатора.
C2H5-C(O)O-C2H5 + 2H2→ 2C2H5OH
CH3-C(O)O-C2H5 + 2H2→ CH3OH + C2H5OH
- Взаимодействие с аммиаком
При взаимодействии сложных эфиров и аммиака образуются амиды кислот и спирты.
C2H5-C(O)O-C3H7 + NH3→ C2H5-C(O)NH2 + C3H7OH
- Взаимодействие с кислородом (горение)
2СН3-С(О)О-СН3 + 7О2→2СО2 + 6Н2О
Применение эфиров
Простым эфирам характерна химическая инертность, поэтому они могут играть роль растворителя. Эфиры с разветвленными радикалами применяются в качестве антидетонационных добавок в моторных топливах. Также благодаря приятным запахам их можно встретить в парфюмерной продукции.
Сложные эфиры используются в парфюмерной, косметической продукции, пищевой промышленности, производстве лаков, красок, клеев и лекарственных препаратов. Также они могут выступать в роли растворителей.
Применение сложных эфиров.
Из сложных эфиров низших карбоновых кислот и спиртов, производят различные эссенции, а от ароматических спиртов – парфюмерную продукцию. Воски входят в состав смазочных веществ, кремов и мазей.
В XIX-ХХ веках ученые получили и изучили сложные эфиры, которые легли в основу многих лекарств. В число препаратов из эфиров входят салол, валидол. Раньше в качестве обезволивающего средства использовался метилсалицилат, который на современном рынке вытеснен другими эффективными лекарственными препаратами.




























