The boiling point of a substance is the temperature at which the substance changes state from liquid state to gas state. The boiling point of a liquid varies depending on the surrounding atmospheric pressure, but it is usually close to the melting point of the solid form of the same substance.
How is Boiling Point Determined?
Boiling point of a substance can be determined by using a Boiling Point Apparatus. This method uses the fact that liquids boil when their vapor pressure equals the atmospheric pressure. The apparatus consists of a container of liquid, a heater, and a mercury manometer. First, the liquid is placed in the container and heated until its vapors fill the container. The mercury manometer is then used to measure the atmospheric pressure inside the container. When the mercury column in the manometer reaches the same level as the liquid in the container, this indicates that the vapors have reached atmospheric pressure and the boiling point has been reached.
Boiling point of Water
Boiling point of water is the temperature at which the liquid water becomes water vapor. The boiling point of water is 212 degrees Fahrenheit using Fahrenheit to Celsius conversion (100 degrees Celsius). The boiling point of water is also known as the “saturation temperature.”
Boiling Point Formula of Liquid
The boiling point of a liquid is the temperature at which the liquid changes state from a liquid to a gas. The boiling point of a liquid is also the temperature at which the vapor pressure of the liquid is equal to the atmospheric pressure. The boiling point of a liquid is affected by the atmospheric pressure, which is why boiling points are usually given at standard atmospheric pressure.
The boiling point of a liquid is the temperature at which the vapor pressure of the liquid is equal to the atmospheric pressure.
The boiling point depends on the pressure of the surrounding atmosphere. When the atmospheric pressure is equal to the vapor pressure of the liquid, the liquid will boil. The boiling point also depends on the purity of the liquid, impurities lower the boiling point of a liquid.
Example: Water boils at 100 degrees Celsius (212 degrees Fahrenheit) at sea level, but only at 93 degrees Celsius (199.4 degrees Fahrenheit) at an altitude of 2,438 meters (8,000 feet).
The formula for calculating the change in the boiling point is:
Kb = RTb2M / ΔHv
where,
Kb is the boiling point constant
R is the universal gas constant (8.314 J/mol-K)
Tb is the boiling point of the liquid
M is the molar mass of the liquid
ΔHv is the heat of vaporization for the particular liquid (2260 J/kg: latent heat of vaporization of water)
Properties of Boiling Point
Following are the properties of the boiling point:
- Boiling point of a liquid varies depending on the surrounding pressure. For example, water boils at 100°C (212°F) at sea level, but only at 93°C (199°F) at an altitude of 1,000 m (3,281 ft).
- Boiling point of a liquid can also be affected by the presence of other substances in the liquid. For example, the boiling point of water is lower when salt is added to it.
- Boiling point of a liquid is a measure of the liquid’s ability to change state from a liquid to a gas. The higher the boiling point, the greater the liquid’s ability to resist changes in state.
- Boiling point of a liquid is also a measure of the liquid’s ability to vaporize. The higher the boiling point, the greater the liquid’s ability to resist vaporization.
- Boiling point of a liquid is a function of the liquid’s vapor pressure. The vapor pressure is the pressure exerted by the vapor of the liquid on the walls of the container.
- Boiling point of a liquid is also a function of the liquid’s volatility. The volatility of a liquid is a measure of the liquid’s ability to vaporize.
- Boiling point of a liquid is affected by the surrounding pressure. The higher the surrounding pressure, the higher the boiling point.
Factors Affecting the Boiling Point of Liquid
The boiling point of a liquid is the temperature at which it changes from a liquid to a gas. The factors that affect the boiling point of a liquid are its pressure, temperature, and purity.
- Purity: The higher the purity of a liquid, the higher its boiling point. This is because impurities lower the vapor pressure of a liquid, making it easier for the liquid to boil.
- Pressure: The boiling point of liquid increases as the pressure on the liquid increases. This is because the vapor pressure of a liquid increases as the pressure on the liquid increases.
- Temperature: The boiling point of a liquid also increases as the temperature around the liquid increases.
How to Find the Boiling Point of a Substance?
To determine the boiling point of a substance, we need to heat the substance until it reaches its boiling point. The boiling point of a substance is defined as the temperature at which the liquid changes its state to gas form. At this temperature, the vapor pressure of the liquid is equal to the atmospheric pressure.
We use a thermometer to measure the temperature of the substance as it is heated. As the substance approaches its boiling point, we will notice that the rate of heating will begin to slow down. This is because the heat is being used to convert the liquid into a gas, rather than increase the temperature of the liquid.
Once the substance reaches its boiling point, it will begin to boil. You can then remove the thermometer and checked the temperature to get the boiling point.
Also, Check
- Molarity
- Mole Concept
- Difference Between Molarity and Molality
Solved Examples on Boiling Point Formula
Example 1: Find the Kb of LiCl if 2 g of LiCl is dissolved in 500 g of water which boils at 100.6°C.
Solution:
Given,
Mass of LiCl = 2 g
Molar mass of LiCl = 42 g/mol
Mass of water = 500 g
Molar mass of water = 18 g/mol
Boiling point of solution = 100.6°CR = 8.314 J/mol-K (Universal gas constant)
Tb = 100.6 + 273 = 373.6 K (Boiling point in Kelvin)
V = 500 / 1000 = 0.5 L (Volume in litres)
M = (2 / 42) + (500 / 18) = 25 mol/L (Molality)
Hv= 2260 J/kg (latent heat of vaporization of water)Kb = RTb2M / ΔHv
= 8.314 × 373.6 × 0.5 × 25 / 2260
= 68.7 molal
Example 2: Find the boiling point of 1 molar solution of sucrose.
Solution:
Given,
Molarity of solution (M) = 1 mol/L
Boiling point elevation (ΔTb) = 100°C (the Kb for sucrose is 100°C/m)
R = 8.314 J/mol-K (universal gas constant)Tb = 100 + 273 = 373 K (boiling point in Kelvin)
Kb = RTb2M / ΔHv
= 8.314 × 373 × 2 × 1 / 2260
= 2.74 molal
Example 3: Find the Kb of the glucose if the solution of glucose in water boils at 103°C when the concentration of the solution is 0.5 molar.
Solution:
Given,
Concentration of solution (c) = 0.5 molar
Boiling point elevation (ΔTb) = 103°C (the Kb for sucrose is 100°C/m)R = 8.314 J/mol-K (universal gas constant)
Tb = 103 + 273 = 376 K (boiling point in Kelvin)
Kb = RTb2M / ΔHv
= 8.314 × 376 × 2 × 0.5 / 2260
= 1.38 molal
FAQs on Boiling Point
Question 1: What is the boiling point of the liquid?
Answer:
The boiling point of a liquid is the temperature at which the liquid changes state from a liquid to a gas.
Question 2: What factors affect the boiling point of a liquid?
Answer:
The boiling point of a liquid is affected by the pressure of the surrounding atmosphere, the purity of the liquid, and the presence of any dissolved solids.
Question 3: How does the boiling point of a liquid change with altitude?
Answer:
The boiling point of a liquid decreases with the rise in altitude. This is because the atmospheric pressure is lower at higher altitudes, and the boiling point of a liquid is inversely affected by the pressure of the surrounding atmosphere.
Question 4: How does the boiling point of a liquid change with the addition of solids?
Answer:
The boiling point of liquid increases with the addition of solids. This is because the solids take up space in the liquid, and the liquid must heat up to a higher temperature in order to vaporize.
Question 5: What is the boiling point of alcohol?
Answer:
The boiling point of alcohol is 78.37 degrees Celsius (172 degrees Fahrenheit).
Question 6: What is the boiling point of mercury?
Answer:
The boiling point of mercury is 356.7 degrees Celsius (673 degrees Fahrenheit.
Last Updated :
17 Jan, 2023
Like Article
Save Article
Температура
(точка) кипения
(англ.
boiling
point)–
температура, при которой происходит
кипение жидкости и переход ее в
парообразное состояние.
Кипение
– процесс
парообразования по всему объему
жидкости.
Любая жидкость
характеризуется определенной температурой
кипения. В отличие от температуры
плавления эта константа зависит от
давления (табл. 15). Жидкость начинает
кипеть тогда, когда давление ее паров
становится равным атмосферному давлению.
При понижении давления температура
кипения уменьшается, при повышении
давления температура кипения
увеличивается. Предельной температурой
кипения является критическая
температура,
при которой плотность и давление
насыщенного пара становится максимальным,
а плотность жидкости, находящейся в
динамическом равновесии с паром
минимальной. При температуре выше
критической температуры газа, его
невозможно сконденсировать ни при
каком давлении. Для определения
температуры кипения используется
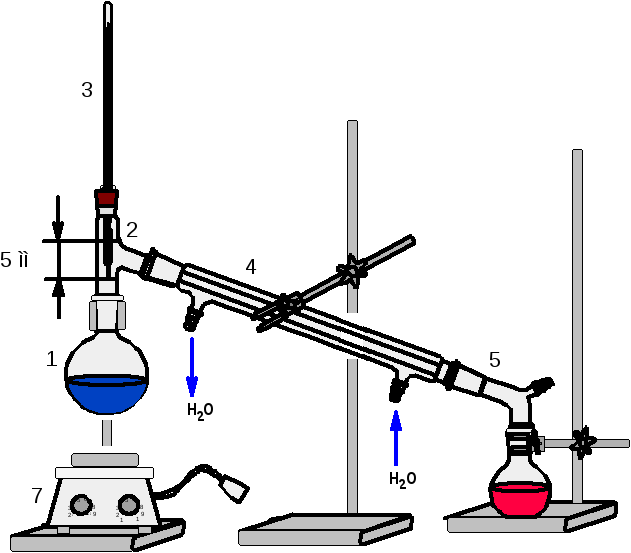
установка для простой перегонки
(рис.90). При определении температуры
кипения высококипящих веществ водяной
холодильник следует заменить на
воздушный.
Таблица 15. —
Температура кипения воды и этанола
в
зависимости от давления
|
Давление |
Температура |
||
|
мм. |
кПа |
воды |
этанола |
|
100 |
13,3 |
50,0 |
34,2 |
|
150 |
20,0 |
60,0 |
42,0 |
|
200 |
26,6 |
68,0 |
47,8 |
|
400 |
53,2 |
82,0 |
62,8 |
|
760 |
101,3 |
100,0 |
78,15 |
|
1100 |
146,7 |
110,5 |
87,8 |
|
1450 |
193,3 |
119,0 |
95,3 |
|
Рисунок |
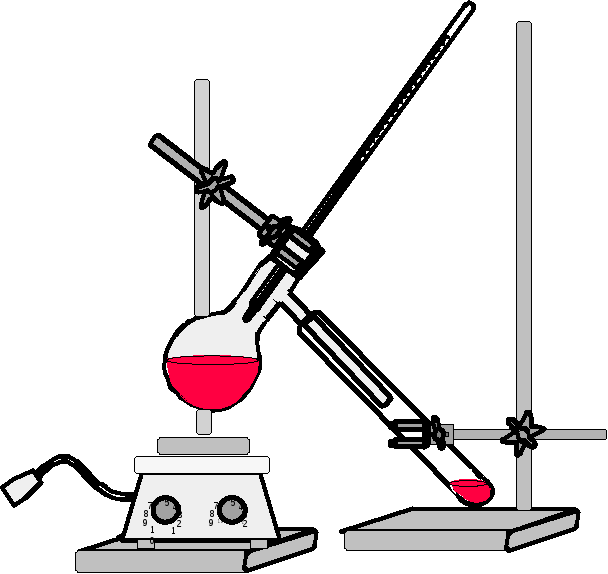
Рисунок 91 —
Установка для определения температуры
кипения высококипящих веществ (т. кип.
> 1500С)
При определении
температуры кипения небольшого
количества жидкости применяют метод
Сиволобова. В стеклянную трубочку
(внутренний диаметр около 5 мм, а длина
2,5-3 см) помещают пипеткой несколько
капель исследуемой жидкости. Затем в
нее погружают тонкий капилляр, запаянный
с верхнего конца. Трубку с жидкостью и
капилляром прикрепляют к термометру,
как и в случае определения температуры
плавления. При медленном нагревании
из тонкого капилляра начинают выделяться
пузырьки воздуха. Температура, при
которой начинается непрерывное выделение
пузырьков, считается температурой
кипения жидкости.
9. Список рекомендуемой литературы
1. Агрономов
А. Е. «Лабораторные работы в органическом
практикуме» М.:Химия, 1974, издание 2-е,
376 стр.,
2. Берлин А.Я.
Техника лабораторной работы в органической
химии. — М.: Госхимииздат, 1963. 372 с.
3. Вейганд
К. «Методы эксперимента в органической
химии» М.:Иностранная литература
1952
4. Гордон
А., Форд Р. «Спутник химика» М.:Мир,
1976
5. Захаров Л. Н.
Техника безопасности в химических
лабораториях: Справ. изд.—2-е изд.
перераб. и доп.— Л.; Химия, 1991.— 336 с: ил.
6. Крель
Э. «Руководство по лабораторной
перегонке» М.:Химия 1980,
пер. с немецкого Чернышевой В.И.,
Шафранского А.В., под ред. Олевского
В.М.,
7.
Беккер
Г., Бергер В., Домшке Г. и др. Органикум.
Практикум по органической химии,
Мир, 1979 г. , 1 т.
8.
Беккер
Г., Бергер В., Домшке Г. и др. Органикум.
Практикум по органической химии,
Мир, 1979 г. , 2 т.
9. Степин
Б. Д. «Техника лабораторного эксперимента
в химии» М.:Химия, 1999
10. Юрьев Ю. К.
«Практические работы по органической
химии» вып.1-2 2-е изд., М.:ИМУ, 1961.
11.Гинзбург
181
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В этой статье обсуждается тема — как определить температуру кипения соединения? Мы все уже должны знать, что температура кипения любого вещества напрямую не зависит от температуры, но именно давление играет жизненно важную роль в определении точки кипения вещества.
Когда мы рассматриваем соединение, оно состоит из более чем одного элемента, каждый из которых имеет свои значения температуры кипения. Как же тогда найти температуру, при которой соединение кипит? Является ли это средним значением отдельных температур кипения или за температуру кипения принимается наибольшее значение? Теперь мы узнаем ответ на этот вопрос в этой статье.
Что вы имеете в виду под точкой кипения?
Температура кипения вещества или соединения – это такое значение температуры, при котором давление паров жидкости/вещества становится равным по величине значению атмосферного давления.
Окружающее давление варьируется от места к месту. Для простоты понимания примем значение атмосферного давления за 1 атм. При давлении в 1 атм вода кипит при 100 градусах Цельсия, в этот момент жидкая вода начинает переходить в газообразное состояние, то есть в пар. Давайте обсудим больше о температуре кипения в следующих разделах.
Как найти наивысшую температуру кипения соединения?
Температура кипения соединения зависит от многих факторов. Если мы хотим найти соединение с более высокой температурой кипения, мы обращаемся к следующим факторам:
- Межмолекулярные силы– Межмолекулярные силы – это те силы, которые действуют между элементами молекул. Трудно кипятить элементы, обладающие высокими межмолекулярными силами, потому что силы притяжения не позволяют легко разрывать связи. Элементы могут иметь много типов связей, это ионная связь, диполь-дипольные взаимодействия, сила Ван-дер-Ваальса и водородная связь. Самая сильная связь – ионная связь, самая слабая – сила Ван-дер-Ваальса.
- Молекулярная масса– Чем крупнее молекула, тем больше склонность к поляризации. А когда склонность к поляризации возрастает, нам потребуются дополнительные усилия, чтобы вскипятить вещество. Причина этого в том, что силы притяжения увеличиваются по величине, когда элемент становится все более и более полярным.
- Форма— Если соединение имеет очень длинную цепочку атомов, это приведет к большей площади поверхности. Из-за большей площади поверхности сила притяжения Ван-дер-Вааль также увеличивается, следовательно, температура кипения также увеличивается. Но когда имеет место разветвление, силы отталкивания побеждают силы притяжения. Следовательно, при разветвлении температура кипения снижается.
Кредиты изображения: Точка кипения
Как найти самую низкую температуру кипения соединения?
Мы уже обсуждали, как определить, будет ли температура кипения высокой или нет. Мы можем использовать те же факторы, чтобы узнать, будет ли температура кипения низкой или нет.
Факторы включают межмолекулярные силы, которые в основном бывают четырех типов: ионная связь, сила Ван-дер-Ваала, водородная связь и диполь-диполь. Затем другими факторами являются форма и молекулярная масса соединения. В предыдущих разделах мы уже видели, насколько сильно эти факторы влияют на температуру кипения соединений.
Как найти температуру кипения химического соединения?
Точку кипения любого химического соединения можно определить, выполнив следующие действия. Рассмотрим пример, в котором мы берем решение. Раствор состоит из растворенного вещества и растворителя. Уравнение, которое мы будем использовать, называется уравнением Клаузиуса Клапейрона.
Уравнение выглядит следующим образом:
Как найти температуру кипения органического соединения?
Мы можем определить температуру кипения органического соединения, проведя простой эксперимент. Эксперимент обсуждается в разделе, приведенном ниже. Мы сразу перейдем к процедурной части эксперимента.
- Пробирку наполняют на 2/3rd высота с органическим соединением, температура кипения которого должна быть определена.
- Затем с помощью резинки пробирку перевязывают термометром таким образом, чтобы колба термометра совпадала с дном пробирки.
- Парафиновую жидкость наливают в химический стакан, который затем держат на горячей плите.
- Пробирку вместе с термометром погружают в этот разогревающийся парафин.
- Берется капиллярная трубка, которую запаивают, нагревая на бунзеновской горелке.
- Открытый конец погружается внутрь пробирки.
- Мы наблюдаем, как пузырьки выходят из открытого конца капиллярной трубки, и через некоторое время пузырьки начинают выходить с большей скоростью. Отметьте температуру как t1, показанную на термометре.
- Теперь выключите плитку и дайте парафиновой жидкости остыть, пузырьки перестанут выходить из капиллярной трубки.
- Теперь запишите эту температуру как t2.
- Среднее значение t1 и t2 представляет собой температуру кипения органического соединения.
Какое соединение имеет самую высокую температуру кипения?
Этанол или этиловый спирт имеют самые высокие точка кипения. Это происходит из-за сильного влияния силы Ван-дер-Ваальса и диполь-дипольных взаимодействий. Эти силы являются частью сильных сил притяжения между молекулами.
Указанные силы являются частью межмолекулярных сил притяжения. Эти силы связывают атомы вместе с большей силой. Нам нужна большая энергия, чтобы разорвать эти связи, поэтому температура кипения соединения также становится выше. Мы обсудили влияние этих факторов на температуру кипения.
Какое органическое соединение имеет самую высокую температуру кипения?
Когда мы говорим об органических соединениях, пропан-1-ол или пропанол имеют самую высокую температуру кипения. Это объясняется присутствием в соединении сильных Н-связей и ОН-группы.
Н-связь также привлекательна по своей природе. Из-за водородных связей, присутствующих внутри пропанола, энергия, необходимая для кипения, увеличивается, поскольку водородные связи слишком прочны и их нелегко разрушить. Если бы водородные связи были слабее, то энергия, необходимая для разрыва связей, была бы меньше, и ее можно было бы легко вскипятить.