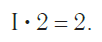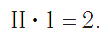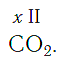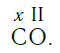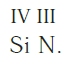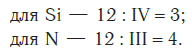степень окисления и валентность элемента численно равны, зная с.о. элементов, можно найти валентность. грубо говоря суммарная с.о. всех элементов должна равняться нулю=>
KBrO3 : у оксигена с.о.= -2 (умножаем это на 3, т.к. количество атомов оксигена 3) , значит у оксигена будет -6
далее знаем, что у калия с.о. +1 (умножать ни на что ненужно, т.к. калий всего один)
складываем -6+1=-5, остается бром, чтобы суммарно получить ноль находим с.о. брома -5-0=+5 => валентность 5
K2CrO4 : Сr = +6 , валентность 6
H2Cr2O7 : Cr=+6, валентность 6
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
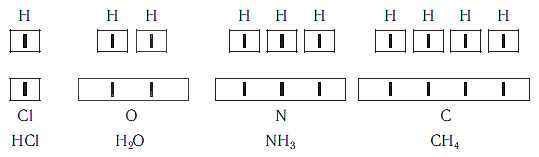
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Содержание
- Определение валентности
- Постоянная и переменная валентность
- Составление химических формул по валентности
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
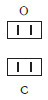
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
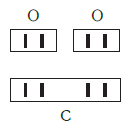
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
Постоянная и переменная валентность
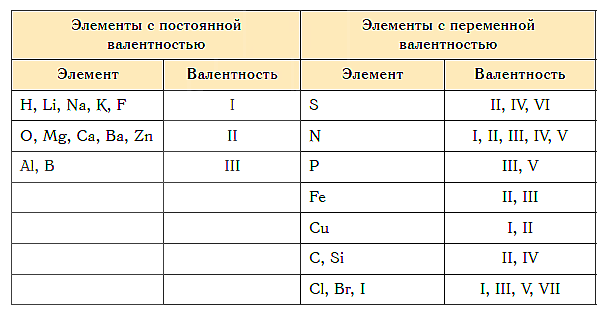
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Существует несколько определений понятия «валентность». Чаще всего этим термином называют способность атомов одного элемента присоединять определённое число атомов других элементов. Часто у тех, кто только начинает изучать химию, возникает вопрос: Как определить валентность элемента?. Сделать это несложно, зная несколько правил.
Валентности постоянные и переменные
Рассмотрим соединения HF, H2S и CaH2. В каждом из этих примеров один атом водорода присоединяет к себе только один атом другого химического элемента, значит его валентность равна одному. Значение валентности записывают над символом химического элемента римскими цифрами.
В приведённом примере атом фтора связан только с одним одновалентным атомом H, значит валентность его тоже равна 1. Атом серы в H2S присоединяет к себе уже два атома H, поэтому она в данном соединении двухвалентна. С двумя водородными атомами связан и кальций в его гидриде CaH2, а значит, и его валентность равна двум.
Кислород в подавляющем большинстве своих соединений двухвалентен, то есть образует две химические связи с другими атомами.
Атом серы в первом случае присоединяет к себе два кислородных атома, то есть всего образует 4 химические связи (один кислород образует две связи, значит сера — два раза по 2), то есть валентность ее равна 4.
В соединении SO3 сера присоединяет уже три атома O, поэтому и валентность ее равна 6 (три раза образует по две связи с каждым атомом кислорода). Атом кальция же присоединяет только один атом кислорода, образуя с ним две связи, значит, его валентность такая же, как и у O, то есть равна 2.
Обратите внимание на то, что атом H одновалентен в любом соединении. Всегда (кроме иона гидроксония H3O(+)) равна 2 валентность кислорода. По две химические связи как с водородом, так и с кислородом образует кальций. Это элементы с постоянной валентностью. Кроме уже указанных, постоянную валентность имеют:
- Li, Na, K, F — одновалентны;
- Be, Mg, Ca, Zn, Cd — обладают валентностью, равной II;
- B, Al и Ga — трехвалентны.
Атом серы, в отличие от рассмотренных случаев, в соединении с водородом имеет валентность, равную II, а с кислородом может быть и четырех- и шестивалентна. Про атомы таких элементов говорят, что они имеют переменную валентность. При этом максимальное ее значение в большинстве случаев совпадает с номером группы, в которой находится элемент в Периодической системе (правило 1).
Из этого правила есть много исключений. Так, элемент 1 группы медь, проявляет валентности и I, и II. Железо, кобальт, никель, азот, фтор, напротив, имеют максимальную валентность, меньшую, чем номер группы. Так, для Fe, Co, Ni это II и III, для N — IV, а для фтора — I.
Минимальное значение валентности всегда соответствует разнице между числом 8 и номером группы (правило 2).
Однозначно определить, какова же валентность элементов, у которых она переменная, можно только по формуле определенного вещества.
Определение валентности в бинарном соединении
Рассмотрим, как определить валентность элемента в бинарном (из двух элементов) соединении. Здесь возможны два варианта: в соединении валентность атомов одного элемента известна точно или же обе частицы с переменной валентностью.
Случай первый:
- Fe2O3 — валентность кислорода постоянна и равна II. Три атома О имеют 2 × 3 = 6 единиц валентности.
- Далее работаем по правилу: суммарное число единиц валентности для атомов одного элемента совпадает с числом единиц валентности для атомов другого вида (правило 3).
- Согласно этому правилу, общее число единиц валентности для железа тоже равно 6.
- Разделим общее число валентных единиц на количество атомов железа, то есть на 2, и получим валентность железа, равную III.
Случай второй:
- SnCI4 — оба атома с переменной валентностью. Применяем ещё одно правило: в бинарном соединении элемент, стоящий на втором месте, имеет минимальную валентность. В соединениях металлов с неметаллами на втором месте записывают неметалл. В формуле вещества, состоящего только из неметаллов, на втором месте пишут символ того элемента, который в ПСХЭ находится правее или выше.
- В приведённом примере Sn (олово) — металл, CI — неметалл, соответственно он и будет иметь минимальную валентность. Её определим, исходя из правила 2: 8 — 7 = 1
- Далее определим суммарное число единиц валентности у хлора: 4 × 1= 4
- Воспользуемся правилом 3. Суммарное количество валентных единиц олова тоже будет равно 4. Все они приходятся на один атом Sn, значит, это и есть его валентность.
Определение валентности по формуле трехэлементной частицы.
Далеко не все химические вещества состоят из двухатомных молекул. Как определить валентность элемента в трёхэлементной частице? Рассмотрим этот вопрос на примере формул двух соединения K2Cr2O7.
- Cr здесь называют центральным атомом. Необходимо помнить, что все остальные атомы связаны с ним через кислородные мостики. Исходя из этого, и будем производить вычисления.
- Кислород — элемент с постоянной валентностью, равной двум. Калий всегда одновалентен.
- Всего атомы O образуют 7 × 2 = 14 единиц валентности, а атомы калия 1 × 2 = 2.
- Из 14 валентных единиц атом серы два расходует на присоединение калия, следовательно, на хром их остаётся 14 — 2 = 12.
- Это число единиц валентности приходится на 2 атома Cr, значит, на один атом приходится 12÷2=6.
Если же вместо калия в формуле будет присутствовать железо, или другой элемент с переменной валентностью, нам потребуется знать, какова же валентность кислотного остатка. Например, нужно вычислить валентности атомов всех элементов в соединении с формулой FeSO4.
- Атом кислорода двухвалентен, всего на кислород приходится II × 4 = 8 единиц валентности.
- Валентность кислотного остатка SO4 равна II (как ее определить, написано в статье «Формулы кислот»).
- По правилу 3 валентность железа в этом случае тоже равна II.
- Центральный атом здесь S. Кислород присоединяет один атом железа, расходуя на него две валентные единицы, следовательно, на серу их остаётся 8 — 2 = 6 единиц валентности. Так как в формуле FeSO4 один атом серы, то это и есть ее валентность.
Следует отметить, что термин «валентность» чаще использую в органической химии. При составлении формул неорганических соединений чаще используют понятие «степень окисления».