Содержание:
- § 1 Валентность химических элементов
- § 2 Определение валентности по формулам соединений
- § 3 Составление химических формул по валентности
- § 4 Определение названия вещества по химической формуле
§ 1 Валентность химических элементов
В свое время, состав всех веществ был установлен на основании данных эксперимента. Однако можно составлять химические формулы, не прибегая к предварительному выполнению сложных опытов, требующих длительной, кропотливой работы.
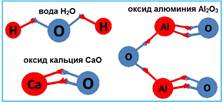
Если сравнить между собой формулы таких веществ, как вода H2O, оксид кальция СаО, оксид алюминия Al2O3, оксид углерода СО2, оксид фосфора Р2О5, оксид серы SО3 и оксид хлора Cl2О7, то можно заметить, что кислород во всех этих соединениях присоединяет к себе неодинаковое число атомов других химических элементов.
Для определения состава бинарных или двухэлементных, то есть состоящих из атомов двух химических элементов соединений, и составления их формул, достаточно знать валентность химических элементов.
Валентность (от латинского слова Valentia – «сила») – свойство атома химического элемента присоединять или замещать определённое число атомов другого химического элемента
Поскольку атомы в молекуле соединены между собой химическими связями, валентность определяется числом простых (одинарных) химических связей, которые данный атом образует с другими атомами.
§ 2 Определение валентности по формулам соединений
Как это можно представить себе, если не прибегать к теории строения атома? Каждый атом имеет определенное число потенциальных химических связей – валентных возможностей.
Например, водород – одну, кислород и кальций – по две, алюминий – три, углерод – четыре, фосфор – пять, сера – шесть, хлор – семь. Соединяться друг с другом эти атомы могут, только используя эти самые валентные возможности.
Поэтому атомы химических элементов и образуют соединения, подчиняясь закону постоянства состава.
Закон постоянства состава утверждает, что вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.
Способность элементов проявлять то или иное значение валентности определяется строением их атомов. Поскольку строение атомов обычно изучается позднее, научимся определять валентность, исходя из положения элементов в периодической системе.
Для этого следует учитывать, что каждая группа (вертикальный столбец) элементов состоит из двух подгрупп: главной А и побочной В.
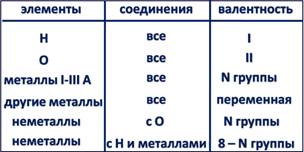
Элементы-металлы, располагающиеся в главных подгруппах I и II групп, проявляют постоянную валентность, равную номеру группы. Это же относится и к алюминию (III группа). А вот металлические элементы IV группы (главная подгруппа) олово и свинец служат исключением и проявляют переменную валентность, численно равную 2 и 4. Длямногих металлов побочных подгрупп также характерно наличие переменной валентности, однако высшее значение валентности обычно равно номеру группы!
Большая часть неметаллов, располагающихся в главных подгруппах групп с четвёртой по седьмую, проявляет переменную валентность. В ряду возможных значений валентностей неметаллов следует выделять высшую и низшую. Высшая валентность равна номеру группы, низшая – разности, полученной вычитанием числа, равного номеру группы, из числа 8. Например: высшая валентность элемента фосфора, стоящего в V группе, равна 5,
низшая: 8-5=3. Следовательно, валентность фосфора переменная – 3 и 5. Следует помнить, что высшая валентность неметаллов проявляется только в соединениях с кислородом, а низшая – в соединениях с металлами и водородом. Валентность водорода всегда во всех соединениях равна 1, валентность кислорода всегда 2.
§ 3 Составление химических формул по валентности
Для составления формул сложных веществ, состоящих из атомов двух неметаллов, следует учитывать, что высшую валентность проявит тот элемент, который стоит в периодической системе левее или ниже, а низшую – соответственно тот, который стоит правее или выше.
Составляем формулы и названия веществ по валентности, используя следующий алгоритм:
1. записываем знаки элементов (по наличию) в порядке: металл, водород, неметалл, кислород;
2. расставляем значения валентностей элементов по периодической системе химических элементов;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность, если она не постоянная.
Составим формулу и название для вещества, состоящего из атомов фосфора и кислорода:
1. записываем знаки Р и О;
2. валентность фосфора высшая, равна 5, валентность кислорода, как и во всех соединениях равна 2;
3. наименьшее общее кратное 10
10/5=2, пишем индекс у знака Р
10/2=5, пишем индекс у знака О
получилось Р2О5;
4. назовем вещество: корень латинского названия кислорода «оксигениум» окс, к нему прибавляем суффикс ид, получаем оксид. Русское название первого элемента – фосфор, валентность его переменная, равная 5. Получилось название «оксид фосфора 5».
§ 4 Определение названия вещества по химической формуле
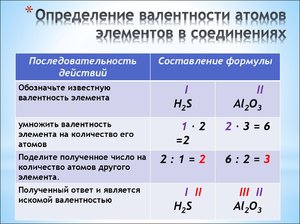
Таким образом, при составлении названия вещества, имеющего определенную химическую формулу, необходимо указывать валентность, а чтобы ее указать, необходимо определить. По периодической системе это получается не всегда. Определить валентность и составить название веществаможно, используя алгоритм:
1. указать валентность известного элемента;
2. умножить указанную валентность на соответствующий индекс;
3. полученный результат делим на индекс элемента с неизвестной валентностью;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность.
Определим валентность и составим название вещества, имеющего формулу CrO3:
1. валентность кислорода постоянна и равна 2;
2. 2×3=6;
3. 6/1=6. Валентность хрома равна 6;
4. название вещества – оксид хрома 6.
Теперь научимся составлять формулу по названию вещества
1. записываем знаки химических элементов в нужном порядке;
2. указываем валентности, обращая внимание на название. Если валентность первого элемента переменная, она будет указана. Валентность второго элемента – низшая;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс.
Определим формулу оксида серы:
1. записываем знаки S и О.
2. валентность серы равна 4, валентность кислорода, как и во всех соединениях – два.
3. наименьшее общее кратное 4
4/2=2, пишем индекс у знака О
4/4=1, пишем индекс у знака S;
4. получилось SО2.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Использованные изображения:
Как определять валентность видео уроки
Валентность. Учимся определять валентность элементов по формулам
Валентность. Часть 1. Учимся определять валентность элементов по формулам.
ВАЛЕНТНОСТЬ химических элементов 8 9 класс химия Габриелян
Как найти валентность?
Смотреть видео:
#химия #химияпросто #неорганика #егэпохимии #эксперименты #химик #егэхимия #химияегэ #урокихимии
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Как найти валентность по формулам веществ
Oksana Antares

Как найти валентность. Ответ подписчикаи
Oksana Antares

Как найти валентность элемента в сложном веществе
Oksana Antares

Курсы ЕГЭ 2019 Химия | Степень окисления, валентность
Ekaterina Zhukova
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
16.12.2021
- Комментарии
RSS
Написать комментарий
Нет комментариев. Ваш будет первым!
Ваше имя:
Загрузка…
Когда мы говорим о химии, мы подразумеваем строительные блоки Вселенной. Все элементы действуют как кирпичи конструктора Лего, присоединяясь друг к другу, пока не создадут нечто большее, например, металлы, воду, химические соединения и даже живых существ. Иногда они не стыкуются и разваливаются или взрываются, ухудшая свои основные формы. Именно эти связи и реакции составляют Вселенную, какой мы ее знаем и видим.
Хотя все вещи на нашей планете состоят из отдельных атомов и элементов, различия между объектами и видами заключаются в способности элементов сочетаться с другими элементами. Как вы, наверное, уже знаете, валентность элемента измеряет его способность сочетаться с другими, а число электронов внутри внешней оболочки элемента называется валентностью.
Содержание:
- Как определить валентность элемента
- Правило октета
- Определение по таблице Менделеева
- Определение зависимости от химических формул
- Видео
Как определить валентность элемента
Для этого существует несколько методов. Первый и самый простой способ — это просто обратиться к периодической таблице Менделеева. Элементы распределены по группам, их 8. В каждой группе они имеют одинаковую валентность. Например, все элементы в группе 8 имеют восемь электронов (высокая стабильность).
Второй метод — посмотреть на общее количество электронов, а затем вычислить их число по атомному номеру. Как только вы узнаете количество электронов, вы можете легко вычислить валентность. Все атомы, кроме водорода, имеют два электрона в первой электронной оболочке и до восьми в каждой последующей. Например, атомный номер хлора равен 17, что делает конфигурацию электронов равной:
- 2;
- 8;
- 7.
То есть валентность хлора равна 7. Кислород имеет восемь электронов, два в первой оболочке и шесть во внешних оболочках, давая ему число 2. Вы можете рассчитать многоэлементные молекулы таким же образом. Например, чтобы определить тетраоксид фосфора, вы должны умножить атомы кислорода (валентность 2) и вычесть из валентности фосфора 5, получив число 3.
Ознакомьтесь с электронной конфигурацией каждого уровня оболочки. Каждый атом имеет два электрона на своей внутренней оболочке и до восьми электронов на каждой оболочке. Например, поскольку литий имеет три электрона, он будет иметь два внутри и один электрон на своей внешней оболочке.
Правило октета
При определении атома или молекулы (для которой вы не можете использовать периодическую таблицу), химики используют правило октета. Согласно этому правилу, атомы и химические вещества объединяются таким образом, чтобы образовать восемь электронов во внешней оболочке любого соединения, которое они образуют. Когда атом или молекула имеет от одного до четырех электронов в своей внешней оболочке, он имеет положительную валентность, то есть он жертвует свои свободные электроны. Когда число электронов составляет:
- четыре;
- пять;
- шесть;
- семь;
— вы определяете его способности путем вычитания электронного числа из 8. Это потому, что атом или молекула легче принимает электроны для достижения стабильности.
Определение по таблице Менделеева
Ученые устроили все элементы в диаграмму, называемую периодической таблицей, и во многих случаях вы можете определить валентность, взглянув на график. Например, все металлы в колонке 1, включая водород и литий, имеют +1, тогда как все те, что указаны в колонке 17, включая фтор и хлор, имеют -1. Благородные газы в колонке 18 имеют 0 и являются инертными.
С помощью этого метода вы не можете найти валентность меди, золота или железа, потому что у них много активных электронных оболочек. Это справедливо для всех переходных металлов в колонках 3–10, более тяжелых элементов в колонках с 11 по 14, лантаноидов (элементы 57–71) и актинидов (элементы 89–103).
Определение зависимости от химических формул
Вы можете определить переходный элемент или радикал в конкретном соединении, заметив, как он сочетается с элементами известной валентности. Эта стратегия основана на правиле октета, которое говорит нам о том, что элементы и радикалы объединяются, чтобы создать стабильную внешнюю оболочку из восьми электронов.
В качестве простых иллюстраций этой стратегии обратите внимание, что натрий (Na), имеющий +1, легко сочетается с хлором (Cl), который имеет -1, с образованием хлорида натрия (NaCl) или поваренной соли. Это пример ионной реакции, в которой электрон пожертвован одним атомом и принят другим. Однако для соединения с серой (S) требуется два атома натрия с образованием сульфида натрия (Na2S), сильнощелочной соли, используемой в целлюлозной промышленности.
Чтобы применить эту стратегию к более сложным молекулам, важно сначала понять, что элементы иногда объединяются с образованием реактивных радикалов, которые еще не достигли стабильности внешней оболочки. Примером является сульфатный радикал (SO4). Это тетраэдрическая молекула, в которой атом серы разделяет электроны с четырьмя атомами кислорода в так называемой ковалентной связи. В таком соединении вы не можете получить валентность атомов в радикале, если посмотреть на формулу. Поскольку для образования этого соединения требуется два атома натрия, валентность серы должна быть -2.
Однако вы можете определить радикал с помощью ионных соединений, которые он образует. Например, сульфатный радикал объединяется ионно с водородом, образуя серную кислоту (H2SO4). Эта молекула содержит два атома водорода, каждая из которых имеет +1, поэтому в этом случае валентность радикала равна -2. Как только вы определили радикал, вы можете использовать ее для вычисления молекул, с которыми он объединяется.
Например, железо (Fe) представляет собой переходный металл, который может проявлять множественные валентности. Когда он сочетается с сульфатным радикалом с образованием сульфата железа, FeSO4, он должен иметь +2 поскольку сульфатный радикал, определяется по связи, которую он образует с водородом.
Видео
Из этого видео вы узнаете, как определять валентность элементов по формулам.