Содержание:
Температура:
Перед тем как, например, пойти на пляж, многие интересуются прогнозом погоды. И если ожидается температура воздуха 10 °С, то, скорее всего, планы будут изменены. А стоит ли отказываться от прогулки, если прогнозируется температура 300 К (кельвинов)? И что на самом деле вкладывают физики в понятие «температура»?
Что такое температура
Эксперименты показывают, что макроскопическая система может переходить из одного состояния в другое. Например, если в морозный день занести в комнату шарик, наполненный гелием, то гелий в шарике будет нагреваться и при этом будут изменяться давление, объем и некоторые другие параметры газа. После того как шарик пробудет в комнате некоторое время, изменения прекратятся. Один из постулатов молекулярной физики и термодинамики — его еще называют нулевое начало термодинамики — гласит: любое макроскопическое тело или система тел при неизменных внешних условиях самопроизвольно переходит в термодинамическое равновесное состояние (состояние теплового равновесия), после достижения которого все части системы имеют одинаковую температуру. Нулевое начало термодинамики фактически вводит и определяет понятие температуры.
Температура — физическая величина, характеризующая состояние теплового равновесия макроскопической системы.
Состояние теплового равновесия — это такое состояние макроскопической системы, при котором все макроскопические параметры системы остаются неизменными сколь угодно долго.
В состоянии теплового равновесия все части системы имеют одинаковую температуру; другие макроскопические параметры неизменны, но могут быть разными. Вспомните пример с шариком: после того как установится тепловое равновесие, температура окружающего воздуха и температура гелия в шарике будут одинаковыми, а давление, плотность и объем — разными.
Как работают термометры
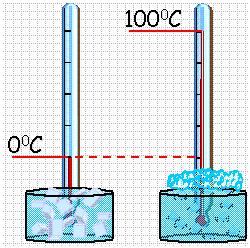
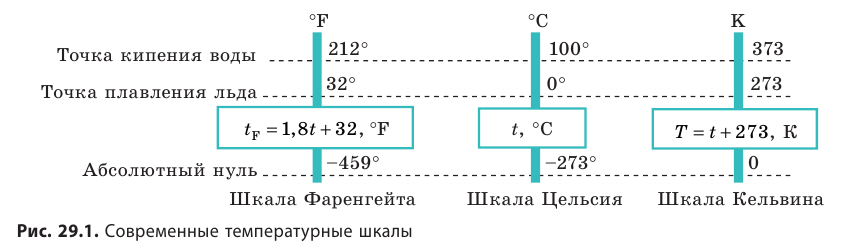
Температура — это физическая величина, и ее можно измерять. Для этого нужно установить шкалу температур. Самые распространенные температурные шкалы — шкалы Цельсия, Кельвина, Фаренгейта (рис. 29.1).
Построение шкалы температур начинается с выбора реперных (опорных) точек, которые должны быть однозначно связаны с какими-либо физическими процессами, которые легко воспроизвести. Например, за нулевую точку температурной шкалы Цельсия принята температура таяния льда при нормальном атмосферном давлении ( t = 0 °С). Температуре кипения воды при нормальном атмосферном давлении приписывают значение t =100 °С. Единица температуры по шкале Цельсия — градус Цельсия: 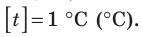
Рис. 29.2. различные виды термометров: а — жидкостный (принцип действия: изменение объема жидкости при изменении температуры); б — термометр сопротивления (изменение электрического сопротивления проводника при изменении температуры); в — биметаллический деформационный (изменение длин двух разных металлических пластин при изменении температуры)
Приборы для измерения температуры — термометры (рис. 29.2). Основные части любого термометра — термометрическое тело (ртуть или спирт в жидкостном термометре, биметаллическая пластина в металлическом деформационном термометре и т. д.) и шкала. Если термометрическое тело привести в контакт с телом, температуру которого нужно измерить, система придет в неравновесное состояние. При переходе в равновесное состояние будут изменяться некоторые параметры термометрического тела (объем, сопротивление и т. п.). Зная, как эти параметры зависят от температуры, определяют температуру тела.
Обратите внимание!
- Термометр фиксирует собственную температуру, равную температуре тела, с которым термометр находится в термодинамическом равновесии.
- Термометрическое тело не должно быть массивным, иначе оно существенно изменит температуру тела, с которым контактирует.
Температура и средняя кинетическая энергия молекул
То, что температура тела должна быть связана с кинетической энергией его молекул, следует из простых соображений. Например, с увеличением температуры увеличивается скорость движения броуновских частиц, ускоряется диффузия, повышается давление газа, а это значит, что молекулы движутся быстрее и их кинетическая энергия становится больше. Можно предположить: если газы находятся в состоянии теплового равновесия, средние кинетические энергии молекул этих газов одинаковы. Но как это доказать, ведь непосредственно измерить эти энергии невозможно?
Обратимся к основному уравнению МКТ идеального газа: 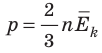
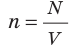
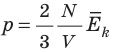
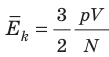
Таким образом, чтобы экспериментально убедиться в равенстве средних кинетических энергий молекул различных газов при одинаковой температуре, нужно измерить объемы (V), давления (p) и массы (m) газов и, зная их молярную массу (M), найти число молекул каждого газа (N) по формуле 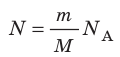
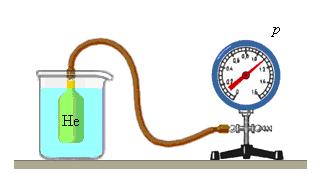
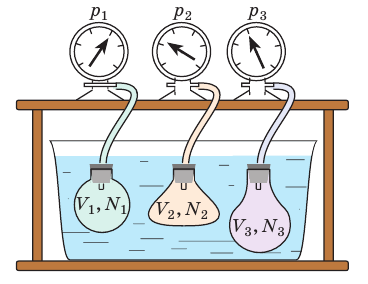
Чтобы обеспечить одинаковую температуру, можно, например, погрузить баллоны с различными газами в сосуд с водой и дождаться состояния теплового равновесия (рис. 29.3).
Рис. 29.3. опыт, позволяющий установить связь между температурой и средней кинетической энергией поступательного движения молекул газа. Газы в сосудах находятся в состоянии теплового равновесия со средой, а следовательно, и друг с другом
Эксперименты показывают, что для всех газов в состоянии теплового равновесия отношение 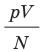
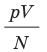
Например, при температуре 0 °С (сосуды с газами погрузили в тающий лед) 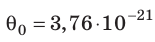
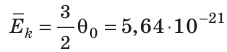
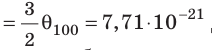
Абсолютная шкала температур
Понятно, что в джоулях представлять температуру неудобно (прежде всего потому, что значения θ очень малы), к тому же неудобно полностью отказываться от шкалы Цельсия. В 1848 г. английский физик Уильям Томсон (лорд Кельвин) (1824–1907) предложил абсолютную шкалу температур (сейчас ее называют шкалой Кельвина).
Температуру Т, измеренную по шкале кельвина, называют абсолютной температурой.
Единица абсолютной температуры — кельвин — основная единица СИ: [T] = 1 К (К).
Шкала Кельвина построена следующим образом:
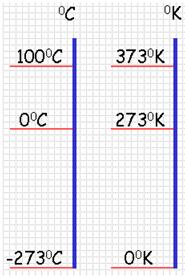
- изменение температуры по шкале Кельвина равно изменению температуры по шкале Цельсия: ∆ = T t ∆ , то есть цена деления шкалы Кельвина равна цене деления шкалы Цельсия: 1 °С = 1 К; температуры, измеренные по шкалам Кельвина и Цельсия, связаны соотношениями:
- температура по шкале Кельвина связана с величиной
соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа:
- абсолютная температура имеет глубокий физический смысл: средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре:
(1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (
). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Давление p газа полностью определяется его абсолютной температурой T и концентрацией n молекул газа: p=nkT (2).
Выводы:
- Физическая величина, характеризующая состояние теплового равновесия макроскопической системы, называется температурой. Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Шкала, за нулевую точку которой взят абсолютный нуль температуры, называется абсолютной шкалой температур (шкалой Кельвина). Единица абсолютной температуры — кельвин (К) — основная единица СИ. Температуры по шкале Кельвина и Цельсия связаны соотношением: T=t + 273; t=T – 273.
- Средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре, а давление газа определяется абсолютной температурой и концентрацией молекул газа:
— постоянная Больцмана.
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Твердые тела и их свойства в физике
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
- Уравнение состояния идеального газа
Температура
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: тепловое равновесие, абсолютная температура.
Мы часто используем слово «температура» в повседневной речи. А что такое температура? В данной статье мы объясним физический смысл этого понятия.
В молекулярной физике и термодинамике рассматриваются макроскопические тела, т. е. тела, состоящие из огромного числа частиц. Например, в стакане воды содержится порядка молекул. Такое грандиозное число с трудом поддаётся осмыслению.
Термодинамическая система
Термодинамической системой называется макроскопическое тело или система тел, которые могут взаимодействовать друг с другом и с окружающими телами. Стакан с водой — пример термодинамической системы.
Термодинамическая система состоит из столь большого числа частиц, что совершенно невозможно описывать её поведение путём рассмотрения движения каждой молекулы в отдельности. Однако именно грандиозность числа молекул делает ненужным такое описание.
Оказывается, что состояние термодинамической системы можно характеризовать небольшим числом макроскопических параметров — величин, относящимся к системе в целом, а не к отдельным атомам или молекулам. Такими макроскопическими параметрами являются давление, объём, температура, плотность, теплоёмкость, удельное сопротивление и др.
Состояние термодинамической системы, при котором все макроскопические параметры остаются неизменными с течением времени, называется тепловым равновесием. В состоянии теплового равновесия прекращаются все макроскопические процессы: диффузия, теплопередача, фазовые переходы химические реакции и т. д.(Следует отметить, что тепловое равновесие является динамическим равновесием. Так, при тепловом равновесии жидкости и её насыщенного пара весьма интенсивно идут взаимные превращения жидкости и пара. Но это — процессы молекулярного масштаба, они происходят с одинаковыми скоростями и компенсируют друг друга. На макроскопическом уровне количество жидкости и пара со временем не меняется).
Термодинамическая система называется изолированной, если она не может обмениваться энергией с окружающими телами. Чай в термосе — типичный пример изолированной системы.
Тепловое равновесие
Фундаментальный постулат, вытекающий из многочисленных опытных данных, гласит: каково бы ни было начальное состояние тел изолированной системы, со временем в ней устанавливается тепловое равновесие. Таким образом, тепловое равновесие — это состояние, в которое любая система, изолированная от окружающей среды, самопроизвольно переходит через достаточно большой промежуток времени.
Температура как раз и является величиной, характеризующей состояние теплового равновесия термодинамической системы.
Температура — это макроскопический параметр, значения которого одинаковы для всех частей термодинамической системы, находящейся в состоянии теплового равновесия. Попросту говоря, температура — это то, что является одинаковым для любых двух тел, которые находятся в тепловом равновесии друг с другом. При тепловом контакте тел с одинаковыми температурами между ними не будет происходить обмен энергией (теплообмен).
В общем же случае при установлении между телами теплового контакта теплообмен начнётся. Говорят, что тело, которое отдаёт энергию, имеет более высокую температуру, а тело, которое получает энергию — более низкую температуру. Температура, таким образом, указывает направление теплообмена между телами. В процессе теплообмена температура первого тела начнёт уменьшаться, температура второго тела — увеличиваться; при выравнивании температур теплообмен прекратится — наступит тепловое равновесие.
Особенность температуры заключается в том, что она не аддитивна: температура тела не равна сумме температур его частей. Этим температура отличается от таких физических величин, как масса, длина или объём. И по этой причине температуру нельзя измерить путём сравнения с эталоном.
Измеряют температуру с помощью термометра.
Для создания термометра выбирают какое-либо вещество (термометрическое вещество), какую-либо характеристику этого вещества (термометрическую величину), и используют зависимость термометрической величины от температуры. При этом выбор термометрического вещества и термометрической величины может быть весьма произвольным.
Так, в бытовых жидкостных термометрах термометрическим веществом является ртуть (или спирт), а термометрической величиной — длина столбика жидкости. Здесь используется линейная зависимость объёма жидкости от температуры.
В идеально-газовых термометрах используется линейная зависимость давления разреженного газа (близкого по своим свойствам к идеальному) от температуры.
Действие электрических термометров (термометров сопротивления) основано на температурной зависимости сопротивления чистых металлов, сплавов и полупроводников.
В процессе измерения температуры термометр приводится в тепловой контакт(В области температур выше (раскалённые газы, расплавленные металлы) используются бесконтактные высокотемпературные термометры — пирометры. Их действие основано на измерении интенсивности теплового излучения в оптическом диапазоне.) с телом, температура которого определяется. Показания термометра после наступления теплового равновесия — это и есть температура тела. При этом термометр показывает свою температуру!
Температурная шкала. Абсолютная температура
При установлении единицы температуры чаще всего поступают следующим образом. Берут две температуры (так называемые реперные точки) — температуру таяния льда и температуру кипения воды при нормальном атмосферном давлении. Первой температуре приписывают значение , второй — значение
, а интервал между ними делят на
равных частей. Каждую из частей называют градусом (обозначают
), а полученную таким образом температурную шкалу — шкалой Цельсия.
При измерениях по шкале Цельсия с помощью жидкостных термометров возникает одна трудность: разные жидкости при изменении температуры изменяют свой объём по-разному. Поэтому два термометра с различными жидкостями, приведённые в тепловой контакт с одним и тем же телом, могут показать разные температуры. От данного недостатка свободны идеально-газовые термометры — зависимость давления разреженного газа от температуры не зависит от вещества самого газа.
Кроме того, для температурной шкалы идеально-газового термометра существует естественное начало отсчёта (исчезает произвол выбора реперной точки!): это та предельно низкая температура, при которой давление идеального газа постоянного объёма обращается в нуль. Эта температура называется абсолютным нулём температур.
Температурная шкала, началом отсчёта которой является абсолютный нуль, а единицей температуры — градус Цельсия, называется абсолютной температурной шкалой.
Температура, измеряемая по абсолютной шкале, называется абсолютной температурой и обозначается буквой . Единица абсолютной температуры называется кельвином (
).
Абсолютному нулю () соответствует температура
. Поэтому связь абсолютной температуры и температуры по шкале Цельсия даётся формулой:
В задачах достаточно использовать формулу
Благодарим за то, что пользуйтесь нашими материалами.
Информация на странице «Температура» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
Физика, 10 класс
Урок №19. Температура. Энергия теплового движения молекул
На уроке рассматриваются понятия: температура и тепловое равновесие; шкалы Цельсия и Кельвина; абсолютная температура как мера средней кинетической энергии теплового движения частиц вещества, зависимость давления от концентрации молекул и температуры.
Глоссарий по теме:
Макроскопические параметры — величины объём V, давление p и температура t, характеризующие состояние макроскопических тел без учёта их молекулярного строения.
Температура характеризует степень нагретости тела (холодное, тёплое, горячее).
Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние) — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Тепловым равновесием называют – такое состояние тел, при котором температура во всех точках системы одинакова.
Тепловым или термодинамическим равновесием, изолированной системы тел, называют состояние, при котором все макроскопические параметры в системе остаются неизменными.
Термометр — это прибор для измерения температуры путём контакта с исследуемым телом. Различают жидкостные, газовые термометры, термопары, термометры сопротивления.
Абсолютная температура Т прямо пропорциональна температуре Θ (тета), выражаемой в энергетических единицах (Дж).
Абсолютный нуль — предельная температура, при которой давление идеального газа обращается в нуль при фиксированном объёме или объём идеального газа стремится к нулю при неизменном давлении.
Абсолютный нуль – температура, при которой прекращается тепловое движение молекул.
Абсолютная шкала температур (Шкала Кельвина) – здесь нулевая температура соответствует абсолютному нулю, а каждая единица температуры равна градусу по шкале Цельсия.
Кельвин — единица абсолютной температуры в Международной системе измерений (СИ).
Постоянная Больцмана – коэффициент
Абсолютная температура есть мера средней кинетической энергии молекул.
Давление газа прямо пропорционально концентрации его молекул и абсолютной температуре Т.
Закон Авогадро – в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул
Обязательная литература:
- Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 195 – 203.
Дополнительная литература:
- Смородинский Я.А. Температура. — 3-е издание. — М.: Бюро Квантум, 2007. (Библиотечка «Квант». Вып. 103. Приложение к журналу «Квант» № 5/2007.) С. 5— 25.
- Кирик Л.А., Генденштейн Л.Э., Гельфгат И.М.. Задачи по физике. 10-11 классы для профильной школы. – М.: Илекса, 2010. – С. 111-115.
- Рымкевич А.П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. — С. 65 – 67.
- Орлов В.А., Сауров Ю.А. Практика решения физических задач. 10-11классы. – М.: Вентана-Граф, 2014. – С. 98-99.
- http://kvant.mccme.ru/1991/09/idealnyj_gaz_-_universalnaya_f.htm
Теоретический материал для самостоятельного изучения
Измеряя расположение звёзд на небе, расстояния на земле, время, люди знали, для чего они это делают и изобретали, телескопы, часы, прототипы современных линеек. О температуре такого же сказать было нельзя. О том, что такое тепловое равновесие и что означает степень нагрева тела (температура), существовали разные мнения. Но человек с незапамятных времен точно знал, что, когда два тела плотно соприкасаются, между ними устанавливается, выражаясь современным языком, тепловое равновесие.
Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно переходят в состояние теплового равновесия.
Тепловым равновесием называют такое состояние тел, при котором температура во всех точках системы одинакова.
Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние) — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
К числу характеристик состояния макроскопических тел (твёрдых тел, жидкостей, газов) и процессов изменения их состояний, относят объём, давление и температуру. Эти величины описывают в целом тела, состоящие из большого числа молекул, а не отдельные молекулы. При этом микроскопические процессы внутри тела не прекращаются при тепловом равновесии: расположения молекул всё время меняются и меняются их скорости при столкновениях.
Величины объём, давление и температуру, характеризующие состояние макроскопических тел без учёта их молекулярного строения, называют макроскопическими параметрами.
Тепловым или термодинамическим равновесием, изолированной системы тел, называют состояние, при котором все макроскопические параметры в системе остаются неизменными.
Для точной характеристики нагретости тела, необходим прибор, способный измерить температуры тел и дать возможности их сравнения.
Термометр — это прибор для измерения температуры путём контакта с исследуемым телом. Различают жидкостные, газовые термометры, термопары, термометры сопротивления.
В 1597 году Галилей создал термоскоп, в собственных сочинениях учёного нет описания этого прибора, но его ученики засвидетельствовали этот факт. Аппарат представлял собой устройство для поднятия воды при помощи нагревания.
Изобретение термометра, данные которого не зависели бы от перепадов атмосферного давления, произошли благодаря экспериментам физика Э. Торричелли, ученика Галилея.
Во всех приборах, изобретённых в XVIII веке, измерение температуры было относительно расширению столбика воды, спирта или ртути и произвольности выбора начала отсчёта, т.е. нулевой температуры. Наполняющие их вещества замерзали или кипели и этими термометрами нельзя было измерять очень низкие или очень высокие температуры. Необходимо было изобрести такую шкалу, чтобы избавиться от зависимости выбранного вещества, на основе которого формировалось градуирование.
Шкала, предложенная шведским учёным Андерсом Цельсием в 1742 г., точно устанавливала положение двух точек: 0 и 100 градусов. По шкале Цельсия температура обозначается буквой t, измеряется в градусах Цельсия (ºС).
На территории Англии и США используется шкала Фаренгейта. Такая шкала была предложена немецким учёным Даниелем Габриелем Фаренгейтом в 1724 г.: 0 °F — температура смеси снега с нашатырём или поваренною солью, 96 °F —температура здорового человеческого тела, во рту или под мышкой.
Рене Антуан де Реомюр не одобрял применения ртути в термометрах вследствие малого коэффициента расширения ртути. В 1730 году изобрёл водно-спиртовой термометр и предложил шкалу от 0 до 80°.
Шкала Реомюра очень долго использовалась на родине учёного во Франции вплоть до настоящего времени.
Различные жидкости при нагревании расширяются не одинаково. Поэтому расстояния на шкале между нулевой отметкой 0 °C и 100 °C будут разными.
Однако существует способ создать тело, которое приближенно обладает нужными качествами. Это идеальный газ. Было замечено, что в отличие от жидкостей все разряжённые газы – водород, гелий, кислород – расширяются при нагревании одинаково и одинаково меняют своё давление при изменении температуры. Это свойство газов позволяет избавиться в термометрах от одного существенного недостатка шкалы Цельсия – произвольности выбора начала отсчёта, то есть нулевой температуры.
При тепловом равновесии, если давление и объём газа массой m постоянны, то средняя кинетическая энергия молекул газа должна иметь строго определённое значение, как и температура.
Практически такую проверку произвести непосредственно невозможно, но с помощью основного уравнения молекулярно-кинетической теории её можно выразить через макроскопические параметры:




Если кинетическая энергия действительно одинакова для всех газов в состоянии теплового равновесия, то и значение давления р должно быть тоже одинаково для всех газов при постоянном значении отношения объёма к числу молекул. Подтвердить или опровергнуть данное предположение может только опыт.
Возьмём несколько сосудов, заполненных различными газами, например, водородом, гелием и кислородом. Сосуды имеют определённые объёмы и снабжены манометрами, для измерения давления газов в сосудах. Массы газов известны, тем самым известно число молекул в каждом сосуде. Приведём газы в состояние теплового равновесия. Для этого поместим их в тающий лёд и подождём, пока не установится тепловое равновесие и давление газов перестанет меняться.
Здесь устанавливается тепловое равновесие и все газы имеют одинаковую температуру 0 °С. При этом показания манометра показывают разное давление р, объёмы сосудов V изначально были разными и число молекул N различно, так как газы, закаченные в баллоны разные. Найдём отношение для водорода всех параметров для одного моля вещества:
Такое значение отношения произведения давления газа на его объём к числу молекул получается для всех газов при температуре тающего льда. Обозначим это отношение через Θ0 (тета нулевое):
Таким образом, предположение, что средняя кинетическая энергия, а также давление р в состоянии теплового равновесия одинаковы для всех газов, если их объёмы и количества вещества одинаковы или если отношение
Если же сосуды с газами поместить в кипящую воду при нормальном атмосферном давлении, то согласно эксперименту, отношение макроскопических параметров будет также одинаковым для всех газов, но значение будет больше предыдущего
Отсюда следует, что величина Θ растёт с повышением температуры и не зависит от других параметром, кроме температуры. Этот опытный факт позволяет рассматривать величину Θ тета как естественную меру температуры и измерять в энергетических единицах — джоулях.
А теперь вместо энергетической температуры введём температуру, которая будет измеряться в градусах. Будем считать величину тета Θ прямо пропорциональной температуре Т, где k- коэффициент пропорциональности
Так как 
По этой формуле вводится температура, которая даже теоретически не может быть отрицательной, так как все величины левой части этого равенства больше или равны нулю. Следовательно, наименьшим значением этой температуры является нуль, при любом другом параметре p, V, N равным нулю.
Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объёме или при которой объём идеального газа стремится к нулю при неизменном давлении, называют абсолютным нулём температуры.
Тепловое движение молекул непрерывно и бесконечно, а при абсолютном нуле молекулы поступательно не двигаются. Следовательно, абсолютный нуль температур при наличии молекул вещества не может быть достигнут. Абсолютный нуль температур — это самая низкая температурная граница, верхней не существует, та «наибольшая или последняя степень холода», существование которой предсказывал М.В. Ломоносов.
В 1848 г. английскому физику Вильяму Томсону (лорд Кельвин) удалось построить абсолютную температурную шкалу (её в настоящее время называют шкалой Кельвина), которая имеет две основные точки 0 К (или абсолютный нуль) и 273К, точка в которой вода существует в трёх состояниях (в твёрдом, жидком и газообразном).
Абсолютная температурная шкала — шкала температур, в которой за начало отсчёта принят абсолютный нуль. Температура здесь обозначается буквой T и измеряется в кельвинах (К).
На шкале Цельсия, есть две основные точки: 0°С (точка, в которой тает лёд) и 100°С (кипение воды). Температура, которую определяют по шкале Цельсия, обозначается t. Шкала Цельсия имеет как положительные, так и отрицательные значения.
Из опыта мы определили значения величины Θ (тета) при 0 °С и 100 °С. Обозначим абсолютную температуру при 0 °С через Т1, а при 100 °С через Т2. Тогда согласно формуле:
Отсюда можно вычислить коэффициент k, который связывает температуру в Θ энергетических единицах (Дж) с абсолютной температурой Т (К)
k = 1,38 • 10-23 Дж/К — постоянная Больцмана.
Зная постоянную Больцмана, можно найти значение абсолютного нуля по шкале Цельсия. Для этого найдём сначала значение абсолютной температуры, соответствующее 0°С:

Один кельвин и один градус шкалы Цельсия совпадают. Поэтому любое значение абсолютной температуры Т будет на 273 градуса выше соответствующей температуры t по Цельсию:

Теперь выведем ещё одну зависимость температуры от средней кинетической энергии молекул. Из основного уравнения молекулярно-кинетической теории и уравнения для определения абсолютной температуры

Здесь видно, что левые части этих уравнений равны, значит правые равны тоже.
Средняя кинетическая энергия хаотического поступательного движения молекул газа пропорциональна абсолютной температуре.
Абсолютная температура есть мера средней кинетической энергии движения молекул.
Из выведенных формул мы можем получить выражение, которое показывает зависимость давления газа от концентрации молекул и температуры


Из этой зависимости вытекает, что при одинаковых давлениях и температурах концентрация молекул у всех газов одна и та же. Отсюда следует закон Авогадро, известный нам из курса химии.
Закон Авогадро: в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Рассмотрим задачи тренировочного блока урока.
1. При температуре _______ (370C; 2830C; 270C) средняя кинетическая энергия поступательного движения молекул равна 6,21·10-21Дж.
Дано:
k = 1,38 • 10-23 Дж/К — постоянная Больцмана
t -?
Решение:
Запишем значение средней кинетической энергии хаотического поступательного движения молекул с зависимостью от абсолютной температуры:
Отсюда выразим Т:
Соотношение между абсолютной температурой и температурой в градусах Цельсия:
Подставим значение абсолютной температуры:
Правильный вариант ответа:
2. При температуре 290 К и давлении 0,8 МПа, средняя кинетическая энергия молекул равна __________ Дж, а концентрация составляет молекул ___________ м-3.
Дано:
Т = 290К
р = 0,8 МПа =0,8·106 Па
k = 1,38 • 10-23 Дж/К — постоянная Больцмана
Ек -? n — ?
Решение:
Значение средней кинетической энергии хаотического поступательного движения молекул:
Подставив значение абсолютной температуры, найдём ответ:
Определим концентрацию газа из соотношения:
Правильный вариант ответа: 6·10-21; 2·1026 м-3.
Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
- Подробности
- Обновлено 07.10.2018 21:52
- Просмотров: 920
Температура — это просто!
Температура
Температура — это мера средней кинетической энергии молекул.
Температура характеризует степень нагретости тел.
Прибор для измерения температуры — термометр.
Принцип действия термометра:
При измерении температуры используется зависимость изменения какого-либо макроскопического параметра (объема, давления, электрического сопротивления и т.д.) вещества от температуры.
В жидкостных термометрах — это изменение объема жидкости.
При контакте двух сред происходит передача энергии от более нагретой среды менее нагретой.
В процессе измерения температура тела и термометра приходят в состояние теплового равновесия.
Жидкостные термометры
На практике часто используются жидкостные термометры: ртутные (в диапазоне от -35oС до +750oС) и спиртовые (от -80oС до +70oС).
В них используется свойство жидкости изменять свой объем при изменении температуры.
Однако, у каждой жидкости существуют свои особенности изменения объема (расширения) при различных температурах.
В результате сравнения, например, показаний ртутного и спиртового термометров, точное совпадение будет только лишь в двух точках (при температурах 0oС и 100oС).
Этих недостатков лишены газовые термометры.
Газовые термометры
Первый газовый термометр был создан французским физиком Ж. Шарлем.
Преимущества газового термометра:
— используется линейная зависимость изменения объема или давления газа от температуры, которая справедлива для всех газов
— точность измерения от 0,003oС до 0,02oС
— интервал температур от -271oС до +1027oС.
Тепловое равновесие
При соприкосновении двух тел различной температуры происходит передача внутренней энергии от более нагретого тела менее нагретому, и температуры обоих тел выравниваются.
Наступает состояние теплового равновесия, при котором все макропараметры (объем, давление, температура) обоих тел остаются в дальнейшем неизменными при неизменных внешних условиях.
Тепловым равновесием называется такое состояние, при котором все макроскопические параметры остаются неизменными сколь угодно долго.
Состояние теплового равновесия системы тел характеризуется температурой: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Установлено, что при тепловом равновесии средние кинетические энергии поступательного движения молекул всех газов одинаковы, т.е.
Для разреженных (идеальных) газов величина
и зависит только от температуры, тогда
где k — постоянная Больцмана
Эта зависимость дает возможность ввести новую температурную шкалу абсолютную шкалу температур, не зависящую от вещества, используемого для измерения температуры.
Абсолютная шкала температур
— введена английским физиком У. Кельвином
— нет отрицательных температур
Единица абсолютной температуры в СИ: [T] = 1K (Кельвин)
Нулевая температура абсолютной шкалы — это абсолютный ноль ( 0К = -273oС ), самая низкая температура в природе. В настоящее время достигнута самая низкая температура — 0,0001К.
По величине 1К равен 1oC.
Связь абсолютной шкалы со шкалой Цельсия
Запомни! В формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».
После введения абсолютной температуры получаем новые выражения для формул:
Средняя кинетическая энергия поступательного движения молекул
Давление газа — основное уравнение МКТ
Средняя квадратичная скорость молекул
И как следствие, закон Авогадро:
В равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Заметьте, здесь концентрация молекул также одинакова!
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.
Понятие температуры – одно из важнейших в молекулярной физике.
Температура — это физическая величина, которая характеризует степень нагретости тел.
Беспорядочное хаотическое движение молекул называется тепловым движением.
Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах средняя кинетическая энергия молекулы может оказаться небольшой. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно диаметру молекулы. При повышении температуры средняя кинетическая энергия молекулы становится больше, молекулы разлетаются, и образуется газообразное вещество.
Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты.
Рассмотрим пример. Если положить нагретый металл на лед, то лед начнет плавится, а металл – охлаждаться до тех пор, пока температуры тел не станут одинаковыми. При контакте между двумя телами разной температуры происходит теплообмен, в результате которого энергия металла уменьшается, а энергия льда увеличивается.
Энергия при теплообмене всегда передается от тела с более высокой температурой к телу с более низкой температурой. В конце концов, наступает состояние системы тел, при котором теплообмен между телами системы будет отсутствовать. Такое состояние называют тепловым равновесием.
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными.
Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии. Возможность введения понятия температуры следует из опыта и носит название нулевого закона термодинамики.
Тела, находящиеся в тепловом равновесии, имеют одинаковые температуры.
Для измерения температур чаще всего используют свойство жидкости изменять объем при нагревании (и охлаждении).
Прибор, с помощью которого измеряется температура, называется термометр.
Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании). Термометры должны быть откалиброваны. Для этого их приводят в тепловой контакт с телами, температуры которых считаются заданными. Чаще всего используют простые природные системы, в которых температура остается неизменной, несмотря на теплообмен с окружающей средой – это смесь льда и воды и смесь воды и пара при кипении при нормальном атмосферном давлении.
Обыкновенный жидкостный термометр состоит из небольшого стеклянного резервуара, к которому присоединена стеклянная трубка с узким внутренним каналом. Резервуар и часть трубки наполнены ртутью. Температуру среды, в которую погружен термометр определяют по положению верхнего уровня ртути в трубке. Деления на шкале условились наносить следующим образом. Цифру 0 ставят в том месте шкалы, где устанавливается уровень столбика жидкости, когда термометр опущен в тающий снег (лед), цифру 100 – в том месте, где устанавливается уровень столбика жидкости, когда термометр погружен в пары воды, кипящей при нормальном давлении (105 Па). Расстояние между этими отметками делят на 100 равных частей, называемых градусами. Такой способ деления шкалы введен Цельсием. Градус по шкале Цельсия обозначают ºС.
По температурной шкале Цельсия точке плавления льда приписывается температура 0 °С, а точке кипения воды – 100 °С. Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками 0 °С и 100 °С принимается равным 1 °С.
В ряде стран (США) широко используется шкала Фаренгейта (TF), в которой температура замерзающей воды принимается равной 32 °F, а температура кипения воды равной 212 °F. Следовательно,
Ртутные термометры применяют для измерения температуры в области от -30 ºС до +800 ºС. Наряду с жидкостными ртутными и спиртовыми термометрами применяются электрические и газовые термометры.
Электрический термометр – термосопротивление – в нем используется зависимость сопротивления металла от температуры.
Особое место в физике занимают газовые термометр, в которых термометрическим веществом является разреженный газ (гелий, воздух) в сосуде неизменного объема (V = const), а термометрической величиной – давление газа p. Опыт показывает, что давление газа (при V = const) растет с ростом температуры, измеренной по шкале Цельсия.
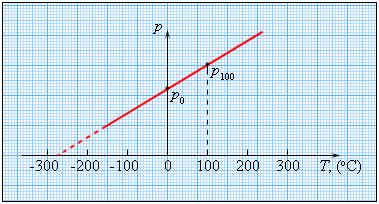
Чтобы проградуировать газовый термометр постоянного объема, можно измерить давление при двух значениях температуры (например, 0 °C и 100 °C), нанести точки p0 и p100 на график, а затем провести между ними прямую линию. Используя полученный таким образом калибровочный график, можно определять температуры, соответствующие другим значениям давления.
Газовые термометры громоздки и неудобны для практического применения: они используются в качестве прецизионного стандарта для калибровки других термометров.
Показания термометров, заполненных различными термометрическими телами, обычно несколько различаются. Чтобы точное определение температуры не зависело от вещества, заполняющего термометр, вводится термодинамическая шкала температур.
Чтобы её ввести, рассмотрим, как зависит давление газа от температуры, когда его масса и объём остаются постоянными.
Термодинамическая шкала температур. Абсолютный нуль.
Возьмем закрытый сосуд с газом, и будем нагревать его, первоначально поместив в тающий лед. Температуру газа t определим с помощью термометра, а давление p манометром. С увеличением температуры газа его давление будет возрастать. Такую зависимость нашел французский физик Шарль. График зависимости p от t, построенный на основании такого опыта, имеет вид прямой линии.
Если продолжить график в область низких давлений, можно определить некоторую «гипотетическую» температуру, при которой давление газа стало бы равным нулю. Опыт показывает, что эта температура равна –273,15 °С и не зависит от свойств газа. Невозможно на опыте получить путем охлаждения газ в состоянии с нулевым давлением, так как при очень низких температурах все газы переходят в жидкие или твердые состояния. Давление идеального газа определяется ударами хаотически движущихся молекул о стенки сосуда. Значит, уменьшение давления при охлаждении газа объясняется уменьшением средней энергии поступательного движения молекул газа Е; давление газа будет равно нулю, когда станет равна нулю энергия поступательного движения молекул.
Английский физик У. Кельвин (Томсон) выдвинул идею о том, что полученное значение абсолютного нуля соответствует прекращению поступательного движения молекул всех веществ. Температуры ниже абсолютного нуля в природе быть не может. Это предельная температура при которой давление идеального газа равно нулю.
Температуру, при которой должно прекратиться поступательное движение молекул, называют абсолютным нулем (или нулем Кельвина).
Кельвин в 1848 г. предложил использовать точку нулевого давления газа для построения новой температурной шкалы –термодинамической шкалы температур (шкала Кельвина). За начало отсчета по этой шкале принята температура абсолютного нуля.
В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой К.
Размер градуса кельвина определяют так, чтобы он совпадал с градусом Цельсия, т.е 1К соответствует 1ºС.
Температура, отсчитанная по термодинамической шкале температур, обозначается Т. Её называют абсолютной температурой илитермодинамической температурой.
Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее удобной при построении физических теорий.
Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры, достаточно принять еще одну фиксированную опорную точку. В шкале Кельвина в качестве такой точки используется температура тройной точки воды (0,01 °С), в которой в тепловом равновесии находятся все три фазы – лед, вода и пар. По шкале Кельвина температура тройной точки принимается равной 273,16 К.
Связь между абсолютной температурой и температурой по шкале Цельсия выражается формулой Т = 273,16 + t , где t – температура в градусах Цельсия.
Чаще пользуются приближенной формулой Т = 273 + t и t = Т – 273
Абсолютная температура не может быть отрицательной.
Температура газа – мера средней кинетической энергии движения молекул.
В опытах Шарлем была найдена зависимость p от t. Эта же зависимость будет и между р и Т: т.е. между р и Т прямопропорциональная зависимость.
С одной стороны, давление газа прямопропорционально его температуре, с другой стороны, мы уже знаем, что давление газа прямопропорционально средней кинетической энергии поступательного движения молекул Е (p = 2/3*E*n ). Значит, Е прямопропорциональна Т.
Немецкий ученый Больцман предложил ввести коэффициент пропорциональности (3/2)k в зависимость Е от Т
Е = (3/2)kТ
Из этой формулы следует, что среднее значение кинетической энергии поступательного движения молекул не зависит от природы газа, а определяется только его температурой.
Так как Е = m*v2/2, то m*v2/2 = (3/2)kТ
откуда средняя квадратичная скорость молекул газа
Постоянная величина k называется постоянная Больцмана.
В СИ она имеет значение k = 1,38*10-23 Дж/К
Если подставить значение Е в формулу p = 2/3*E*n , то получим p = 2/3*(3/2)kТ* n, сократив, получим p = n* k*Т
Давление газа не зависит от его природы, а определяется только концентрацией молекул n и температурой газа Т.
Соотношение p = 2/3*E*n устанавливает связь между микроскопическими (значения определяются с помощью расчетов) и макроскопическими (значения можно определить по показаниям приборов) параметрами газа, поэтому его принято называть основным уравнением молекулярно – кинетической теории газов.



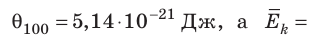
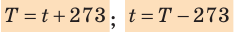
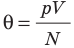 соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа:
соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа: 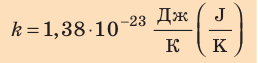
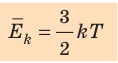 (1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (
(1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (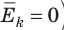 ). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.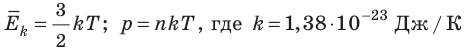 — постоянная Больцмана.
— постоянная Больцмана.